肠道是营养物质消化吸收的主要器官,与动物机体物质代谢和生长发育密切相关[1]。大肠杆菌广泛地分布于自然界内,是人和动物肠道中的常居菌,一般情况下不会引起动物疾病,甚至在一定程度上有利于维持动物肠道微生态的平衡。但在某些情况下,产肠毒素大肠杆菌(enterotoxigenic Escherichia coli, ETEC)会表现出致病性,可导致动物机体感染和中毒,引发各类肠道疾病[2],ETEC有很多血清型,其中K88是导致畜禽腹泻的重要病原菌。当畜禽感染K88后,病菌会在肠道内大量繁殖,引发动物腹泻甚至死亡[3-4],给养殖业带来巨大的经济损失[5]。
饲粮与动物肠道健康息息相关,通过开发功能性饲料添加剂以增强动物抗病抗菌能力,改善动物肠道及机体健康已成为研究热点[6]。天然植物多糖是一种新型、绿色、高效的饲料添加剂,受到了人们广泛关注。其中,南瓜多糖(pumpkin polysaccharide,PP)是一种大量存在于南瓜中的植物多糖[7],价格相对低廉,且具有抗氧化、提高免疫、降血糖等生物学功能,对动物肠道菌群具有一定的调节作用[8-10]。
本试验通过灌胃ETEC K88感染小鼠建立肠道炎症模型,研究PP对小鼠血清生化指标、血清及肝脏抗氧化指标以及肠道和肝脏炎症因子表达的影响,探究PP对动物肠道的保护作用及其机制,可以为ETEC感染导致的肠道炎症提供新的治疗思路,并为PP作为饲料添加剂提供理论基础。
1 材料与方法 1.1 试验材料PP由陕西某生物有限公司提供(纯度为80%);ETEC来自东北农业大学动物营养研究所,使用前浓度调整为5.0×109 CFU/mL;血清及肝脏中的总抗氧化能力(T-AOC)和氧化氢酶(CAT)活性采用南京建成生物工程研究所的试剂盒进行检测,T-AOC测定试剂盒产品号为A015-1-2,CAT活性测定试剂盒产品号为A007-1-1;白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)和白细胞介素-1β(IL-1β)的引物由上海生物工程股份有限公司合成;小鼠基础饲粮购自北京科澳协力饲料有限公司,其营养水平如表 1所示,该饲粮为全价饲粮,由玉米、豆粕、鱼粉、面粉、麸皮、碳酸氢钙、石粉、多种维生素、多种微量元素、多种氨基酸等组成,试验饲粮为基础饲粮中添加10 g/kg PP。
|
|
表 1 基础饲粮的营养水平(风干基础) Table 1 Nutrient levels of the basal diet (air-dry basis) |
将40只健康无特定病原体(SPF级)雄性ICR小鼠(年龄5~6周龄,体重25~27 g)随机分为4组,每组10只。小鼠圈养在温度和湿度均可控的环境中,室温在(21±2) ℃,相对湿度在40%~60%。小鼠自由采食、饮水1周,使其适应环境,消除应激。7 d后进入试验期,试验期为21 d。小鼠分组情况如下:1)对照(C)组:试验期饲喂基础饲粮,第18~20天14:00每天每只小鼠灌服无菌磷酸缓冲盐溶液(PBS)0.2 mL;2)ETEC组:试验期饲喂基础饲粮,第18~20天14:00每天每只小鼠灌服ETEC K88(浓度为5.0×109 CFU/mL)0.2 mL;3)PP组:试验期饲喂试验饲粮,第18~20天14:00每天每只小鼠灌服无菌PBS 0.2 mL;4)ETEC+PP组:试验期饲喂试验饲粮,第18~20天14:00每天每只小鼠灌服ETEC K88(浓度为5.0×109 CFU/mL)0.2 mL。
试验于第21天对小鼠进行乙醚麻醉,在处死前对全部小鼠进行眼球摘取采血,静置30 min后,4 ℃的条件下3 000 r/min离心10 min,用于制备血清;再脱颈处死,取小鼠的肝脏、脾脏,同时取小鼠结肠组织,用PBS漂洗干净后,放入液氮中快速封存,再置于-80 ℃冰箱中保存备用。
1.3 临床表现观察及疾病活动指数评估灌服菌液后,每天观察并记录小鼠活动、精神状态、呼吸、毛发及腹泻等情况,并于第21天处死,取样前对小鼠临床表现进行评分。小鼠ETEC感染后疾病活动指数评估标准[11]如表 2所示。
|
|
表 2 小鼠ETEC感染后疾病活动指数评估标准 Table 2 Disease activity indexes of mice infected with ETEC |
在小鼠宰前进行称重,脱颈处死后,立即取出肝脏和脾脏,用PBS冲洗并用滤纸吸干表面水分后精确称重、记录。计算公式如下:
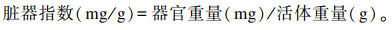
|
血清生化指标谷丙转氨酶(ALT)、谷草转氨酶(AST)活性由黑龙江省哈尔滨市省医院协同检测完成,使用Beckman Coulter美国全自动生化分析仪(UnicelDxC800 Synchron Clinical System)分析。
1.6 血清及肝脏抗氧化指标测定血清及肝脏抗氧化指标采用南京建成生物工程研究所的抗氧化试剂盒进行检测,取各组小鼠的血清及肝脏组织,按照试剂盒说明书检测方法测定样本T-AOC及CAT活性。
1.7 肠道与肝脏组织炎症因子表达水平测定将组织样品称取0.1 g左右于研磨管中,加入1 mL Trizol,振荡溶解。冰上静置15 min,4 ℃条件离心;加入氯仿后振荡离心分相,经异丙醇及75%无水乙醇沉淀及洗涤,干燥后加入70 μL焦碳酸二乙酯(DEPC)水溶解;以提取的总RNA为模板,将RNA进行反转录。反转录体系为10 μL,总RNA为2.5 μL,反转录条件为37 ℃,15 min及85 ℃ 5 s。RT产物cDNA放于-20 ℃保存。然后进行实时荧光定量PCR(qRT-PCR)检测炎症因子IL-6、TNF-α和IL-1β mRNA相对表达水平情况,所用引物由上海生工生物工程股份有限公司合成,引物序列见表 3。qRT-PCR反应采用SYBR Green Real-Time PCR进行。反应体系为10 μL,配好混合液进行反应。以β-肌动蛋白(β-actin)为内参,根据2-ΔΔCt方法计算各目的基因的相对表达量。
|
|
表 3 实时荧光定量PCR引物序列 Table 3 Quantitative real-time PCR primer sequence |
使用Excel 2016初步处理,SPSS 26.0分析数据,用Duncan氏法检验进行多组间差异显著性分析,数据均为平均值±标准差。P < 0.05为差异显著,P < 0.01为差异极显著。
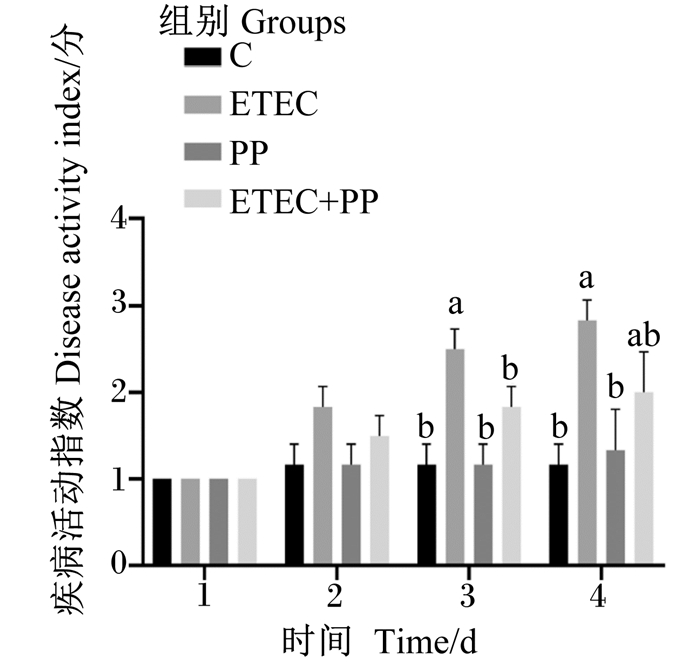
2 结果与分析 2.1 PP对ETEC感染小鼠疾病活动指数的影响如图 1所示,在第1~4天时,C组及PP组无明显症状,疾病活动指数未见明显上升;灌服ETEC后,ETEC组小鼠逐渐显现出精神萎靡、反应迟缓、采食量降低以及活动减弱等症状,疾病活动指数迅速升高;而ETEC+PP组疾病活动指数增长相对缓慢,在第3天时,ETEC+PP组疾病活动指数显著低于ETEC组(P < 0.05),在第4天时,无显著性差异(P > 0.05)。这表明采食添加0.1% PP的饲粮一定程度上能缓解灌服ETEC小鼠的应激反应。
|
不同小写字母表示差异显著(P < 0.05)。下图同。 Different small letters mean significant difference (P < 0.05). The same as below. 图 1 PP对小鼠感染ETEC后疾病活动指数的影响 Fig. 1 Effects of PP on disease activity indexes of mice infected with ETEC |
如表 4所示,较于C组,ETEC极显著提高了小鼠的肝脏指数和脾脏指数(P < 0.01);ETEC+PP组的小鼠其肝脏指数和脾脏指数相比于ETEC组极显著降低(P < 0.01)。这表明PP具有减轻小鼠肠道炎症代谢器官损伤的作用。
|
|
表 4 PP对ETEC感染小鼠脏器指数的影响 Table 4 Effects of PP on organ indexes in mice infected with ETEC |
如表 5所示,与ETEC组相比,ETEC+PP组血清AST及ALT活性略有下降,但无显著性差异(P > 0.05)。与C组相比,ETEC组血清T-AOC及CAT活性极显著降低(P < 0.01),而ETEC+PP组则极显著地改善了这种情况(P < 0.01)。结果表明,灌服ETEC后,血清抗氧化平衡遭到破坏,抗氧化能力显著降低,PP可以增强机体抗氧化能力,恢复血清抗氧化平衡。
|
|
表 5 PP对ETEC感染小鼠血清生化指标的影响 Table 5 Effects of PP on serum biochemical indexes in mice infected with ETEC |
如表 6所示,与C组相比,ETEC组肝脏中的CAT活性和T-AOC均有降低的趋势(P > 0.05),而ETEC+PP组的这些指标均有升高的趋势,但无显著差异(P > 0.05)
|
|
表 6 PP对ETEC感染小鼠肝脏抗氧化指标的影响 Table 6 Effects of PP on antioxidant indexes in liver of mice infected with ETEC |
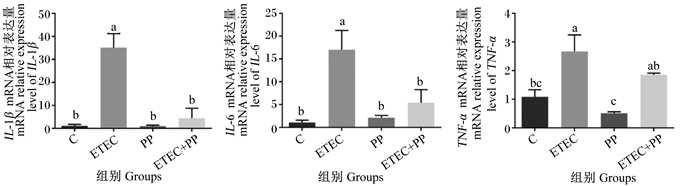
由图 2可知,ETEC组小鼠肠道中IL-6、TNF-α、IL-1β的mRNA相对表达量均显著高于C组(P < 0.05),同时,ETEC+PP组的IL-6和IL-1β mRNA相对表达量显著低于ETEC组(P < 0.05),TNF-α mRNA相对表达量相较于ETEC组无显著性差异(P > 0.05)。总的来说,PP可以降低ETEC引起的小鼠肠道组织促炎因子的表达增加,减轻肠道炎症。
|
图 2 PP对ETEC攻毒小鼠肠道炎性细胞因子mRNA相对表达量的影响 Fig. 2 Effects of PP on mRNA relative expression levels of inflammatory cytokines in intestinal tract of mice with ETEC |
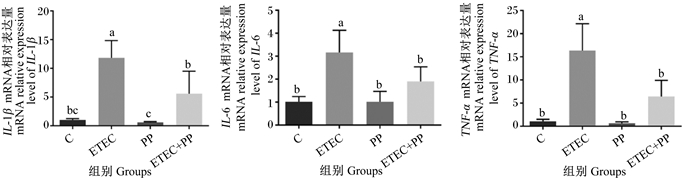
由图 3可知,ETEC组小鼠肝脏中IL-6、TNF-α及IL-1β mRNA相对表达量均显著高于C组(P < 0.05),而ETEC+PP组的IL-6、TNF-α及IL-1β mRNA相对表达量显著低于ETEC组(P < 0.05),这表明PP能有效抑制肝脏炎性细胞因子释放,缓解肝脏炎症。
|
图 3 PP对ETEC攻毒小鼠肝脏炎性细胞因子mRNA相对表达量的影响 Fig. 3 Effects of PP on mRNA relative expression levels of inflammatory cytokines in live of mice with ETEC |
产肠毒素大肠杆菌ETEC是一种重要的人畜共患病原体,通常会感染幼年畜禽,引起败血症、肠炎和畜禽死亡等情况,给养殖业带来巨大的经济损失。以往对于ETEC感染的预防及治疗多依赖于抗生素。然而,由于抗生素滥用造成的耐药性及残留等隐患危害着畜禽产品的生物安全,我国已全面禁止饲料中添加抗生素,抗生素替代产品的开发迫在眉睫。近年来,开发功能性饲料添加剂从而促进动物生长、预防病原菌感染以及改善动物肠道健康成为研究热点。值得关注的是,来源于天然植物提取物的植物多糖,其作为饲料添加剂不仅可以提供糖类、氨基酸、纤维素、维生素等营养素,还具有抑制细菌生长、调节肠道菌群、增强机体免疫力、抗氧化等作用,有望成为饲料中理想的抗生素替代物。本研究采用灌服大肠杆菌ETEC K88建立肠炎模型[12-13],以探究PP对小鼠肠道损伤的保护作用及其机制。
ALT和AST是肝脏细胞内重要的氨基转移酶及代谢酶[14]。肝脏受损时,血清中ALT和AST活性会明显升高[15-16]。因此,血清中ALT和AST活性在一定程度上可以反映肝脏细胞损伤情况。研究结果显示,健康SPF级雄性ICR小鼠灌服产肠毒素大肠杆菌后,虽然肝脏没有明显的病理现象,但血清中ALT、AST活性升高,肝脏指数显著上升,而饲喂0.1% PP试验饲粮(ETEC+PP组)的小鼠肝脏指数及血清中ALT、AST活性相较于ETEC组均显著下降。李毅腾等[17]研究证实了PP的提取物对于糖尿病大鼠血清AST、ALT活性具有显著的改善作用。本试验结果表明,PP可以通过降低血清关键转氨酶活性来缓解ETEC对肝脏功能的损伤,对动物机体具有一定的保护作用。
CAT活性及T-AOC是评价动物机体抗氧化能力的常用指标,当机体受到损伤时,血清及组织抗氧化平衡遭到破坏,抗氧化能力降低[18]。感染产肠毒素ETEC K88的小鼠肝脏以及血清中T-AOC及CAT的活性降低,说明其机体抗氧化与氧化系统的平衡被破坏,这可能进一步加剧组织和细胞的损伤。而ETEC+PP组小鼠血清CAT活性和T-AOC相较于ETEC组显著升高。宋丽君等[19]研究发现,PP灌胃小鼠血清CAT活性极显著增加。以上结果表明,PP可以通过提高自由基清除系统的活性来平衡机体代谢过程中不断产生的自由基,使得机体免受ETEC感染引起的抗氧化机能损伤。
小鼠的肠道炎症反应往往伴随促炎细胞因子释放的增加,所以小鼠肠道炎症的严重程度可通过检测促炎细胞因子(包括IL-6、TNF-α和IL-1β)的表达水平来评估。本试验结果表明,灌胃ETEC后,ETEC组小鼠肝脏以及肠道IL-6、TNF-α以及IL-1β的mRNA相对表达量显著增加,ETEC+PP组小鼠炎性细胞因子mRNA相对表达量较ETEC组显著下降,表明PP可以有效抑制IL-6、TNF-α以及IL-1β mRNA相对表达量,说明PP具有一定的抗炎作用。
在动物生产中,黄芪多糖、白术多糖、牛膝多糖等多糖可在一定程度替代抗生素保护肠道免受损伤[20]。值得注意的是,不仅在传统意义上的药用植物,在非药用植物中也有大量多糖在动物生产中应用,例如海藻多糖、苜蓿多糖等。但是目前对于PP作为一种新型添加剂应用于饲粮却鲜有报道。PP具有多重生物功能,与硒化枸杞多糖相比,PP具有更明显的保护肝脏的能力[21]。研究发现,PP消化率更高,不仅具有抗炎作用,还可以抗肿瘤[22-23],并且南瓜来源广泛,价格低廉[24]。因此,相较于其他多糖,PP有更为广阔的应用前景。
4 结论本试验通过灌胃ETEC K88感染小鼠建立肠道炎症模型,研究PP对小鼠血清生化指标、血清及肝脏抗氧化指标以及肠道和肝脏炎症因子表达的影响,探究PP对动物肠道的保护作用及其机制。结果发现,饲粮中添加PP对ETEC感染小鼠机体损伤有一定的保护作用,并且提高了机体抗氧化能力,使机体免受ETEC感染引起的抗氧化机能损伤,同时,PP可抑制肠道及肝脏炎症因子的表达,对动物机体炎症反应具有缓解作用。
| [1] |
WIJTTEN P J A, VAN DER MEULEN J, VERSTEGEN M W A. Intestinal barrier function and absorption in pigs after weaning: a review[J]. British Journal of Nutrition, 2011, 105(7): 967-981. DOI:10.1017/S0007114510005660 |
| [2] |
齐田琪. 致病性大肠杆菌对犊牛血液生化指标、抗氧化及肠组织形态的影响[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2020. QI T Q. Effects of pathogenic E. coli on blood biochemical indexes, antioxidant capacity and intestinal morphology of newborn calves[D]. Master's Thesis. Hohhot: Inner Mongolia Agricultural University, 2020. (in Chinese) |
| [3] |
XIA L, DAI L, ZHU L Q, et al. Proteomic analysis of IPEC-J2 cells in response to coinfection by porcine transmissible gastroenteritis virus and enterotoxigenic Escherichia coli K88[J]. Proteomics Clinical Applications, 2017, 11(11/12): 1600137. |
| [4] |
LIN Q, FU Q Q, LI X, et al. Human β-defensin 118 attenuates Escherichia coli K88-induced inflammation and intestinal injury in mice[J]. Probiotics and Antimicrobial Proteins, 2021, 13(2): 586-597. DOI:10.1007/s12602-020-09725-9 |
| [5] |
解影, 马勇, 谢春艳, 等. 浒苔多糖对ETEC感染小鼠肠道黏膜损伤的保护作用及机制研究[J]. 中国饲料, 2019(23): 64-68. JIE Y, MA Y, XIE C Y, et al. The mechanism of Enteromorpha polysaccharides in protecting the intestinal barrier injury of mice infected with ETEC[J]. China Feed, 2019(23): 64-68 (in Chinese). |
| [6] |
包晓玮, 李凤鸣, 韩海霞, 等. 南瓜及刺山柑多糖对小鼠免疫功能的影响[J]. 新疆农业科学, 2010, 47(3): 508-511. BAO X W, LI F M, HAN H X, et al. Effects of pumpkin polycose and capparis spinosa Linn polycose on immune function of mice[J]. Xinjiang Agricultural Sciences, 2010, 47(3): 508-511 (in Chinese). |
| [7] |
常慧萍, 陶令霞, 夏铁骑. 南瓜多糖对四氧嘧啶型糖尿病小鼠血糖和血脂的影响[J]. 食品科技, 2008, 33(6): 246-249. CHANG H P, TAO L X, XIA T Q. Effects of pumpkin polysaccharides on blood glucose and lipids in diabetic model rats by alloxan[J]. Food Science and Technology, 2008, 33(6): 246-249 (in Chinese). |
| [8] |
柳红, 张静. 不同南瓜多糖体外清除羟基自由基作用的研究[J]. 武汉植物学研究, 2007, 25(4): 356-359. LIU H, ZHANG J. Study on the scavenging effect of different pumpkin polysaccharide on hydroxide free radicals in vitro[J]. Journal of Wuhan Botanical Research, 2007, 25(4): 356-359 (in Chinese). DOI:10.3969/j.issn.2095-0837.2007.04.007 |
| [9] |
孟志卿, 王玲. 南瓜多糖对糖尿病小鼠血糖值、SOD、MDA的影响[J]. 信阳师范学院学报(自然科学版), 2010, 23(1): 75-78. MENG Z Q, WANG L. The effect of pumpkin polysaccharide on the blood sugar of mice[J]. Journal of Xinyang Normal University (Natural Science Edition), 2010, 23(1): 75-78 (in Chinese). |
| [10] |
SONG Y, YANG Y, ZHANG Y Y, et al. Effect of acetylation on antioxidant and cytoprotective activity of polysaccharides isolated from pumpkin (Cucurbita pepo, lady godiva)[J]. Carbohydrate Polymers, 2013, 98(1): 686-691. DOI:10.1016/j.carbpol.2013.06.049 |
| [11] |
黄诗琦, 韦雅妮, 赵雨川, 等. 鸡血藤总黄酮对大肠杆菌败血症的治疗作用[J]. 中国畜牧兽医, 2019, 46(5): 1541-1550. HUANG S Q, WEI Y N, ZHAO Y C, et al. Therapeutic effect of total flavonoid of Spatholobus suberectus dunn on Escherichia coli sepsis[J]. China Animal Husbandry & Veterinary Medicine, 2019, 46(5): 1541-1550 (in Chinese). |
| [12] |
赵宁. 产肠毒素性大肠杆菌感染小鼠致腹泻LncRNA表达谱的构建[D]. 硕士学位论文. 银川: 宁夏大学, 2016. ZHAO N. LncRNA expression signatures in response to enterotoxigenic Escherichia coli infection in mice[D]. Master's Thesis. Yinchuan: NingXia University, 2016. (in Chinese) |
| [13] |
YU E, CHEN D W, YU B, et al. Manno-oligosaccharide attenuates inflammation and intestinal epithelium injury in weaned pigs upon enterotoxigenic Escherichia coli K88 challenge[J]. British Journal of Nutrition, 2020, 1-10. |
| [14] |
GONG Z H, LIU Q L, LIN L, et al. l-theanine prevents ETEC-induced liver damage by reducing intrinsic apoptotic response and inhibiting ERK1/2 and JNK1/2 signaling pathways[J]. European Journal of Pharmacology, 2018, 818: 184-190. DOI:10.1016/j.ejphar.2017.10.050 |
| [15] |
王晓杰, 吾买尔江·牙合甫, 阿丽米热·买买提, 等. 菊苣多糖对小鼠药物性肝损伤保护作用的筛选[J]. 现代畜牧兽医, 2021(4): 9-13. WANG X J, YAKUP OMAR, MAMAT ALMIRA, et al. Screening of the protective effect of Cichorium intybus L. polysaccharide on drug-induced liver injury[J]. Modern Journal of Animal Husbandry and Veterinary Medicine, 2021(4): 9-13 (in Chinese). |
| [16] |
吴凡, 田娟, 喻丽娟, 等. 饲料糖脂比对养成中期吉富罗非鱼生长性能、体成分和血清生化指标的影响[J]. 动物营养学报, 2020, 32(12): 5805-5815. WU F, TIAN J, YU L J, et al. Effects of dietary carbohydrate to lipid ratio on growth performance, body composition and serum biochemical indices of genetic improvement of farmed tilapia in growth mid-stage[J]. Chinese Journal of Animal Nutrition, 2020, 32(12): 5805-5815 (in Chinese). |
| [17] |
李毅腾, 王晓闻, 何庆峰, 等. 苦瓜皂苷与南瓜多糖或苦荞黄酮联合作用改善2型糖尿大鼠脂代谢的研究[J]. 现代食品科技, 2015, 31(9): 14-19, 37. LI Y T, WANG X W, HE Q F, et al. Effect of bitter melon saponins with buckwheat flavones or pumpkin polysaccharides on glucose and lipid metabolism in type-2 diabetic rats[J]. Modern Food Science & Technology, 2015, 31(9): 14-19, 37 (in Chinese). |
| [18] |
BAKAR E, ULUCAM E, CERKEZKAYABEKIR A, et al. Investigation of the effects of naringin on intestinal ischemia reperfusion model at the ultrastructural and biochemical level[J]. Biomedicine & Pharmacotherapy, 2019, 109: 345-350. |
| [19] |
宋丽君. 南瓜多糖对糖尿病大鼠血糖、血脂及氧化应激能力的影响[J]. 中国应用生理学杂志, 2015, 31(1): 65-66, 71. SONG L J. Effects of pumpkin polysaccharide on the blood glucose, blood lipid and oxidative stress in diabetes rat[J]. Chinese Journal of Applied Physiology, 2015, 31(1): 65-66, 71 (in Chinese). |
| [20] |
印遇龙, 杨哲. 天然植物替代饲用促生长抗生素的研究与展望[J]. 饲料工业, 2020, 41(24): 1-7. YIN Y L, YANG Z. Research and prospect of natural plant substitute for antibiotic growth promoters in feed[J]. Feed Industry, 2020, 41(24): 1-7 (in Chinese). |
| [21] |
张超. 硒化枸杞多糖的制备、抗氧化及保肝作用研究[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2019. ZHANG C. Study of preparation, antioxidation and liver protection of selenizing Lycium barbarum polysaccharide[D]. Master's Thesis. Hohhot: Inner Mongolia Agricultural University, 2019. (in Chinese) |
| [22] |
刘颖, 梁盈, 林亲录, 等. 南瓜多糖的提取及其抗氧化活性研究进展[J]. 食品与机械, 2014, 30(3): 239-243. LIU Y, LIANG Y, LIN Q L, et al. Research progress on polysaccharide extracted and antioxidant activity of pumpkin[J]. Food & Machinery, 2014, 30(3): 239-243 (in Chinese). |
| [23] |
李哲涛. 苦瓜多糖、南瓜多糖抗肿瘤与抗氧化活性的研究[D]. 硕士学位论文. 西安: 陕西师范大学, 2013. LI Z T. Study on anti-tumor and antioxidant activity of polysaccharides from balsam pear and pumpkin[D]. Master's Thesis. Xi'an: Shaanxi Normal University, 2013. (in Chinese) |
| [24] |
李红宇, 许丽. 籽用南瓜果肉用作反刍动物饲料的探讨[J]. 饲料研究, 2017(13): 49-52. LI H Y, XU L. Discussion on seed pumpkin flesh used as ruminant feed[J]. Feed Research, 2017(13): 49-52 (in Chinese). |




