豆粕是一种最主要的饲用蛋白质原料,其中存在着一些抗营养寡糖,如棉子糖和水苏糖等。单胃动物由于肠道内缺少相应的α-半乳糖苷酶(α-galactosidase,EC 3.2.1.22),采食豆粕后常导致后肠产生二氧化碳和甲烷等,因此造成胀气、腹痛和腹泻等肠胃疾病,导致饲料转化率降低,这造成了巨大的经济损失。在饲粮中添加α-半乳糖苷酶,即酶学钝化法是目前较为直接有效的钝化手段[1]。
α-半乳糖苷酶在1895年发现于Frohberg和Saaz 2种下面发酵啤酒酵母的混合物中,1936年被正式命名为α-半乳糖苷酶[2]。α-半乳糖苷酶是一种外切糖苷酶,能够催化α-1, 2-半乳糖苷键、α-1, 3-半乳糖苷键、α-1, 4-半乳糖苷键及α-1, 6-半乳糖苷键的水解,使不同α-D-半乳糖苷裂解其非还原性末端的半乳糖残基[3-5]。α-半乳糖苷酶可酶解多种底物,如蜜二糖、棉子糖、水苏糖和毛蕊花糖等低聚糖[6](图 1),半乳甘露聚糖、支链多糖等多聚糖,以及糖脂、糖蛋白等复合多糖[2]。就目前的报道来看,α-半乳糖苷酶具有3种活性,除酶解活性外,在底物浓度较高时存在转半乳糖基的活性(可用于寡糖和环糖衍生物的合成),少数植物来源的α-半乳糖苷酶还存在类似凝集素的活性[7]。
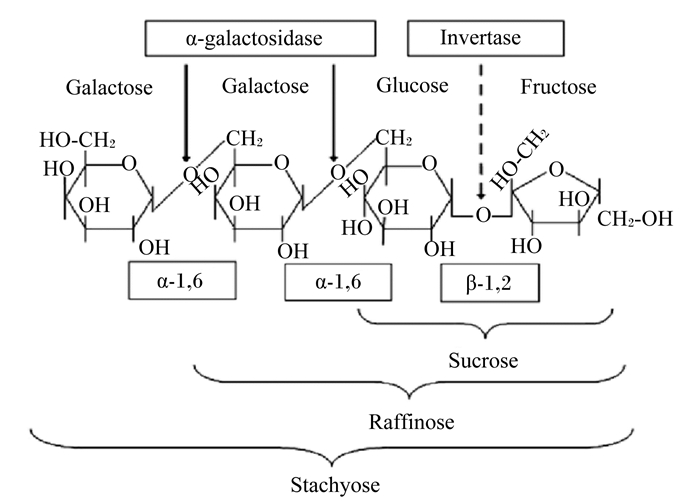
|
α-galactosidase:α-半乳糖苷酶;Invertase:转化酶;Galactose:半乳糖;Glucose:葡萄糖;Fructose:果糖;Sucrose:蔗糖;Raffinose:棉子糖;Stachyose:水苏糖。 图 1 蔗糖、棉子糖和水苏糖化学结构及其水解示意图 Fig. 1 Schematic diagram of chemical structure and hydrolysis of sucrose, raffinose and stachyose[6] |
在碳水化合物活性酶(carbohydrate-active enzymes,CAZy)数据库(http://www.cazy.org/)中,糖苷水解酶(glycoside hydrolases,GH)根据其氨基酸序列相似性及其疏水基团,现被分类为170个家族,即GH1~GH170。α-半乳糖苷酶目前主要被划分入7个糖苷水解酶家族,即GH4、GH27、GH31、GH36、GH57、GH97和GH110。其中,GH4、GH57和GH97家族的酶大多来自细菌,小部分来自古细菌;GH27家族的酶大多来自细菌,小部分来自真核生物;GH31和GH36家族的酶大多来自细菌,小部分来自真核生物和古细菌;GH110家族的酶目前只来源于细菌。GH27和GH36家族是α-半乳糖苷酶酶的主要来源,GH27家族多在酸性条件下有活性,GH36家族多在中性或碱性时功能最佳[8]。
本试验以实验室前期对硫色曲霉(Aspergillus sulphureus)的全基因组测序为基础,选取1条功能鉴定为α-半乳糖苷酶的cDNA序列,命名为硫色曲霉α-半乳糖苷酶基因(As-gal1)(GH27家族),根据毕赤酵母密码子使用频率表进行优化,构建毕赤酵母工程菌株。进一步将工程菌株进行72 h摇瓶表达,探究其酶学性质,然后进行30 L发酵罐高密度发酵(采用RDM培养基),用所得粗酶液进行豆浆中大豆寡糖的酶解试验,探究其水解效果。
1 材料与方法 1.1 试验材料 1.1.1 菌株和载体目的基因和载体pPICZαA合成至大肠杆菌DH5α(由苏州金唯智生物科技有限公司完成),巴斯德毕赤酵母X-33为本实验室保存。
1.1.2 工具酶、主要试剂及培养基限制性内切酶BglⅡ、EcoRⅠ和XbaⅠ(New England Biolabs公司,美国),酵母提取物和胰蛋白胨(Oxoid公司,英国),Zeocin(Invitrogen公司,美国),生物素(田斌制药公司,日本),琼脂糖(Biowest公司,西班牙),细菌基因组DNA提取试剂盒、真菌基因组DNA提取试剂盒、酵母基因组DNA提取试剂盒和琼脂糖凝胶回收试剂盒(Omega公司,美国),TEMED(Sigma公司,美国),蛋白质分子质量标准(TaKaRa公司,日本)。其他试剂均为国产分析纯试剂。
微量盐溶液:6.0 g CuSO4·5H2O、0.09 g KI、3.0 g MnSO4·H2O、0.2 g Na2MoO4·2H2O、0.02 g硼酸、0.5 g CoCl2·6H2O、20 g ZnCl2、65 g FeSO4·7H2O和5 mL浓H2SO4,双蒸水定容至900 mL,高压灭菌后加入100 mL 0.2%生物素,4 ℃保存。
维生素溶液:称取7.5 g肌醇、0.3 g盐酸硫胺、0.3 g泛酸钙、0.3 g烟酸、0.3 g盐酸吡哆醇、0.015 g生物素和0.06 g对氨基苯甲酸,加适量双蒸水溶解,定容至1 L,0.22 μm滤膜过滤除菌,4 ℃保存。
脂肪酸溶液:2 mg花生四烯酸、10 mg亚油酸、10 mg亚麻酸、10 mg肉豆蔻酸、10 mg油酸、10 mg软脂酸、10 mg硬脂酸、2.2 g吐温-80、70 mg醋酸生育酚和1 g聚醚F-68,加适量双蒸水溶解,定容至1 L,0.22 μm滤膜过滤除菌,4 ℃保存。
RDM培养基:称取12 g KH2PO4、4.7 g MgSO4·7H2O、0.36 g CaCl2·2H2O、1.65 g (NH4)2SO4、和3.37 g KOH,溶于500 mL双蒸水,高压灭菌。称取1.74 g谷氨酰胺和1.46 g精氨酸溶于100 mL双蒸水,过滤除菌后全部加入于刚配好的500 mL盐溶液。以此为基础,加入3.33 mL维生素、10 mL脂肪酸、4.34 mL微量盐溶液和适量双蒸水定容至1 L。使用时用H2SO4和氨水调节所需pH。
1.2 试验方法 1.2.1 As-gal1的序列分析和密码子优化将选取的As-gal1通过DNAMAN 9.0进行分析,通过NCBI Protein BLAST网站分别比对出在蛋白序列数据库中与As-gal1编码氨基酸序列相似性最高的10个蛋白,并用MEGA 11.0软件分别构建As-gal1和其BLAST结果的发育进化树。通过https://web.expasy.org/protparam/在线预测蛋白理论分子质量和等电点,通过http://www.cbs.dtu.dk/services/SignalP/进行信号肽序列分析,通过http://busca.biocomp.unibo.it/进行蛋白质亚细胞定位预测。根据毕赤酵母密码子使用频率表进行序列优化,去掉信号肽,去掉序列中SacⅠ和BglⅡ限制性内切酶酶切位点,不引入BspHⅠ和BamHⅠ酶切位点,在序列5′端加入EcoRⅠ酶切位点,在序列3′端加入XbaⅠ酶切位点,将设计好的序列全基因合成到载体pPICZαA上,构建成重组表达质粒pPIC-As-gal1-opt,优化基因的合成和测序由苏州金唯智生物科技有限公司完成。通过https://yanglab.nankai.edu.cn/trRosetta/对优化序列进行深度学习和同源建模相结合的蛋白质从头结构预测。
1.2.2 As-gal1毕赤酵母工程菌株的构建将含有pPIC-As-gal1-opt质粒的穿刺菌接种于含有Zeocin(100 μg/mL)的10 mL LB培养基在50 mL锥形瓶中,37 ℃、200 r/min过夜培养。利用质粒提取试剂盒进行质粒提取,将所提取质粒用BglⅡ限制性内切酶于37 ℃酶切过夜,线性化质粒电转入新制备的毕赤酵母X-33感受态细胞中,电击结束后立刻加入1 mL冰预冷的1 mol/L山梨醇溶液,充分混匀后转移至50 mL离心管中,28 ℃培养3 h。将菌体悬液涂布于YPDS固体平板上(含有100 μg/mL Zeocin),28 ℃培养约3 d,直至培养出清晰的菌落。挑取单菌落划线于YPD固体平板(含有100 μg/mL Zeocin)上,28 ℃培养约3 d,直至培养出清晰的菌落。
1.2.3 As-gal1工程菌株的摇瓶表达挑取划线纯化后的X-33/As-ga11-opt阳性单克隆,接种于含有Zeocin(100 μg/mL)的10 mL YPD培养基在50 mL锥形瓶中,28 ℃、250 r/min培养约24 h,取100 μL菌液移接至装有50 mL BMGY培养基的500 mL锥形瓶中,28 ℃、250 r/min培养至600 nm波长下吸光度(OD600 nm)值达到2.0。将BMGY菌液在4 ℃、5 000 r/min离心5 min,去掉上清液,保留菌体,用50 mL BMMY培养基进行重旋,于500 mL锥形瓶中,28 ℃、250 r/min培养72 h,每隔24 h补加甲醇进行诱导(终浓度为0.5%)。BMMY培养基摇瓶72 h结束,每24 h取样1次,4 ℃、13 300 r/min离心5 min,取上清液于4 ℃保存。
1.2.4 α-半乳糖苷酶活性的测定参照Rezessy-Szabó等[9]的方法,采用对硝基苯基-β-D-吡喃半乳糖苷(PNPG)法测定α-半乳糖苷酶活性。对硝基苯酚标准曲线制作方法如下:准确称取对硝基苯酚1.391 2 g(10 mmol),用0.5 mol/L Na2CO3溶液定容至1 L,配成0.01 mol/L的母液。取1 mL母液用Na2CO3溶液定容至100 mL,配成0.1 mmol/L的对硝基苯酚工作液。分别吸取该溶液0、1、2、4、8、12、16和20 mL,用Na2CO3溶液定容至50 mL,配成浓度分别为0、0.002、0.004、0.008、0.016、0.024、0.032和0.040 mmol/L的标准梯度溶液。405 nm波长下测定溶液的吸光度。以吸光度为横坐标、对硝基苯酚浓度为纵坐标,绘制标准曲线。
α-半乳糖苷酶活性测定步骤如下:在1 mL离心管中加入100 μL PNPG底物溶液,于50 ℃水浴预热5 min,加入100 μL经过适当稀释(用pH 5.0的柠檬酸-磷酸氢二钠缓冲液稀释)的酶液,55 ℃条件下反应10 min,加入800 μL 0.5 mol/L的Na2CO3溶液终止反应并显色,于405 nm波长下测定溶液的吸光度。试验重复数为3。酶活定义为:在55 ℃和pH 5.0的条件下,每分钟从浓度10 mmol/L的PNPG底物溶液中释放1 μmol的对硝基苯酚所需要的酶量为1个酶活单位(U)。
1.2.5 酶学性质分析 1.2.5.1 最适pH和pH稳定性最适pH:使用pH分别为2.0、3.0、4.0、4.5、5.0、5.5、6.0、6.5、7.0和8.0的柠檬酸-磷酸氢二钠缓冲液适当稀释酶液,底物PNPG也用相应的缓冲液配成10 mmol/L的底物溶液。在50 ℃条件下测定酶活性。试验重复数为3。
pH稳定性:将酶液分别置于上述pH的缓冲液中,室温处理30 min后,最适条件下测定残余酶活性。试验重复数为3。
1.2.5.2 最适温度和温度稳定性最适温度的确定:将酶液适当稀释后,分别在20、25、30、35、40、45、50、55、60和70 ℃温度下测定并计算酶活性,确定最适温度。试验重复数为3。
温度稳定性的确定:将酶液适当稀释后置于70 ℃保温5 min,60 ℃保温5、10、15、20和25 min,并分别取样。每个温度设置1个对照组,均保存于冰上,其预处理均与试验组相同。处理后于最适条件50 ℃和pH 5.0下测定酶活性。试验重复数为3。
1.2.5.3 金属离子对酶活性的影响用最适pH的柠檬酸-磷酸二氢钠缓冲液配成浓度为20 mmol/L的含有不同金属的化合物溶液[FeCl3、KCl、CaCl2、NH4Cl、乙二胺四乙酸二钠(EDTA-2Na)、CuSO4、ZnSO4、MnSO4、MgSO4、(NH4)2SO4、NaCl和CoCl2],将适当稀释的酶液与金属离子溶液1 ∶ 1(体积比)混合,使金属离子终浓度为10 mmol/L。室温处理1 h后,最适条件下测定残余酶活性,鉴定不同金属离子对酶活性的影响,以不添加金属离子的酶液作为空白对照。试验重复数为3。
1.2.6 工程菌株的30 L发酵罐高密度发酵挑取工程菌株X-33/As-gal1-opt接种于200 mL YPD液体培养基于500 mL锥形瓶中,180 r/min、30 ℃培养24 h,将200 mL菌液倒入至装有7.5 L YPD液体培养基的15 L种子罐中,温度28 ℃,转速300~500 r/min,通气量10.5~15.0 L/min,罐内压力0.05 MPa,当菌体湿重达到60 g/L时,将1 kg菌液接种至装有14 L pH 5.0 RDM培养基的30 L发酵罐中。初始条件为:28 ℃,用氨水调节pH使其稳定在5.0,通气量为25.0 L/min,发酵过程中通过调节转速控制相对溶氧在20%以上。培养至14 h左右,观察到溶氧值迅速升高时(此时基础碳源葡萄糖耗尽),进入50%(质量体积分数)甘油补料阶段,控制补料速度使溶氧值保持在20%以上。当菌体湿重达到212 g/L时,停止甘油补料,饥饿2 h使菌体耗尽剩余的甘油。然后开始甲醇诱导,通过调节转速和甲醇流速控制相对溶氧在20%。每隔24 h取样测菌体湿重和酶活性。待菌体湿重及酶活性达到峰值保持稳定或呈下降趋势时,停止发酵。8 000 r/min离心5 min后取上清,对上清液进行12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析。
1.2.7 豆浆中大豆寡糖的体外酶解将10%(质量体积分数)的豆浆8 000 r/min离心10 min后取上清液进行酶解试验。试验设置2个试验组和2个对照组,每组设置2个平行。2个试验组加酶量分别是1和2 U/mL。取10 mL离心后的豆浆放入50 mL离心管中,分别加入1和2 mL酶活性为12 U/mL的发酵液,前一组补加双蒸水1 mL以保证豆浆浓度一致;对照组用双蒸水代替酶液,反应体系为12 mL。55 ℃水浴条件下进行酶解反应,每隔1 h取样2 mL,共取样3次,80 ℃加热5 min灭活,15 000 r/min、4 ℃离心10 min后取上清液作为待测液。将待测液用水稀释500倍后用0.22 μm滤膜过滤后上机进行离子色谱分析,测定产物半乳糖和蔗糖以及所剩底物棉子糖和水苏糖的含量,以水苏糖含量的减少量计算降解率。
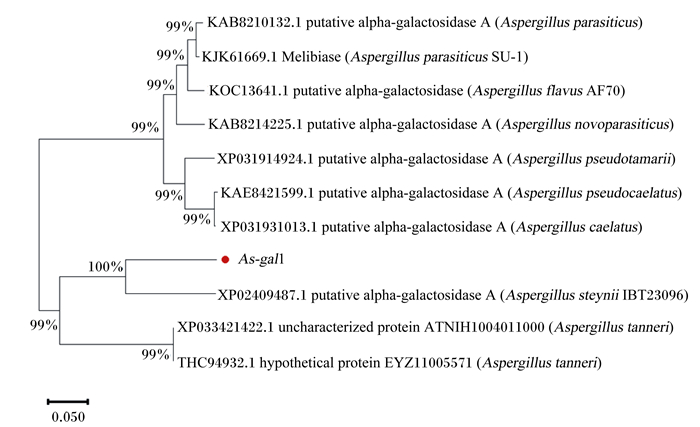
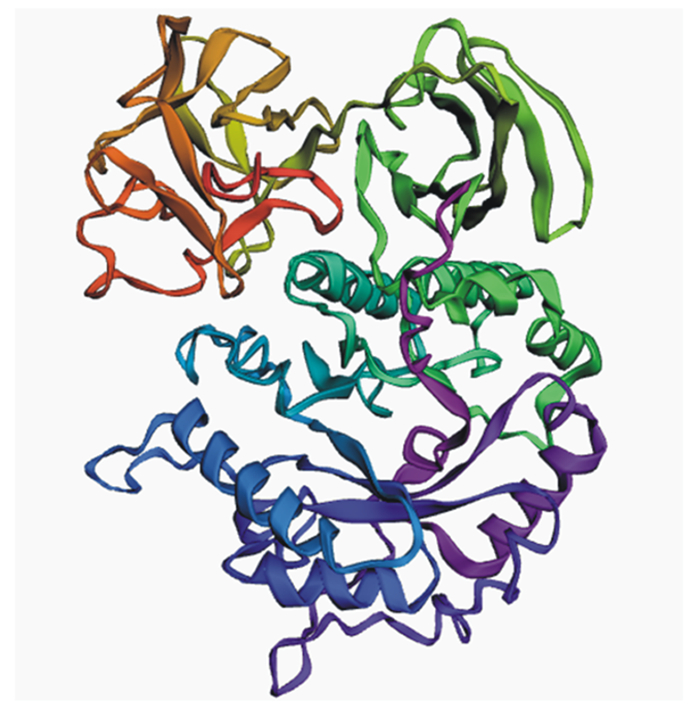
2 结果与分析 2.1 As-gal1的序列分析As-gal1序列全长1 626 bp,编码541个氨基酸,其中前27个氨基酸为信号肽序列。将该基因与NCBI上已知序列进行比对(图 2)发现,本试验所使用的硫色曲霉α-半乳糖苷酶与来源于Aspergillus steynii IBT 23096的α-半乳糖苷酶相似度为79.12%,与来源于鞣革曲霉(Aspergillus tanneri)的α-半乳糖苷酶(XP_033421422.1)也具有67.98%的相似度;该酶预测蛋白等电点为4.91,理论蛋白分子质量为59.56 ku。蛋白质亚细胞定位在细胞外基质,蛋白质结构如图 3所示,该酶具备GH27家族的典型特征,即N端催化结构域和C端结构域,其中N端催化结构域为(β/α)8桶状结构,C端结构域为由反向平行的β折叠形成的折叠股。
|
putative alpha-galactosidase:推定的α-半乳糖苷酶;Aspergillus parasiticus:寄生曲霉;Melibiase:蜜二糖酶;Aspergillus flavus AF70:黄曲霉AF70;uncharacterized protein ATNIH1004 011000:非特征蛋白ATNIH1004 011000;Aspergillus tanneri:鞣革曲霉。 结点处的数字为自展值,表示分支的可信度;0.050表示氨基酸替换率。 Numbers at the junctions were bootstrap values, representing the credibility of the branches; 0.050 was the replacement rate of the amino acids. 图 2 As-gal1编码的氨基酸序列系统发育进化树 Fig. 2 Phylogenetic dendrogram of amino acid sequence coded by As-gal1 |
|
图 3 硫色曲霉α-半乳糖苷酶的蛋白质结构预测 Fig. 3 Protein structure prediction of α-galactosidase from Aspergillus sulphureus |
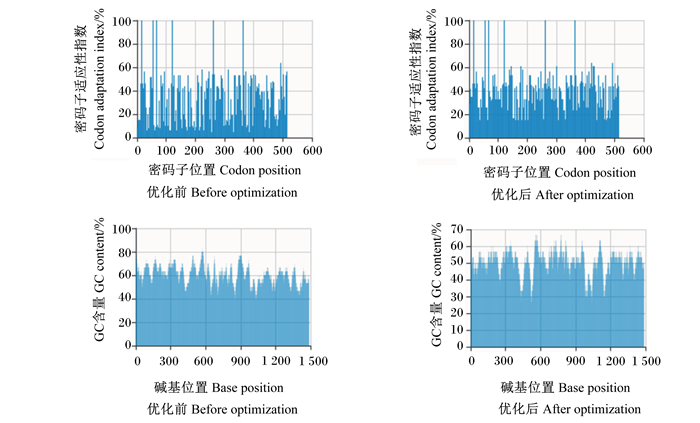
根据毕赤酵母密码子偏好性,去掉信号肽,去除和增加上述酶切位点,在不改变氨基酸序列的情况下,有367个碱基被替换,替换率为23.75%,优化基因序列与野生型基因序列的一致性为76.25%(图 4)。密码子适应性指数(codon adaptation index,CAI)优化前为0.59,优化后为0.82;GC含量(鸟嘌呤和胞嘧啶所占碱基的比例)优化前为60.00%,优化后为50.03%(图 5)。

|
wt:野生型wild type;opt:优化型optimized type;Consensus:一致。 深蓝色为相同碱基,浅蓝色为不同碱基。The dark blue mean the same bases, and the light blue mean the different bases. 图 4 As-gal1野生型和优化型序列比较 Fig. 4 Comparison of wild type and optimized type sequence of As-gal1 |
|
图 5 As-gal1序列优化前后的密码子适应指数和GC含量 Fig. 5 Codon adaptation index and GC content before and after optimization of As-gal1 sequence |
将重组工程菌株X-33/As-gal1-opt摇瓶表达72 h,24 h时酶活性为(1.17±0.21) U/mL,48 h时酶活性为(2.20±0.06) U/mL,72 h时酶活性为(3.20±0.21) U/mL。
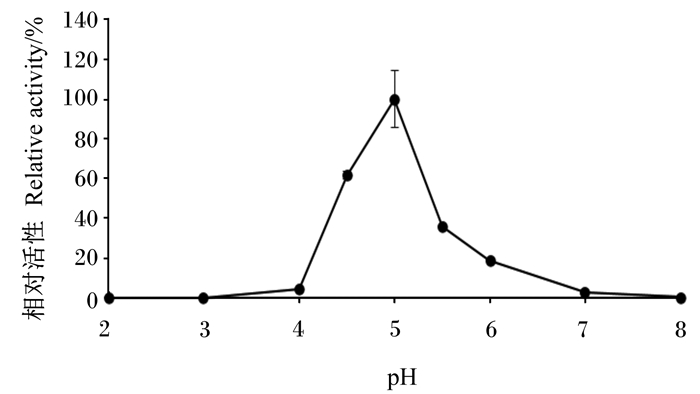
2.4 α-半乳糖苷酶的酶学性质分析 2.4.1 最适pH和pH稳定性α-半乳糖苷酶在pH 5.0时水解能力最强,在pH 4.5~5.0进行水解反应,该酶可以保持60%以上的活性,在pH 4.0以下或pH 7.0以上时该酶几乎完全失活(图 6)。
|
图 6 pH对α-半乳糖苷酶活性的影响 Fig. 6 Effects of pH on α-galactosidase activity |
该酶在pH 4.0~5.5具备较好的稳定性,pH降到4.0以下时,其水解活性急剧下降至失活,在pH 6.0时稳定性也较差(图 7)。
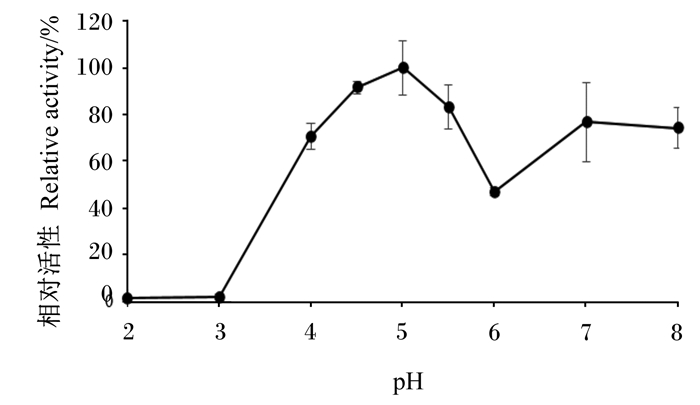
|
图 7 α-半乳糖苷酶的pH稳定性 Fig. 7 pH stability of α-galactosidase |
α-半乳糖苷酶在55 ℃时达到最高催化活性,在40~60 ℃时可保持50%以上的活性,超过60 ℃则活性迅速下降(图 8)。
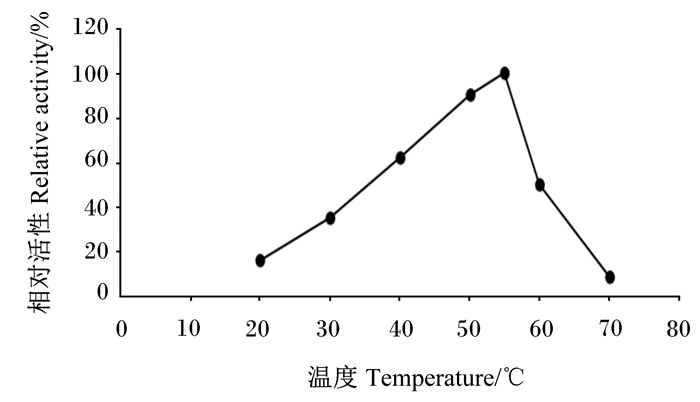
|
图 8 温度对α-半乳糖苷酶活性的影响 Fig. 8 Effects of temperature on α-galactosidase activity |
α-半乳糖苷酶对温度稳定性的结果如图 9所示,可以看出α-半乳糖苷酶的热稳定性较差,60 ℃ 10 min和70 ℃ 5 min即可近乎全部失活。
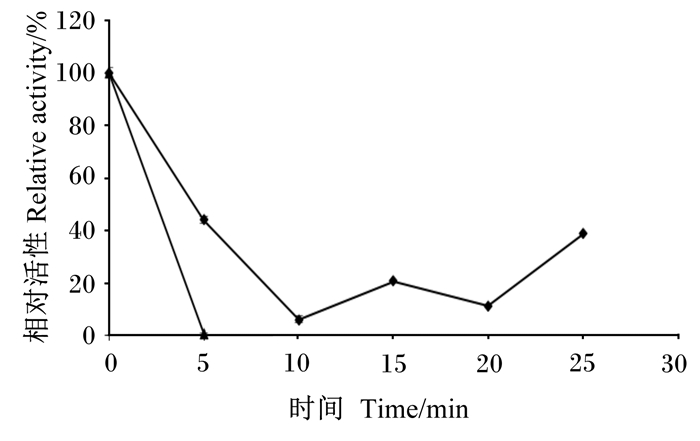
|
◆:60 ℃;▲:70 ℃。 图 9 α-半乳糖苷酶的温度稳定性 Fig. 9 Temperature stability of α-galactosidase |
α-半乳糖苷酶对各种金属离子的耐受性结果见表 1,可以看出,MgSO4对α-半乳糖苷酶有抑制作用,可降低约15%的活性;FeCl3对α-半乳糖苷酶有极显著的促进作用(P < 0.01),可提高约60%的活性。
|
|
表 1 金属离子对α-半乳糖苷酶活性的影响 Table 1 Effects of metal ions on α-galactosidase activity |
将工程菌株X-33/As-gal1-opt进行30 L发酵罐高密度发酵,在1 kg种子液从15 L种子罐接种至30 L发酵罐14 h后,观察到溶氧迅速上升,随后稳定在较高的水平,说明培养基中的基础碳源葡萄糖已经耗尽,测得此时菌体湿重为80 g/L。此时开始进行50%(质量体积分数)甘油补料,补料期间控制相对溶氧稳定在20%以上。发酵进行24 h时,菌体湿重达到212 g/L,30 min后停止甘油补料,饥饿3 h使菌体耗光剩余的甘油。3 h后开始甲醇诱导。优化型α-半乳糖苷酶工程菌株X-33/As-gal1-opt发酵过程中的菌体湿重和酶活性变化如图 10所示。随着诱导时间的延长,菌体湿重与酶活性逐渐提高,当甲醇诱导至188 h时,菌体湿重为557 g/L,酶活性在177 h达到最高,为190 U/mL。分别取甲醇诱导0、24、48、72、96、120、144、168、177和188 h的发酵上清液进行12% SDS-PAGE分析,在48 ku处可见明显的目的条带(图 11)。
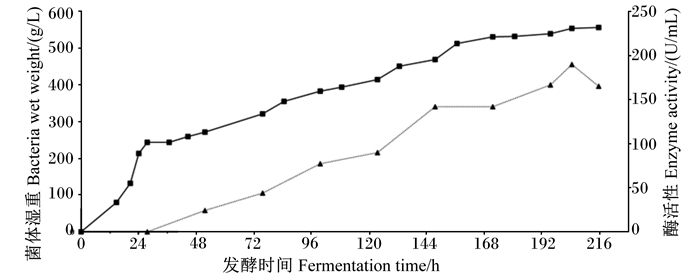
|
■:菌体湿重bacteria wet weight;▲:酶活性enzyme activity。 图 10 30 L发酵罐中优化型α-半乳糖苷酶工程菌株X-33/As-gal1-opt的菌体湿重增长曲线及酶活性 Fig. 10 Bacteria wet weight growth curve and enzyme activity of optimized α-galactosidase engineering strain X-33/As-gal1-opt in 30 L fermentor |

|
1:未诱导not induced;2:24 h;3:48 h;4:72 h;5:96 h;6:120 h;7:144 h;8:168 h;9:177 h;10:188 h;M:蛋白分子质量标准protein molecular weight marker。 图 11 优化型α-半乳糖苷酶工程菌株X-33/As-gal1-opt发酵上清液SDS-PAGE分析 Fig. 11 SDS-PAGE analysis of optimized α-galactosidase engineering strain X-33/As-gal1-opt fermentation supernatant |
将发酵所得的粗酶液进行适当稀释,在最适条件下水解调制好的10%(质量体积分数)豆浆溶液以进行体外酶解试验,测试该酶对豆浆中寡糖的降解效果。酶解产物经高效离子色谱测定,通过外标法依照各组分保留时间进行定性,依据峰面积积分得出各组分的含量,各组分的保留时间见图 12。以水苏糖含量的减少量计算水苏糖降解率,结果见图 13。α-半乳糖苷酶于55 ℃、添加量分别为1和2 U/mL的情况下,1 h时水苏糖的降解率分别为3.49%和1.14%;2 h时得到对水苏糖的最高降解率,降解率分别为3.91%和5.22%;3 h时降解率分别为0.36%和-1.46%。
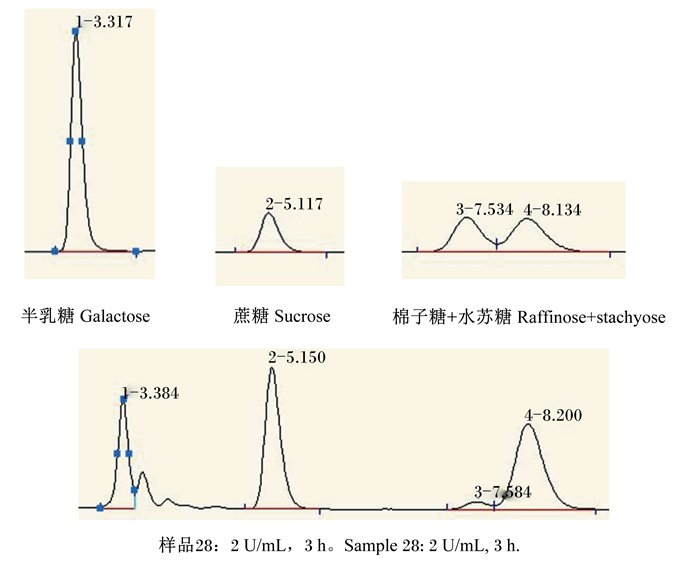
|
图 12 酶解产物中寡糖含量的离子色谱分析 Fig. 12 Analysis of contents of oligosaccharides in enzymatic products by ion chromatography |
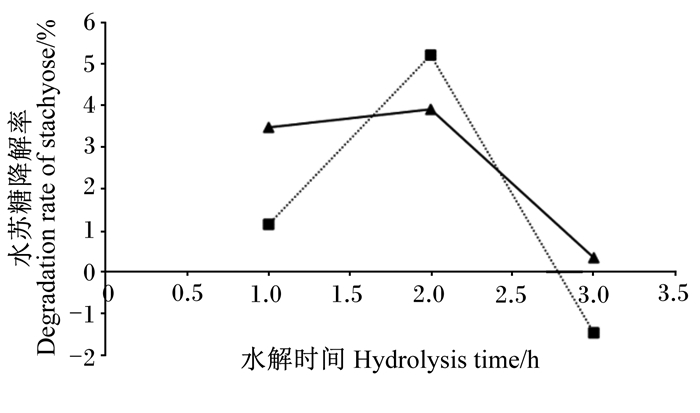
|
加酶量:1 U/mL(▲);2 U/mL(■)。 Volume of enzyme: 1 U/mL (▲); 2 U/mL (■). 图 13 α-半乳糖苷酶对水苏糖的水解 Fig. 13 Hydrolysis of α-galactosidase on stachyose |
由于1分子水苏糖去掉1个半乳糖残基后可生成1分子棉子糖,因此棉子糖同时作为酶解反应的底物和产物,故采用半乳糖含量的增加量计算水苏糖和棉子糖为底物的总寡糖降解率。总寡糖降解率结果见图 14。随着时间的延长,总寡糖降解率逐渐提高,酶解1 h后,加酶量为1和2 U/mL的2组总寡糖降解率分别为34.60%和35.92%;酶解2 h后,总寡糖降解率分别为37.35%和40.53%;酶解3 h后,总寡糖降解率分别为39.71%和49.07%。结果表明,α-半乳糖苷酶在降解豆浆中的棉子糖和水苏糖方面具有极大潜力。
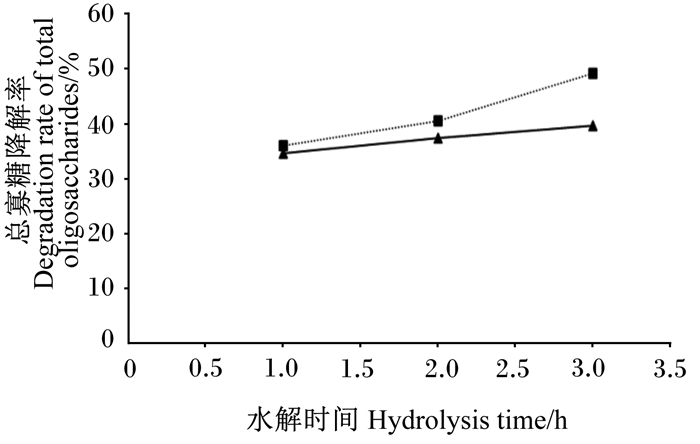
|
加酶量:1 U/mL(▲);2 U/mL(■)。 Volume of enzyme: 1 U/mL (▲); 2 U/mL (■). 图 14 α-半乳糖苷酶对总寡糖的水解 Fig. 14 Hydrolysis of α-galactosidase on total oligosaccharides |
查阅BRENDA酶学综合信息库(https://www.brenda-enzymes.org/index.php),获取该酶的酶学信息。目前α-半乳糖苷酶的分子质量范围为17~400 ku。真菌中分离出来酶多来源于曲霉和青霉。曲霉来源的α-半乳糖苷酶是一个具有高度可变分子性质的异质性群体,分子质量不均匀;青霉来源的α-半乳糖苷酶分子质量为55~67 ku。细菌α-半乳糖苷酶也是一组结构更为复杂的异质性酶,其分子质量为45~400 ku,变化很大[10]。α-半乳糖苷酶等电点为3.5~9.3,最适pH为2.5~8.0,pH耐受为2.0~10.0。细菌α-半乳糖苷酶的最适pH为6.0~7.5,而真菌α-半乳糖苷酶的最适pH为3.5~5.0[9]。α-半乳糖苷酶最适温度为20~105 ℃。
本试验所选用的酶来自于GH27家族。Ye等[11]从猴头菇(Hericium erinaceus)子实体中分离出一种新的GH27家族的57 ku α-半乳糖苷酶,该酶在pH 6.0和60 ℃时活性最高,在pH 2.2~7.0稳定,且在较窄的温度范围内稳定;Zn2+、Fe3+和Ag+对该酶有较强的抑制作用;纯化倍数为1 251倍,比活性为46 U/mg。Hu等[12]从红平菇(Pleurotus djamor)中分离出一种GH27家族的酸性α-半乳糖苷酶,分子质量约为60 ku,最适pH为5.0,最适温度为53.5 ℃,在pH 3.0~10.0表现出很好的稳定性;K+、Cd2+、Cu2+、Hg2+、Al3+、Fe3+和Ag+对该酶有较强的抑制作用。本试验所选用的α-半乳糖苷酶,最适pH为5.0,最适温度为55 ℃,在pH 4.0~8.0处理30 min几乎不变性(pH 6.0除外),具有较好的金属离子稳定性,与上述2种GH27家族的酶较为相似。
3.2 工程菌株的30 L发酵罐高密度发酵培养基是工程菌株生存的直接外部化学环境,是限制菌株生长与表达的主要因素。任延升[13]用30 L发酵罐对毕赤酵母HS3-1-溶菌酶菌株进行高密度发酵,采用BSM培养基,初始装液量为18 L,接菌量为10%,发酵进行到40 h开始进行甲醇诱导,此时菌体湿重为225 g/L;发酵至140 h时结束,菌体湿重约为220 g/L。瞿曼[14]用30 L发酵罐对毕赤酵母X-33-脂肪酶菌株进行高密度发酵,初始装液量10 L,接菌量10%,采用BSM培养基对发酵条件进行优化,在最适生长温度和最适生长pH并以甲醇为单一诱导碳源,诱导144 h,菌体湿重最高稳定在463 g/L。与常用的发酵毕赤酵母菌株所使用的发酵基础盐BSM培养基不同,本试验使用了一种新型培养基——丰富限定培养基RDM,30 L发酵罐初始装液量为14 L,接菌量为1 kg,菌种为毕赤酵母X-33,发酵进行到24 h时菌体湿重为212 g/L,饥饿3 h开始甲醇诱导,期间保持相对溶氧率在20%以上,诱导96 h时菌体湿重为415 g/L,诱导144 h时菌体湿重为531 g/L,最终于诱导188 h时菌体湿重最高为557 g/L。在相对应和最终时刻,本试验菌体湿重远高于上述报道的文献,证明RDM培养基较BSM培养基更适合毕赤酵母X-33菌株的生长。
3.3 α-半乳糖苷酶对豆浆中大豆寡糖的酶解效果Wang等[15]将来自米曲霉YZ1的α-半乳糖苷酶基因GalC导入毕赤酵母X-33构建工程菌株,经5 L发酵罐高密度培养192 h后,用粗酶液于体外酶解豆浆中的寡糖,加酶量为5、10和15 U/mL,豆浆体积为10 mL,反应体系为15 mL,25 ℃下反应。降解3 h后,5 U/mL的试验组对水苏糖的降解率为91%,15 U/mL的试验组可对水苏糖实现完全降解(100%)。总寡糖降解方面,3 h后3个试验组对总寡糖的降解率分别为87.1%、88.0%和97.8%。
本试验中,α-半乳糖苷酶的添加量较少,为1和2 U/mL,于最适温度55 ℃下酶解3 h。可以观察到,无论是1 U/mL还是2 U/mL,该酶对水苏糖的降解率随着时间的增加呈现出先提升后下降的趋势。经分析,若α-半乳糖苷酶耐热性不好,随着时间的增加逐渐失活,降解率至少在3 h时应该与2 h时保持同一数值,而不是下降,甚至不应出现负值。结合部分α-半乳糖苷酶具有转半乳糖基的活性,且GH27家族自身就包含具有水解和转糖基活性的酶[7, 16]的事实,因此推测该酶可能随着水解的进行,在半乳糖基浓度较高时发生了转糖基作用。在添加浓度较低的情况下,3 h后该酶对总寡糖的降解率可达39.71%和49.07%,表明该酶对豆浆中的大豆总寡糖具有较好的降解潜力。
4 结论① 本试验选取了来自硫色曲霉的α-半乳糖苷酶cDNA序列As-gal1,该序列全长1 626 bp,编码541个氨基酸,其中前27个氨基酸为信号肽序列。预测蛋白等电点为4.91,理论蛋白分子质量为59.56 ku。蛋白质亚细胞定位在细胞外基质。摇瓶诱导72 h最高酶活性为3.20 U/mL。
② 该酶最适温度为55 ℃,最适pH 5.0,除pH为6.0外,在pH 4.0~8.0具有较好的稳定性,耐热性较差,60和70 ℃各处理10和5 min几乎失活。
③ 对工程菌株X-33/As-gal1-opt进行30 L发酵罐高密度发酵,甲醇诱导177 h后酶活性最高可达190 U/mL,菌体湿重于188 h最高可达557 g/L。
④ 体外水解试验表明,酶添加量为2 U/mL,反应温度为55 ℃,2 h对水苏糖的降解率为5.22%,3 h对总寡糖的降解率为49.07%,具有较好的降解潜力。
| [1] |
游金明, 李德发. 大豆抗营养因子研究进展[J]. 畜牧产业, 2006(1): 52-58. YOU J M, LI D F. Research progress of anti-nutrient factors in soybean[J]. Animal Agriculture, 2006(1): 52-58 (in Chinese). |
| [2] |
BHATIA S, SINGH A, BATRA N, et al. Microbial production and biotechnological applications of α-galactosidase[J]. International Journal of Biological Macromolecules, 2020, 150: 1294-1313. DOI:10.1016/j.ijbiomac.2019.10.140 |
| [3] |
ZAPROMETOVA O M, ULEZLO I V, LAKHTIN V M. Structure and properties of a Cephalosporium acremonium alpha-galactosidase[J]. Glycoconjugate Journal, 1990, 7(4): 287-300. DOI:10.1007/BF01073373 |
| [4] |
VARBANETS L D, MALANCHUK V M, BUGLOVA T T, et al. Penicillium sp. 23 alpha-galactosidase: purification and substrate specificity[J]. Carbohydrate Polymers, 2001, 44(4): 357-363. DOI:10.1016/S0144-8617(00)00252-6 |
| [5] |
KATROLIA P, RAJASHEKHARA E, YAN Q J, et al. Biotechnological potential of microbial α-galactosidases[J]. Critical Reviews in Biotechnology, 2014, 34(4): 307-317. DOI:10.3109/07388551.2013.794124 |
| [6] |
LEBLANC J G, SILVESTRONI A, CONNES C, et al. Reduction of non-digestible oligosaccharides in soymilk: application of engineered lactic acid bacteria that produce alpha-galactosidase[J]. Genetics and Molecular Research, 2004, 3(3): 432-440. |
| [7] |
邓春, 易弋, 李平, 等. α-半乳糖苷酶的研究进展[J]. 食品工业, 2016, 37(2): 255-260. DENG C, YI Y, LI P, et al. Resarch advance of α-galactosidase[J]. The Food Industry, 2016, 37(2): 255-260 (in Chinese). |
| [8] |
闫巧娟, 刘瑜, 江正强. 微生物α-半乳糖苷酶的研究进展[J]. 微生物学杂志, 2017, 37(3): 1-9. YAN Q J, LIU Y, JIANG Z Q. Advances in microbial α-galactosidase[J]. Journal of Microbiology, 2017, 37(3): 1-9 (in Chinese). DOI:10.3969/j.issn.1005-7021.2017.03.001 |
| [9] |
REZESSY-SZABÓ J M, NGUYEN Q D, HOSCHKE Á, et al. A novel thermostable alpha-galactosidase from the thermophilic fungus Thermomyces lanuginosus CBS 395.62/b: purification and characterization[J]. Biochimica et Biophysica Acta: General Subjects, 2007, 1770(1): 55-62. DOI:10.1016/j.bbagen.2006.06.022 |
| [10] |
PANDEY A, NEGI S, SOCCOL C R. Current developments in biotechnology and bioengineering: production, isolation and purification of industrial products[M]. Amsterdam: Elsevier, 2017: 369-394.
|
| [11] |
YE F, GENG X R, XU L J, et al. Purification and characterization of a novel protease-resistant GH27α-galactosidase from Hericium erinaceus[J]. International Journal of Biological Macromolecules, 2018, 120(Part B): 2165-2174. |
| [12] |
HU Y J, TIAN G T, ZHAO L Y, et al. A protease-resistant α-galactosidase from Pleurotus djamor with broad pH stability and good hydrolytic activity toward raffinose family oligosaccharides[J]. International Journal of Biological Macromolecules, 2017, 94(Part A): 122-130. |
| [13] |
任延升. 海参i-型溶菌酶发酵生产及酶学性质研究[D]. 硕士学位论文. 大连: 大连工业大学, 2018. REN Y S. Study on the fermentation production and enzymatic properties of sea cucumber i-type lysozyme[D]. Master's Thesis. Dalian: Dalian Polytechnic University, 2018. (in Chinese) |
| [14] |
瞿曼. 脂肪酶MAS1的基因克隆、表达及其性质研究[D]. 硕士学位论文. 广州: 华南理工大学, 2016. QU M. Cloning, expression and characterization of lipase MAS1[D]. Master's Thesis. Guangzhou: South China University of Technology, 2016. (in Chinese) |
| [15] |
WANG J, YANG X, YANG Y Z, et al. Characterization of a protease-resistant α-galactosidase from Aspergillus oryzae YZ1 and its application in hydrolysis of raffinose family oligosaccharides from soymilk[J]. International Journal of Biological Macromolecules, 2020, 158: 708-720. DOI:10.1016/j.ijbiomac.2020.04.256 |
| [16] |
STRATILOVÁ B, KLAUDINY J, Ř EHULKA P, et al. Characterization of a long-chain α-galactosidase from Papiliotrema flavescens[J]. World Journal of Microbiology & Biotechnology, 2018, 34(2): 19. |




