畜牧业是农业现代化的标志性产业,“十三五”期间质量兴牧持续推进,畜牧业发展保持稳定向好的态势。据统计,2020年我国肉类、禽蛋、奶类总产量分别为7 748万、3 468万和3 530万t,肉类、禽蛋产量继续保持世界首位,奶类产量位居世界前列[1]。同时,产业素质明显提高,规模化、集约化养殖快速发展并呈现龙头企业引领的趋势,为“十四五”行业高质量发展奠定良好基础。畜牧业是一个年产值4万亿规模的民生基础产业,健康、高效养殖不仅是为提高优质、充裕肉蛋奶的重大需求,也是为缓解饲料用粮急骤增长和提高粮食安全的重大战略需求。在现代养殖生产中,饲料成本占养殖成本的60%以上[2]。以往养殖模式中通常按动物最大需求量供给各类营养物质,导致饲料转化为动物产品的利用效率偏低。近年来,逐渐发展为根据动物品种遗传特性、生理阶段以及生产用途等方面制定饲养标准,即精准动物饲养,以期在满足如动物最佳生长速度和蛋白质沉积所需各类营养物质的同时,降低生产成本的投入和环境负荷。据报道,通过精准营养调控可提高生长猪对营养物质的利用效率,明显降低生产成本(>8%)、蛋白质和磷的摄入(25%)、粪便排泄(40%)以及温室气体排放(6%)[2-3]。然而,目前的畜禽精准饲养策略往往忽略了环境因素,限制着畜牧业健康发展[4]。
1 畜禽精准饲养技术的发展势头以及当前复杂环境下面临的挑战据预测,到2050年全球人口将增长到90亿,必须增加60%的粮食生产才能满足需求,集约化饲养的猪和家禽的产量至少需要增加1倍,才足以满足人类对动物源食品日益增长的需求[5]。鉴于全球资源有限,环境保护压力激增,各国将面临的关键挑战是食用粮和饲用粮生产系统的可持续性。随着近几年畜禽精准饲养概念的提出,探讨准确评定饲料原料中可利用营养物质含量的方法及不同品种、生理阶段畜禽营养需求量的精准评估,并进一步优化饲料配方等措施,不仅有效提高了饲料利用率,节约了饲料原料资源,在保障畜禽产品安全、降低环境污染等方面也发挥了重要作用[6]。例如,研究表明,饲料原料中多种化学成分与饲料原料的有效能值显著相关,通过建立基于不同饲料原料化学成分的预测方程可以较为准确地评定其有效能值[6]。随着全自动仿生消化装置的开发与改良,可实现准确、快速地测定饲料原料营养物质的生物学效价[7]。根据实时收集个体猪的日采食量、体重及日增重等信息,建立相关数学模型,对个体猪只氨基酸需要量进行动态估测,在不影响育肥猪生长性能的前提下节省蛋白质原料消耗,从而降低饲料成本[8]。此外,国内外复杂环境下催动我国畜禽养殖发展面临诸多挑战。我国畜牧业在生产数量增长的同时,仍存在生产效率低、畜禽发病率高、设施工艺水平差、畜产品质量安全隐患等问题[4],畜牧生产迫切需要完成从追求数量增长向追求高质量发展的转型升级。同时,蛋白质饲料资源不足、优质牧草饲料资源短缺成为制约我国未来粮食安全的重要因素[9]。且养殖业以养为本,养重于防、防重于治已成共识,养殖环境是畜禽健康高效生产的前提条件,也是养殖业高质量发展的科学技术短板[10]。因此,认识环境对畜禽健康的影响因素,以建立健康、高效的养殖环境参数尤为重要。
2 畜禽养殖环境的重要性——夯实绿色发展根基畜禽养殖是集遗传、环境、营养、饲养管理、生物安全等高度统一体的系统工程,共同决定其生产水平,其中30%~40%取决于环境[11]。研究环境因素对畜禽生理的影响及其机制,并以此制定利用、控制、保护和改造环境的技术措施,一直是畜牧业发展的重大技术需求和研究方向。“十三五”期间,科研工作者采用多组学、单细胞测序等前沿技术和方法在环境领域针对养殖过程中主要影响因素开展了一系列研究,为建立满足动物生产性能和福利需求的新型畜牧生产环境打下坚实基础。
2.1 养殖环境中的适宜参数及饲养密度对畜禽健康的影响前期开展的系列研究揭示了光照、环境温度、有毒有害气体、饲养密度和群体规模、空气颗粒物和微生物气溶胶共5类主要环境因素对畜禽生长、免疫、繁殖、健康的影响,表明畜禽舍环境是影响动物健康、高效生产、产品质量安全的直接要素[12]。例如,通过动物试验结合细胞研究手段,明确了光照通过褪黑素(MT)介导的氧化应激信号通路影响精子发生的生理机制,以及激活丝氨酸/苏氨酸激酶(Akt)-核因子E2相关因子(Nrf2)通路抑制公鸡睾丸间质细胞凋亡(MT-Akt-Nrf2途径)的作用[13-14];单色绿光(12 h光照,12 h黑暗)可刺激并加速松果体的早期组织学发育和节律功能成熟以及MT分泌,缩短鸡胚胎孵化时间而不影响孵化性能[15]。
饲养密度会直接影响畜禽舍的温度、湿度、灰尘数、有毒有害气体浓度、微生物数量及噪声等,通过这些因素的互作,进而影响畜禽健康和生产[16]。此外,猪群饲养密度过大,影响体况较差个体的正常采食,容易引发应激并刺激交感神经促进儿茶酚胺和糖皮质激素释放,影响体增重[17]。在奶牛上研究表明,高放养密度对早期泌乳阶段机体的氧化还原稳态产生负面影响,且降低血清催乳素和生长激素浓度,增加乳腺通透性,有引发氧化应激和降低奶品质的风险[18]。在肉鸡上,高养殖密度导致其生长性能下降,可能与肌肉和骨骼的生长迟缓有关[19];进一步研究发现,高养殖密度(18.75只/m2)的环境可通过下丘脑神经肽Y(NPY)和促肾上腺皮质激素释放因子(CRF)途径抑制肉鸡食欲,影响其健康生长[20]。
2.2 养殖环境中的温度、颗粒物和气溶胶对畜禽健康的影响机制随着畜禽饲养环境相关研究的深入,从整体、组织、细胞和分子水平上系统探究了温热环境对畜禽的营养物质代谢、肠道健康、器官发育、免疫功能和繁殖性能的影响机制。研究发现,温热环境影响动物体内脂质代谢和胆汁酸代谢[21-22],如牛磺型胆汁酸、血液胆固醇和甘油三酯含量可指示生长猪的热应激反应[22]。热应激状态下,畜禽采食量的下降尤为明显。研究表明,一方面,长期热暴露导致的采食量下降与肉鸡食欲相关激素(瘦素)的表达和分泌增加有关,以及肠道中味觉受体1型成员1(T1R1)和味觉受体1型成员3(T1R3)的表达增加[23];另一方面,长期热应激通过诱导线粒体功能障碍和影响能量物质有氧代谢,导致糖酵解和肌内脂肪沉积增加等,进而对肉质造成影响[24]。在繁殖性能方面,以猪卵丘-卵母细胞复合体为模型,研究发现热应激通过干扰跨透明带突起(TZPs)中丝状肌动蛋白(F-actin)的组装与稳态,破坏卵丘颗粒细胞和卵母细胞的间隙连接,以及激活细胞中半胱天冬蛋白酶-3(Caspase-3)的表达导致其卵母细胞成熟缓慢和质量下降[25];还有研究表明,长期热暴露抑制线粒体ATP产生,增加线粒体活性氧(ROS),上调卵丘颗粒细胞RNA去甲基化酶(FTO)表达,并诱导穿透素3(PTX3)mRNA 3’端非编码区(3’-UTR)特定位点去甲基化,导致猪卵母细胞成熟障碍[26]。热应激还会干扰妊娠后期母体肠道微生物组成及垂直传递,影响子代的肠道微生物组成和血清代谢谱,对机体代谢稳态起到负面作用[27]。在雄性动物方面,研究发现,热应激通过诱导糖原合成酶激酶3α(GSK3α)激活,进而对精子活力造成影响[28]。此外,研究还发现了热应激通过上调葡萄糖调节蛋白78(GRP78)和Caspase-3表达诱导内质网应激并下调Wnt/β-连环蛋白(β-catenin)信号通路抑制肠上皮细胞增殖和干细胞扩增,破坏肠道上皮完整性,而Wnt/β-catenin是改善肠上皮损伤的重要靶点[29]。
如上所述,高密度饲养引起养殖场空气质量问题日益突出,特别是养殖舍内颗粒物污染和气溶胶可通过呼吸直接刺激呼吸道,引起家畜呼吸道健康及相关疾病的问题不容忽视。在畜禽舍中,悬浮在空气中的固态和液态颗粒物(粒径1 nm~100 μm)形成的气溶胶,往往附着氨气(NH3)、病原微生物等成分,其中,粒径低于2.5 μm的粒子可进入呼吸道甚至进入肺泡并沉积,引发畜禽气管炎、支气管炎或肺炎等疾病[30]。还有研究表明,在断奶仔猪、生长肥育猪、妊娠母猪和分娩母猪4种猪舍中,最丰富的微生物和抗生素抗性基因类型分别是变形菌门(Proteobacteria)和氨基糖苷类(aminoglycosides),并在舍内生物气溶胶中发现了3种潜在的病原体和18种可能的携带抗生素抗性基因的微生物属[31]。对从保育猪舍收集的PM2.5研究发现,颗粒物浓度普遍较高(如内毒素浓度高达681.80 EU/mg),PM2.5可激活3D4/21猪肺泡巨噬细胞Toll样受体4(TLR4)/髓样分化因子88(MyD88)通路和核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)炎性体,诱导细胞凋亡、ROS产生和炎性细胞因子如白细胞介素-1β(IL-1β)、白细胞介素-18(IL-18)、肿瘤坏死因子-α(TNF-α)和环氧化酶-2(COX-2)的释放,且发现TLR4/MyD88、丝裂原活化蛋白激酶(MAPK)和核因子-κB(NF-κB)的下游信号通路参与了NLRP3炎症体的激活[32]。畜禽舍内的空气颗粒物对人和动物的呼吸健康均有不利影响,有研究利用蛋鸡舍PM2.5处理人肺腺癌肺泡基底上皮细胞(A549细胞)诱导炎症反应,发现Nrf2过表达可显著降低TNF-α、白细胞介素-6(IL-6)、白细胞介素-8(IL-8)以及NF-κB p65和NF-κB pp65的水平,抑制氧化应激和内质网应激,进而减轻由PM2.5刺激引起的炎症反应[33]。
2.3 养殖环境中的有毒有害气体对畜禽健康的影响机制畜禽养殖过程中会产生许多有毒有害气体,其中NH3占比最多,硫化氢(H2S)的毒性最大。近年来,大量研究揭示了H2S和NH3导致气管组织和免疫器官炎症反应、细胞凋亡的表观遗传调控机制,并发现环状RNA(cirRNA)、长非编码RNA(lncRNA)和微小RNA(miRNA)参与有毒有害气体调控炎症、细胞凋亡、细胞焦亡的分子机制,例如lncRNA-107053293、miR-148a-3p、cirRNA-17828、miR-6631-5p、lncRNA3037、miR-15a、cir-PTPN23等一批表征损伤的分子标记物[34-37]。
研究还发现,养殖环境中的NH3干扰生长猪骨骼肌脂质代谢(图 1),且存在浓度依赖性,当NH3浓度达到10 mg/m3时即增加骨骼肌粗脂肪含量,引起骨骼肌肌纤维类型转化;当浓度大于25 mg/m3时,除肌内脂肪含量增加和肌纤维由氧化型向酵解型转化外,骨骼肌中脂质代谢相关基因表达发生明显改变[38]。猪暴露在高NH3浓度环境(NH3浓度高于25 mg/m3)中时,肝脏、肺脏和肌肉中支链氨基酸转氨酶1/2(BCAT1/2)和脱氢酶复合物(BCKDC)的表达受到不同程度的抑制,增加了血清或肝脏外组织中游离支链氨基酸(BCAA)含量[39];养殖环境高NH3浓度暴露导致肠道中潜在致病菌[阴性芽孢杆菌属(Negativibacillus)、拟普雷沃氏菌属(Alloprevotella)]丰度增加,有益菌[阿克曼氏菌属(Akkermansia)]丰度减少,肠道菌群紊乱,进而影响机体胆汁酸代谢[40]。进一步研究发现,环境NH3暴露引起肝外BCAA和芳香族氨基酸以及微生物来源的次级胆汁酸[石胆酸(LCA)和去氧胆酸(DCA)]含量升高,可作为信号分子激活骨骼肌哺乳动物雷帕霉素靶蛋白(mTOR)信号通路,抑制5’单磷酸腺苷活化蛋白激酶(AMPK)信号通路,最终通过上调脂质合成相关基因、下调β-氧化相关基因,紊乱骨骼肌脂质代谢[41]。
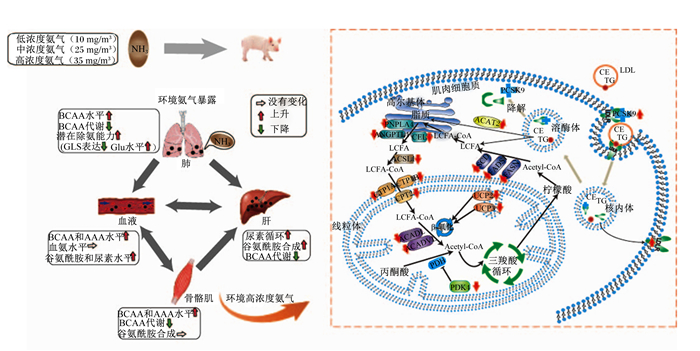
|
NH3:氨气ammonia;BCAA:支链氨基酸branched-chain amino acids;AAA:芳香族氨基酸aromatic amino acid;GLS:谷氨酰胺酶glutaminase;Glu:谷氨酸glutamate;LDL:低密度脂蛋白low-density lipoprotein;CE:胆固醇酯cholesterol esters;TG:甘油三酯triglyceride;PCSK9:前蛋白转化酶枯草溶菌素9 proprotein convertase subtilisin kexin type 9;UCP2/3:解偶联蛋白2/3 uncoupling protein 2/3;PNPLA4:Patatin样磷脂酶结构蛋白Patatin like phospholipase domain containing 4;ANGPTL4:血管生成素样蛋白4 angiopoietin like protein 4;CEL:羧基酯脂肪酶carboxyl ester lipase;LCFA-CoA:长链脂肪酸-辅酶A long chain fatty acid-CoA;ACAT2:乙酰辅酶A乙酰转移酶2 acetyl-CoA acetyltransferase 2;ACSL1:长链酰基-辅酶A合成酶1 long-chain acyl-CoA synthetase 1;CTP1A/1B/2:肉碱棕榈酰基转移酶A/1B/2 carnitine palmitoyltransferase 1A/1B/2;ACADL:长链酰基辅酶A脱氢酶acyl-CoA dehydrogenase long chain;ACADVL:极长链酰基辅酶A脱氢酶acyl-CoA dehydrogenase very long chain;Acetyl-CoA:乙酰辅酶A acetyl coenzyme A;PDH:丙酮酸脱氢酶pyruvate dehydrogenase;PDK4:丙酮酸脱氢酶激酶4 pyruvate dehydrogenase kinase 4。 图 1 氨气暴露通过BCAA-mTOR途径紊乱骨骼肌脂质代谢 Fig. 1 NH3 exposure disrupts skeletal muscle lipid metabolism through BCAA-mTOR pathway[39, 41] |
在繁殖方面,环境中高浓度NH3、H2S等有害气体导致畜禽精神萎靡、食欲不振,间接紊乱其生殖相关激素水平,对胚胎发育造成危害;而H2S还会干扰雄性动物的精子生成,影响卵母细胞的发育,降低后叶催产素的刺激作用,并导致母畜分娩时间延长[42]。有趣的是,研究发现,H2S呈浓度依赖性方式通过激活磷脂酰肌醇3-激酶(PI3K)/Akt和NF-κB信号通路,改善牛乳腺上皮细胞(MAC-T细胞)活力、炎症反应和凋亡,而Akt似乎是起到“桥梁”作用的关键串扰分子,表明硫氢化钠(NaHS)在临床上可用于预防或治疗乳房炎[43]。进一步研究发现,NaHS提供的外源H2S通过PI3K/Akt-mTOR途径对母猪乳腺上皮细胞(PMEC)的增殖产生双相效应,10 μmol/L NaHS会促进PMEC细胞增殖,而当浓度大于600 μmol/L时会诱导相关增殖基因表达的变化[44]。
3 精准营养需求下的畜禽养殖环境生理学与调控创新研究的思考当前我国动物营养与环境领域在理论探索、关键技术突破以及标准制定等方面表现出良好的开端,下一步还需系统解析主要畜禽集约化养殖生产中环境因素对其生长发育、基础代谢、蛋白质沉积等生理过程的影响。并利用Meta分析等手段整合交互作用,建立畜禽舍环境参数耦合优化的精准饲养技术,是实现畜禽健康、高效生产和绿色养殖的重要途径(图 2)。
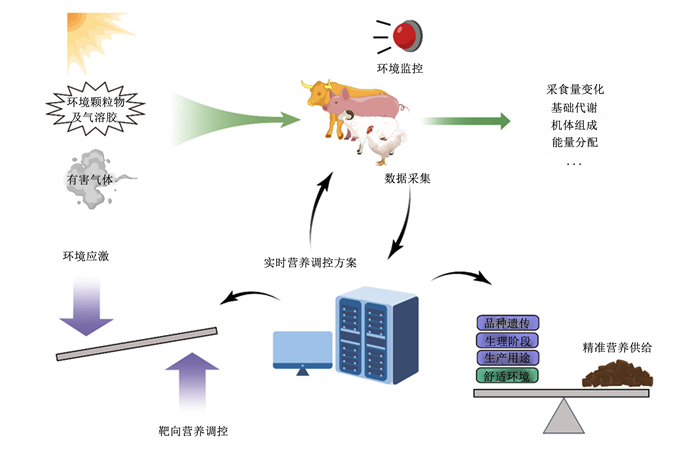
|
图 2 动物营养-环境交叉融合创新策略 Fig. 2 Animal nutrition-environment cross-integration innovation strategy |
鉴于此,从不同“思维角度”提出精准饲养-环境创新研究发展的如下思考:
3.1 养殖环境因素对畜禽基础代谢、食欲、机体组成及能量分配的影响机制目前,畜禽在不同环境下的能量动态代谢规律以及营养需求仍不清晰,且深入探究环境因素干预畜禽下丘脑与胃肠道的途径、与脂肪组织等外周组织“信息交流”的方式,以及不同环境的综合调控作用,对未来健康、高效养殖技术的发展具有重要的指导意义。此外,如上述的研究表明,环境NH3暴露在生长猪骨骼肌发育和脂肪沉积过程中发挥着明显的干预作用,而类似的系统性研究还较为缺乏,亟需拓展环境因素(包括但不限于温热)影响畜禽机体代谢和机体养分分配的相关研究,以阐明其中涉及的重要机制。
3.2 养殖环境因素及其精准营养供给模型的构建健康和高效的精准饲养技术的发展,还需对复杂情况下畜禽营养需要及环境生理学进行精确研究,准确定位参数。一方面,建立可精准调节的单一环境因素影响畜禽采食、生长及生产等相关基础模型;另一方面,构建复杂小气候中畜禽的动态能量需要和代谢规律等综合模型以支撑高效精准饲养技术的发展。
3.3 养殖环境应激的营养与代谢调控机制研究从畜禽自身健康出发,以改善其抗病、抗应激能力为主题,开发靶向营养与代谢调控、减抗替抗等产品或技术。此外,还需发展养殖环境精准把控技术,包括动物行为分析、环境因素精准监测等,提高智能化水平,并与精准饲养技术结合,通过高效、可靠和综合的管理手段,实现畜禽产品绿色、高效、安全转化。
4 小结畜禽养殖是个系统性工程,其中,环境因素对动物不同生理阶段及生理活动的影响机制极为复杂。养殖舍内环境因子众多,包括温湿度、有毒有害气体、单元密度、颗粒物、光照、噪音、电磁波、微生物等,可协同对畜禽健康产生复合效应。养殖环境是畜禽生存和生产最直接的影响因素,也是精准饲养乃至畜禽产品优质安全的重要前提,进一步实现健康、高效养殖亟需发展畜禽舍环境参数耦合优化的精准饲养技术。因此,动物营养与环境领域融合创新是突破养殖业高质量、可持续发展瓶颈的有力措施。
| [1] |
佚名. "十四五"全国畜牧兽医行业发展规划[J]. 中国畜牧业, 2022(1): 16-25. Anon. Fourteen-five national animal husbandry and veterinary medicine industry development planning[J]. China Animal Industry, 2022(1): 16-25 (in Chinese). |
| [2] |
POMAR C, REMUS A. Precision pig feeding: a breakthrough toward sustainability[J]. Animal Frontiers, 2019, 9(2): 52-59. DOI:10.1093/af/vfz006 |
| [3] |
ANDRETTA I, POMAR C, RIVEST J, et al. Precision feeding can significantly reduce lysine intake and nitrogen excretion without compromising the performance of growing pigs[J]. Animal, 2016, 10(7): 1137-1147. DOI:10.1017/S1751731115003067 |
| [4] |
张宏福. 加强环境生理研究应用支撑畜禽养殖绿色发展[J]. 中国农业科学, 2018, 51(16): 3159-3161. ZHANG H F. Strengthen the application of environmental physiology research and support the development of healthy livestock and poultry farming[J]. Scientia Agricultura Sinica, 2018, 51(16): 3159-3161 (in Chinese). DOI:10.3864/j.issn.0578-1752.2018.16.011 |
| [5] |
印遇龙. 动物营养学: 无抗时代下的精准营养与肠道城墙[J]. 中国科学(生命科学), 2020, 50(9): 895-896. YIN Y L. Animal nutrition: precision nutrition and intestinal walls in an antibiotic-free era[J]. Science China (Life Sciences), 2020, 50(9): 895-896 (in Chinese). |
| [6] |
胡杰, 刘岭, 张帅, 等. 影响猪饲料原料有效能值的关键化学成分[J]. 中国科学(生命科学), 2020, 50(9): 939-947. HU J, LIU L, ZHANG S, et al. Key chemical components affecting the available energy of feed ingredients in pigs[J]. Science China (Life Sciences), 2020, 50(9): 939-947 (in Chinese). |
| [7] |
王钰明, 赵峰, 张虎, 等. 仿生消化法评定猪饲料营养价值的研究进展[J]. 动物营养学报, 2016, 28(5): 1324-1331. WANG Y M, ZHAO F, ZHANG H, et al. Advance on the development of bionic digestion method to evaluate the nutritional value of feed for pig[J]. Chinese Journal of Animal Nutrition, 2016, 28(5): 1324-1331 (in Chinese). DOI:10.3969/j.issn.1006-267X.2016.05.006 |
| [8] |
HAUSCHILD L, LOVATTO P A, POMAR J, et al. Development of sustainable precision farming systems for swine: estimating real-time individual amino acid requirements in growing-finishing pigs[J]. Journal of Animal Science, 2012, 90(7): 2255-2263. DOI:10.2527/jas.2011-4252 |
| [9] |
陈伟生, 关龙, 黄瑞林, 等. 论我国畜牧业可持续发展[J]. 中国科学院院刊, 2019, 34(2): 135-144. CHEN W S, GUAN L, HUANG R L, et al. Sustainable development of animal husbandry in China[J]. Bulletin of the Chinese Academy of Sciences, 2019, 34(2): 135-144 (in Chinese). DOI:10.16418/j.issn.1000-3045.2019.02.002 |
| [10] |
张宏福. 环境生理在畜禽健康养殖中的研究与应用[J]. 中国家禽, 2015, 37(24): 1-4. ZHANG H F. Research and application of environmental physiology in livestock and poultry healthy breeding[J]. China Poultry, 2015, 37(24): 1-4 (in Chinese). DOI:10.16372/j.issn.1004-6364.2015.24.001 |
| [11] |
郑卫军. 养猪应重视猪场和猪舍环境[J]. 中国猪业, 2009, 4(3): 62-63. ZHENG W J. Pig raising should pay attention to the environment of pig farms and pig houses[J]. China Swine Industry, 2009, 4(3): 62-63 (in Chinese). DOI:10.16174/j.cnki.115435.2009.03.016 |
| [12] |
张宏福. 畜禽环境生物学[M]. 北京: 科学出版社, 2021. ZHANG H F. Environmental biology of livestock and poultry[M]. Beijing: Science Press, 2021 (in Chinese). |
| [13] |
LI Z Q, ZHAO J, LIU H Y, et al. Melatonin inhibits apoptosis in mouse Leydig cells via the retinoic acid-related orphan nuclear receptor α/p53 pathway[J]. Life Sciences, 2020, 246: 117431. DOI:10.1016/j.lfs.2020.117431 |
| [14] |
DONG Y Y I, ZHAO J, ZHU Q Y, et al. Melatonin inhibits the apoptosis of rooster Leydig cells by suppressing oxidative stress via AKT-Nrf2 pathway activation[J]. Free Radical Biology and Medicine, 2020, 160: 1-12. DOI:10.1016/j.freeradbiomed.2020.06.024 |
| [15] |
WANG P L, SUN Y Y, LI Y L, et al. Monochromatic green light stimulation during incubation shortened the hatching time via pineal function in white Leghorn eggs[J]. Journal of Animal Science and Biotechnology, 2021, 12(1): 17. DOI:10.1186/s40104-020-00539-x |
| [16] |
冯培功, 郭艳丽, 杨华明, 等. 畜禽饲养密度对畜禽生产性能及健康影响的研究进展[J]. 黑龙江畜牧兽医, 2018(4): 34-38. FENG P G, GUO Y L, YANG H M, et al. Research progress on the effect of stocking density on the health and production of livestock and poultry[J]. Heilongjiang Animal Science and Veterinary Medicine, 2018(4): 34-38 (in Chinese). DOI:10.13881/j.cnki.hljxmsy.2017.06.0128 |
| [17] |
周凯, 刘春龙, 吴信. 集约化饲养条件下饲养密度对猪生长性能和健康影响的研究进展[J]. 动物营养学报, 2019, 31(1): 57-62. ZHOU K, LIU C L, WU X. Research progress of effects of stocking density on growth performance and health of pigs under intensive production model[J]. Chinese Journal of Animal Nutrition, 2019, 31(1): 57-62 (in Chinese). DOI:10.3969/j.issn.1006-267x.2019.01.007 |
| [18] |
LIN S X, LIU J X, WANG K Y, et al. Effects of stocking density on oxidative stress status and mammary gland permeability in early lactating dairy cows[J]. Animal Science Journal, 2019, 90(7): 894-902. DOI:10.1111/asj.13206 |
| [19] |
袁艳枝, 魏凤仙, 王琳燚, 等. 肉鸡饲养密度研究进展[J]. 中国家禽, 2020, 42(6): 96-101. YUAN Y Z, WEI F X, WANG L Y, et al. Research progress on stocking density of broilers[J]. China Poultry, 2020, 42(6): 96-101 (in Chinese). |
| [20] |
LI X M, ZHANG M H, LIU S M, et al. Effects of stocking density on growth performance, growth regulatory factors, and endocrine hormones in broilers under appropriate environments[J]. Poultry Science, 2019, 98(12): 6611-6617. DOI:10.3382/ps/pez505 |
| [21] |
YIN C, XIA B, TANG S L, et al. The effect of exogenous bile acids on antioxidant status and gut microbiota in heat-stressed broiler chickens[J]. Frontiers in Nutrition, 2021, 8: 747136. DOI:10.3389/fnut.2021.747136 |
| [22] |
FANG W, WEN X B, MENG Q S, et al. Alteration in bile acids profile in large white pigs during chronic heat exposure[J]. Journal of Thermal Biology, 2019, 84: 375-383. DOI:10.1016/j.jtherbio.2019.07.027 |
| [23] |
HE X F, LU Z, MA B B, et al. Effects of chronic heat exposure on growth performance, intestinal epithelial histology, appetite-related hormones and genes expression in broilers[J]. Journal of the Science of Food and Agriculture, 2018, 98(12): 4471-4478. DOI:10.1002/jsfa.8971 |
| [24] |
LU Z, HE X F, MA B B, et al. Chronic heat stress impairs the quality of breast-muscle meat in broilers by affecting redox status and energy-substance metabolism[J]. Journal of Agricultural and Food Chemistry, 2017, 65(51): 11251-11258. DOI:10.1021/acs.jafc.7b04428 |
| [25] |
YIN C, LIU J, HE B, et al. Heat stress induces distinct responses in porcine cumulus cells and oocytes associated with disrupted gap junction and trans-zonal projection colocalization[J]. Journal of Cellular Physiology, 2019, 234(4): 4787-4798. DOI:10.1002/jcp.27277 |
| [26] |
YIN C, LIU J, CHANG Z L, et al. Heat exposure impairs porcine oocyte quality with suppressed actin expression in cumulus cells and disrupted F-actin formation in transzonal projections[J]. Journal of Animal Science and Biotechnology, 2020, 11(1): 71. |
| [27] |
HE J W, ZHENG W J, TAO C Y, et al. Heat stress during late gestation disrupts maternal microbial transmission with altered offspring's gut microbial colonization and serum metabolites in a pig model[J]. Environmental Pollution, 2020, 266(Pt 3): 115111. |
| [28] |
GONG Y B, ZHANG Z L, CHANG Z L, et al. Inactivation of glycogen synthase kinase-3α is required for mitochondria-mediated apoptotic germ cell phagocytosis in Sertoli cells[J]. Aging, 2018, 10(11): 3104-3116. |
| [29] |
ZHOU J Y, HUANG D G, ZHU M, et al. Wnt/β-catenin-mediated heat exposure inhibits intestinal epithelial cell proliferation and stem cell expansion through endoplasmic reticulum stress[J]. Journal of Cellular Physiology, 2020, 235(7/8): 5613-5627. |
| [30] |
许铭洙, 杨勇, 郭振东, 等. 保育和育肥猪舍气溶胶微生物组成和四环素类抗性基因丰度研究[J]. 中国畜牧杂志, 2019, 55(5): 99-102, 106. XU M Z, YANG Y, GUO Z D, et al. Comparison of bacterial composition and antibiotic resistance genes abundances in bioaerosols between nursery buildings and finishing buildings[J]. Chinese Journal of Animal Science, 2019, 55(5): 99-102, 106 (in Chinese). |
| [31] |
YAN H L, LI Y, ZHANG Y, et al. Deciphering of microbial diversity and antibiotic resistome of bioaerosols in swine confinement buildings[J]. Science of the Total Environment, 2021, 781: 147056. |
| [32] |
TANG Q, HUANG K, LIU J Z, et al. Fine particulate matter from pig house induced immune response by activating TLR4/MAPK/NF-κB pathway and NLRP3 inflammasome in alveolar macrophages[J]. Chemosphere, 2019, 236: 124373. |
| [33] |
DAI P Y, SHEN D, SHEN J K, et al. The roles of Nrf2 and autophagy in modulating inflammation mediated by TLR4-NFκB in A549 cell exposed to layer house particulate matter 2.5 (PM2.5)[J]. Chemosphere, 2019, 235: 1134-1145. |
| [34] |
WANG W, SHI Q X, WANG S C, et al. Ammonia regulates chicken tracheal cell necroptosis via the LncRNA-107053293/MiR-148a-3p/FAF1 axis[J]. Journal of Hazardous Materials, 2020, 386: 121626. |
| [35] |
CHI Q R, HU X Y, ZHAO B, et al. Regulation of H2S-induced necroptosis and inflammation in broiler bursa of Fabricius by the miR-15b-5p/TGFBR3 axis and the involvement of oxidative stress in this process[J]. Journal of Hazardous Materials, 2021, 406: 124682. |
| [36] |
SONG N, LI X J, CUI Y, et al. Hydrogen sulfide exposure induces pyroptosis in the trachea of broilers via the regulatory effect of circRNA-17828/miR-6631-5p/DUSP6 crosstalk on ROS production[J]. Journal of Hazardous Materials, 2021, 418: 126172. |
| [37] |
WANG S C, WANG W, LI X J, et al. Cooperative application of transcriptomics and ceRNA hypothesis: lncRNA-107052630/miR-205a/G0S2 crosstalk is involved in ammonia-induced intestinal apoptotic injury in chicken[J]. Journal of Hazardous Materials, 2020, 396: 122605. |
| [38] |
TANG S L, XIE J J, ZHANG S, et al. Atmospheric ammonia affects myofiber development and lipid metabolism in growing pig muscle[J]. Animals, 2019, 10(1): 2. |
| [39] |
TANG S L, YIN C, XIE J J, et al. Aerial ammonia exposure induces the perturbation of the interorgan ammonia disposal and branched-chain amino acid catabolism in growing pigs[J]. Animal Nutrition, 2021, 7(4): 947-958. |
| [40] |
TANG S L, ZHONG R Q, YIN C, et al. Exposure to high aerial ammonia causes hindgut dysbiotic microbiota and alterations of microbiota-derived metabolites in growing pigs[J]. Frontiers in Nutrition, 2021, 8: 689818. |
| [41] |
TANG S L, XIE J J, WU W D, et al. High ammonia exposure regulates lipid metabolism in the pig skeletal muscle via mTOR pathway[J]. Science of the Total Environment, 2020, 740: 139917. |
| [42] |
赵勇, 沈伟, 张宏福. 大气微粒、氨气和硫化氢影响动物繁殖机能和生产性能的研究进展[J]. 中国农业科技导报, 2016, 18(4): 132-138. ZHAO Y, SHEN W, ZHANG H F. Research progress on effects of air particle matters, NH3 and H2S on animal fertility and performance[J]. Journal of Agricultural Science and Technology, 2016, 18(4): 132-138 (in Chinese). |
| [43] |
WANG Y Y, ZHANG C Y, XU C M, et al. H2S mediates apoptosis in response to inflammation through PI3K/Akt/NFκB signaling pathway[J]. Biotechnology Letters, 2020, 42(3): 375-387. |
| [44] |
ZHANG J, YE J Y, YUAN C, et al. Exogenous H2S exerts biphasic effects on porcine mammary epithelial cells proliferation through PI3K/Akt-mTOR signaling pathway[J]. Journal of Cellular Physiology, 2018, 233(10): 7071-7081. |



