美国佛罗里达大学、加州大学、巴基斯坦白沙瓦农业大学等近年来的研究显示,反刍动物添加酶制剂是有效果的[1-3]。特别是高投入、高产出的奶牛,就如一个“奶产品工厂”,其瘤胃是一个“生物发酵罐”,在高投入、富营养等情况下,瘤胃微生物和微生态的压力及应激状态已经超过了瘤胃本身的能力,需要外源酶制剂等辅助通过营养和调控的手段来保证其发酵系统完整[4-5]。在应激的情况下(如高温应激、高营养应激等),会影响瘤胃的微生物和整个微生态的系统,导致一些健康的问题,也需要外源酶制剂等修复因此损伤的瘤胃功能。反刍动物应用外源酶制剂的3个基础包括:一是酶制剂能够有效促进粗饲料高效消化分解;二是酶制剂能够调节瘤胃微生物活性与微生态问题;三是酶制剂能够减少瘤胃的异常发酵[6]。
但是,目前的反刍动物酶制剂还局限于普通猪、禽等单胃动物用酶制剂的传统思路,只是帮助消化饲粮,这是不完整的酶制剂应用模式,必须创新反刍动物用酶思维、拓宽反刍动物用酶思路,特别是多生产周期、多个胎次、多年利用的高产奶牛尤其如此。
1 反刍动物酶制剂的特殊性及其饲用价值 1.1 反刍动物饲料原料的复杂性反刍动物饲料原料的复杂性体现在物理特性和化学特性2方面。物理特性是指饲料原料组分中不同成分的空间结构与嵌合方式及程度等;化学特性是指饲料原料,特别是粗饲料,内部有很多结构,不仅仅是蛋白质、纤维、植酸等同一类成分的组成单位的差异与主链长短及支链分布形式等[2, 5]。
1.2 反刍动物消化道的复杂性反刍动物消化道的复杂性体现在瘤胃的功能与微生物维系2方面。瘤胃的功能方面,瘤胃本身就是一个“生物发酵罐”,既消化分解也生物合成。人工的微生物发酵和酶制剂的生产,实际上是一种天然生物发酵罐的仿生。微生物维系方面,微生物有个最大生物量,需要持久的良性微生态平衡,也许这个发酵罐是完整的,功能是完善的,但是瘤胃里的微生物包括细菌、真菌、病毒,甚至原虫,生物活性是敏感而且脆弱的,保持有效的活菌数等功能方面受到许多因素的影响,这是反刍动物消化生理的独特性[7-9]。
瘤胃是一个精巧的、多功能的天然“生物发酵罐”,可以消化分解低质粗饲料(差的变好),另外也可能浪费优质精饲料(好的变差),需要考虑如何规避后种情况[10-11]。另外,瘤胃可以生物合成与分解,一方面合成许多营养和生物活性因子(氨基酸、功能肽、维生素K和B族维生素、消化分解酶等),另一方面消耗营养(能量、氨基酸、维生素等)。添加外源酶制剂来帮助瘤胃消化,减轻了微生物瘤胃消化过程的消耗,是一种营养的节省,瘤胃微生物的发酵、分解的过程,是一种能量、维生素消耗的过程,如果用外源酶制剂来消化,就减少了一些珍贵营养物质的消耗,使其可以在消化道后段被吸收[6, 12]。
作为“生物发酵罐”,瘤胃容易受到理化因素的影响,特别是高投入、高产出的奶牛,容易超负荷,进而出现代谢病,影响其发酵功能,影响“生物发酵罐”的完整性,导致奶牛生产性能下降,甚至影响奶牛产奶的利用年限。作为“生物发酵罐”的瘤胃需要维护,可以考虑以下3个方面:一是饲粮的组成成分适合、营养成分适当、营养水平适度;二是外源调节物添加,减轻瘤胃微生物的负担;三是外源调节物添加,提高瘤胃微生物的综合生物量(微生物种类、数量、有效活力和繁殖潜力等)[6, 13]。
1.3 反刍动物酶制剂的应用价值酶制剂在反刍动物中的应用有3个目的:一是酶制剂通过降解饲料组分(如粗纤维、粗蛋白质)直接帮助消化;二是酶制剂通过分解导致异常发酵的组分(如高淀粉、非淀粉多糖)减轻瘤胃负担;三是酶制剂通过产生饲料原料型的益生元促进瘤胃微生物的繁殖。外源酶、益生菌、益生元等都可以作为发酵功能的瘤胃外源调节物,而外源酶制剂同时具有双重作用:一是催化分解,辅助消化,减轻发酵压力;二是调节微生物的发酵潜力,产生有益的产物,提高发酵效率,水解碳水化合物(包括非淀粉多糖)可能产生微生物需要的益生元,水解蛋白质可能产生微生物需要的功能肽[6, 12, 14]。
2 反刍动物酶制剂的技术体系与单胃动物不同,反刍动物用酶的助消化、改善饲料消化利用、提高有效营养供应只是其中一个方面,还需要考虑反刍动物,特别是高产奶牛多胎制、长时间利用年限的动物生物特点、生理特性、生产模式的不同。传统的单酶和复合酶及其技术体系能满足单胃动物的需要,但是无法满足反刍动物的需要。所以,反刍动物的酶制剂应用需要构建一个新的技术体系[15-16]。
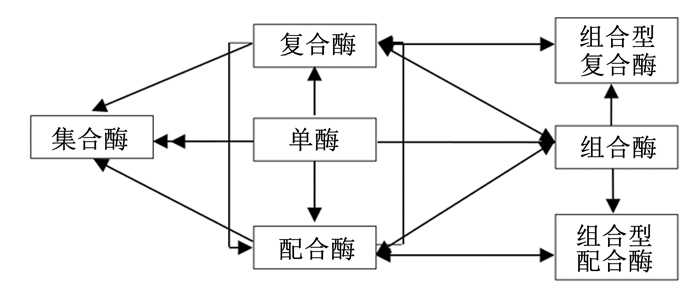
2.1 反刍动物酶制剂的整体架构体系加拿大农业与农业食品Lethbridge研究中心在讨论反刍动物添加饲料酶制剂时指出:“学者将来的任务是阐明外源性酶制剂的作用模式,这种作用模式可以是一个,也可以是多种的组合,使得外源性酶制剂能更好地改善饲料效率,增加生长和产奶量”[6]。长期以来,我们致力于饲料酶制剂技术体系的研究与实践,包括探索构建反刍动物酶制剂技术体系,通过理论思考和科学试验发现,反刍动物酶制剂技术体系是由多个作用模式组成,而且不同作用模式是可以组合的,在此基础上构建了一个反刍动物酶制剂的整体架构体系(图 1),该体系具有四大基础板块:单酶、复合酶、组合酶、配合酶,还有主效酶和辅效酶(针对微生物、部分益生元)2个辅助板块;形成集合酶、过瘤胃酶等5个反刍动物应用方案。

|
图 1 反刍动物饲料酶制剂技术体系 Fig. 1 Technology system of ruminant feed enzyme preparation |
基于长期酶制剂研究实践结合反刍动物消化生理与饲粮结构的特殊性,我们思考提炼出如下4个方面的新思路或者理论:1)解决粗饲料消化问题,需要一个具有仿生天然多酶系统的集合,称之为集合酶思路[17];2)瘤胃后段的真胃和小肠部位存在包括过瘤胃饲料与微生物产生的营养消化问题,外源酶需要逃脱瘤胃微生物及其酶的分解破坏进入到小肠,通过降低小肠食糜黏度或者水解瘤胃未能消化的饲料底物及微生物产生营养物质和产物,改善整体营养物质的吸收效果和效率,称之为过瘤胃酶思路[18];3)保证瘤胃微生态健康问题,需要一种外源酶与内源菌协同构建良好理化、营养、生物活性条件,称之为酶菌同构思路[19];4)反刍动物饲料体积大、粗饲料多,需要体外酶制剂预处理解决粗饲料消化问题,精料直接添加酶制剂在体内解决瘤胃微生物营养与微生态问题及消化道健康(特别是酸中毒和酮病等)问题,称之为体外处理与体内添加结合思路[12, 20-21]。
在上述4个创新思路或者理论基础上,形成反刍动物4个酶制剂的应用模式:1)粗饲料原料酶预处理;2)分解复杂原料的集合酶制剂;3)过瘤胃酶(包被处理);4)产生益生元酶制剂(如木聚糖酶主效酶,配合阿魏酸酯酶、阿拉伯呋喃糖苷酶等辅效酶)。4个酶制剂的应用模式可以是单独使用,也可以是多个组合使用,具体使用可根据动物的种类、发育阶段、生产周期、饲粮类型等。有些简单的情况,比如青贮的酶制剂预处理,需要用纤维素酶、木聚糖酶、果胶酶等,也可以添加过瘤胃淀粉酶、蛋白酶、脂肪酶等。高产奶牛生理状况比较敏感、微生态比较脆弱的情况下,需要添加特殊的外源酶产生益生元(益生元是瘤胃的细菌所需要的营养)。低产或者停止泌乳的奶牛,使用简单的复合酶或者配合酶即可。只有围产期的高产奶牛,才需要同时考虑4个模式的综合方案[6, 16, 18]。
2.3 反刍动物酶制剂的特色应用方案4种酶制剂应用方案中,过瘤胃酶和集合酶是其中最具反刍动物特色的应用方案。过瘤胃酶制剂可以对瘤胃内还没有完全消化的饲料成分和微生物产物继续进行消化,不仅是蛋白质、淀粉、脂肪和一些纤维类,甚至是由于体积比较大等没有被瘤胃微生物分解的营养物质,以及饲料残留的抗营养因子或有害成分。或者,协助消化降解瘤胃微生物产生的营养物质,包括菌体蛋白,通过瘤胃的蛋白酶就可以发挥作用,还可以降解瘤胃细菌,特别是细菌细胞壁等产生后生元(postbiotics),发挥维护后段消化道生态健康的积极作用[22-23]。
我们早期提出的组合型或者配合型酶的理念,实际上大自然里天然就存在这方面的系统,微生物及其产生的酶系或者酶的族群是大自然自我循环系统的重要组成。我们可以模拟天然多酶系统,也就是人工集合酶系统。集合酶思路是把单酶、复合酶、组合酶、配合酶等进行集合,根据饲粮类型与变化,作为一个整体考虑,或者是多种解决复杂原料酶制剂方案的一个集合(简称集合酶)。集合酶不像复合酶、组合酶等是一种产品,而是一种技术方案,特别是把组合酶与配合酶协同,形成集合酶系统,综合考虑饲料原料复杂的物理结构与多样的化学组成,最大程度解决消化的高效性问题(图 2)[16, 24]。
|
图 2 集合酶系统 Fig. 2 Aggregate enzyme system |
酶菌同构理念与过去酶制剂思维有本质的不同,它把酶制剂与微生物结合起来,考虑酶对菌的影响和意义,而传统的饲料酶只考虑酶对动物(宿主)的影响和价值。酶菌同构就把反刍动物特有的瘤胃看作是一个复杂而且精巧的“生物发酵罐”、“生物反应器”。为了保证最大效率和功能完整持久,需要外源因子与内源微生态互作,共同构建最适条件。除了营养物质外,外源添加的调控因子(如益生元、酵母细胞壁、酶制剂、酸碱缓冲剂等)主要是围绕瘤胃细菌,称为酶制剂应用的酶菌同构作用模式,或者称之为“瘤胃微生物益生酶”作用模式。瘤胃的酶菌同构是酶作为调控因子对目标细菌施加调节影响,是对应关系,需要强调的是以酶为主。
酶菌同构理念的价值有3个:一是酶制剂辅助细菌消化;二是酶制剂作用调节瘤胃的理化环境;三是外源酶可以使饲料底物产生益生元[6, 25-29]。
3.1 辅助瘤胃微生物发挥消化功能酶菌同构第1方面内容是酶辅助微生物消化,帮助瘤胃微生物消化。高产奶牛在高采食量、高营养的情况下,有针对性地结合复合酶,或者组合酶、配合酶,进行外源酶制剂集合,解决大量的难消化饲料的消化问题,减轻瘤胃微生物消化的负担[18, 30]。
3.2 调节瘤胃的理化环境酶菌同构第2方面内容是酶调节瘤胃理化环境。高产奶牛敏感脆弱特点,容易多种应激叠加,表现在瘤胃内部理化环境的变化,比如说酸中毒、离子状态、渗透压异常等。特别是采食大量高精料时,淀粉类饲料在异常发酵情况下产生丙酸、乳酸等,容易引起奶牛酸中毒,使用淀粉酶、糖化酶等,让可溶性糖水解直接吸收(如葡萄糖)。维持瘤胃良好的理化环境,减少淀粉类发酵产生丙酸、乳酸等,不影响瘤胃作为天然发酵罐的功能,减少酸中毒对微生物的活性、瘤胃组织功能的影响,对于需要维持比较长的利用年限的奶牛特别重要(相对而言,肉牛、肉羊考虑比较少)[15, 31-33]。
3.3 产生微生物需要的益生元酶菌同构第3方面内容是酶产生微生物需要的益生元,使瘤胃的微生物、细菌保持良好的状态。瘤胃的微生物补充能量、氨基酸、维生素以外,还要补充有别于宿主的益生元,需要通过外源酶来添加[34]。酶制剂具有益生功能,我们专门提出了“益生型酶制剂”的理念[15],就是酶制剂的降解产物,部分可以作为肠道微生物的益生元,调节肠道健康和微生态正常。这方面真正有重要价值的是在反刍动物肠道微生物,特别是瘤胃的细菌营养底物。益生元(主要为低聚糖)对肠道健康的调节是一种非侵略性的调节,因而具有更好的安全性[35-36]。
反刍动物要实现高产,还需要进一步考虑对瘤胃功能、瘤胃微生物的影响,可以借鉴酵母细胞壁应用的思路,进一步拓展酶菌同构的技术方案。木聚糖酶等主效酶结合阿魏酸脂酶、阿拉伯呋喃糖苷酶等辅效酶(或者说是小品种酶)的应用,可以产生瘤胃细菌需要的益生元,这与专门通过外源添加的益生元不同,这种内生性的,同生、伴生的益生元,有附加额外的价值[37-38]。
4 反刍动物酶制剂的研究实践酶制剂对反刍动物作用研究始于20世纪60年代,但效果不稳定[39-41]。随着发酵成本的降低及高活性酶制剂的问世,外源酶制剂对瘤胃微生物和反刍动物本身表现出越来越多、越来越大的积极作用。
酶制剂对奶牛产奶量影响报道,始于20世纪90年代中期,给奶牛饲喂由50%精料和喷洒2种酶制剂的玉米青贮组成的饲粮,产奶量增加了2.5 kg/d。研究表明,酶制剂可以增加饲喂紫花苜蓿干草/青贮饲粮的奶牛产奶量,且产奶量受酶制剂添加水平的影响[17]。外源性酶制剂对奶牛和肉牛生产性能具有促进作用已经得到证实,但遗憾的是至今还缺乏试验结果的一致性。加拿大农业与食品Lethbridge研究中心研究得出结论,在反刍动物饲粮中添加酶制剂对生产性能有改善作用,但是结果并不完全一致[18]。瘤胃消化道的特点(如有很多微生物菌落,能产生很多内源性酶制剂)使外源酶制剂在反刍动物体内作用机制更加复杂。外源性酶制剂在未被动物采食之前,就已经开始了对饲料的消化,能改善反刍动物瘤胃内的消化,减少后段消化道中饲料的消化负担。传统的反刍动物酶制剂主要是基于降解植物细胞壁而制作的酶,主要是纤维素酶和木聚糖酶。这些商品酶制剂中各种单一酶的相对比例和活性组成不同,会影响其效果。
新思路、新理念,甚至新的理论来构建奶牛酶制剂技术的体系是突破目前反刍动物酶制剂应用技术的重要基础。郑达文[39]研究发现,可以使用一些小品种酶来解决益生元的问题,用配合酶来解决一些结构性的问题。在此基础上,华南农业大学冯定远教授研究团队提出酶菌同构理念来设计反刍动物酶制剂,建议的酶谱组成如下:1)含有非淀粉多糖酶(包括木聚糖酶、纤维素酶等),特别是多种木聚糖酶的组合酶;2)含有蛋白酶、淀粉酶等,与第1类组成解决复杂饲料原料的配合酶;3)含有阿魏酸脂酶、阿拉伯呋喃糖苷酶等,与第1类组成酶菌同构的益生酶。酶菌同构设计出来的反刍动物酶制剂具有3个有效组分:外源酶、宿主消化道微生物菌群、消化道内源酶,3者相互配合,在空间上和时效上扩展放大酶制剂的作用效率。外源酶一方面起到饲料前处理作用,提供瘤胃丰富短链碳水化合物,以快速启动和高效促进瘤胃微生物消化效率,提高瘤胃微生物菌体蛋白合成效率;另一方面微生物发酵产生丰富且组成合理的有机酸,为消化道后段过瘤胃酶和宿主内源酶配合发挥延续性酶解作用提供重要的内环境,再者酶制剂定向酶解产生功能性寡糖有利于构建反刍动物消化道良性的微生态环境,酶菌良性互动,构建协同效应体系。
5 小结反刍动物,特别是高产奶牛的高投入、高产出模式,超过了瘤胃本身消化能力,容易产生应激,影响瘤胃微生物活性和微生态系统,外源酶制剂帮助有其必要性。为解决粗饲料消化和保证瘤胃微生物活性问题,与单胃动物酶制剂不同,需要构建新型反刍动物饲料酶技术体系,包括多酶系统集合的集合酶、外源酶与内源菌协同的酶菌同构等设计思路。
国内外的酶制剂开发应用实践表明,反刍动物酶制剂,特别是奶牛酶制剂具有突出价值。目前反刍动物酶制剂还停留在助消化(特别是粗饲料消化)的认知中,这是单胃动物酶制剂的技术思路。反刍动物酶制剂应用更复杂,结果不一致,影响因素很多。应该进一步考虑对瘤胃功能、瘤胃微生物的影响,进一步拓展酶菌同构的技术方案。理论上,找到合适的技术方案,可以提高反刍动物生产性能,特别是高产奶牛的产奶性能。
| [1] |
FERRARETTO L F, SHAVER R D, LUCK B D. Silage review: recent advances and future technologies for whole-plant and fractionated corn silage harvesting[J]. Journal of Dairy Science, 2018, 101(5): 3937-3951. DOI:10.3168/jds.2017-13728 |
| [2] |
CARDOSO F C. Invited review: applying fungicide on corn plants to improve the composition of whole-plant silage in diets for dairy cattle[J]. Applied Animal Science, 2020, 36(1): 57-69. DOI:10.15232/aas.2019-01905 |
| [3] |
LUCK B D, DREWRY J L, SHAVER R D, et al. Predicting in situ dry matter disappearance of chopped and processed corn kernels using image-analysis techniques[J]. Applied Animal Science, 2020, 36(4): 480-488. DOI:10.15232/aas.2020-01993 |
| [4] |
ZHANG M F, QIN Y H, MA J Y, et al. Depolymerization of microcrystalline cellulose by the combination of ultrasound and Fenton reagent[J]. Ultrasonics Sonochemistry, 2016, 31: 404-408. DOI:10.1016/j.ultsonch.2016.01.027 |
| [5] |
吴爽, 周玉香, 贾柔, 等. 饲用酶制剂在反刍动物生产中的应用概况[J]. 动物营养学报, 2020, 32(7): 3005-3011. WU S, ZHOU Y X, JIA R, et al. Application situation of feeding enzyme preparation in ruminant production[J]. Chinese Journal of Animal Nutrition, 2020, 32(7): 3005-3011 (in Chinese). |
| [6] |
冯定远. 反刍动物饲料酶制剂作用模式及其技术体系的建立[J]. 饲料工业, 2022, 43(7): 1-8. FENG D Y. The functional mechanism and technical system establishment of exogenous enzymes preparation for ruminant feed[J]. Feed Industry, 2022, 43(7): 1-8 (in Chinese). |
| [7] |
SIDIQUE H S, KHAN M T, ULLAH H A. Effect of different levels of fibrolytic enzyme on feed digestibility and production performance in lactating dairy cows[J]. Pure Applied Biology, 2020, 9(1): 918-924. |
| [8] |
DEVANT M, YU S K, GENÍS S, et al. Effects of exogenous glucoamylase enzymes alone or in combination with a neutral protease on apparent total tract digestibility and feces D-lactate in crossbred Angus bulls fed a ration rich in rolled corn[J]. Animals, 2020, 10(6): 1077. DOI:10.3390/ani10061077 |
| [9] |
PECH-CERVANTES A A, OGUNADE I M, JIANG Y, et al. Effects of a xylanase-rich enzyme on intake, milk production, and digestibility of dairy cows fed a diet containing a high proportion of bermudagrass silage[J]. Journal of Dairy Science, 2021, 104(7): 7671-7681. DOI:10.3168/jds.2020-19340 |
| [10] |
WHITE B A, MACKIE R I, DOERNER K C. Enzymatic hydrolysis of forage cell walls[C]//JUNG H G, BUXTON D R, HATFIELD R D, et al. Forage Cell Wall Structure and Digestibility. Madison: American Society of Agronomy Crop Science Society of America Soil Science Society of America, 1993: 455-484.
|
| [11] |
赵连生, 王典, 王有月, 等. 饲粮中添加复合酶制剂对奶牛瘤胃发酵、营养物质表观消化率和生产性能的影响[J]. 动物营养学报, 2018, 30(10): 4172-4180. ZHAO L S, WANG D, WANG Y Y, et al. Effects of compound enzyme preparation on rumen fermentation, apparent digestibility of nutrients and performance of lactating Cows[J]. Chinese Journal of Animal Nutrition, 2018, 30(10): 4172-4180 (in Chinese). DOI:10.3969/j.issn.1006-267x.2018.10.043 |
| [12] |
解祥学, 杜红方, 陈书琴, 等. 外源酶制剂在反刍动物上的应用与展望[J]. 动物营养学报, 2016, 28(4): 1011-1019. JIE X X, DU H F, CHEN S Q, et al. Application and outlook of exogenous enzymes in ruminants[J]. Chinese Journal of Animal Nutrition, 2016, 28(4): 1011-1019 (in Chinese). DOI:10.3969/j.issn.1006-267x.2016.04.007 |
| [13] |
贾仙宝. 外源纤维酶对奶牛瘤胃发酵、消化代谢及生产性能影响的研究[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2009. JIA X B. Effects of exogenous fibrolytic enzyme on rumen fermentation, digestion, metabolism and performance of lactating cows[D]. Master's Thesis. Hohhot: Inner Mongolia Agricultural University, 2009. (in Chinese) |
| [14] |
李朝云. 壳聚糖与纤维素酶对瘤胃发酵、甲烷产生及微生物区系的影响[D]. 博士学位论文. 杨凌: 西北农林科技大学, 2014. LI C Y. Effects of chitosan and exogenous fibrolytic enzymes on in vitro ruminal fermentation, methane production and microorganism populations[D]. Ph. D. Thesis. Yangling: Northwest A&F University, 2014. (in Chinese) |
| [15] |
冯定远, 左建军. 饲料酶制剂技术体系的研究与实践[M]. 北京: 中国农业大学出版社, 2011. FENG D Y, ZUO J J. Research and application of feed enzyme technology[M]. Beijing: China Agricultural University Press, 2011 (in Chinese). |
| [16] |
冯定远, 左建军. 饲料酶制剂技术体系的发展与应用[M]. 北京: 中国农业出版社, 2019. FENG D Y, ZUO J J. Development and application of technical system of feed enzyme preparation[M]. Beijing: China Agriculture Press, 2019 (in Chinese). |
| [17] |
BEAUCHEMIN K A, RODE L M, YANG Z, et al. Use of feed enzymes in ruminant nutrition[C]//Proceedings of the 33th Pacific Northwest Nutrition Conference. [s. l. ]: [s. n. ], 1998: 121-135.
|
| [18] |
BEDFORD M R, PARTRIDGE G G. Enzymes in farm animal nutrition[M]. London: CABI Publishing, 2001: 273-298.
|
| [19] |
张盛明, 于兴华, 刘雨龙, 等. 植物乳杆菌与反刍动物专用复合酶混合处理对玉米秸秆瘤胃降解的影响[J]. 南京农业大学学报, 2021, 44(5): 951-957. ZHANG S M, YU X H, LIU Y L, et al. Effect of mixed treatment with Lactobacillus plantarum and ruminant complex enzyme on rumen degradation of corn straw[J]. Journal of Nanjing Agricultural University, 2021, 44(5): 951-957 (in Chinese). |
| [20] |
HRISTOV A N, MCALLISTER T A, CHENG K J. Effect of dietary or abomasal supplementation of exogenous polysaccharide-degrading enzymes on rumen fermentation and nutrient digestibility[J]. Journal of Animal Science, 1998, 76(12): 3146-3156. DOI:10.2527/1998.76123146x |
| [21] |
HRISTOV A N, MCALLISTER T A, CHENG K J. Intraruminal supplementation with increasing levels of exogenous polysaccharide-degrading enzymes: effects on nutrient digestion in cattle fed a barley grain diet[J]. Journal of Animal Science, 2000, 78(2): 477-487. DOI:10.2527/2000.782477x |
| [22] |
CONSIDINE P J, COUGHLAN M P. Production of carbohydratehydrolyzing enzyme blends by solid-stage fermentation[M]. New York: Elservier Applied Science, 1989: 273-281.
|
| [23] |
GASHE B A. Cellulase production and activity by Trichoderma sp.A-001[J]. Journal of Applied Bacteriology, 1992, 73(1): 79-82. DOI:10.1111/j.1365-2672.1992.tb04973.x |
| [24] |
INOUE H, YANO S N H, ENDO T, et al. Combining hot-compressed water and ball milling pretreatments to improve the efficiency of the enzymatic hydrolysis of eucalyptus[J]. Biotechnology for Biofuels, 2008, 1(1): 2. DOI:10.1186/1754-6834-1-2 |
| [25] |
NEWBOLD C J, FRUMHOLTZ P P, WALLACE R J. Influence of Aspergillus oryzae fermentation extract on rumen fermentation and blood constituents in sheep given diets of grass hay and barley[J]. The Journal of Agricultural Science, 1992, 119(3): 423-427. DOI:10.1017/S0021859600012272 |
| [26] |
HATFIELD R D. Cell wall polysaccharide interactions and degradability[C]//JUNG H G, BUXTON D R, HATFIELD R D, et al. Forage cell wall structure and digestibility. Madison: American Society of Agronomy Crop Science Society of America Soil Science Society of America, 2015: 285-313.
|
| [27] |
TENKANEN M, SCHUSEIL J, PULS J, et al. Production, purification and characterization of an esterase liberating phenolic acids from lignocellulosics[J]. Journal of Biotechnology, 1991, 18(1/2): 69-83. |
| [28] |
VAREL V H, KREIKEMEIER K K, JUNG H J, et al. in vitro stimulation of forage fiber degradation by ruminal microorganisms with Aspergillus oryzae fermentation extract[J]. Applied and Environmental Microbiology, 1993, 59(10): 3171-3176. DOI:10.1128/aem.59.10.3171-3176.1993 |
| [29] |
YANG W Z, BEAUCHEMIN K A, RODE L M. Effects of an enzyme feed additive on extent of digestion and milk production of lactating dairy cows[J]. Journal of Dairy Science, 1999, 82(2): 391-403. DOI:10.3168/jds.S0022-0302(99)75245-8 |
| [30] |
BEAUCHEMIN K A, JONES S D M, RODE L M, et al. Effects of fibrolytic enzymes in corn or barley diets on performance and carcass characteristics of feedlot cattle[J]. Canadian Journal of Animal Science, 1997, 77(4): 645-653. DOI:10.4141/A97-050 |
| [31] |
RUSSELL J B, DOMBROWSKI D B. Effect of pH on the efficiency of growth by pure cultures of rumen bacteria in continuous culture[J]. Applied and Environmental Microbiology, 1980, 39(3): 604-610. DOI:10.1128/aem.39.3.604-610.1980 |
| [32] |
GREVE L C, LABAVITCH J M, HUNGATE R E. Alpha-L-arabinofuranosidase from Ruminococcus albus 8:purification and possible role in hydrolysis of alfalfa cell wall[J]. Applied and Environmental Microbiology, 1984, 47(5): 1135-1140. DOI:10.1128/aem.47.5.1135-1140.1984 |
| [33] |
MATTE A, FORSBERG C W. Purification, characterization, and mode of action of endoxylanases 1 and 2 from Fibrobacter succinogenes S85[J]. Applied and Environmental Microbiology, 1992, 58(1): 157-168. DOI:10.1128/aem.58.1.157-168.1992 |
| [34] |
VAHJEN W, GLASER K, SCHAFER K, et al. Influence of xylanase-supplemented feed on the development of selected bacterial groups in the intestinal tract of broiler chicks[J]. The Journal of Agricultural Sciences, 1998, 130(4): 489-500. |
| [35] |
NEWBOLD C J, BROCK R, WALLACE R J. The effect of Aspergillus oryzae fermentation extract on the growth of fungi and ciliate protozoa in the rumen[J]. Letters in Applied Microbiology, 1992, 15(3): 109-112. DOI:10.1111/j.1472-765X.1992.tb00739.x |
| [36] |
NEWBO1D C J, FRUMHOLTZ P P, WALLACE R J. Influenceof Aspergillus oryzae fermentation extract on rumen fermentation and blood constituents in sheep given diets of grass hay and barley[J]. The Journal of Agricultural Science, 1992, 119(3): 423-427. DOI:10.1017/S0021859600012272 |
| [37] |
雷钊. 特异性阿拉伯木聚糖降解酶促进肉鸡肠道乳酸菌增殖的机理研究[D]. 博士学位论文. 北京: 中国农业大学, 2017. LEI Z. The machanisms of arabinoxylan-specific degrading enzymes improving Lactobacillus proliferation in the gut of broliers[D]. Ph. D. Thesis. Beijing: China Agricultural University, 2017. (in Chinese) |
| [38] |
郑达文. 木聚糖主链酶与侧链降解酶配合对猪日粮纤维的分解作用及应用价值研究[D]. 硕士学位论文. 广州: 华南农业大学, 2019. ZHENG D W. Study on the utilization of porcine Diet fiber by xylanase combined with arabinofuranosidase and ferulic acid esterase[D]. Master's Thesis. Guangzhou: South China Agricultural University, 2019. (in Chinese) |
| [39] |
BURROUGHS W, WOODS W, EWING S A, et al. Enzyme additions to fattening cattle rations[J]. Journal Animal Science, 1960, 19(2): 458-464. DOI:10.2527/jas1960.192458x |
| [40] |
ROVICS J J, ELY C M. Response of beef cattle to enzyme supplement[J]. Journal of Animal Science, 1962, 21: 1012. |
| [41] |
RUST J W, JACOBSEN N L, MCGILLIARD A D, et al. Supplementation of dairy calf diets with enzymes.Ⅱ.Effect on nutrient utilization and on composition of rumen fluid[J]. Journal of Animal Science, 1965, 24(1): 156-160. |



