抗生素促生长剂在畜禽养殖中长期大量使用导致的耐药基因传递和生物富集问题严重危害动物和人体健康。我国自2020年7月1日起禁止在商品饲料生产中使用抗生素。在饲料抗生素禁用和畜禽健康养殖的发展趋势下,研究和开发新型的替代抗生素类促生长剂的绿色饲料添加剂成为热点。植物多糖凭借其来源广泛、生物活性多样和无毒副作用等特点成为研究关注的热点。现代动物生产中,在动物饲粮中添加适宜水平的植物多糖可促进动物生长和提高养殖效益已获得共识,开发易制备、性质稳定、生物学利用率高的植物多糖已经成为畜牧业高质量发展的迫切需求[1-2]。浒苔(Enteromorpha prolifera)是药食两用的海洋藻类生物,属绿藻门石莼目石莼科浒苔属植物,其资源丰富,广泛分布于我国东部沿海地区。浒苔营养丰富,含有多种生物活性物质,而多糖是其主要功能成分[3]。近年来,随着浒苔多糖(Enteromorpha prolifera polysaccharide,EPP)的提取工艺和分析方法的发展以及研究的不断深入,已确认EPP具有肠道菌群调节、抗氧化、抗肿瘤、降血脂、抗菌、免疫调节等多种功效[4]。EPP因具有天然无残留、无污染且不会产生细菌耐药性问题等优势,是畜牧、饲料行业抗生素替抗研究与开发利用的重要资源。本文对EPP的营养生理功能及其在动物生产中的应用进行综述,旨在为其饲用化研究提供参考依据。
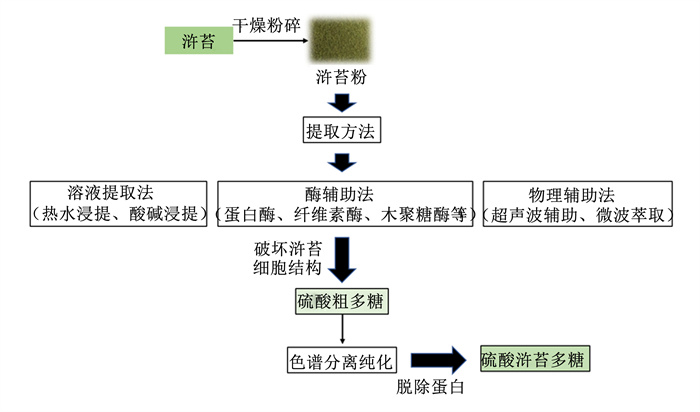
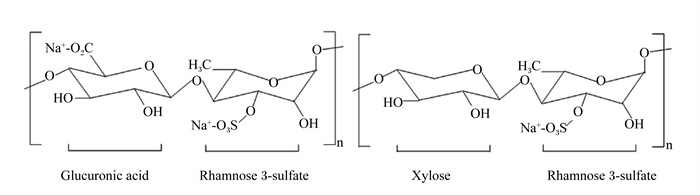
1 EPP的理化性质及其构效关系EPP作为一种硫酸多糖,是浒苔细胞壁的主要成分,不同的提取制备工艺影响EPP的产量、分子质量和化学组成等。目前,EPP的提取方法主要包括3类:溶液提取法(如热水浸提法和酸碱浸提法)、酶辅助提取法和物理辅助法(如超声波辅助和微波萃取),通过不同提取方法获得的粗多糖均不同程度含有蛋白质和脂类等非糖杂质,需要经过进一步的色谱分离纯化得到可用于结构分析和活性研究的EPP[5]。EPP的提取纯化工艺流程如图 1所示。因浒苔品种、浒苔的生长条件、多糖纯化过程和分析方法的不同,EPP的产量、分子质量和化学组成存在差异,其分子质量通常在103~106 Da[4]。研究表明,EPP主要由鼠李糖(rhamnose,Rha)、木糖(xylose,Xyl)、葡萄糖(glucose,Glu)和葡萄糖醛酸(glucuronic acid,GlcUA)等单糖或单糖醛酸组成,其结构骨架由以上各种单糖通过α-和β-1, 4糖苷键的线性和分支连接以及硫酸基团修饰而成,含D-GlcUA p-α-(1→4)-3-sulfate-L-Rha p-β-(1→4)-D-Xyl p-β-(1→4)-3-sulfate-L-Rha p结构单元,其中硫酸基团连接在Rha的C-3位[6-7],EPP的结构如图 2所示。EPP的生物学功能与其特定结构密切相关,如分子质量大小、单糖组成以及化学结构修饰等[8]。因此,对EPP结构和化学组成的合理修饰,可以改善其生物学活性,从而提高EPP在动物体内的生物利用率[9-10]。研究发现,从浒苔中提取的多糖具有相似的硫酸基团和单糖组成,但低分子质量的EPP表现出更强的羟自由基清除活性和螯合效应[9],表明分子质量大小是影响EPP抗氧化能力和免疫活性的关键因素。此外,硫酸化或羧甲基化修饰EPP可显著增强其抗氧化能力[11-12]。不同EPP的结构及构效关系详见表 1,EPP结构的复杂多样性不仅体现在单糖组成上,还体现在单糖间糖苷键的连接方式和硫酸基团的修饰位置以及支链的数量,从而影响EPP的生物学功能。
|
图 1 EPP的提取纯化工艺流程示意图 Fig. 1 Schematic diagram of technological process of extraction and purification of EPP |
|
Glucuronic acid:葡萄糖醛酸;Rhamnose 3-sulfate:鼠李糖3-硫酸盐;Xylose:木糖。 图 2 EPP的结构 Fig. 2 Structure of EPP[4] |
|
|
表 1 不同EPP的结构及构效关系 Table 1 Structure and structure-activity-relationship of different EPP |
肠道屏障和微生态环境稳定是维持动物健康的基础。肠道屏障是存在于肠腔内的具有高效选择性功能的防御系统,EPP可以多方面修复肠道屏障,抵御病原微生物入侵,调节肠道微生态平衡。EPP可以促进肠道上皮紧密连接蛋白的表达,有利于保持上皮细胞结构完整、改善肠道屏障和维持肠道通透性稳定。Zou等[15]研究表明,EPP能够增加断奶仔猪空肠黏膜中紧密连接蛋白闭锁小带蛋白-1(ZO-1)、封闭蛋白-1(claidin-1)和闭合蛋白(occludin)的表达,降低血清中二胺氧化酶(DAO)活性及D-乳酸(D-lactate)含量,有利于修复肠道屏障损伤。肠道菌群结构及其代谢产物与肠道屏障功能密切相关,是动物维持机体健康的重要保证。当动物受到外源物质刺激或处于应激状态时,其肠道微生物区系易发生紊乱,肠道菌群平衡受到破坏,肠道屏障功能和机体免疫机能低下,影响宿主健康。肠道微生物可以编码生成丰富的碳水化合物活性酶,从而将海藻多糖降解为容易被胃肠道吸收利用的寡糖[16]。研究也发现,饲粮中添加EPP可以增加肉鸡盲肠中拟杆菌属的丰度,降低粪杆菌属的丰度[17],而拟杆菌参与编码碳水化合物酶基因,是碳水化合物降解的主要参与者。此外,EPP可以促进仔猪肠道乳酸杆菌等有益菌生长,抑制大肠杆菌增殖[15]。这些研究表明,EPP进入肠道后与有害菌抢占肠壁内有利定植位点,有效降低有害菌附植在肠壁上,增加与其竞争的有益菌的增殖。更重要的是,EPP还可作为发酵底物被肠道微生物利用,产生短链脂肪酸(SCFAs),调节肠细胞能量代谢[18]。Zou等[15]研究发现,EPP增加了仔猪盲肠中乙酸和丁酸的含量。相似的,Wassie等[17]研究表明,在肉鸡饲粮中添加EPP可调节肠道微生态平衡,促进乙酸、丙酸和丁酸的产生,有利于改善肠道免疫反应和肠上皮结构完整性。关于EPP影响肠道微生物与宿主免疫系统间的交流与互作机制可以在畜禽生产中进行深入研究,对于认识肠道微生物与宿主健康的关系具有重要意义。
2.2 抗炎及调节免疫系统功能机体免疫系统主要通过免疫细胞及其分泌的细胞因子协同作用抵御病原微生物的侵入,在维持内环境稳态和正常生理活动方面发挥重要功能。EPP具有免疫调节活性,可以改善巨噬细胞增殖活力,刺激一氧化氮(NO)和下游细胞因子分泌,增强免疫功能。Kim等[19]研究发现,EPP可激活RAW 264.7巨噬细胞,诱导免疫调节因子[NO、白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、白细胞介素-10(IL-10)]产生和释放增加,发挥调节巨噬细胞免疫功能的作用。EPP在巨噬细胞内主要通过Toll样受体(TLR)介导激活细胞内信号传导途径,调节机体炎症反应和免疫应答。TLR4激活髓样分化因子88(MyD88),活化的MyD88结合白细胞介素-1受体相关激酶(IRAK),并进一步作用于肿瘤坏死因子受体相关因子6(TRAF6),激活丝裂原活化蛋白激酶(MAPK)和核因子-κB(NF-κB)信号途径,激活后的NF-κB发生核易位,激活巨噬细胞,促进靶基因的转录,增加细胞因子如IL-1β、TNF-α和IL-6的分泌,提高机体免疫力[20]。Liu等[21]研究发现,EPP通过TLR4/MAPK/NF-κB信号途径诱导巨噬细胞活化,实现调节免疫系统的功能。Zou等[15]研究也表明,EPP激活TLR4-MyD88信号传导通路,并产生IL-6和TNF-α等细胞因子,增强仔猪肠道免疫反应能力。研究表明,EPP能够增强正常小鼠免疫力,并呈剂量依赖方式提高免疫相关酶如碱性磷酸酶(AKP)、超氧化物歧化酶(SOD)和乳酸脱氢酶(LDH)的活性,同时增强NF-κB的表达水平[22]。此外,在四氯化碳诱导的急性肝损伤小鼠中的研究结果显示,EPP显著降低NF-κB表达,抑制促炎细胞因子[TNF-α、IL-6和单核细胞趋化蛋白-1(MCP-1)]和促炎酶类[一氧化氮合成酶(iNOS)和环氧化酶-2(COX-2)]的释放,缓解肝脏炎症和细胞凋亡[23]。因此,EPP发挥抗炎和调节免疫功能的作用机理与动物生理状态和机体健康状况密切相关。
2.3 抗氧化功能活性氧(reactive oxygen species,ROS)是生物体内有氧代谢的副产物,其产生和清除的动态平衡是维持机体氧化还原系统稳态的关键,在机体处于应激、病理情况时,ROS的过量积累导致细胞氧化损伤[24-25]。EPP具有较强的抗氧化能力,可有效清除自由基。Xu等[5]研究发现,EPP具有对1, 1-二苯基-2-苦味酰肼自由基(DPPH·)、羟基自由基(·HO)和超氧阴离子自由基(O2-·)的清除能力,并且EPP对自由基清除活性随其浓度的增加而增加。Li等[9]研究发现,分子质量大小显著影响EPP的抗氧化活性,低分子质量EPP对羟基自由基表现出更强的清除能力。同时,EPP可通过提高机体抗氧化酶系统活性有效预防或减少机体氧化损伤,增强抗氧化能力。Guo等[26]研究表明,EPP可提高罗曼蛋鸡血清SOD活性以及肝脏和空肠过氧化氢酶(CAT)活性,降低丙二醛(MDA)含量。此外,EPP参与调节细胞内抗氧化应激信号通路,改善机体的抗氧化状态。作为细胞内重要的抗氧化应激转录因子,核转录因子E2相关因子2(Nrf2)是诱导机体氧化应激反应蛋白[血红素氧合酶-1(HO-1)]和抗氧化酶表达的前提,而EPP通过激活Nrf2/HO-1信号途径,增强机体抗氧化防御系统,减轻黄曲霉毒素B1诱导的细胞氧化还原平衡紊乱[27]。
2.4 脂质代谢调节EPP在调节机体脂肪代谢、抑制甘油三酯沉积和维持机体血糖平衡及代谢健康方面发挥着重要的作用。EPP能够提高胰岛素信号通路敏感性,抑制脂肪组织沉积和炎症发生,改善胰岛素抵抗和机体代谢功能紊乱[28]。Zhao等[29]研究报道,EPP通过磷酸腺苷活化蛋白激酶(AMPK)信号途径调节脂质代谢相关基因表达,发挥降血脂的功效,保证机体代谢健康。基于核磁共振(NMR)代谢组学研究发现,EPP主要通过影响柠檬酸循环、酮体合成和降解、丙酮酸代谢等代谢途径缓解高脂饮食诱导的肥胖仓鼠代谢功能紊乱,改善脂质代谢[30]。Ren等[31]研究发现,给大鼠口服EPP增加血清硫化氢含量,降低血清甘油三酯(TG)含量,改善非酒精性脂肪肝。肠道菌群及其代谢产物能够调节脂质代谢稳态的动态平衡,维持肠道微生物群的内环境稳定,是调控机体脂质代谢的重要基础。因此,对于EPP诱导的肠道菌群变化与脂质代谢的因果关系可以在食品营养和动物生产应用中进行深入研究。
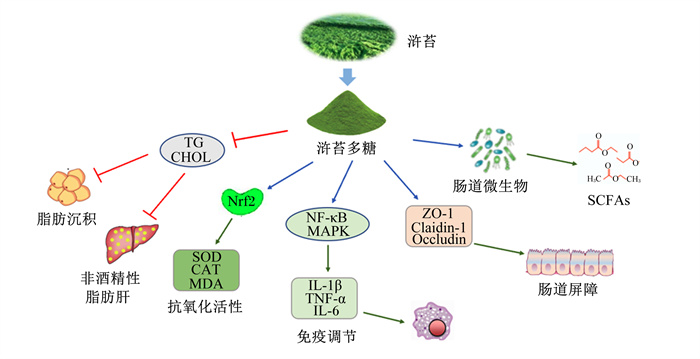
2.5 其他生物学功能EPP作为天然植物成分,除了以上功能外,还具有抗癌、抗菌、抗病毒、清除环境污染物、心脏保护等功能。研究发现,EPP具有对人肺癌细胞A549的增殖抑制作用,同时,EPP对小鼠肿瘤生长抑制率(59%)较高,可作为潜在的肺癌治疗剂[32]。细菌感染易诱发幼龄动物发生疾病甚至死亡,EPP对畜禽生产中常见的感染源如金黄色葡萄球菌、沙门氏菌、绿脓杆菌和大肠杆菌均有显著的抗菌活性[33]。研究表明,EPP可抑制猪繁殖与呼吸综合征病毒(PRRSV)感染Marc-145细胞,并呈剂量依赖的方式抑制PRRSV增殖,其作用的最小剂量为1.56 mg/mL[34]。聚丙烯酰胺在水处理过程中长期被用作助凝剂,但其具有损伤人神经系统的潜在风险,而EPP可以有效清除腐殖酸等有机物质,并且具有良好的生物安全性和生物降解性[35]。随着EPP的生物学功能在畜禽生产研究中的不断深入,EPP将具有更高的实践应用价值(图 3)。
|
TG:甘油三酯triglyceride;CHOL:胆固醇cholesterol;Nrf2:核转录因子E2相关因子2 nuclear factor erythroid 2 related factor 2;NF-κB:核因子-κB nuclear factor-κB;MAPK:丝裂原活化蛋白激酶mitogen activated protein kinase;ZO-1:闭锁小带蛋白-1 zonula occludens protein-1;Claidin-1:封闭蛋白-1;Occludin:闭合蛋白;SCFAs:短链脂肪酸short-chain fatty acids;SDO:超氧化物歧化酶superoxide dismutase;CAT:过氧化氢酶catalase;MDA:丙二醛malondialdehyde;IL-1β:白细胞介素-1β interleukin-1β;TNF-α:肿瘤坏死因子-α tumor necrosis factor-α;IL-6:白细胞介素-6 interleukin-6。 图 3 EPP的生物学功能 Fig. 3 Biological function of EPP |
EPP作为绿色功能性饲料添加剂,在动物生产的应用研究中表现出良好的促生长、调节机体免疫机能和改善肠道健康等作用效果。因此,EPP作为天然植物成分在现代动物生产养殖中具有广阔的发展和应用空间。
3.1 在猪生产中的应用断奶应激导致仔猪肠道功能紊乱及抗病力下降,仔猪对疾病的易感性增加,严重影响生猪高效健康生产。EPP可以促进肠道发育和减轻应激对肠黏膜功能的损伤,提高仔猪的抗病力。Zou等[15]研究发现,饲粮中添加400 mg/kg EPP能显著提高断奶仔猪的生长性能和降低腹泻率,并促进TNF-α、IL-6和分泌型免疫球蛋白A(sIgA)的产生,增强抗氧化能力和免疫力。EPP还可增强空肠紧密连接蛋白的表达和调节肠道菌群结构。因此,EPP能够缓解仔猪断奶应激,具有保护肠道形态完整性和屏障功能的作用。研究表明,天然植物多糖通过与金属离子形成的配合物具有更强的抗氧化能力和免疫调节力[36-37]。Xie等[38]在仔猪饲粮中添加800 mg/kg EPP锌复合物,结果显示EPP锌复合物能够增强机体的抗氧化水平,促进肠道发育和改善肠道健康,并可达到替代抗生素的效果。这些结果表明,EPP及其复合物具有高效、安全、优质的特点,满足绿色饲料添加剂的要求。
3.2 在家禽生产中的应用EPP可以促进家禽对营养物质的消化吸收,有利于免疫器官发育,增强机体抗氧化能力和抵御细菌能力,改善生长性能。杜恒裔等[339]研究表明,饲粮中添加EPP可提高肉鸡肠道糜蛋白酶和胰蛋白酶等消化酶活性,对乳酸菌增殖及养分表观利用率有一定促进作用,且EPP添加水平为0.10%~0.40%时作用效果最佳。Guo等[27]研究发现,在肉鸡饲粮中添加2 500 mg/kg EPP可通过Nrf2信号通路和线粒体凋亡通路调控细胞氧化还原平衡和凋亡,缓解黄曲霉毒素诱导的法氏囊损伤,增强肉鸡的免疫功能。Wassie等[40]研究EPP锌对肉鸡氨基酸和脂肪酸代谢的影响,结果表明饲粮中添加400 mg/kg EPP锌显著提高了表观回肠氨基酸消化率,促进了肌肉抗氧化稳定性及肌肉蛋白质合成,同时增强了肝脏脂肪酸氧化,抑制脂质沉积,从而改善肉鸡的生长性能。同时,研究还发现饲粮中添加400 mg/kg EPP可改善肉鸡肠黏膜形态结构,促进机体免疫功能,并调节盲肠菌群结构,增加乙酸、丙酸和丁酸等挥发性脂肪酸产量,从而发挥促生长作用[17]。在蛋鸡上的研究表明,EPP有利于提高产蛋率、改善蛋壳品质及抗氧化能力,并能改善肠道黏膜形态,其添加水平为1 000和2 500 mg/kg时效果最佳。
3.3 在水产动物中的应用抗氧化酶系统和溶菌酶是水产动物先天性免疫的重要组成部分。EPP具有调节机体免疫机能及肠道微生物区系组成、促进水产动物生长的作用。Liu等[41]在幼龄对虾上的研究结果表明,1 g/kg EPP能显著提高血淋巴中SOD、谷胱甘肽过氧化物酶(GPx)、谷胱甘肽硫转移酶(GST)、酚氧化酶(PO)及溶菌酶活性,降低MDA含量,增强机体非特异性免疫力,并提高厚壁菌门的丰度,降低弧菌属的丰度,从而改善动物肠道健康和生长性能。Zhou等[42]研究发现,40 g/kg EPP可以提高鲫鱼肠道蛋白酶、脂肪酶和淀粉酶活性,改善机体脂质代谢,并使血清溶菌酶和抗氧化酶活性及机体蛋白质含量增加,机体脂肪含量下降,从而改善生长性能和体成分组成。同时,EPP增强了鲫鱼抵御嗜水气单胞菌感染的能力,提高了抗病力。
4 小结EPP在动物生产中具有促进动物生长、提高抗氧化能力、增强肠道屏障功能和机体免疫机能等生理学功能,同时还可与金属离子形成配合物,增强免疫调节和抗氧化效果。EPP具有纯天然、无毒副作用、无残留、资源丰富等特点,可作为绿色饲料添加剂科学应用于动物生产中,保证动物健康。但EPP结构复杂,其精细结构和生物活性机制尚不清楚,未来还需要探索EPP的结构修饰方法,并解析多糖结构与生物学活性之间的关系,进一步提高EPP的活性及生物学利用率,提升EPP的开发利用价值。
| [1] |
杨玲, 胡睿智, 夏嗣廷, 等. 植物多糖的功能性研究进展及其在动物生产中的应用[J]. 动物营养学报, 2019, 31(6): 2534-2543. YANG L, HU R Z, XIA S T, et al. Plant polysaccharide: research progress of biological function and its application in animal production[J]. Chinese Journal of Animal Nutrition, 2019, 31(6): 2534-2543 (in Chinese). |
| [2] |
MIRZADEH M, KESHAVARZ LELEKAMI A, KHEDMAT L. Plant/algal polysaccharides extracted by microwave: a review on hypoglycemic, hypolipidemic, prebiotic, and immune-stimulatory effect[J]. Carbohydrate Polymers, 2021, 266: 118134. DOI:10.1016/j.carbpol.2021.118134 |
| [3] |
TANNA B, MISHRA A. Nutraceutical potential of seaweed polysaccharides: structure, bioactivity, safety, and toxicity[J]. Comprehensive Reviews in Food Science and Food Safety, 2019, 18(3): 817-831. DOI:10.1111/1541-4337.12441 |
| [4] |
WASSIE T, NIU K M, XIE C Y, et al. Extraction techniques, biological activities and health benefits of marine algae Enteromorpha prolifera polysaccharide[J]. Frontiers in Nutrition, 2021, 8: 747928. DOI:10.3389/fnut.2021.747928 |
| [5] |
XU J, XU L L, ZHOU Q W, et al. Isolation, purification, and antioxidant activities of degraded polysaccharides from Enteromorpha prolifera[J]. International Journal of Biological Macromolecules, 2015, 81: 1026-1030. DOI:10.1016/j.ijbiomac.2015.09.055 |
| [6] |
YU Y, LI Y P, DU C Y, et al. Compositional and structural characteristics of sulfated polysaccharide from Enteromorpha prolifera[J]. Carbohydrate Polymers, 2017, 165: 221-228. DOI:10.1016/j.carbpol.2017.02.011 |
| [7] |
LAHAYE M, ROBIC A. Structure and functional properties of ulvan, a polysaccharide from green seaweeds[J]. Biomacromolecules, 2007, 8(6): 1765-1774. DOI:10.1021/bm061185q |
| [8] |
ZHONG R T, WAN X Z, WANG D Y, et al. Polysaccharides from marine Enteromorpha: structure and function[J]. Trends in Food Science & Technology, 2020, 99: 11-20. |
| [9] |
LI B, LIU S, XING R E, et al. Degradation of sulfated polysaccharides from Enteromorpha prolifera and their antioxidant activities[J]. Carbohydrate Polymers, 2013, 92(2): 1991-1996. DOI:10.1016/j.carbpol.2012.11.088 |
| [10] |
CHI Y Z, LI Y P, ZHANG G L, et al. Effect of extraction techniques on properties of polysaccharides from Enteromorpha prolifera and their applicability in iron chelation[J]. Carbohydrate Polymers, 2018, 181: 616-623. DOI:10.1016/j.carbpol.2017.11.104 |
| [11] |
SHI M J, WEI X Y, XU J, et al. Carboxymethylated degraded polysaccharides from Enteromorpha prolifera: preparation and in vitro antioxidant activity[J]. Food Chemistry, 2017, 215: 76-83. DOI:10.1016/j.foodchem.2016.07.151 |
| [12] |
LI J X, CHI Z, YU L J, et al. Sulfated modification, characterization, and antioxidant and moisture absorption/retention activities of a soluble neutral polysaccharide from Enteromorpha prolifera[J]. International Journal of Biological Macromolecules, 2017, 105(Pt 2): 1544-1553. |
| [13] |
CHO M, YANG C, KIM S M, et al. Molecular characterization and biological activities of watersoluble sulfated polysaccharides from Enteromorpha prolifera[J]. Food Science and Biotechnology, 2010, 19(2): 525-533. DOI:10.1007/s10068-010-0073-3 |
| [14] |
TANG Z H, GAO H W, WANG S, et al. Hypolipidemic and antioxidant properties of a polysaccharide fraction from Enteromorpha prolifera[J]. International Journal of Biological Macromolecules, 2013, 58: 186-189. DOI:10.1016/j.ijbiomac.2013.03.048 |
| [15] |
ZOU T D, YANG J, GUO X B, et al. Dietary seaweed-derived polysaccharides improve growth performance of weaned pigs through maintaining intestinal barrier function and modulating gut microbial populations[J]. Journal of Animal Science and Biotechnology, 2021, 12(1): 28. DOI:10.1186/s40104-021-00552-8 |
| [16] |
SHANG Q S, JIANG H, CAI C, et al. Gut microbiota fermentation of marine polysaccharides and its effects on intestinal ecology: an overview[J]. Carbohydrate Polymers, 2018, 179: 173-185. DOI:10.1016/j.carbpol.2017.09.059 |
| [17] |
WASSIE T, LU Z, DUAN X Y, et al. Dietary Enteromorpha polysaccharide enhances intestinal immune response, integrity, and caecal microbial activity of broiler chickens[J]. Frontiers in Nutrition, 2021, 8: 783819. DOI:10.3389/fnut.2021.783819 |
| [18] |
KONG Q, DONG S Y, GAO J, et al. In vitro fermentation of sulfated polysaccharides from E. prolifera and L. japonica by human fecal microbiota[J]. International Journal of Biological Macromolecules, 2016, 91: 867-871. DOI:10.1016/j.ijbiomac.2016.06.036 |
| [19] |
KIM J K, CHO M L, KARNJANAPRATUM S, et al. In vitro and in vivo immunomodulatory activity of sulfated polysaccharides from Enteromorpha prolifera[J]. International Journal of Biological Macromolecules, 2011, 49(5): 1051-1058. DOI:10.1016/j.ijbiomac.2011.08.032 |
| [20] |
TIAN H, LIU Z J, PU Y W, et al. Immunomodulatory effects exerted by Poria cocos polysaccharides via TLR4/TRAF6/NF-κB signaling in vitro and in vivo[J]. Biomedicine & Pharmacotherapy, 2019, 112: 108709. |
| [21] |
LIU Y J, WU X L, JIN W H, et al. Immunomodulatory effects of a low-molecular weight polysaccharide from Enteromorpha prolifera on RAW 264.7 macrophages and cyclophosphamide- induced immunosuppression mouse models[J]. Marine Drugs, 2020, 18(7): 340. DOI:10.3390/md18070340 |
| [22] |
WEI J T, WANG S X, LIU G, et al. Polysaccharides from Enteromorpha prolifera enhance the immunity of normal mice[J]. International Journal of Biological Macromolecules, 2014, 64: 1-5. DOI:10.1016/j.ijbiomac.2013.11.013 |
| [23] |
GUO F C, ZHUANG X Y, HAN M Y, et al. Polysaccharides from Enteromorpha prolifera protect against carbon tetrachloride-induced acute liver injury in mice via activation of Nrf2/HO-1 signaling, and suppression of oxidative stress, inflammation and apoptosis[J]. Food & Function, 2020, 11(5): 4485-4498. |
| [24] |
VOLPE C M O, VILLAR-DELFINO P H, DOS ANJOS P M F, et al. Cellular death, reactive oxygen species (ROS) and diabetic complications[J]. Cell Death & Disease, 2018, 9(2): 119. |
| [25] |
BHATTACHARYYA A, CHATTOPADHYAY R, MITRA S, et al. Oxidative stress: an essential factor in the pathogenesis of gastrointestinal mucosal diseases[J]. Physiological Reviews, 2014, 94(2): 329-354. DOI:10.1152/physrev.00040.2012 |
| [26] |
GUO Y, ZHAO Z H, PAN Z Y, et al. New insights into the role of dietary marine-derived polysaccharides on productive performance, egg quality, antioxidant capacity, and jejunal morphology in late-phase laying hens[J]. Poultry Science, 2020, 99(4): 2100-2107. DOI:10.1016/j.psj.2019.12.032 |
| [27] |
GUO Y, BALASUBRAMANIAN B, ZHAO Z H, et al. Marine algal polysaccharides alleviate aflatoxin B1-induced bursa of Fabricius injury by regulating redox and apoptotic signaling pathway in broilers[J]. Poultry Science, 2021, 100(2): 844-857. DOI:10.1016/j.psj.2020.10.050 |
| [28] |
XIE F, ZOU T D, CHEN J, et al. Polysaccharides from Enteromorpha prolifera improves insulin sensitivity and promotes adipose thermogenesis in diet-induced obese mice associated with activation of PGC-1α-FNDC5/irisin pathway[J]. Journal of Functional Foods, 2022, 90: 104994. DOI:10.1016/j.jff.2022.104994 |
| [29] |
ZHAO A L, CHEN Y Q, LI Y X, et al. Sulfated polysaccharides from Enteromorpha prolifera attenuate lipid metabolism disorders in mice with obesity induced by a high-fat diet via a pathway dependent on AMP-activated protein kinase[J]. The Journal of Nutrition, 2022, 152(4): 939-949. DOI:10.1093/jn/nxab432 |
| [30] |
GUO F C, HAN M Y, LIN S, et al. Enteromorpha prolifera polysaccharide prevents high- fat diet-induced obesity in hamsters: a NMR-based metabolomic evaluation[J]. Journal of Food Science, 2021, 86(8): 3672-3685. DOI:10.1111/1750-3841.15818 |
| [31] |
REN R D, YANG Z, ZHAO A L, et al. Sulfated polysaccharide from Enteromorpha prolifera increases hydrogen sulfide production and attenuates non-alcoholic fatty liver disease in high-fat diet rats[J]. Food & Function, 2018, 9(8): 4376-4383. |
| [32] |
JIN W H, HE X Y, LONG L F, et al. Structural characterization and anti-lung cancer activity of a sulfated glucurono-xylo-rhamnan from Enteromorpha prolifera[J]. Carbohydrate Polymers, 2020, 237: 116143. DOI:10.1016/j.carbpol.2020.116143 |
| [33] |
SHAO L L, XU J, SHI M J, et al. Preparation, antioxidant and antimicrobial evaluation of hydroxamated degraded polysaccharides from Enteromorpha prolifera[J]. Food Chemistry, 2017, 237: 481-487. DOI:10.1016/j.foodchem.2017.05.119 |
| [34] |
SHEN M Y, SUN Q Y, ZHANG G B, et al. The antiPRRSV activity of the polysaccharide from Enteromorpha prolifera[J]. International Journal of Clinical and Experimental Medicine, 2017, 10(3): 5656-5661. |
| [35] |
ZHAO S, SUN Q S, GU Y Q, et al. Enteromorpha prolifera polysaccharide based coagulant aid for humic acids removal and ultrafiltration membrane fouling control[J]. International Journal of Biological Macromolecules, 2020, 152: 576-583. DOI:10.1016/j.ijbiomac.2020.02.273 |
| [36] |
WANG L Q, WANG C Q, GAO X, et al. Purification, characterization and anti-aging capacity of mycelia zinc polysaccharide by Lentinus edodes SD-08[J]. BMC Complementary and Alternative Medicine, 2015, 15: 111. DOI:10.1186/s12906-015-0630-7 |
| [37] |
ZHANG Y M, DUAN X Y, WASSIE T, et al. Enteromorpha prolifera polysaccharide-zinc complex modulates the immune response and alleviates LPS-induced intestinal inflammation via inhibiting the TLR4/NF-κB signaling pathway[J]. Food & Function, 2022, 13(1): 52-63. |
| [38] |
XIE C Y, ZHANG Y M, NIU K M, et al. Enteromorpha polysaccharide-zinc replacing prophylactic antibiotics contributes to improving gut health of weaned piglets[J]. Animal Nutrition, 2021, 7(3): 641-649. DOI:10.1016/j.aninu.2021.01.008 |
| [39] |
杜恒裔, 刘浩民, 杨光源, 等. 浒苔多糖对肉鸡肠道消化酶活性、菌群数量和养分表观利用率的影响[J]. 动物营养学报, 2019, 31(2): 956-961. DU H Y, LIU H M, YANG G Y, et al. Effects of Enteromorpha prolifera polysaccharide on intestinal digestive enzyme activity, microbial number and nutrient apparent utilization of broilers[J]. Chinese Journal of Animal Nutrition, 2019, 31(2): 956-961 (in Chinese). DOI:10.3969/j.issn.1006-267x.2019.02.053 |
| [40] |
WASSIE T, DUAN X Y, XIE C Y, et al. Dietary Enteromorpha polysaccharide-Zn supplementation regulates amino acid and fatty acid metabolism by improving the antioxidant activity in chicken[J]. Journal of Animal Science and Biotechnology, 2022, 13(1): 18. DOI:10.1186/s40104-021-00648-1 |
| [41] |
LIU W C, ZHOU S H, BALASUBRAMANIAN B, et al. Dietary seaweed (Enteromorpha) polysaccharides improves growth performance involved in regulation of immune responses, intestinal morphology and microbial community in banana shrimp Fenneropenaeus merguiensis[J]. Fish & Shellfish Immunology, 2020, 104: 202-212. |
| [42] |
ZHOU Z, PAN S K, WU S J. Modulation of the growth performance, body composition and nonspecific immunity of crucian carp Carassius auratus upon Enteromorpha prolifera polysaccharide[J]. International Journal of Biological Macromolecules, 2020, 147: 29-33. DOI:10.1016/j.ijbiomac.2020.01.065 |




