2. 北京农学院动物科学技术学院, 北京 102206
2. College of Animal Science and Technology, Beijing University of Agriculture, Beijing 102206, China
蛋白质及氨基酸是奶牛营养的重要组成部分,是机体合成乳蛋白的主要来源[1]。研究表明,饲粮中添加过瘤胃氨基酸(rumen protected amino acid,RPAA)是满足奶牛氨基酸需要、提高经济效益的有效方法[2]。精准掌握饲粮及RPAA中氨基酸的生物利用率是奶牛高效生产的关键,但RPAA产品保护方法多样,如钙盐、脂质包被和类似物等,不同的包被工艺影响氨基酸的生物利用率[3]。因此,准确评价RPAA生物利用率至关重要,本文重点对RPAA现有生物利用率的评价方法进行阐述。
1 RPAA及其应用的必要性奶牛对蛋白质营养的需要本质上是对氨基酸的需求,氨基酸是奶牛合成乳蛋白的前体物质,主要来源于饲粮中蛋白质和非蛋白氮等[1]。研究发现,在一定范围内提高饲粮蛋白质水平或补充必需氨基酸能显著提高奶牛产奶量,且乳成分产量有不同程度提升[4-6]。为追求更高的产奶量,生产中往往饲喂过量的蛋白质,但由此会因能氮不平衡影响到瘤胃微生物利用氮素的效率,从而导致奶牛氮素转化率低[7-8],而氨基酸平衡低蛋白质饲粮是提高氮利用效率的策略之一[9]。氨基酸不平衡是限制奶牛发挥最大生产性能的重要因素。饲粮中瘤胃可降解蛋白和非蛋白氮被瘤胃微生物利用合成菌体蛋白,其氨基酸组成较为平衡,但研究显示补充尿素等非蛋白氮超过一定限度时,瘤胃氨态氮浓度过高会影响瘤胃稳态,导致奶牛生产性能下降[10-11]。而直接饲喂高剂量游离氨基酸也可满足奶牛需求,但奶牛可能出现一定程度的毒性反应[12]。综上可知,需要额外补充受保护的氨基酸以满足奶牛营养需要以及平衡饲粮氨基酸组成[13]。
RPAA是氨基酸通过某种技术进行保护,降低其在瘤胃内的降解,使更多氨基酸能到达小肠后才释放并被机体消化吸收。研究显示,在奶牛产前和产后饲粮中补充过瘤胃蛋氨酸(rumen protected methionine, RP-Met)和过瘤胃赖氨酸(rumen protected lysine, RP-Lys)能有效改善奶牛产奶量和氮利用效率,提高犊牛的生长性能和免疫力[14-15]。因此,RPAA可作为调控、优化动物蛋白质营养和氨基酸平衡的有效措施。
2 RPAA生物利用率的评价方法精准掌握RPAA中氨基酸生物利用率是其发挥最大效益的前提。目前,评估RPAA生物利用率的方法主要分为体外法、半体内法和体内法,其中体内法主要包括产奶量剂量效应法、乳蛋白剂量效应法、牛奶硒元素稀释法、曲线下面积法、血浆游离氨基酸剂量效应法和稳定同位素法等。
2.1 体外法体外法是基于实验室条件,体外模拟瘤胃、皱胃和小肠环境对RPAA生物利用率进行评价。在Mbanzamihigo等[16]方法的基础上,Gargallo等[17]改进体外流程,形成体外试验的三步法。该方法中将待测RPAA称重后放入尼龙袋(5 cm×10 cm、孔径50 μm,样品5 g),流程如图 1所示,各相孵育后取部分尼龙袋的残留物进行氨基酸分析,计算氨基酸的瘤胃保护率和肠道释放率,确定RPAA的保护效果。
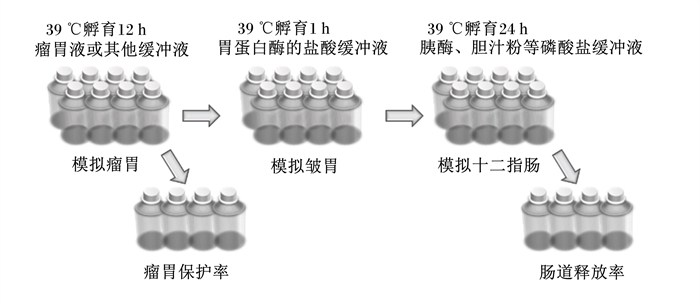
|
图 1 体外三步法流程 Fig. 1 A 3-step in vitro procedure |
在上述基础上,Ross等[18]对孵育时间以及使用的酶进行了优化。样品在体外分别孵育4、8、12、16、24和30 h,然后加胃蛋白酶孵育1 h,随后加入氢氧化钠(NaOH)中和pH,添加胰蛋白酶、胰凝乳蛋白酶、淀粉酶、脂肪酶、胆汁盐和磷酸钾缓冲液混合,孵育16 h模拟肠道消化;孵育结束后,取内容物过滤进行氨基酸分析。Miyazawa等[19]用含脂肪酶的改良McDougal缓冲液代替瘤胃液,胃蛋白酶的盐酸缓冲液模拟皱胃,添加胰蛋白酶和胆汁粉的磷酸盐缓冲液模拟十二指肠,孵育时间与Gargallo等[17]相同,完全用缓冲溶液代替奶牛消化环境,方便实验室操作。Larson等[20]使用培养基瓶代替溶解瓶,使该方法更加经济。
在该方法中,瘤胃保护率与肠道释放率由模拟瘤胃孵育和肠道消化结束后残留的氨基酸量决定,RPAA的生物利用率以模拟条件下得到的瘤胃保护率乘以肠道释放率获取[21]。体外方法成本低、检测速度快,可获得RPAA生物利用率的初步信息。但体外模拟缺乏动物采食及反刍等过程的影响,与其真实利用率间存在一定的差异。除此之外,缓冲液pH、孵育时间、所用酶和浓度等各实验室存在差异也会影响准确性,如果做到标准化,体外法在RPAA的初步评价中可能会更有用[22]。
2.2 半体内法半体内法或称为尼龙袋法是以动物为基础使用尼龙袋进行瘤胃孵育,构建指数模型估算氨基酸的瘤胃消失率[23],以及使用尼龙袋随肠道消化移动获得肠道消失的估计值[24],确定RPAA生物利用率。该方法先将RPAA放入尼龙袋[12~15 mg/cm2、孔径(50±15) μm]在瘤胃中培养16 h后测定残留物氨基酸含量,然后模拟皱胃环境,将尼龙袋转移到胃蛋白酶-盐酸溶液,39 ℃孵育1.0~2.5 h后通过十二指肠瘘管投入十二指肠,24 h内从回肠或粪便中回收移动尼龙袋,测定残留物中氨基酸含量;RPAA的生物利用率以离开瘤胃的氨基酸百分比乘以其在肠道中消失的氨基酸百分比获得[24-28]。半体内法的流程如图 2所示。
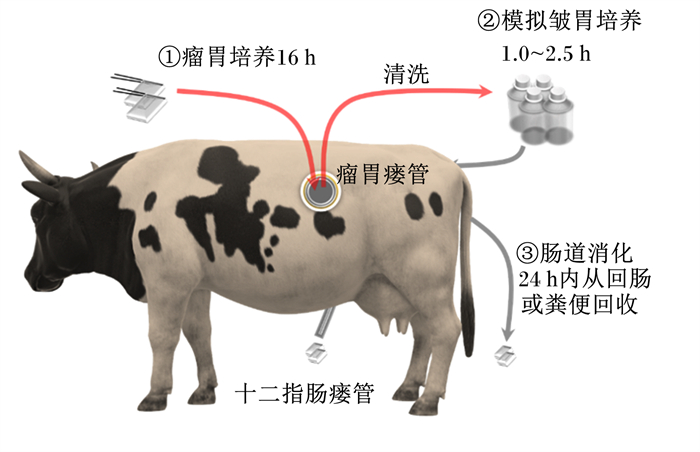
|
图 2 半体内法流程 Fig. 2 Schematic of the in situ |
半体内法以动物体内消化环境为主,但该方法假设氨基酸从尼龙袋中消失代表其在瘤胃降解或被小肠吸收,没有考虑到氨基酸被后肠道利用情况[22],也没有考虑奶牛采食和反刍的影响,结果可能高估或低估氨基酸的生物利用率。另外,所选择的瘤胃滞留时间、尼龙袋和样品的大小、孔径等都会影响生物利用率值[29-30]。因此,该方法不适宜用于评价粒径较小或可溶性RPAA[31],当过多逃离尼龙袋的样品被计算到离开瘤胃的氨基酸百分比中时,会导致评价不准确。
2.3 体内法体内法直接将RPAA用于奶牛,包括剂量效应法(产奶量、乳蛋白)、牛奶硒元素稀释法、曲线下面积法、血浆游离氨基酸剂量效应法和稳定同位素法等。这些方法相较于体外法和半体内法能更好地反映奶牛利用RPAA的真实情况,具有较高的准确性和精确性。
2.3.1 剂量效应法产奶量剂量效应法和乳蛋白剂量效应法的原理是产奶量、乳蛋白浓度及产量随氨基酸摄入量的增加呈线性增加,达到充足水平后趋于稳定[32]。赖氨酸(Lys)和蛋氨酸(Met)是奶牛主要的限制性氨基酸,能影响产奶量和乳蛋白的合成[33-34];当代谢蛋白质满足需求时,代谢Lys和Met占代谢蛋白质的7.2%和2.4%能够达到最佳产奶性能[35]。因此,在缺乏Lys或Met的饲粮中添加RP-Lys或RP-Met,能够通过产奶性能的改变来评估氨基酸的生物利用率。
Schwab等[36]和Ordway等[37]使用乳蛋白剂量效应评价了Met类似物的生物利用率,采用重复的5×5拉丁方设计,基础饲粮配制为缺乏Met,以Smartamine M作为阳性对照,分别饲喂5个水平的Smartamine M和Met类似物,使用线性部分的剂量反应关系计算生物利用率为Met类似物与Smartamine M的乳蛋白浓度变化响应斜率的比值。Fleming等[33]使用已知生物利用率的AjiProL-Gen 2为阳性对照,饲喂4个水平待测RP-Lys,减少了试验重复数,根据上述公式得出待测RP-Lys的生物利用率接近于AjiProL-Gen 2的2倍。
与体外和半体内法相比,该方法不需要瘘管奶牛,RPAA物理性质没有限制,且受到反刍等体内影响。高产奶牛对氨基酸缺乏和RPAA增加更敏感,产奶量越高可能越适合这种方法[22]。但该方法也存在局限,试验奶牛需要保持氨基酸缺乏的状态,且超过需求量后提供的氨基酸不会引起响应,这会使置信区间可能较大,导致生物利用率估计值的准确性降低[33]。
2.3.2 牛奶硒元素稀释法牛奶硒元素稀释法假设各组硒代蛋氨酸的吸收速率相同,即硒水平一致。Met浓度增加会引起硒与Met比值降低,两者比值的变化代表可代谢Met的变化,进而根据两者比值对Met的生物利用率进行评价[38],但该方法仅适用于Met的评价(图 3)。
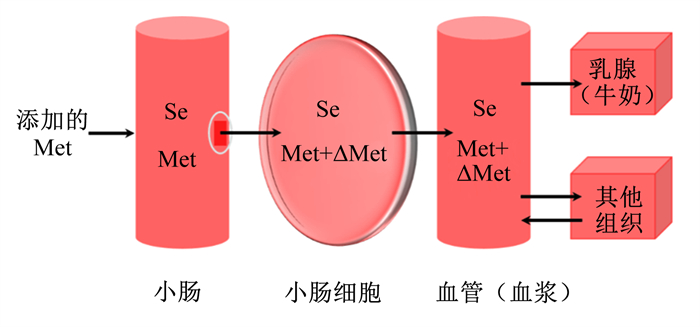
|
Se:硒selenium;Met:蛋氨酸methionine。 图 3 Met代谢的简化动力学模型及硒/Met变化 Fig. 3 Simplified kinetic model of metabolism of Met and change of Se/Met[38] |
Weiss等[38]验证了牛奶硒元素稀释法能够量化可代谢Met供给的改变,在该研究中,所有奶牛均采食相同饲粮(CPM估测代谢Met水平为49 g/d),经皱胃分别灌注9 g/d Met溶液或水,检测牛奶样品中的氮、硒和Met含量;2组牛奶的硒与Met比值变化反映奶牛代谢Met水平的变化,故试验组代谢Met水平为对照组代谢Met水平乘以2组硒与Met的比值,即57.33×(49×1.17) g/d,推算出灌注Met所提供的可代谢Met为8.33 g/d;用硒与氮的比值计算得试验组的代谢Met水平为58.31×(49×1.19) g/d,较对照组多9.31 g/d,与灌注量接近。由此可见,牛奶中硒与Met或氮的比值都能对Met的生物利用率进行评价。
2.3.3 曲线下面积法曲线下面积法原理是短时间内提供给动物一定量RPAA,连续检测血液中氨基酸浓度并绘制曲线,计算曲线下面积,与皱胃灌注氨基酸纯品所得曲线下面积进行比较,得到RPAA生物利用率[39-40]。
Graulet等[39]将RP-Met经瘘管投入瘤胃,使用开始灌注前24、12、6、0 h血浆氨基酸浓度来确定基线值,绘制补充RP-Met后的检测值减去基线值的曲线,生物利用率计算为根据曲线估计的可代谢Met与补充剂量水平的比率。Estes等[40]和Fleming等[33]将PRAA在瘤胃孵育8 h,残留物再灌注到奶牛皱胃,对照组则灌注等量未保护氨基酸纯品,在灌注前4、2、0 h以及灌注后0.33、0.67、1、2、4、6、8、10、12和16 h采血,检测血浆氨基酸浓度,根据过瘤胃保护和未保护氨基酸曲线下面积比值估算RPAA生物利用率。
曲线下面积法是对氨基酸的直接测量,反应更加快速,使得置信区间小,评价生物利用率精度较高。但该方法没有考虑动物采食和反刍的影响,并且试验提供给奶牛的RPAA剂量超过正常剂量,易诱导氨基酸分解代谢[33];且采血次数较多且持续时间较长,由此产生的应激是否会对评价生物利用率造成影响尚不可知。
2.3.4 血浆游离氨基酸剂量效应法血浆游离氨基酸剂量效应法的原理是血液中氨基酸占总氨基酸的比例分别与氨基酸的饲喂量和输注氨基酸纯品的量呈线性关系,两者斜率比值代表RPAA生物利用率[41]。Rulquin等[42]、Hanigan等[43]证明了饲粮氨基酸缺乏或满足需要量时Lys和Met都存在这一线性关系。Rulquin等[42]使用该方法评估了RP-Met和RP-Lys的生物利用率,该试验中饲喂不同水平的待测产品,15 min后将剩余饲料经瘤胃瘘管进入瘤胃,对照组氨基酸纯品通过十二指肠瘘管连续输注到十二指肠;在试验第4天,每小时通过颈静脉采血,持续12 h,进行氨基酸分析。Whitehouse等[41]研究指出,奶牛连续摄入氨基酸超过4 d,血浆氨基酸浓度达到稳态,并提出采用重复的拉丁方设计,每期试验设置7 d,在第5~7天采集血液样品;该研究还发现,采集2~8 h与2~24 h血液样品得到的生物利用率较接近,建议采集饲喂后2、4、6和8 h的血样用于生物利用率评价。
与曲线下面积法相比,血浆游离氨基酸剂量效应法采血操作的次数减少,持续时间缩短,在进行相对利用率的比较时通过氨基酸的饲喂量可在无瘘管奶牛的情况下开展评价[41]。由此可见,该方法适用于单一RPAA生物利用率测定,但难以测定饲料原料中的所有氨基酸。
2.3.5 稳定同位素法稳定同位素法假设饲粮天然同位素标记和非同位素的氨基酸进入血液时处于稳态,两者比值基本稳定,当以恒定速率向动物静脉血管中灌注同位素标记的氨基酸,原有稳态被打破,但经过一段时间灌注后能达到新的稳态[40](图 4)。然后,通过观测到每种氨基酸同位素与非同位素比值推导出RPAA或饲料原料中氨基酸的血浆进入率,结合线性回归可以对氨基酸的生物利用率进行评估[31]。
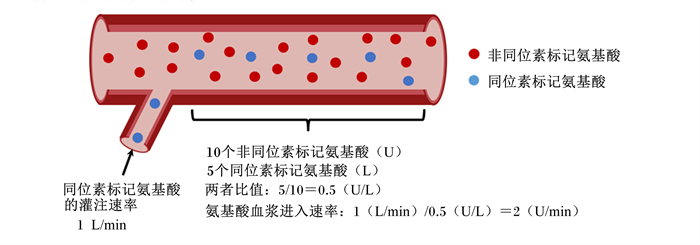
|
图 4 稳定同位素法原理 Fig. 4 Principle of stable isotope-based approach |
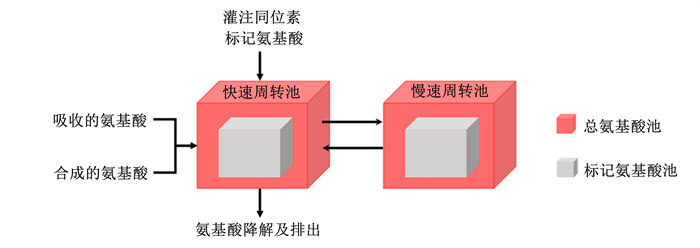
Borucki等[44]和Maxin等[45]使用一种基于同位素稀释结合氨基酸2池模型(血浆池A和胞内池或蛋白池B)的方法,评估皱胃灌注Lys和Met的回收率时,回收率达95%和96%,单独灌注Lys时回收率达100%,表明该方法能够有效评估氨基酸的生物利用率。Estes等[40]和Huang等[31]的试验中以饲喂无保护的氨基酸和酪蛋白作为对照,饲喂以不同原料配制成的蛋白质水平相近的饲粮,通过颈静脉插管以恒定速率灌注13C标记氨基酸混合物2 h,从开始灌注前至灌注结束后连续采集血液样品,观测同位素富集的动态变化。Estes等[40]将2池模型发展为4池模型(图 5),快速周转池代表游离氨基酸和少部分半衰期短(< 30 min)的蛋白质,慢速周转池代表与蛋白质结合的氨基酸,根据氨基酸同位素与非同位素的比值推导每种氨基酸的血浆进入率,进而通过模型评估的每种原料氨基酸生物利用率,研究显示其误差小于10%。Estes等[40]和Huang等[31]建议灌注时间可延长至4~6 h,应该能更好地了解体内蛋白质周转以及估计慢速周转池以降低总进入率偏差。Huang等[46]引入另一种同位素(15N)来标记菌体蛋白,利用稳定同位素法分别推导瘤胃不可降解蛋白和菌体蛋白的必需氨基酸吸收量,可应用于了解不同蛋白质类别的氨基酸有效性。
|
图 5 氨基酸4池动态模型 Fig. 5 The 4-pool dynamic model of amino acid[40] |
稳定同位素法考虑了氨基酸在动物体内的代谢过程,适用于RPAA和饲料原料单个氨基酸的生物利用率评价,灵敏度较高,但长时间恒定速率灌注的操作较为复杂,需要准确记录每次采血时间,所用标记氨基酸和检测成本较高[40]。
3 小结综上所述,RPAA对奶牛精准饲喂和提质增效具有重要意义。现有评价方法中,体外法和半体内法能快速获得RPAA生物利用率的初步信息,适用于大批量样品检测和对RPAA产品的氨基酸生物利用率进行排序;获得绝对生物利用率值建议选择牛奶硒元素稀释法(Met)或稳定同位素法,只需相对生物利用率值可选用曲线下面积法或血浆游离氨基酸剂量效应;牧场评估可能更适合剂量效应法。不过,上述评价方法都具有一定局限,RPAA生物利用率的准确评估仍是反刍动物营养具有挑战性的工作之一。未来,迫切需要建立更便捷、准确、适用性更广泛的评价方法,以获得RPAA生物利用率,达到进一步优化奶牛饲粮、促进奶牛高效生产的目的。
| [1] |
PEGOLO S, MACH N, RAMAYO-CALDAS Y, et al. Integration of GWAS, pathway and network analyses reveals novel mechanistic insights into the synthesis of milk proteins in dairy cows[J]. Scientific Reports, 2018, 8(1): 566. DOI:10.1038/s41598-017-18916-4 |
| [2] |
芦娜, 潘振亮, 陈龙宾, 等. 日粮添加过瘤胃氨基酸对高产奶牛生产性能、乳成分和经济效益的影响[J]. 饲料工业, 2019, 40(5): 44-47. LU N, PAN Z L, CHEN L B, et al. Effects of rumen-protected amino acid supplementation on production performance, milk composition and economic benefits in high producting dairy cows[J]. Feed Industry, 2019, 40(5): 44-47 (in Chinese). DOI:10.13302/j.cnki.fi.2019.05.008 |
| [3] |
ZHANG Y, ZHANG C X, ZHANG M M, et al. In situ and in vitro evaluation of the bioavailability of rumen-protected methionine with coating prototypes[J]. Journal of the Mechanical Behavior of Biomedical Materials, 2022, 133: 105355. DOI:10.1016/j.jmbbm.2022.105355 |
| [4] |
ZHAO K, LIU W, LIN X Y, et al. Effects of rumen-protected methionine and other essential amino acid supplementation on milk and milk component yields in lactating Holstein cows[J]. Journal of Dairy Science, 2019, 102(9): 7936-7947. DOI:10.3168/jds.2018-15703 |
| [5] |
ZANG Y, SILVA L H P, GENG Y C, et al. Dietary starch level and rumen-protected methionine, lysine, and histidine: effects on milk yield, nitrogen, and energy utilization in dairy cows fed diets low in metabolizable protein[J]. Journal of Dairy Science, 2021, 104(9): 9784-9800. DOI:10.3168/jds.2020-20094 |
| [6] |
CARDOSO F F, DONKIN S S, PEREIRA M N, et al. Effect of protein level and methionine supplementation on dairy cows during the transition period[J]. Journal of Dairy Science, 2021, 104(5): 5467-5478. DOI:10.3168/jds.2020-19181 |
| [7] |
NICHOLS K, DIJKSTRA J, VAN LAAR H, et al. Energy and nitrogen partitioning in dairy cows at low or high metabolizable protein levels is affected differently by postrumen glucogenic and lipogenic substrates[J]. Journal of Dairy Science, 2019, 102(1): 395-412. DOI:10.3168/jds.2018-15249 |
| [8] |
MATTHEWS C, CRISPIE F, LEWIS E, et al. The rumen microbiome: a crucial consideration when optimising milk and meat production and nitrogen utilisation efficiency[J]. Gut Microbes, 2019, 10(2): 115-132. DOI:10.1080/19490976.2018.1505176 |
| [9] |
郭伟, 李文娟, 呼秀智, 等. 反刍动物低蛋白日粮应用的研究进展[J]. 饲料工业, 2020, 41(1): 47-51. GUO W, LI W J, HU X Z, et al. Advances in the application of ruminant low protein diets[J]. Feed Industry, 2020, 41(1): 47-51 (in Chinese). DOI:10.13302/j.cnki.fi.2020.01.010 |
| [10] |
徐诣轩, 李志鹏, 申军士, 等. 微生物介导反刍动物瘤胃氨生成及其对瘤胃功能的影响[J]. 微生物学报, 2019, 59(5): 781-788. XU Y X, LI Z P, SHEN J S, et al. Microbe-mediated ruminal ammonia production in ruminants and its impacts on rumen function[J]. Acta Microbiologica Sinica, 2019, 59(5): 781-788 (in Chinese). DOI:10.13343/j.cnki.wsxb.20180291 |
| [11] |
王二旦, 刘吉生, 刘巧兰, 等. 生物调控释放型尿素对奶牛产奶量、乳成分、瘤胃发酵参数和血清生化指标的影响[J]. 动物营养学报, 2021, 33(11): 6523-6533. WANG E D, LIU J S, LIU Q L, et al. Effects of bio-regulated release urea on milk yield, milk composition, rumen fermentation parameters and serum biochemical indexes of dairy cows[J]. Chinese Journal of Animal Nutrition, 2021, 33(11): 6523-6533 (in Chinese). DOI:10.3969/j.issn.1006-267x.2021.11.051 |
| [12] |
VELLE W, SJAASTAD O V, AULIE A, et al. Rumen escape and apparent degradation of amino acids after individual intraruminal administration to cows[J]. Journal of Dairy Science, 1997, 80(12): 3325-3332. DOI:10.3168/jds.S0022-0302(97)76308-2 |
| [13] |
陈傲东. 石河子垦区泌乳奶牛氨基酸平衡日粮的设计与饲喂效果的研究[D]. 硕士学位论文. 石河子: 石河子大学, 2016. CHEN A D. The study of the design and feeding effects of amino acid balance diet on lactating dairy cows in reclamation area of Shihezi[D]. Master's Thesis. Shihezi: Shihezi University, 2016. (in Chinese) |
| [14] |
ELSAADAWY S A, WU Z H, BU D P. Feasibility of supplying ruminally protected lysine and methionine to periparturient dairy cows on the efficiency of subsequent lactation[J]. Frontier in Veterinary Science, 2022, 9: 892709. DOI:10.3389/fvets.2022.892709 |
| [15] |
GIRMA D D, MA L, WANG F, et al. Effects of close-up dietary energy level and supplementing rumen-protected lysine on energy metabolites and milk production in transition cows[J]. Journal of Dairy Science, 2019, 102(8): 7059-7072. DOI:10.3168/jds.2018-15962 |
| [16] |
MBANZAMIHIGO L, VANDYCKE E, DEMEYER D I. Degradation of methionine by rumen contents in vitro and efficiency of its protection[J]. Animal Feed Science and Technology, 1997, 67(4): 339-347. DOI:10.1016/S0377-8401(97)00008-4 |
| [17] |
GARGALLO S, CALSAMIGLIA S, FERRET A. Technical note: a modified three-step in vitro procedure to determine intestinal digestion of proteins[J]. Journal of Animal Science, 2006, 84(8): 2163-2167. DOI:10.2527/jas.2004-704 |
| [18] |
ROSS D A, GUTIERREZ-BOTERO M, VAN AMBURGH M E. Development of an in vitro intestinal digestibility assay for ruminant feeds[C]//Proceedings of the Cornell Nutrition Conference for Feed Manufacturers. East Syracuse, NY: Cornell University, 2013.
|
| [19] |
MIYAZAWA M, MIURA M, FUJIEDA T, et al. A three steps in vitro procedure for evaluating rumen-protected lysine products[J]. Journal of Dairy Science, 2014, 97(E-Suppl.1): 756. |
| [20] |
LARSON H E, SHINZATO I, MIURA M, et al. Evaluation of three rumen-protected lysine sources produced in two different batches using a modified three-step in vitro procedure[J]. Journal of Dairy Science, 2015, 98(Suppl.2): 157. |
| [21] |
ISHIMARU S, ELSABAGH M, SAIKI S, et al. Evaluating the rumen-protected lysine stability in forage-based total mixed rations in vitro and determining the lysine Brix value[J]. Animal Science Journal, 2019, 90(8): 932-938. DOI:10.1111/asj.13245 |
| [22] |
WHITEHOUSE N L. Using the plasma free amino acid dose response method to determine metabolizable protein concentrations of lysine and methionine in rumen protected supplements[D]. Ph. D. Thesis. Durham: University of New Hampshire, 2016.
|
| [23] |
ØRSKOV E R, MCDONALD I. The estimation of protein degradability in the rumen from incubation measurements weighted according to rate of passage[J]. The Journal of Agricultural Science, 1979, 92(2): 499-503. DOI:10.1017/S0021859600063048 |
| [24] |
OVERTON T R, LACOUNT D W, CICELA T M, et al. Evaluation of a ruminally protected methionine product for lactating dairy cows[J]. Journal of Dairy Science, 1996, 79(4): 631-638. DOI:10.3168/jds.S0022-0302(96)76408-1 |
| [25] |
BERTHIAUME R, LAPIERRE H, STEVENSON M, et al. Comparison of the in situ and in vivo intestinal disappearance of ruminally protected methionine[J]. Journal of Dairy Science, 2000, 83(9): 2049-2056. DOI:10.3168/jds.S0022-0302(00)75086-7 |
| [26] |
EVANS E, CLARK N, BLOCK E. Use of plasma lysine to assess postruminal amino acid bioavailabilityin rumen bypass lysine from megamine-L[J]. Journal of Dairy Science, 2013, 96(E-Suppl.1): 11. |
| [27] |
WU Z, BERNARD J K, EGGLESTON R B, et al. Ruminal escape and intestinal digestibility of ruminally protected lysine supplements differing in oleic acid and lysine concentrations[J]. Journal of Dairy Science, 2012, 95(5): 2680-2684. DOI:10.3168/jds.2011-5203 |
| [28] |
BORUCKI CASTRO S I, PHILLIP L E, LAPIERRE H, et al. Ruminal degradability and intestinal digestibility of protein and amino acids in treated soybean meal products[J]. Journal of Dairy Science, 2007, 90(2): 810-822. DOI:10.3168/jds.S0022-0302(07)71565-5 |
| [29] |
NORRIS A B, TEDESCHI L O, MUIR J P. Assessment of in situ techniques to determine indigestible components in the feed and feces of cattle receiving supplemental condensed tannins[J]. Journal of Animal Science, 2019, 97(12): 5016-5026. DOI:10.1093/jas/skz329 |
| [30] |
ADAMS J M, NORRIS A B, DIAS BATISTA L F, et al. Comparison of in situ techniques to evaluate the recovery of indigestible components and the accuracy of digestibility estimates[J]. Journal of Animal Science, 2020, 98(10): skaa296. DOI:10.1093/jas/skaa296 |
| [31] |
HUANG X, ESTES K A, YODER P S, et al. Assessing availability of amino acids from various feedstuffs in dairy cattle using a stable isotope-based approach[J]. Journal of Dairy Science, 2019, 102(12): 10983-10996. DOI:10.3168/jds.2019-16597 |
| [32] |
VYAS D, ERDMAN R A. Meta-analysis of milk protein yield responses to lysine and methionine supplementation[J]. Journal of Dairy Science, 2009, 92(10): 5011-5018. DOI:10.3168/jds.2008-1769 |
| [33] |
FLEMING A J, ESTES K A, CHOI H, et al. Assessing bioavailability of ruminally protected methionine and lysine prototypes[J]. Journal of Dairy Science, 2019, 102(5): 4014-4024. DOI:10.3168/jds.2018-14667 |
| [34] |
LAROCHE J P, GERVAIS R, LAPIERRE H, et al. Milk production and efficiency of utilization of nitrogen, metabolizable protein, and amino acids are affected by protein and energy supplies in dairy cows fed alfalfa-based diets[J]. Journal of Dairy Science, 2022, 105(1): 329-346. DOI:10.3168/jds.2021-20923 |
| [35] |
NRC. Nutrient requirements of dairy cattle[S]. 7th ed. Washington, D.C. : The National Academies Press, 2001.
|
| [36] |
SCHWAB C G, WHITEHOUSE N L, MCLAUGHLIN A M, et al. Use of milk protein concentrations to estimate the methionine bioavailability of two forms of 2-hydroxy-4-methylthio butanoic acid (HMB) for lactating cows[J]. Journal of Dairy Science, 2001, 84(Suppl.1): 35. |
| [37] |
ORDWAY R S, SCHWAB C G, SLOAN B K, et al. Effects of two different ruminant methionine technologies on milk and milk component production across a range of metabolizable methionine adequacy[J]. Journal of Dairy Science, 2013, 96(E-Suppl.1): 250. |
| [38] |
WEISS W P, ST-PIERRE N R. A method to quantify changes in supply of metabolizable methionine to dairy cows using concentrations of selenium in milk[J]. Journal of Dairy Science, 2009, 92(6): 2835-2842. DOI:10.3168/jds.2008-1882 |
| [39] |
GRAULET B, RICHARD C, ROBERT J C. Methionine availability in plasma of dairy cows supplemented with methionine hydroxy analog isopropyl ester[J]. Journal of Dairy Science, 2005, 88(10): 3640-3649. DOI:10.3168/jds.S0022-0302(05)73049-6 |
| [40] |
ESTES K A, WHITE R R, YODER P S, et al. An in vivo stable isotope-based approach for assessment of absorbed amino acids from individual feed ingredients within complete diets[J]. Journal of Dairy Science, 2018, 101(8): 7040-7060. |
| [41] |
WHITEHOUSE N L, SCHWAB C G, BRITO A F. The plasma free amino acid dose-response technique: a proposed methodology for determining lysine relative bioavailability of rumen-protected lysine supplements[J]. Journal of Dairy Science, 2017, 100(12): 9585-9601. |
| [42] |
RULQUIN H, KOWALCZYK J. Development of a method for measuring lysine and methionine bioavailability in rumen-protected products for cattle[J]. Journal of Animal and Feed Sciences, 2003, 12: 465-474. |
| [43] |
HANIGAN M D, VANDERHOOF C, GARBADE S, et al. In vivo determination of lysine bioavailability of rumen protected lysine in lactating dairy cows[J]. Journal of Dairy Science, 2009, 92(E-Suppl.1): 290. |
| [44] |
BORUCKI CASTRO S I, LAPIERRE H, PHILLIP L E, et al. Towards non-invasive methods to determine the effect of treatment of soya-bean meal on lysine availability in dairy cows[J]. Animal, 2008, 2(2): 224-234. |
| [45] |
MAXIN G, OUELLET D R, LAPIERRE H. Effect of substitution of soybean meal by canola meal or distillers grains in dairy rations on amino acid and glucose availability[J]. Journal of Dairy Science, 2013, 96(12): 7806-7817. |
| [46] |
HUANG X, YODER P S, CAMPOS L, et al. A method of assessing essential amino acid availability from microbial and ruminally undegraded protein in lactating dairy cows[J]. Journal of Dairy Science, 2021, 104(2): 1777-1793. |



