营养、管理、高温等应激因素以及繁殖时期的高合成代谢状态会造成母猪机体代谢旺盛,产生氧化应激[1]。研究表明,妊娠后期和泌乳期母猪机体氧化应激严重,其会使母猪泌乳性能、产仔性能、仔猪成活率及健康水平降低[2]。因此,对妊娠或泌乳阶段母猪进行营养干预,如通过饲粮外源添加抗氧化剂和自由基清除剂,可通过母猪胎盘或乳汁方式传递抗氧化物质来增强仔猪抗氧化能力,并改善母猪繁殖性能。
异黄酮-S(isoflavones-s,ISO-S)为纯度99%的大豆异黄酮,是黄酮类的一种亚类化合物,常温下性质稳定,在大豆中含量较多,主要分为游离型苷元和结合型糖苷两大类。其主要成分包括染料木黄酮、黄豆黄苷、大豆苷元和生物链霉素A[3-4],已被证明具有多种生物学特性,作为天然的植物雌激素[5],具有抗氧化[6]、免疫调节[7]、抗癌[8-9]以及抗炎症[10-11]的功能。由于异黄酮可抑制自由基的产生并清除,诱导增强内源抗氧化酶活性,近年来异黄酮的抗氧化作用已引起国内外学者的广泛关注。本课题组先前研究发现,饲粮中添加异黄酮可增强机体抗氧化能力,显著缓解氧化应激损伤;能有效缓解母猪氧化应激,改善母猪乳腺发育,提高泌乳量和乳品质,从而增加仔猪断奶重和成活率[12]。同时,通过体外细胞试验发现,抗氧化剂异黄酮可缓解猪乳腺上皮细胞的氧化损伤,促进细胞的增殖[13]。然而,关于补充ISO-S对母猪繁殖、免疫、泌乳性能的影响,以及其抗氧化功能能否传递给哺乳仔猪的研究报道仍很有限。因此,本试验旨在研究在妊娠后期及泌乳期母猪饲粮中添加ISO-S对母猪繁殖性能、抗氧化能力、免疫功能的影响,为缓解母猪氧化应激、提高泌乳性能和改善仔猪生长发育提供可靠参考。
1 材料与方法 1.1 试验材料ISO-S,纯度为99%,由广东某饲料科技有限公司提供。
1.2 试验设计与饲粮试验选取20头健康长大二元母猪配种后,按照体况、胎次均衡的原则将其为2组,每组10头,每个重复1头。对照组(CON组)饲喂基础饲粮,ISO-S组在基础饲粮中添加40 mg/kg ISO-S。参考NRC(2012)母猪营养需要标准配制妊娠期和泌乳期母猪玉米-豆粕型基础饲粮,其组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
饲养按规模化猪场操作规程进行,母猪在同一猪舍内饲养。妊娠母猪限饲,泌乳母猪自由采食,自动饮水器供水,每天准确记录母猪的采食量及母猪、仔猪健康情况,保持猪舍通风、卫生。妊娠第75天开展试验,试验期至断奶结束。妊娠第75~90天每天每头母猪饲喂2.4 kg饲粮;妊娠第91~115天每天每头母猪饲喂2.8 kg饲粮。在整个试验期间出现母猪返情、流产、疾病和健康异常等不能客观反映试验现象的母猪给予淘汰。
1.4 采集样本 1.4.1 血样采集母猪每头都采样,并在母猪妊娠第30、50、70、90、110天和哺乳第14天08:00空腹从耳缘静脉采血10 mL到肝素钠抗凝管中,3 500 r/min、低温离心15 min,分离血清,-20 ℃保存。在哺乳第14天,每组每头母猪中所有仔猪进行称重求平均值后,选取与平均体重相近的仔猪公、母各1只,共14只进行采血,血样3 500 r/min、低温离心15 min,制备血清于-20 ℃保存。
1.4.2 乳样采集收集母猪分娩后2 h内和哺乳第14天乳汁。从母猪的前、中、后乳头收集混合乳样20 mL,-80 ℃冰箱保存待测。初乳直接采取,常乳采前每头母猪注射2 mL缩宫素。
1.4.3 肠道样本采集哺乳第21天,对每组每头母猪的所有仔猪进行称重后取平均值,选取与平均体重相近的仔猪公、母各1只,共14只进行屠宰后取肠道样本,使用苏木精-伊红染色检测空肠和回肠形态。在脱水、包埋、切片和染色后,用计算机辅助显微镜(尼康ECLIPSE E200,日本)测量绒毛高度、隐窝深度,计算绒毛高度/隐窝深度。在空肠、回肠组织切片上,选5个典型视野(绒毛完整、走向平直),测量每100个肠上皮细胞中的杯状细胞数。
1.5 指标测定 1.5.1 繁殖性能母猪正常分娩后记录:窝总仔数、窝活仔数、窝死胎数、初生窝重、初生个体重。记录母猪采食量及断奶仔猪窝重,并计算平均日增重(ADG)、平均日增窝重、平均日采食量(ADFI)。
1.5.2 免疫指标采用酶联免疫吸附试验(ELISA)试剂盒(武汉华美生物工程有限公司)检测初乳中分泌性免疫球蛋白A(SIgA)含量,使用试剂盒(上海酶联生物科技有限公司)检测初乳免疫球蛋白A(IgA)、免疫球蛋白G(IgG)和免疫球蛋白M(IgM)含量。
1.5.3 抗氧化指标采用试剂盒(南京建成生物工程研究所)测定母猪和仔猪血清、母猪初乳中超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)活性,丙二醛(MDA)含量和总抗氧化能力(T-AOC)。
1.5.4 乳成分乳成分采用乳成分自动分析仪(UL40AC,杭州浙大优创科技有限公司)测定,测定指标包括乳蛋白、乳脂肪、总乳固体、非脂乳固体、乳糖含量。
1.6 统计分析试验数据用Excel 2019初步整理后,使用Graph Prime 8进行t检验分析,结果以平均值±均值标准误(SEM)表示。P < 0.05表示差异显著,P < 0.01表示差异极显著,0.05 < P < 0.10表示有趋势。
2 结果 2.1 ISO-S对母猪繁殖性能的影响由表 2可见,与对照组相比,饲粮中添加ISO-S显著提高了泌乳期母猪ADFI(P < 0.05);仔猪ADG有增加趋势(P=0.076 5);平均日增窝重、窝死胎数、仔猪初生个体重、窝总仔数均无显著变化(P>0.05)。
|
|
表 2 ISO-S对母猪繁殖性能的影响 Table 2 Effects of ISO-S on reproductive performance of sows |
由表 3可见,与对照组相比,母猪妊娠第110天,饲粮中添加ISO-S对妊娠母猪血清中CAT、GSH-Px、SOD活性,MDA含量及T-AOC未产生显著影响(P>0.05);哺乳第14天,饲粮中添加ISO-S对妊娠母猪血清中CAT、GSH-Px、SOD活性,MDA含量、T-AOC均未产生显著影响(P>0.05)。
|
|
表 3 ISO-S对母猪血清抗氧化指标的影响 Table 3 Effects of ISO-S on serum antioxidant indexes of sows |
由表 4可见,与对照组相比,饲粮中添加ISO-S显著提高了哺乳仔猪血清CAT活性(P < 0.05);饲粮中添加ISO-S对哺乳仔猪血清中GSH-Px、SOD活性,MDA含量,T-AOC均未产生显著影响(P>0.05)。
|
|
表 4 ISO-S对哺乳仔猪血清抗氧化指标的影响 Table 4 Effects of ISO-S on serum antioxidant indexes of suckling piglets |
由表 5可见,与对照组相比,饲粮中添加ISO-S极显著提升了母猪初乳CAT和SOD的活性(P < 0.01),显著提升了母猪初乳GSH-Px活性和T-AOC(P < 0.05)。
|
|
表 5 ISO-S对母猪初乳抗氧化指标的影响 Table 5 Effects of ISO-S on colostrum antioxidant indexes of sows |
由表 6可见,与对照组相比,饲粮中添加ISO-S显著提升了母猪初乳IgA、SIgA的含量(P < 0.05),对母猪初乳IgM、IgG含量未见显著影响(P>0.05)。
|
|
表 6 ISO-S对母猪初乳免疫指标的影响 Table 6 Effects of ISO-S on colostrum immune indexes of sows |
由图 1、图 2可见,与对照组相比,饲粮中添加ISO-S显著提高了母猪初乳中乳脂肪的含量(P < 0.05),对乳蛋白、总乳固体、非脂乳固体、乳糖含量均无显著影响(P>0.05);对母猪常乳中乳脂肪、乳蛋白、总乳固体、非脂乳固体、乳糖含量均未见显著影响(P>0.05)。
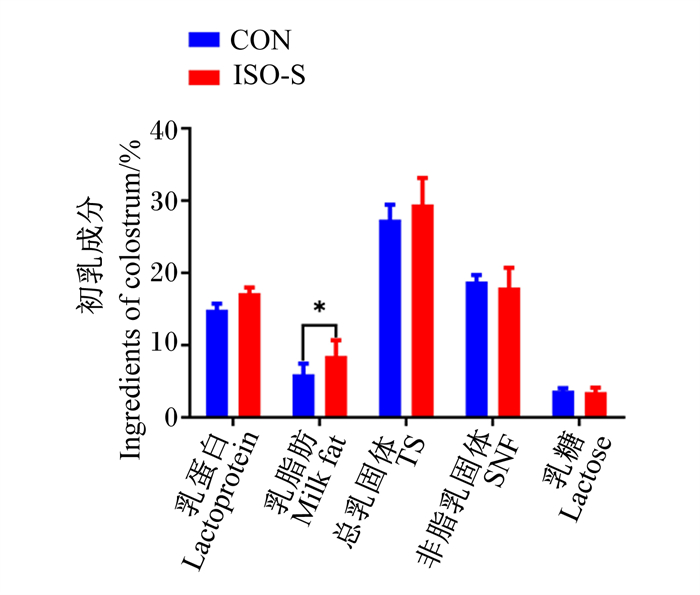
|
CON:对照组;ISO-S:ISO-S组。数据柱形标注*表示差异显著(P < 0.05),标注* *表示差异极显著(P < 0.01)。下图同。 CON: control group; ISO-S: ISO-S group. Values columns with * mean significant difference (P < 0.05), with * * mean extremely significant difference (P < 0.01). The same as below. 图 1 ISO-S对母猪初乳成分的影响 Fig. 1 Effects of ISO-S on colostrum ingredients of sows |
|
图 2 ISO-S对母猪常乳成分的影响 Fig. 2 Effects of ISO-S on ordinary milk ingredients of sows |
由表 7可见,与对照组相比,饲粮中添加ISO-S对回肠及空肠杯状细胞数、空肠绒毛高度/隐窝深度、回肠绒毛高度/隐窝深度均未见显著影响(P>0.05)。
|
|
表 7 ISO-S对哺乳仔猪肠道形态的影响 Table 7 Effects of ISO-S on intestinal morphology of suckling piglets |
ISO可与下丘脑及垂体中的雌二醇受体紧密结合,直接对神经内分泌体系产生影响,促使生长激素(GH)和胰岛素样生长因子-1(IGF-1)的分泌,从而促进猪的生长发育,提高生长性能。有研究表明,饲粮中添加ISO显著提高了断奶仔猪的末重和42~72日龄仔猪的ADFI和ADG[14]。Greiner等[15]研究也证实了饲粮中添加ISO可使仔猪的ADG和ADFI提高。Farmer等[16]的研究发现,饲粮中添加ISO能提高生长育肥猪的屠宰性能。本试验在饲粮中添加40 mg/kg ISO-S后显著提高了妊娠母猪的ADFI,提示添加ISO-S可提高猪的生长性能,这与前人研究结果一致;本试验添加ISO-S对母猪各项繁殖性能指标未见显著影响。有研究表明,饲粮中添加ISO可提高初生仔猪个体重和窝重,并呈现线性关系,20、28日龄仔猪个体重和窝重显著高于对照组[17]。Rehfeldt等[18]的试验表明,在妊娠后期母猪饲粮中添加ISO对窝产仔数、窝重和仔猪出生体重未见显著影响,但改善了仔猪肉品质并增加了骨骼肌细胞的数量。有试验在母猪妊娠后期饲粮中添加0.01% ISO后,仔猪断奶窝均重和日增重均高于对照组[19]。本试验结果表明,母猪妊娠后期饲粮中添加40 mg/kg ISO-S使仔猪ADG有增加趋势,提示添加ISO-S可增强仔猪的生长性能;对窝总仔数、窝活仔数及仔猪初生个体重、仔猪平均日增窝重均无显著影响。
3.2 ISO-S对妊娠期、泌乳期母猪及哺乳仔猪抗氧化能力的影响动物进行正常生命活动会消耗大量的能量与氧气,并伴随着大量自由基的产生,加之集约化养殖以及高密度饲养、哺乳动物体内产热增加,引发热应激[20]。母猪在热应激条件下,体内各类自由基增多,超过机体自由基清除系统的调节能力,形成氧化应激,削弱了机体抗氧化系统功能[2],导致产生某些代谢性疾病及乳腺疾病[21-22]。过量的自由基会使膜脂过氧化,破坏生物膜正常生理功能。SOD、CAT和GSH-Px是细胞中主要的抗氧化酶,在清除自由基和降低氧化应激中发挥重要作用。MDA含量可评估细胞氧化损伤的程度。因此,抗氧化酶活性和MDA含量是机体抗氧化能力的关键指标。ISO可消除活性氧(ROS)以减少MDA的形成,有效提高机体的抗氧化能力[23]。研究发现,饲粮补充ISO能改善仔猪肠道形态,增强机体抗氧化功能和免疫能力,从而减轻氧化应激[24]。本课题组另一试验发现,在肉鸡饲粮中添加ISO可减缓脂质过氧化,提高抗氧化能力[25]。本课题组研究发现,用10~40 μmol/L ISO处理仔猪肠上皮细胞,能减轻氧化应激对其的损伤作用,增强肠上皮细胞抗氧化能力并显著减少细胞凋亡[26]。在饲粮中添加10~40 mg/kg ISO能缓解断奶仔猪十二指肠绒毛损伤,并降低空肠组织中MDA含量,提高SOD、GSH-Px活性[27]。有研究表明,在饲粮中添加640 mg/kg高浓度ISO可提高肥育猪背最长肌SOD活性和T-AOC,同时增加脂肪、肝脏和血浆中MDA含量[28]。本试验结果表明,饲粮中添加40 mg/kg ISO-S显著提高了14日龄仔猪血清CAT活性,表明ISO-S可增强仔猪的抗氧化能力,在一定程度上降低了MDA含量并提高了SOD活性,但未达到显著水平;饲粮中添加40 mg/kg ISO-S对妊娠第110天和哺乳第14天母猪血清CAT、GSH-Px、SOD活性,MDA含量,T-AOC均未见显著影响;在饲粮中添加40 mg/kg ISO-S显著增加了母猪初乳中CAT、SOD、GSH-Px活性及T-AOC,表明ISO-S能增强母猪初乳抗氧化能力;在饲粮中添加ISO-S对初乳MDA含量未见显著影响。
3.3 ISO-S对母猪乳成分及初乳免疫指标的影响初生仔猪的增重主要是从母乳中获取营养物质和能量,母猪泌乳量及乳蛋白、乳脂肪、乳糖等营养物质含量在很大程度上影响仔猪的健康及生长发育。本试验结果表明,饲粮中添加40 mg/kg ISO-S,显著提高了母猪初乳中乳脂肪的含量,而乳蛋白质、总乳固体、非脂乳固体、乳糖含量没有显著变化,常乳成分含量无显著变化。ISO具有抗炎特性[29],对病原体有直接抑制作用[30],IgA、IgG、IgM是机体内重要的免疫球蛋白,添加ISO可使机体免疫抗体分泌升高。有研究发现,在妊娠母猪饲粮中添加ISO显著增加了母仔猪血浆中IgM的含量并提高了母猪初乳中的IgA和IgG含量[31]。本试验结果表明,在饲粮中添加40 mg/kg ISO-S显著提升了母猪初乳中IgA、SIgA的含量,表明ISO-S能增强母猪初乳免疫能力;在饲粮中添加ISO-S对初乳IgM、IgG含量均未见显著影响。有试验发现,饲粮中添加ISO可通过抑制脂多糖(LPS)诱导的p38和Toll样受体4(TLR4)依赖通路的激活,在一定程度上减轻LPS对断奶仔猪肠道屏障的破坏作用,改善仔猪肠道屏障功能[32]。Jenkins等[33]研究表明,添加73 mg/d ISO对血清中白细胞介素-6(IL-6)含量有显著提升作用。ISO还可增加妊娠后期母猪血液和初乳中猪瘟抗体的浓度,并显著提高初生仔猪血清中母源抗体的含量[34]。有研究发现,添加ISO的染病猪产生抗体更快,并且死亡率显著降低[35]。综上所述,饲粮添加ISO-S可增强猪的免疫功能。
3.4 ISO-S对仔猪肠道形态的影响在肠道中,微生物和饲粮的刺激会使肠道自由基增多,造成肠细胞膜的破坏,导致肠绒毛损伤,增加隐窝深度,增加分泌细胞,减少吸收细胞,降低营养吸收能力[36-37]。本课题组试验发现,饲粮中添加10~40 mg/kg ISO可以使十二指肠绒毛损伤得到缓解[27]。有研究表明,ISO作为植物雌激素可通过提高肠道益生菌的数量来抑制炎症相关基因的表达[38]。本试验结果显示,在饲粮中添加40 mg/kg ISO-S对空肠绒毛高度/隐窝深度、回肠绒毛高度/隐窝深度无显著影响。
4 结论综上所述,在饲粮中添加ISO-S可提高泌乳期母猪ADFI,仔猪ADG也有提高趋势;可提高母猪初乳中乳脂肪的含量;对泌乳期母猪初乳免疫指标及抗氧化指标、仔猪血清抗氧化指标均有显著改善作用。
| [1] |
高开国, 胡友军, 郑春田, 等. 母猪的氧化应激及营养调控策略[J]. 养猪, 2014(5): 17-20. GAO K G, HU Y J, ZHENG C T, et al. Oxidative stress and nutritional regulation strategies in sows[J]. Swine Production, 2014(5): 17-20 (in Chinese). DOI:10.13257/j.cnki.21-1104/s.2014.05.063 |
| [2] |
BERCHIERI-RONCHI C B, KIM S W, ZHAO Y, et al. Oxidative stress status of highly prolific sows during gestation and lactation[J]. Animal an International Journal of Animal Bioscience, 2011, 5(11): 1774-1779. DOI:10.1017/S1751731111000772 |
| [3] |
VITALE D C, PIAZZA C, MELILLI B, et al. Isoflavones: estrogenic activity, biological effect and bioavailability[J]. European journal of drug metabolism and pharmacokinetics, 2013, 38(1): 15-25. DOI:10.1007/s13318-012-0112-y |
| [4] |
GARCÍA-LAFUENTE A, GUILLAMÓN E, VILLARES A, et al. Flavonoids as anti-inflammatory agents: implications in cancer and cardiovascular disease[J]. Inflammation Research, 2009, 58(9): 537-552. DOI:10.1007/s00011-009-0037-3 |
| [5] |
QIN W Y, ZHU W Z, SHI H D, et al. Soy isoflavones have an antiestrogenic effect and alter mammary promoter hypermethylation in healthy premenopausal women[J]. Nutrition and Cancer-An International Journal, 2009, 61(2): 238-244. DOI:10.1080/01635580802404196 |
| [6] |
JIANG S Q, JIANG Z Y, WU T X, et al. Protective effects of a synthetic soybean isoflavone against oxidative damage in chick skeletal muscle cells[J]. Food Chemistry, 2007, 105(3): 1086-1090. DOI:10.1016/j.foodchem.2007.05.010 |
| [7] |
WEI J, BHATT S, CHANG L M, et al. Isoflavones, genistein and daidzein, regulate mucosal immune response by suppressing dendritic cell function[J]. PLoS One, 2012, 7(10): e47979. DOI:10.1371/journal.pone.0047979 |
| [8] |
MAGEE P J, ROWLAND I. Soy products in the management of breast cancer[J]. Current opinion in clinical nutrition and metabolic care, 2012, 15(6): 586-591. DOI:10.1097/MCO.0b013e328359156f |
| [9] |
SARKAR F H, LI Y W. Mechanisms of cancer chemoprevention by soy isoflavone genistein[J]. Cancer Metastasis Reviews, 2002, 21(3/4): 265-280. DOI:10.1023/A:1021210910821 |
| [10] |
VERDRENGH M, JONSSON I M, HOLMDAHL R, et al. Genistein as an anti-inflammatory agent[J]. Inflammation Research, 2003, 52(8): 341-346. DOI:10.1007/s00011-003-1182-8 |
| [11] |
KHAN A Q, KHAN R, REHMAN M U, et al. Soy isoflavones (daidzein & genistein) inhibit 12-O-tetradecanoylphorbol-13-acetate (TPA) -induced cutaneous inflammation via modulation of COX-2 and NF-κB in Swiss albino mice[J]. Toxicology, 2012, 302(2/3): 266-274. |
| [12] |
HU Y J, GAO K G, ZHENG C T, et al. Effect of dietary supplementation with glycitein during late pregnancy and lactation on antioxidative indices and performance of primiparous sows[J]. Journal of Animal Science, 2015, 93(5): 2246-2254. DOI:10.2527/jas.2014-7767 |
| [13] |
MA X, JIANG Z, JIAN Z, et al. Isoflavone ameliorates H2O2 induced injury by activating the antioxidant system of sow mammary gland cell[J]. Natural Science, 2015, 7(12): 571-580. DOI:10.4236/ns.2015.712057 |
| [14] |
LI Y P, JIANG X R, WEI Z X, et al. Effects of soybean isoflavones on the growth performance, intestinal morphology and antioxidative properties in pigs[J]. Animal, 2020, 14(11): 2262-2270. DOI:10.1017/S1751731120001123 |
| [15] |
GREINER L L, STAHLY T S, et al. The effect of dietary soy daidzein on pig growth and viral replication during a viral challenge[J]. Journal of Animal Science, 2001, 79(12): 3113-3119. DOI:10.2527/2001.79123113x |
| [16] |
FARMER C, ROBERTSON P, XIAO C W, et al. Exogenous genistein in late gestation: effects on fetal development and sow and piglet performance[J]. Animal an International Journal of Animal Bioscience, 2016, 10(9): 1423-1430. DOI:10.1017/S1751731116000355 |
| [17] |
韦习会, 夏东, 陈杰, 等. 饲喂大豆异黄酮对母猪繁殖性能及哺乳仔猪生长的影响[J]. 江苏农业学报, 2004, 20(1): 51-54. WEI X H, XIA D, CHEN J, et al. Effects of feeding soy isoflavone on the reproductive performance of sows and growth of piglets[J]. Jiangsu Journal of Agricultural Sciences, 2004, 20(1): 51-54 (in Chinese). DOI:10.3969/j.issn.1000-4440.2004.01.011 |
| [18] |
REHFELDT C, ADAMOVIC I, KUHN G. Effects of dietary daidzein supplementation of pregnant sows on carcass and meat quality and skeletal muscle cellularity of the progeny[J]. Meat Science, 2007, 75(1): 103-111. DOI:10.1016/j.meatsci.2006.06.028 |
| [19] |
邹芳, 付中明. 饲料中添加"巴罗顿"和大豆异黄酮对母猪繁殖性能及哺乳仔猪生长的影响[J]. 养殖技术顾问, 2010(10): 206-207. ZOU F, FU Z M. Effects of"Barrowton"and soy isoflavones in feed on reproductive performance of sows and growth of suckling piglets[J]. Technical Advisor for Animal Husbandry, 2010(10): 206-207 (in Chinese). DOI:10.3969/j.issn.1673-1921.2010.10.202 |
| [20] |
KADZERE C T, MURPHY M R, SILANIKOVE N, et al. Heat stress in lactating dairy cows: a review[J]. Livestock Production Science, 2002, 77(1): 59-91. DOI:10.1016/S0301-6226(01)00330-X |
| [21] |
FREI B, STOCKER R, AMES B N. Antioxidant defenses and lipid peroxidation in human blood plasma[J]. Proceedings of the National Academy of Sciences of the United States of America, 1988, 85(24): 9748-9752. DOI:10.1073/pnas.85.24.9748 |
| [22] |
SORDILLO L M. Factors affecting mammary gland immunity and mastitis susceptibility[J]. Livestock Production Science, 2005, 98(1/2): 89-99. |
| [23] |
JIANG Z Y, ZHOU G L, LIN Y C, et al. Effects of soybean isoflavones on in vitro antioxidative capacity of satellite cells of porcine skeletal muscles[J]. Agricultural Sciences in China, 2011, 10(1): 120-125. DOI:10.1016/S1671-2927(11)60314-3 |
| [24] |
HUANG L, MA X Y, JIANG Z Y, et al. Effects of soybean isoflavone on intestinal antioxidant capacity and cytokines in young piglets fed oxidized fish oil[J]. Journal of Zhejiang University-Science B, 2016, 17(12): 965-974. DOI:10.1631/jzus.B1600078 |
| [25] |
JIANG Z Y, JIANG S Q, LIN Y C, et al. Effects of soybean isoflavone on growth performance, meat quality, and antioxidation in male broilers[J]. Poultry Science, 2007, 86(7): 1356-1362. DOI:10.1093/ps/86.7.1356 |
| [26] |
胡胜兰, 肖昊, 王丽, 等. 大豆异黄酮对体外氧化应激仔猪肠上皮细胞的影响及机制研究[J]. 动物营养学报, 2021, 33(12): 6699-6708. HU S L, XIAO H, WANG L, et al. Effects and mechanism research of soybean isoflavones on intestinal epithelial cells of piglets under oxidative stress in vitro[J]. Chinese Journal of Animal Nutrition, 2021, 33(12): 6699-6708 (in Chinese). |
| [27] |
林厦菁, 陈芳, 蒋守群, 等. 大豆异黄酮对早期断奶仔猪生长性能, 抗氧化功能及肠粘膜形态结构的影响[J]. 中国农业科学, 2020, 53(10): 2101-2111. LIN X J, CHEN F, JIANG S Q, et al. Effects of soybean isoflavones on growth performance, antioxidant performance and intestinal morphology of early-weaned piglets[J]. Scientia Agricultura Sinica, 2020, 53(10): 2101-2111 (in Chinese). DOI:10.3864/j.issn.0578-1752.2020.10.016 |
| [28] |
CHEN W, MA X Y, LIN Y C, et al. Dietary supplementation with a high dose of daidzein enhances the antioxidant capacity in swine muscle but experts pro-oxidant function in liver and fat tissues[J]. Journal of Animal Science and Biotechnology, 2016, 7: 43. DOI:10.1186/s40104-016-0102-z |
| [29] |
BOYD R D, JOHNSTON M E, ZIER-RUSH C. Soybean meal level modulates the adverse effect of high immune stress on growth and feed efficiency in growing pigs[C]//Minnesota Nutrition Conference, St. Paul Minnesota: University of Minnesota, 2010: 167-174.
|
| [30] |
AZZAM M M, JIANG S Q, CHEN J L, et al. Effect of soybean isoflavones on growth performance, immune function, and viral protein 5 mRNA expression in broiler chickens challenged with infectious bursal disease virus[J]. Animals an Open Access Journal From MDPI, 2019, 9(5): 247. |
| [31] |
刘杰, 李永明, 徐子伟, 等. 大豆黄酮对母仔猪生产性能和免疫功能的影响[J]. 浙江农业科学, 2012(3): 400-402. LIU J, LI Y M, XU Z W, et al. Effects of daidzein on performance and immune function of sows and piglets[J]. Journal of Zhejiang Agricultural Sciences, 2012(3): 400-402 (in Chinese). DOI:10.3969/j.issn.0528-9017.2012.03.049 |
| [32] |
ZHU C, WU Y P, JIANG Z Y, et al. Dietary soy isoflavone attenuated growth performance and intestinal barrier functions in weaned piglets challenged with lipopolysaccharide[J]. International Immunopharmacology, 2015, 28(1): 288-294. DOI:10.1016/j.intimp.2015.04.054 |
| [33] |
JENKINS D J A, KENDALL C W C, JACKSON C J C, et al. Effects of high-and low-isoflavone soyfoods on blood lipids, oxidized LDL, homocysteine, and blood pressure in hyperlipidemic men and women[J]. The American Journal of Clinical Nutrition, 2002, 76(2): 365-372. DOI:10.1093/ajcn/76.2.365 |
| [34] |
张荣庆, 韩正康, 陈杰, 等. 大豆黄酮的对母猪免疫功能和血清及初乳中GH、PRL、SS水平的影响[J]. 动物学报, 1995(2): 201-206. ZHANG R Q, HAN Z K, CHEN J, et al. Effects of daidzein on immune function and levels of GH, PRL and SS in serum and colostrum of sows[J]. Current Zoology, 1995(2): 201-206 (in Chinese). DOI:10.3321/j.issn:0001-7302.1995.02.013 |
| [35] |
SMITH B N, OELSCHLAGER M L, ABDUL RASHEED M S, et al. Dietary soy isoflavones reduce pathogen-related mortality in growing pigs under porcine reproductive and respiratory syndrome viral challenge[J]. Journal of Animal Science, 2020, 98(2): skaa024. DOI:10.1093/jas/skaa024 |
| [36] |
CAIRO P L G, GOIS F D, SBARDELLA M, et al. Effects of dietary supplementation of red pepper (Schinus terebinthifolius Raddi) essential oil on performance, small intestinal morphology and microbial counts of weanling pigs[J]. Journal of the Science of Food and Agriculture, 2018, 98(2): 541-548. DOI:10.1002/jsfa.8494 |
| [37] |
JIAO L F, KE Y L, XIAO K, et al. Effects of cello-oligosaccharide on intestinal microbiota and epithelial barrier function of weanling pigs[J]. Journal of Animal Science, 2015, 93(3): 1157-1164. DOI:10.2527/jas.2014-8248 |
| [38] |
MONTEIRO N E S, QUEIRÓS L D, LOPES D B, et al. Impact of microbiota on the use and effects of isoflavones in the relief of climacteric symptoms in menopausal women-a review[J]. Journal of Functional Foods, 2018, 41: 100-111. DOI:10.1016/j.jff.2017.12.043 |




