2. 广州奇龙生物科技有限公司,广州 510663
2. Guangzhou Qilong Biological Technology Co., Ltd., Guangzhou 510663, China
随着我国畜禽饲用产品禁用抗生素政策的颁布实施,开发有效替代抗生素的饲用产品已成为目前畜牧行业的研究热点。溶菌酶作为生物体内重要的非特异性免疫因子之一,广泛存在于泪液、唾液、乳汁和蛋清等机体组织或分泌液当中,能够杀菌而对细胞无任何影响,是一种具有杀菌作用的天然抗感染物质[1],具有促进机体肠道有益菌群的繁殖[2]、抑制病原菌[3]、调节机体免疫[4]等功能。目前溶菌酶已经在饲料产业、食品工业和医药业等方面广泛应用[5]。研究发现,溶菌酶具有提高肉鸡生长性能[6]、蛋鸡生产性能和蛋品质[7]、肥育猪免疫功能[8]以及改善肉鸡肉品质[9]等作用。目前商品化成熟的溶菌酶为鸡蛋清溶菌酶,对蛋源溶菌酶的研究居多,但人溶菌酶本身就是机体的蛋白质,它有着比蛋清溶菌酶更好的活性和热稳定性,当前重组人溶菌酶还未收录在饲料添加剂目录中,且关于重组人溶菌酶对于黄羽肉鸡的作用尚未见研究报道。因此,本试验通过研究重组人溶菌酶对黄羽肉鸡生长性能、免疫功能和肠道健康的影响,探讨重组人溶菌酶在黄羽肉鸡应用的可能性,以期为重组人溶菌酶在肉鸡生产中的应用提供重要参考和依据。
1 材料与方法 1.1 试验动物与分组试验采用单因素随机分组设计,选用1 440只健康、发育良好的1日龄黄羽肉鸡(快速型麻黄鸡),按照体重一致原则随机分为6个组,每组8个重复,每个重复30只鸡(公、母各占1/2)。对照组饲喂基础饲粮,作为空白对照;抗生素组饲喂在基础饲粮中添加抗生素(200 mg/kg的4%恩拉霉素)的试验饲粮,作为阳性对照;4个试验组分别饲喂添加1、2、3、4 g/kg重组人溶菌酶的试验饲粮。试验期共50 d,分为1~21日龄、22~42日龄、43~50日龄3个阶段饲养。
1.2 试验饲粮试验采用玉米-豆粕型基础饲粮(颗粒料),参考《黄羽肉鸡营养需要量》(NY/T 3645—2020)标准中快速型黄羽肉鸡的营养需要量参数配制。基础饲粮组成及营养水平见表 1。按照试验设计添加不同剂量的重组人溶菌酶或抗生素。试验饲粮重组人溶菌酶由广州某公司生产提供,其中有效成分重组人溶菌酶活性≥10 000 U/g。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of basal diets (air-dry basis) |
试验鸡采用地面平养,垫料使用清洁卫生的谷壳。1周龄期间室温维持在32~34 ℃,从第2周起,每周下降2~3 ℃,第4周起,室温保持27~28 ℃;前期鸡舍相对湿度保持70%~80%,后期相对湿度保持在65%~75%;其他按照常规饲养操作规程饲养和常规免疫程序免疫。试验期间安排专人负责饲养,鸡只自由采食和饮水,保持鸡舍清洁卫生。
1.4 测定指标及方法 1.4.1 生长性能在试验鸡21、42、50日龄前1天20:00断料不断水,于次日08:00以重复为单位称重、结料,准确记录给料量和剩料量,计算试验期肉鸡的平均日增重(ADG)、平均日采食量(ADFI)和料重比(F/G)。每天观察鸡只健康情况和粪便情况,统计每个饲养阶段各组试验鸡的死亡率。
1.4.2 血液免疫指标在21、50日龄时,从每个重复选取1只试验鸡(每组公、母各4只),使用抗凝管翅静脉采血3 mL,按照试剂盒(Solarbio,北京索莱宝科技有限公司)说明书用淋巴细胞分离液从外周血样品中分离外周血淋巴细胞。按照试剂盒(Southern Biotechnology Associates,美国)说明书加入小鼠抗鸡CD3-FITC、小鼠抗鸡CD4-APC或小鼠抗鸡CD8a-PE在37 ℃孵育30 min,然后用磷酸盐缓冲液(PBS)洗涤2次以去除多余的抗体。采用流式细胞仪(BD Accuri C6 Plus,Becton, Dickinson and Company公司,美国)测定和分析CD3+、CD4+和CD8+淋巴细胞亚群百分率并计算CD4+/CD8+比值。
1.4.3 肠道黏膜形态结构在21、50日龄时,从每各重复选取1只试验鸡(每组公、母各4只),剪取空肠、回肠肠段中段样,使用多聚甲醛对组织进行固定,制作石蜡切片,进行苏木精-伊红(HE)染色,显微镜镜检,图像采集分析,观察肠绒毛形态结构,测定空肠和回肠绒毛高度和隐窝深度,计算绒毛高度与隐窝深度的比值(绒隐比)。
1.4.4 盲肠菌群结构在21、50日龄时,从每各重复取1只试验鸡(每组公、母各4只),剪取盲肠,采用十六烷基三甲基溴化铵(CTAB)手提法提取盲肠样本基因组DNA。以样品基因组DNA为模板,采用细菌通用引物和518R扩增样品16S rDNA的V3区序列。将PCR产物进行变性梯度凝胶电泳(DGGE)分析。DGGE完毕后,采用银染法染色。PCR产物采用OMEGA公司DNA Gel Extraction试剂盒纯化回收。采用Quantity one分析软件包对DGGE图谱的电泳条带数目、条带密度进行数字化分析。再将DGGE图谱中优势条带进行回收,对总菌、大肠杆菌、乳酸菌、沙门氏菌和双歧杆菌测序,将提取的DNA上PCR仪(TIB8600,泰普生物科学有限公司)检测,根据样品Ct值和标准曲线计算出各样品菌群数量,再换算成每克样品中细菌拷贝数的对数值。
1.4.5 肠道黏膜细胞因子含量在21日龄时,从每个重复取1只试验鸡(每组公、母各4只),刮取空肠和回肠黏膜,采用酶联免疫吸附测定(ELISA)法使用多功能酶标仪(spectra max M-5,Molecular Devices公司,美国)测定γ-干扰素(IFN-γ)、白细胞介素-10(IL-10)、白细胞介素-1β(IL-1β)、白细胞介素-8(IL-8)、分泌型免疫球蛋白A(sIgA)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)含量。在50日龄时,每个重复取1只试验鸡(每组公、母各4只),刮取空肠黏膜,采用ELISA法使用多功能酶标仪测定IFN-γ、IL-10、IL-1β、IL-8、sIgA、IL-6、TNF-α和溶菌酶含量。试剂盒均采购于北京厚泽鸿业科技有限公司,根据试剂盒说明书进行检测。
1.5 数据处理与统计分析试验数据采用SAS 8.0软件的一般线性模型(GLM)程序进行单因素方差分析,并对试验数据采用Duncan氏法进行多重比较,统计显著水平为P < 0.05,试验数据均以平均值和均值标准误(SEM)表示。
2 结果 2.1 重组人溶菌酶对黄羽肉鸡生长性能的影响由表 2可知,1~21日龄,2 g/kg重组人溶菌酶组试验鸡平均日增重和平均日采食量最高,比对照组分别提高5.16%、3.22%,但与对照组相比无显著差异(P>0.05);22~42日龄,4 g/kg重组人溶菌酶组平均日增重显著高于对照组(P < 0.05),比对照组提高6.61%;43~50日龄,2 g/kg重组人溶菌酶组平均日增重最高,但比对照组相比无显著差异(P>0.05)。整个试验期(1~50日龄),抗生素组的生长性能与添加不同水平重组人溶菌酶的各试验组无显著差异(P>0.05)。
|
|
表 2 重组人溶菌酶对黄羽肉鸡生长性能的影响 Table 2 Effects of recombinant human lysozyme on growth performance of yellow-feathered broilers |
由表 3可知,饲粮中添加不同水平重组人溶菌酶对21日龄黄羽肉鸡外周血CD4+/CD8+比值有显著影响(P < 0.05),其中3 g/kg重组人溶菌酶组外周血CD4+/CD8+比值显著高于对照组。饲粮中添加不同水平重组人溶菌酶对50日龄黄羽肉鸡外周血CD3+、CD4+、CD8+淋巴细胞亚群百分率均有显著影响(P < 0.05),其中2 g/kg重组人溶菌酶组外周血CD3+淋巴细胞亚群百分率显著高于抗生素组和1 g/kg重组人溶菌酶组(P < 0.05);2 g/kg重组人溶菌酶组外周血CD4+淋巴细胞亚群百分率显著高于对照组、抗生素组和1 g/kg重组人溶菌酶组(P < 0.05);2 g/kg重组人溶菌酶组外周血CD8+淋巴细胞亚群百分率显著高于抗生素组(P < 0.05)。
|
|
表 3 重组人溶菌酶对黄羽肉鸡外周血淋巴细胞亚群百分率的影响 Table 3 Effects of recombinant human lysozyme on percentages of lymphocyte subsets in peripheral blood of yellow-feathered broilers |
由表 4可知,饲粮中添加不同水平重组人溶菌酶对21日龄黄羽肉鸡空肠黏膜细胞因子含量无显著影响(P>0.05)。饲粮中添加不同水平重组人溶菌酶显著影响21日龄黄羽肉鸡回肠黏膜IL-1β、IFN-γ含量(P < 0.05),其中1 g/kg重组人溶菌酶组回肠黏膜IL-1β含量显著高于其他组(P < 0.05);1、2 g/kg重组人溶菌酶组回肠黏膜IFN-γ含量高于对照组和4 g/kg重组人溶菌酶组(P < 0.05)。饲粮中添加不同水平重组人溶菌酶对50日龄黄羽肉鸡空肠黏膜IL-1β、IL-6、IL-8、IL-10、IFN-γ、sIgA和溶菌酶含量均有显著影响(P < 0.05),其中1 g/kg重组人溶菌酶组空肠黏膜IL-1β含量显著高于其他组(P < 0.05);3 g/kg重组人溶菌酶组空肠黏膜IL-6含量显著高于2 g/kg重组人溶菌酶组(P < 0.05);3 g/kg重组人溶菌酶组空肠黏膜IL-8含量显著高于4 g/kg重组人溶菌酶组(P < 0.05);3 g/kg重组人溶菌酶组空肠黏膜IL-10含量显著高于对照组(P < 0.05);3 g/kg重组人溶菌酶组空肠黏膜IFN-γ含量显著高于1 g/kg重组人溶菌酶组(P < 0.05);3 g/kg重组人溶菌酶组空肠黏膜sIgA含量显著高于对照组和4 g/kg重组人溶菌酶组(P < 0.05);抗生素组和2、3、4 g/kg重组人溶菌酶组空肠黏膜溶菌酶含量显著高于对照组(P < 0.05)。
|
|
表 4 重组人溶菌酶对黄羽肉鸡肠道黏膜细胞因子含量的影响 Table 4 Effects of recombinant human lysozyme on intestinal mucosal cytokine contents of yellow-feathered broilers |
由表 5可知,饲粮中添加不同水平重组人溶菌酶对21日龄黄羽肉鸡盲肠乳酸杆菌数量有显著影响,其中3 g/kg重组人溶菌酶组和抗生素组盲肠乳酸杆菌数量显著高于对照组(P < 0.05)。饲粮中添加不同水平重组人溶菌酶对50日龄黄羽肉鸡盲肠大肠杆菌、乳酸杆菌、双歧杆菌和总菌数量有显著影响(P>0.05),其中4 g/kg重组人溶菌酶组盲肠乳酸杆菌数量显著高于其他组(P < 0.05),1和2 g/kg重组人溶菌酶组盲肠双歧杆菌数量显著高于抗生素组(P < 0.05);抗生素组盲肠总菌数量显著低于其他组(P < 0.05)。
|
|
表 5 重组人溶菌酶对黄羽肉鸡盲肠菌群组成的影响 Table 5 Effects of recombinant human lysozyme on cecal microflora composition of yellow-feathered broilers |
由表 6可知,21日龄,抗生素组空肠隐窝深度显著高于3 g/kg重组人溶菌酶组(P<0.05);1 g/kg重组人溶菌酶组空肠绒隐比显著高于抗生素组(P<0.05);3 g/kg重组人溶菌酶组回肠绒毛高度显著高于对照组和1 g/kg重组人溶菌酶组(P<0.05),绒隐比显著高于对照组、1 g/kg重组人溶菌酶组和抗生素组(P<0.05)。50日龄,2 g/kg重组人溶菌酶组空肠绒毛高度显著高于3和4 g/kg重组人溶菌酶组(P<0.05);对照组空肠隐窝深度显著高于3和4 g/kg重组人溶菌酶组(P<0.05);4 g/kg重组人溶菌酶组回肠绒毛高度和绒隐比显著高于1 g/kg重组人溶菌酶组(P<0.05)。黄羽肉鸡空肠和回肠HE染色切片图见图 1。
|
|
表 6 重组人溶菌酶对黄羽肉鸡空肠和回肠黏膜形态结构的影响 Table 6 Effects of recombinant human lysozyme on mucosal morphology of jejunum and ileum of yellow-feathered broilers |
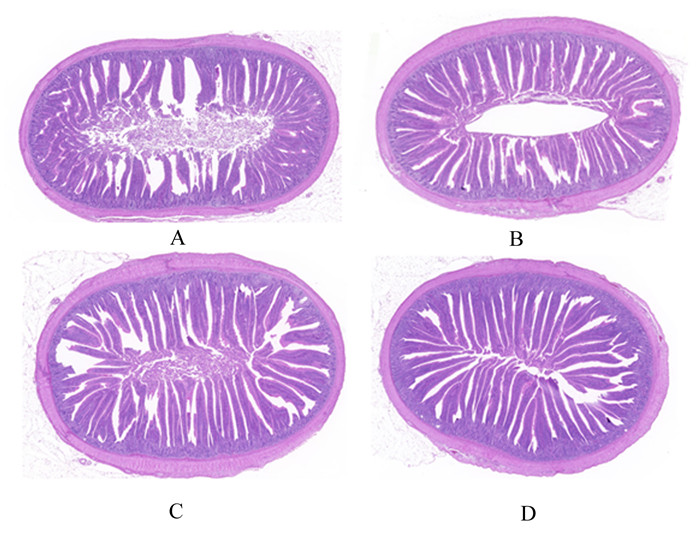
|
A:对照组回肠HE染色切片图(21日龄);B:3 g/kg重组人溶菌酶组回肠HE染色切片图(21日龄);C:对照组空肠HE染色切片图(50日龄);D:3 g/kg重组人溶菌酶组空肠HE染色切片图(50日龄)。所有HE染色切片图均放大20倍。 A: ileum HE staining section of control group (21 days of age); B: ileum HE staining section of 3 g/kg recombinant human lysozyme group (21 days of age); C: jejunum HE staining section of control group (50 days of age); D: jejunum HE staining section of 3 g/kg recombinant human lysozyme group (50 days of age). All HE staining sections were magnified 20 times. 图 1 黄羽肉鸡空肠和回肠HE染色切片图 Fig. 1 HE staining section of jejunum and ileum of yellow-feathered broilers |
本试验结果显示,饲粮中添加重组人溶菌酶对黄羽肉鸡生长性能有改善作用,其中1~21日龄和43~50日龄阶段饲粮添加2 g/kg重组人溶菌酶时生长性能最佳,22~42日龄阶段饲粮添加4 g/kg重组人溶菌酶时生长性能最佳并且平均日增重显著高于对照组,说明重组人溶菌酶在黄羽肉鸡不同生长阶段适宜添加量存在差异,整个试验期抗生素组的生长性能与添加不同水平重组人溶菌酶的各试验组无显著差异。刘伟等[10]研究发现,在饲粮中添加蛋源溶菌酶能够显著提高黄羽肉鸡的全期生长性能,与抗生素组相比无显著差异,这个结果与本试验结果相似,也与Abdel-Latif等[11]和Liu等[12]在肉鸡上的研究结果相近。姚远等[13]研究显示,饲粮中添加天蚕素抗菌肽可以提高肉鸡的生长性能,其分析原因认为是通过改善肠道功能和提高有益菌数量来间接实现的。本试验结果也显示重组人溶菌酶可以改善黄羽肉鸡肠道黏膜形态和提高肠道有益菌数量,推测这也是间接提高其生长性能的原因。
3.2 重组人溶菌酶对黄羽肉鸡免疫功能的影响溶菌酶是生物体内重要的非特异性免疫因子之一,它参与机体多种免疫反应,能够激发T淋巴细胞的产生,提高机体体液免疫和细胞免疫水平[14]。研究发现,溶菌酶可以使肉鸡淋巴细胞在刀豆蛋白A(ConA)刺激下,增强血液中淋巴细胞转化率[15]。本试验结果显示,饲粮中添加重组人溶菌酶可以提高黄羽肉鸡外周血CD3+淋巴细胞亚群百分率和CD4+/CD8+比值,说明重组人溶菌酶有促进体细胞免疫的作用。
细胞因子是免疫调节蛋白,它在先天性和适应性免疫反应中具有重要的作用,同时它也是肠道屏障健康的重要影响因素。IL-10是Th2细胞因子,主要参与体液免疫,能够抑制炎症细胞的增殖[16]。IL-1β、IFN-γ等炎症细胞因子在机体的免疫应答反应中具有重要作用,其中IL-1β可以诱导淋巴细胞的分化增殖,刺激抗体产生[17];IFN-γ是Th1细胞因子,具有抗炎和促进细胞免疫的作用[18]。sIgA是肠道免疫重要防御屏障,以它为主的体液免疫在肠道黏膜免疫中起到重要作用[19]。本试验结果显示,在黄羽肉鸡饲粮中添加适量重组人溶菌酶可以提高肠道黏膜中IL-1β、IL-10、IFN-γ、sIgA含量。研究报道,肉鸡饲粮中添加溶菌酶可以显著提高肠道中IFN-γ和IL-10的表达水平[11]。也有研究发现,肉鸡饲粮中添加溶菌酶对血清中IL-6、IL-10的含量无显著影响,可显著提高sIgA的含量[10],降低血清中IFN-γ的含量[20]。不同研究所得结果不一致,可能是由于虽然IL-1β、IFN-γ一般认为是炎症因子,但这些炎症因子的作用是双向的。在炎症初期,抗炎物质会抑制炎症因子过多产生,缓解炎症反应;若作用于补偿期,抑制抗炎症因子过多产生,缓解免疫应激反应,抗炎和促炎处于平衡状态才能维持机体正常的生命活动。溶菌酶是动物机体重要的非特异性免疫因子,其含量也是反映机体免疫功能强弱的重要指标。本试验结果显示,饲粮添加重组人溶菌酶可提高黄羽肉鸡肠道黏膜中溶菌酶含量。以上试验结果均说明重组人溶菌酶对于黄羽肉鸡肠道免疫功能具有增强作用。
3.3 重组人溶菌酶对黄羽肉鸡肠道黏膜形态结构的影响肠道绒毛是家禽肠道吸收营养物质的特有结构,它的高度和隐窝深度对肠道的消化吸收能力有最直接的影响[21]。绒毛高时,成熟细胞较多,养分吸收能力强;隐窝浅,表明细胞成熟率增多,分泌功能增强,所以绒隐比越高,肠道的消化吸收能力越强[22]。本试验结果显示,与对照组和抗生素组对比,3 g/kg重组人溶菌酶组21日龄黄羽肉鸡回肠绒隐比显著提高,说明重组人溶菌酶对黄羽肉鸡的肠道黏膜形态结构有改善作用。本试验结果与Sindaye等[23]、Humphrey等[24]、Torki等[25]在肉鸡上的试验结果相似,说明溶菌酶改善肠道黏膜形态的效果优于抗生素,而溶菌酶对肠道形态结构的改善作用可能与肠道菌群组成的变化[26]或是促进肠上皮细胞的增殖分化、加快组织修复相关[27]。
3.4 重组人溶菌酶对黄羽肉鸡盲肠菌群结构的影响溶菌酶可以通过增强肠道中有益菌和抑制致病菌的增殖来改善肠道菌群结构,保护肠道的微生态平衡[28]。Xu等[29]研究显示,在母猪饲粮中添加溶菌酶可以显著降低肠道中放线菌、螺旋体等有害菌的数量,增加乳酸杆菌的数量。程时军[30]研究报道,在肉鸡饲粮中添加溶菌酶可以显著降低十二指肠和空肠中梭菌和大肠杆菌数量。在肉鸭的试验中也发现溶菌酶能够显著降低盲肠中大肠杆菌数量,提高乳酸杆菌数量,并且该作用优于3种抗生素[31]。本试验结果显示,饲粮中添加适量重组人溶菌酶可以提高黄羽肉鸡盲肠中双歧杆菌和乳酸杆菌的数量,且1和2 g/kg重组人溶菌酶组50日龄黄羽肉鸡盲肠中双歧杆菌和总菌数量显著高于抗生素组,说明饲粮中添加重组人溶菌酶对黄羽肉鸡盲肠菌群结构有明显的改善作用,并且这种作用要优于抗生素。
4 结论在本试验条件下,饲粮中添加重组人溶菌酶可促进黄羽肉鸡的生长,增强机体免疫功能,改善肠道黏膜形态结构和盲肠菌群组成,并且效果要优于抗生素。黄羽肉鸡饲粮中重组人溶菌酶的适宜添加水平为1~4 g/kg(10 000~40 000 U/kg)。目前重组人溶菌酶还未收录在饲料添加剂目录中,本试验结果可为重组人溶菌酶在肉鸡生产中的应用提供重要参考和依据。
| [1] |
WANG H, WU H P, WANG K J, et al. Expression of recombinant human lysozyme in transgenic chicken promotes the growth of Bifidobacterium in the intestine and improves postnatal growth of chicken[J]. AMB Express, 2016, 6(1): 110. DOI:10.1186/s13568-016-0280-2 |
| [2] |
XIONG X, ZHOU J, LIU H N, et al. Dietary lysozyme supplementation contributes to enhanced intestinal functions and gut microflora of piglets[J]. Food & Function, 2019, 10(3): 1696-1706. |
| [3] |
陈亚迎. 乳酸链球菌素和溶菌酶对湖羊生长性能、瘤胃发酵及微生物菌群的影响[D]. 硕士学位论文. 南京: 南京农业大学, 2017. CHEN Y Y. Effects of nisin and lysozyme on growth performance, rumen fermentation and rumen microbiota of Hu sheep[D]. Master's Thesis. Nanjing: Nanjing Agricultural University, 2017. (in Chinese) |
| [4] |
LEE M, KOVACS-NOLAN J, YANG C B, et al. Hen egg lysozyme attenuates inflammation and modulates local gene expression in a porcine model of dextran sodium sulfate (DSS)-induced colitis[J]. Journal of Agricultural and Food Chemistry, 2009, 57(6): 2233-2240. DOI:10.1021/jf803133b |
| [5] |
庞恋苏, 李亚男. 重组人溶菌酶的研究进展[J]. 中华老年口腔医学杂志, 2017, 15(5): 306-309. PANG L S, LI Y N. Research progress of recombinant human lysozyme[J]. Chinese Journal of Geriatric Dentistry, 2017, 15(5): 306-309 (in Chinese). DOI:10.3969/j.issn.1672-2973.2017.05.015 |
| [6] |
KHALIL K K I, ISLAM A, SUJAN K M, et al. Dietary acidifier and lysozyme improve growth performances and hemato-biochemical profile in broiler chicken[J]. Journal of Advanced Biotechnology and Experimental Therapeutics, 2020, 3(3): 241-247. DOI:10.5455/jabet.2020.d130 |
| [7] |
杨荣芳. 日粮添加溶菌酶对蛋鸡生产性能和蛋品质的影响[J]. 辽宁农业职业技术学院学报, 2010, 12(4): 9-11. YANG R F. Effects of lysozyme in diets on production performance and egg quality of layers[J]. Journal of Liaoning Agricultural Technical College, 2010, 12(4): 9-11 (in Chinese). DOI:10.3969/j.issn.1671-0517.2010.04.005 |
| [8] |
ZOU L J, XIONG X, LIU H N, et al. Effects of dietary lysozyme levels on growth performance, intestinal morphology, immunity response and microbiota community of growing pigs[J]. Journal of the Science of Food and Agriculture, 2019, 99(4): 1643-1650. DOI:10.1002/jsfa.9348 |
| [9] |
丁亦男. 人重组溶菌酶对肉鸡生产性能及胴体品质的影响[J]. 安徽农业科学, 2010, 38(28): 15677-15678. DING Y N. Effects of recombinant lysozyme on growth performance and carcass traits in broilers[J]. Journal of Anhui Agricultural Sciences, 2010, 38(28): 15677-15678 (in Chinese). DOI:10.3969/j.issn.0517-6611.2010.28.090 |
| [10] |
刘伟, 鞠婷婷, 王永侠, 等. 日粮添加蛋源溶菌酶对岭南黄鸡生产性能和免疫功能的影响[J]. 中国畜牧杂志, 2018, 54(6): 112-117. LIU W, JU T T, WANG Y X, et al. Effects of dietary lysozyme supplementation on performance and immune function of Lingnan yellow chickens[J]. Chinese Journal of Animal Science, 2018, 54(6): 112-117 (in Chinese). |
| [11] |
ABDEL-LATIF M A, EL-FAR A H, ELBESTAWY A R, et al. Exogenous dietary lysozyme improves the growth performance and gut microbiota in broiler chickens targeting the antioxidant and non-specific immunity mRNA expression[J]. PLoS One, 2017, 12(10): e0185153. DOI:10.1371/journal.pone.0185153 |
| [12] |
LIU D, GUO Y M, WANG Z, et al. Exogenous lysozyme influences Clostridium perfringens colonization and intestinal barrier function in broiler chickens[J]. Avian Pathology, 2010, 39(1): 17-24. DOI:10.1080/03079450903447404 |
| [13] |
姚远, 匡伟, 黄忠阳, 等. 抗菌肽天蚕素对鸡生长性能、肠道黏膜形态、盲肠菌群及免疫功能的影响[J]. 江苏农业学报, 2014, 30(2): 331-338. YAO Y, KUANG W, HUANG Z Y, et al. Effect of antibacterial peptide cecropin on growth performance, intestinal mucosal morphology, caecal microflora and immune function of chickens[J]. Jiangsu Journal of Agricultural Sciences, 2014, 30(2): 331-338 (in Chinese). DOI:10.3969/j.issn.1000-4440.2014.02.017 |
| [14] |
MAI W J, HU C Q. Molecular cloning, characterization, expression and antibacterial analysis of a lysozyme homologue from Fenneropenaeus merguiensis[J]. Molecular Biology Reports, 2008, 36(6): 1587. |
| [15] |
丁亦男. 人重组溶菌酶对肉鸡生产性能及免疫功能的影响[D]. 硕士学位论文. 长春: 吉林农业大学, 2008: 21-31. DING Y N. Effects of recombinant lysozyme on growth performance and immune function in broilers[D]. Master's Thesis. Changchun: Jilin Agricultural University, 2008: 21-31. (in Chinese) |
| [16] |
FERNÁNDEZ A, MARTELES D, DE ARCAUTE M R, et al. Relationship between pro-inflammatory cytokines, IL-10 anti-inflammatory cytokine and serum proteins in healthy lambs and with diarrhea[J]. Pakistan Veterinary Journal, 2016, 36(1): 63-67. |
| [17] |
DAI M M, FENG M, XIE T T, et al. ALV-J infection induces chicken monocyte death accompanied with the production of IL-1β and IL-18[J]. Oncotarget, 2017, 8(59): 99889-99900. DOI:10.18632/oncotarget.21906 |
| [18] |
YANG X, ARSLAN M, LIU X J, et al. IFN-γ establishes interferon-stimulated gene-mediated antiviral state against Newcastle disease virus in chicken fibroblasts[J]. Acta Biochimica et Biophysica Sinica, 2020, 52(3): 268-280. DOI:10.1093/abbs/gmz158 |
| [19] |
TIAN E J, ZHOU B H, WANG X Y, et al. Effect of diclazuril on intestinal morphology and SIgA expression in chicken infected with Eimeria tenella[J]. Parasitology Research, 2014, 113(11): 4057-4064. DOI:10.1007/s00436-014-4074-7 |
| [20] |
苏长城, 鞠婷婷, 刘伟, 等. 日粮添加蛋源溶菌酶对肉鸡血清和组织细胞因子水平的影响[J]. 中国家禽, 2018, 40(3): 19-22. SU C C, JU T T, LIU W, et al. Effect of dietary egg lysozyme on the levels of cytokines in serum and tissue of broilers[J]. China Poultry, 2018, 40(3): 19-22 (in Chinese). |
| [21] |
PATRA A K. Influence of plant bioactive compounds on intestinal epithelial barrier in poultry[J]. Mini Reviews in Medicinal Chemistry, 2020, 20(7): 566-577. DOI:10.2174/1389557520666191226111405 |
| [22] |
张利环, 张若男, 贾浩, 等. 3种不同益生菌对肉鸡生长性能、肠道消化吸收功能的影响[J]. 中国畜牧杂志, 2021, 57(5): 188-192. ZHANG L H, ZHANG R N, JIA H, et al. Effects of three different probiotics on growth performance and Intestinal digestion and absorption function of broilers[J]. Chinese Journal of Animal Science, 2021, 57(5): 188-192 (in Chinese). |
| [23] |
SINDAYE D, 肖再利, 张帆, 等. 饲粮中添加溶菌酶对蛋雏鸡生长性能、肠道形态和抗氧化能力的影响[J]. 饲料研究, 2021, 44(11): 35-38. SINDAYE D, XIAO Z L, ZHANG F, et al. Effect of dietary lysozyme on growth performance, intestinal morphology and antioxidant capacity of egg chicks[J]. Feed Research, 2021, 44(11): 35-38 (in Chinese). |
| [24] |
HUMPHREY B D, HUANG N, KLASING K C. Rice expressing lactoferrin and lysozyme has antibiotic-like properties when fed to chicks[J]. The Journal of Nutrition, 2002, 132(6): 1214-1218. DOI:10.1093/jn/132.6.1214 |
| [25] |
TORKI M, SCHOKKER D, DUIJSTER-LENSING M, et al. Effect of nutritional interventions with quercetin, oat hulls, β-glucans, lysozyme and fish oil on performance and health status related parameters of broilers chickens[J]. British Poultry Science, 2018, 59(5): 579-590. DOI:10.1080/00071668.2018.1496402 |
| [26] |
OLIVER W T, WELLS J E. Lysozyme as an alternative to antibiotics improves growth performance and small intestinal morphology in nursery pigs[J]. Journal of Animal Science, 2013, 91(7): 3129-3136. DOI:10.2527/jas.2012-5782 |
| [27] |
BRUNDIGE D R, MAGA E A, KLASING K C, et al. Lysozyme transgenic goats' milk influences gastrointestinal morphology in young pigs[J]. The Journal of Nutrition, 2008, 138(5): 921-926. DOI:10.1093/jn/138.5.921 |
| [28] |
GONG M, ANDERSON D, RATHGEBER B, et al. The effect of dietary lysozyme with EDTA on growth performance and intestinal microbiota of broiler chickens in each period of the growth cycle[J]. Journal of Applied Poultry Research, 2017, 26(1): 1-8. |
| [29] |
XU S Y, SHI J K, SHI X L, et al. Effects of dietary supplementation with lysozyme during late gestation and lactation stage on the performance of sows and their offspring[J]. Journal of Animal Science, 2018, 96(11): 4768-4779. |
| [30] |
程时军. 溶菌酶在肉鸡中的应用及作用机制研究[D]. 硕士学位论文. 武汉: 华中农业大学, 2010: 15-30. CHENG S J. Study on the effect and mechanism of lysozyme fed to broilers[D]. Master's Thesis. Wuhan: Huazhong Agricultural University, 2010: 15-30. (in Chinese) |
| [31] |
孙小青. 在肉鸭日粮中溶菌酶与几种抗生素饲用价值的比较[D]. 硕士学位论文. 重庆: 西南大学, 2008: 27-39. SUN X Q. Comparsion of lysozyme and some antibiotics in the feeding value of duck diet[D]. Master's Thesis. Chongqing: Southwest University, 2008: 27-39. (in Chinese) |




