2. 滨州市海洋发展研究院, 滨州 256603;
3. 山东省海水养殖病害防治重点实验室, 青岛 266104
2. Binzhou Ocean Development Research Institute, Binzhou 256603;
3. Key Laboratory of Mariculture Disease Control of Shandong Province, Qingdao 266104, China
凡纳滨对虾(Litopenaeus vannamei)是全世界主要的甲壳类养殖物种之一[1]。近年来,随着对虾的高密度、集约化养殖,种质退化、养殖环境恶化和病害等灾害造成了不少经济损失[2-4]。使用激素和抗生素是作为预防和治疗病害的传统方法,但往往导致了致病微生物的进化、药物残留以及环境污染[5-6]。作为抗生素的重要替代物,益生菌具备健康、绿色、安全等特点,普遍应用于虾蟹类等水珍品养殖过程中[7-9]。
迄今为止,许多常见菌株已被用作对虾养殖的益生菌,包括枯草芽孢杆菌(Bacillus subtilis)、地衣芽孢杆菌(Bacillus licheniformis)、粪肠球菌(Enterococcus faecalis)和乳酸菌(Lactobacillus)等。其中,枯草芽孢杆菌能够耐受高温、高压、高盐度、低氧、低水分等不利条件,其生长繁殖可以分泌大量消化酶类,帮助宿主降解、吸收营养物质。Chai等[10]研究发现,口服芽孢杆菌PC465可以提高凡纳滨对虾的生长性能和存活率。采用枯草芽孢杆菌和地衣芽孢杆菌作为饲料添加剂,可显著提高对虾肠道内芽孢杆菌的丰度,促进对虾生长发育[11-13]。本试验通过向饲料中添加不同水平的枯草芽孢杆菌HSP05,以评估其对凡纳滨对虾生长性能、抗病力和非特异性免疫力的影响,为该菌株在作为饲料添加剂的应用提供科学依据。
1 材料与方法 1.1 菌株来源与计数枯草芽孢杆菌HSP05为实验室保藏菌株,从健康养殖3年以上的对虾养殖池中分离得到。将枯草芽孢杆菌HSP05按1%的比例接种到LB营养肉汤培养基中,30 ℃、165 r/min过夜培养进行活化,随后逐级扩大培养。3 000 r/min离心20 min,弃掉上清液收集菌体。用适量无菌生理盐水调整菌株浓度,逐级稀释添加到饲料制作过程中。
采用平板菌落计数法进行菌株数量统计。用磷酸盐缓冲液(PBS)将菌液稀释,于LB固体平板上进行涂布,每个梯度涂布3个平板做为平行,挑选合适的稀释梯度进行计数,计数结果取3个平行的平均值。
1.2 试验设计和饲料制作挑选大小一致的1 200尾凡纳滨对虾虾苗,体长(3.0±0.2) cm,随机分为4个组,每组3个重复,每个重复100尾。各组分别投喂枯草芽孢杆菌HSP05添加量为0(对照组)、105(BS1组)、107(BS2组)、109 CFU/g(BS3组)的试验饲料。试验期4周。
以鱼粉、豆粕和玉米粕为主要蛋白质源,鱼油和磷脂油为主要脂肪源,小麦面粉为主要糖源,并补充无机盐、维生素等配制出基础饲料,基础饲料组成及营养水平见表 1。饲料原料经粉碎、80目过筛、混合均匀后,添加不同体积固定浓度的枯草芽孢杆菌HSP05,配制枯草芽孢杆菌HSP05终浓度分别为105、107、109 CFU/g的试验饲料,对照组添加等体积的生理盐水。饲料原料全部混合均匀后,喷水制备面团,用饲料颗粒机挤压膨化成型,常温阴至半干,剪切成1.5 mm×(3~5) mm的颗粒,置阴凉干燥处保存。
|
|
表 1 基础饲料组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
健康的凡纳滨对虾幼虾购自山东烟台海阳对虾养殖场,在试验前于25~28 ℃和27‰~30‰盐度的循环水养殖系统中暂养2周。暂养期间饲喂基础饲料。随后挑选大小一致的虾苗,体长(3.0±0.2) cm,随机分散到12个玻璃缸(300 L)中开始养殖试验。养殖周期为4周。
养殖期间每天投喂对虾4次(06:00、12:00、17:00和22:00),每天清除残饵和粪便,并记录摄食量和健康状况,每周测定1次体长、体重。养殖全过程不间断充气,溶解氧含量不低于5 mg/L,氨氮含量不高于0.03 mg/L。每天换水1次,每次换水占总水量的2/3。
1.4 样品采集使用含有抗凝剂的1 mL无菌注射器从对虾的围心腔内抽取血淋巴。其中抗凝剂与血淋巴的混合体积比为1:1。随后将血淋巴离心,用PBS调整至血细胞数量达到106个/mL,进行吞噬活性和呼吸暴发试验,每组9个平行。
使用1 mL无菌注射器从对虾的围心腔内抽取血淋巴,4 ℃放置过夜后,3 500 r/min离心10 min,收集上清液置于液氮中速冻,储存于-80 ℃,用于免疫相关酶活性的分析,每组8个平行。
收集对虾肝胰腺置于液氮速冻,并储存于-80 ℃,用于消化酶和免疫相关酶活性的分析,每组8个平行。在酶活性测定时,将适量对虾肝胰腺样品加入PBS匀浆缓冲液中制成20%的组织匀浆样品,4 ℃,2 500×g离心10 min,收集上层澄清匀浆液分装备用。
1.5 侵染试验饲养试验结束后,进行为期1周的副溶血弧菌侵染试验。每个玻璃缸中留50 L海水和25只凡纳滨对虾,用浓度为107 CFU/mL的副溶血弧菌浸浴。侵染期间不换水,投喂添加菌株的饲料,每12 h统计一次死亡情况,及时捞出死虾和粪便。
1.6 指标测定 1.6.1 生长性能在养殖试验过程中,每周、每缸随机选取8尾对虾测定其体长(body length,BL)、体重(body weight,BW)。试验结束后,对各缸对虾进行计数,计算存活率(survival rate,SR)、增重率(weight gain rate,WGR)、饱满度(condition factor,CF)和特定生长率(specific growth rate,SGR),计算公式如下:

|
式中:W0为对虾初始体重;Wt为对虾终末体重;Lt为对虾终末体长;T为养殖试验时间。
1.6.2 血细胞免疫反应测定 1.6.2.1 吞噬活性试验方法在Delaporte等[15]的方法基础上稍作修改,简述如下:用PBS调整血细胞浓度为106个/mL;取4 μL、25%的荧光微球加入400 μL血细胞中,混合均匀,18 ℃下避光孵育1 h;加入26 μL多聚甲醛终止反应;4 ℃、800×g离心10 min去除游离的荧光微球;加入400 μL PBS重悬血细胞,采用流式细胞仪FL-1通道检测分析血细胞的绿色荧光。采用血细胞吞噬率,即吞噬微球的血细胞数目占血细胞总数的百分比来表征吞噬能力。
1.6.2.2 呼吸爆发血细胞呼吸爆发产生的活性氧自由基(reactive oxygen species,ROS)可以将二氢罗丹明123(dihydrorhodamine 123,DHR123)氧化为发荧光的罗丹明123(rhodamine 123,RHO123)[16],经流式细胞仪检测,比较呼吸爆发吸收峰偏移程度以比较血细胞的呼吸爆发活性。将对虾血细胞数量调整为106个/mL,于25 ℃、黑暗条件下孵育10 min,添加佛波酯(PMA)使其终浓度达到0.1 μg/mL,继续孵育10 min后添加DHR123,使DHR123终浓度为2 μg/mL,继续孵育30 min。采用流式细胞仪FL-1通道检测分析呼吸爆发活性。
1.6.3 酶活性测定肝胰腺消化酶[淀粉酶(AMS)、蛋白酶(PR)、脂肪酶(LPS)]、转氨酶[(谷丙转氨酶(ALT)、谷草转氨酶(AST)]、抗氧化相关酶[超氧化物歧化酶(SOD)、过氧化氢酶(CAT)]活性和血清免疫相关酶[酚氧化酶(PO)、溶菌酶(LZM)]活性均采用南京建成生物工程研究所试剂盒测定。
1.7 数据处理与分析试验结果以平均值±标准差(mean±SD)表示,采用SPSS 16.0统计软件对所有数据进行单因素方差分析(one-way ANOVE),采用LSD方差齐性检验方法比较各组之间的差异,显著性水平定义为P < 0.05。
2 结果 2.1 饲料中添加枯草芽孢杆菌HSP05对凡纳滨对虾生长性能的影响如表 2所示,各组存活率均在75%以上,各组之间无显著差异(P>0.05)。BS1、BS2和BS3组的终末体重和终末体长显著高于对照组(P < 0.05),BS1、BS2和BS3组之间无显著差异(P>0.05)。各组之间饱满度无显著差异(P>0.05)。BS1、BS2和BS3组的增重率显著高于对照组(P < 0.05),BS2组的增重率显著高于BS3组(P < 0.05)。BS1、BS2和BS3组的特定生长率显著高于对照组(P < 0.05),BS1、BS2和BS3组之间无显著差异(P>0.05)。
|
|
表 2 饲料中添加枯草芽孢杆菌HSP05对凡纳滨对虾生长性能的影响 Table 2 Effects of dietary Bacillus subtilis HSP05 on growth performance of Litopenaeus vannamei |
如表 3所示,BS1、BS2和BS3组的肝胰腺蛋白酶、淀粉酶活性显著高于对照组(P < 0.05),BS2和BS3组的肝胰腺蛋白酶、淀粉酶活性显著高于BS1组(P < 0.05)。各组之间肝胰腺脂肪酶活性无显著差异(P>0.05)。BS1、BS2和BS3组的肝胰腺谷丙转氨酶和谷草转氨酶活性均显著低于对照组(P < 0.05),BS2组的肝胰腺谷丙转氨酶活性显著低于BS1组(P < 0.05),BS1、BS2和BS3组之间肝胰腺谷草转氨酶活性无显著差异(P>0.05)。
|
|
表 3 饲料中添加枯草芽孢杆菌HSP05对凡纳滨对虾肝胰腺消化酶和转氨酶活性的影响 Table 3 Effects of dietary Bacillus subtilis HSP05 on activities of digestive enzyme and transaminase in hepatopancreas of Litopenaeus vannamei |
如表 4所示,BS1、BS2和BS3组的血清酚氧化酶和溶菌酶活性显著高于对照组(P < 0.05),BS1、BS2和BS3组之间血清酚氧化酶活性无显著差异(P>0.05),BS2和BS3组的血清溶菌酶活性显著高于BS1组(P < 0.05)。BS1、BS2和BS3组的肝胰腺过氧化氢酶活性显著高于对照组(P < 0.05),BS2和BS3组的肝胰腺过氧化氢酶活性显著高于BS1组(P < 0.05)。BS2和BS3组的肝胰腺超氧化物歧化酶活性显著高于对照组(P < 0.05),BS3组的肝胰腺超氧化物歧化酶活性显著高于BS2组(P < 0.05)。
|
|
表 4 饲料中添加枯草芽孢杆菌HSP05对凡纳滨对虾血清和肝胰腺免疫相关酶活性的影响 Table 4 Effects of dietary Bacillus subtilis HSP05 on serum and hepatopancreas immune related enzyme activities of Litopenaeus vannamei |
如表 5所示,BS1、BS2和BS3组的血细胞吞噬率显著高于对照组(P < 0.05),BS2和BS3组的血细胞吞噬率显著高于BS1组(P < 0.05)。BS1、BS2和BS3组的呼吸爆发活性显著低于对照组(P < 0.05),BS2和BS3组的呼吸爆发活性显著低于BS1组(P < 0.05)。
|
|
表 5 饲料中添加枯草芽孢杆菌HSP05对凡纳滨对虾血细胞免疫活性的影响 Table 5 Effects of dietary Bacillus subtilis HSP05 on blood cell immune activities of Litopenaeus vannamei |
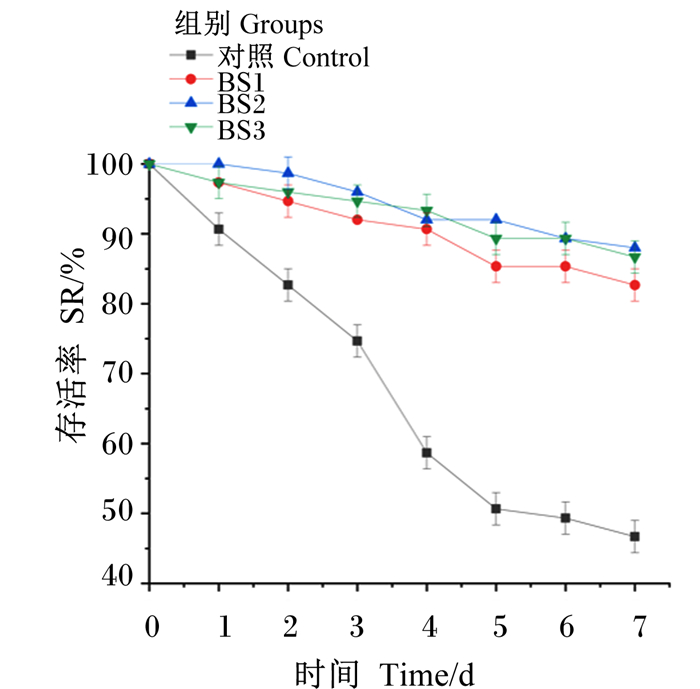
如图 1所示,副溶血弧菌侵染持续3 d时,对照组的存活率就已明显低于BS1、BS2和BS3组;副溶血弧菌侵染持续7 d时,对照组的存活率为46.67%,而BS1、BS2和BS3组的存活率均达到82.67%以上,且BS1、BS2和BS3组之间的差异不明显。
|
图 1 饲料中添加枯草芽孢杆菌HSP05对凡纳滨对虾抗病力的影响 Fig. 1 Effects of dietary Bacillus subtilis HSP05 on disease resistance of Litopenaeus vannamei |
枯草芽孢杆菌是水产养殖中常用的益生菌株,其丰富的产酶系统可促进饲料中大分子营养物质的利用,促进水产动物的健康生长。本研究结果表明,饲料中添加枯草芽孢杆菌HSP05能显著提高凡纳滨对虾的终末体长、终末体重、增重率和特定生长率。综合枯草芽孢杆菌HSP05对凡纳滨对虾生长性能的影响,尤其是增重率方面,发现107 CFU/g是促进凡纳滨对虾生长的适宜添加量。这与芽孢杆菌对刺参(Apostichopus japonicus)[17-18]、斑节对虾(Penaeus monodon)[19-20]及凡纳滨对虾[21-22]等的研究结果相似。在本试验中,枯草芽孢杆菌HSP05的促生长效果与其添加量不呈正相关,109 CFU/g枯草芽孢杆菌HSP05组的增重率显著低于107 CFU/g枯草芽孢杆菌HSP05组。这可能是由于过量的枯草芽孢杆菌抑制了凡纳滨对虾肠道内其他菌群的生长,导致肠道菌群失衡而造成其生长缓慢,更深层次的原因还有待深入研究。
3.2 饲料中添加枯草芽孢杆菌HSP05对凡纳滨对虾肝胰腺消化酶和转氨酶活性的影响枯草芽孢杆菌促进对虾生长可能与其产酸、抗菌肽、胞外酶等小分子活性物质等作用有关。本研究中,饲料中添加枯草芽孢杆菌HSP05能显著提高凡纳滨对虾肝胰腺蛋白酶、淀粉酶活性,这与胡毅等[23]的研究结果类似,其在凡纳滨对虾饲料中添加枯草芽孢杆菌、地衣芽孢杆菌及复合益生菌,结果显示添加益生菌可提高对虾肠道消化酶活性,促进对虾健康生长。此外,谷丙转氨酶和谷草转氨酶升高往往代表着肝胰腺出现炎症。本试验中,饲料中添加了枯草芽孢杆菌HSP05显著降低了凡纳滨对虾肝胰腺谷丙转氨酶和谷草转氨酶活性,这与Vega-Carranza等[12]、张健等[24]研究结果相似,表明枯草芽孢杆菌HSP0有着改善健康、增强免疫的作用。
3.3 饲料中添加枯草芽孢杆菌HSP05对凡纳滨对虾非特异性免疫力的影响凡纳滨对虾免疫能力是细胞免疫和体液免疫协同作用的结果。酚氧化酶原存在于血细胞内,极微量微生物多糖可引起血细胞的胞吐作用,释放、激活酚氧化酶原系统,提高机体对病原微生物的抵抗力[25-26]。在本研究中,与对照组相比,BS1、BS2和BS3组凡纳滨对虾血清酚氧化酶和溶菌酶活性显著上升,这是激活酚氧化酶原系统的必然结果。类似的,谢佳磊等[27]的研究得出,饲料中添加枯草芽孢杆菌(5×109 CFU/kg)可以提高克氏原螯虾(Procambarus clarkii)血清溶菌酶和酚氧化酶活性。同时,超氧化物歧化酶、过氧化氢酶能够有效清除氧自由基,避免其造成生物体损伤,在提高对虾机体免疫能力、增强对虾疾病防御起重要作用。在本试验中,BS1、BS2和BS3组肝胰腺过氧化氢酶和超氧化物歧化酶活性均高于对照组,肝胰腺过氧化氢酶和超氧化物歧化酶活性分别在枯草芽孢杆菌HSP05添加量为107和109 CFU/g时达到最大值,表明饲喂枯草芽孢杆菌HSP05可提高两者活性,这与王苓等[28]以枯草芽孢杆菌饲喂凡纳滨对虾后所得结果相似。上述结果表明饲料中添加适量的枯草芽孢杆菌HSP05可提高凡纳滨对虾的非特异性免疫力,或可有助于提高其抗病力。
血细胞免疫反应是机体抵御病原微生物侵袭的重要手段。凡纳滨对虾血细胞的吞噬率随着枯草芽孢杆菌HSP05添加量增加而增加,原因可能是枯草芽孢杆菌HSP05被摄入后,利用表面抗原或其产生的代谢物调节对虾的免疫防御系统,使对虾血细胞吞噬率提高。Rengpipat等[29]研究结果同样表明添加芽孢杆菌S11可以激活细胞免疫防御功能。在吞噬作用期间,呼吸爆发被用来杀死病原菌,特别是依赖于ROS,但是它们的过度产生会干扰包括脂类、蛋白质和核酸在内的生物分子,并产生氧化损伤和氧化应激[30]。在本研究中,饲料中添加枯草芽孢杆菌HSP05可以抑制血细胞呼吸爆发活性,即血细胞ROS产量被显著抑制,从而降低过量的ROS对机体的损害。这种对呼吸爆发的抑制能力可能与过氧化氢酶和超氧化物歧化酶活性提高有关。
3.4 饲料中添加枯草芽孢杆菌HSP05对凡纳滨对虾抗病力的影响病害问题是造成凡纳滨对虾养殖成功率低的主要原因,存活率是抗病力的外在直观体现,副溶血弧菌是引起凡纳滨对虾肝胰腺坏死综合征的致病菌,致死率较高[31-32]。国内外均有研究显示,用芽孢杆菌饲喂对虾或对虾幼体,可用于控制病原菌的感染[8, 33-34]。本研究结果与上述结果类似,饲料中添加枯草芽孢杆菌HSP05提高了凡纳滨对虾在副溶血弧菌侵染下的存活率,充分发挥了免疫防御作用,但枯草芽孢杆菌HSP05的添加量对对虾抗病力没有明显影响。这说明低浓度下的枯草芽孢杆菌HSP05依旧具有抗感染效果。
4 结论饲料中添加枯草芽孢杆菌HSP05可促进凡纳滨对虾生长,增强免疫力,提高抗病力。枯草芽孢杆菌HSP05的添加量为107 CFU/g时,凡纳滨对虾的生长表现最优,非特异性免疫得到有效提高。
| [1] |
THORNBER K, VERNER-JEFFREYS D, HINCHLIFFE S, et al. Evaluating antimicrobial resistance in the global shrimp industry[J]. Reviews in Aquaculture, 2020, 12(2): 966-986. DOI:10.1111/raq.12367 |
| [2] |
ASCHE F, ANDERSON J L, BOTTA R, et al. The economics of shrimp disease[J]. Journal of Invertebrate Pathology, 2021, 186: 107397. DOI:10.1016/j.jip.2020.107397 |
| [3] |
BONDAD-REANTASO M G, SUBASINGHE R P, ARTHUR J R, et al. Disease and health management in Asian aquaculture[J]. Veterinary Parasitology, 2005, 132(3/4): 249-272. |
| [4] |
SAULNIER D, HAFFNER P, GOARANT C, et al. Experimental infection models for shrimp vibriosis studies: a review[J]. Aquaculture, 2000, 191(1/2/3): 133-144. |
| [5] |
MAHASRI G, RO ZI, MUKTI A T, et al. The correlation between ectoparasite infestation and the total plate count of Vibrio sp. in pacific white shrimp (Litopenaeus vannamei) in ponds[J]. IOP Conference Series: Earth and Environmental Science, 2019, 236: 012081. DOI:10.1088/1755-1315/236/1/012081 |
| [6] |
于道德, 宋静静, 叶海斌, 等. 生态理念下对虾健康养殖发展建议[J]. 生态学杂志, 2021, 40(2): 568-576. YU D D, SONG J J, YE H B, et al. Suggestions on the development of healthy shrimp culture under ecological framework[J]. Chinese Journal of Ecology, 2021, 40: 568-576 (in Chinese). DOI:10.13292/j.1000-4890.202102.013 |
| [7] |
PRABAWATI E, HU S Y, CHIU S T, et al. A synbiotic containing prebiotic prepared from a by-product of king oyster mushroom, Pleurotus eryngii and probiotic, Lactobacillus plantarum incorporated in diet to improve the growth performance and health status of white shrimp, Litopenaeus vannamei[J]. Fish & Shellfish Immunology, 2022, 120: 155-165. DOI:10.12131/20210141 |
| [8] |
TSENG D Y, HO P L, HUANG S Y, et al. Enhancement of immunity and disease resistance in the white shrimp, Litopenaeus vannamei, by the probiotic, Bacillus subtilis E20[J]. Fish & Shellfish Immunology, 2009, 26(2): 339-344. |
| [9] |
KARVONEN A, RÄIHÄ V, KLEMME I, et al. Quantity and quality of aquaculture enrichments influence disease epidemics and provide ecological alternatives to antibiotics[J]. Antibiotics, 2021, 10(3): 335. DOI:10.3390/antibiotics10030335 |
| [10] |
CHAI P C, SONG X L, CHEN G F, et al. Dietary supplementation of probiotic Bacillus PC465 isolated from the gut of Fenneropenaeus chinensis improves the health status and resistance of Litopenaeus vannamei against white spot syndrome virus[J]. Fish & Shellfish Immunology, 2016, 54: 602-611. |
| [11] |
ABDOLLAHI-ARPANAHI D, SOLTANI E, JAFARYAN H, et al. Retracted: efficacy of two commercial and indigenous probiotics, Bacillus subtilis and Bacillus licheniformis on growth performance, immuno-physiology and resistance response of juvenile white shrimp (Litopenaeus vannamei)[J]. Aquaculture, 2018, 496: 43-49. DOI:10.1016/j.aquaculture.2018.06.082 |
| [12] |
VEGA-CARRANZA A S, CERVANTES-CHÁVEZ J A, LUNA-BÁRCENAS G, et al. Alginate microcapsules as delivery and protective systems of Bacillus licheniformis in a simulated shrimp's digestive tract[J]. Aquaculture, 2021, 540: 736675. DOI:10.1016/j.aquaculture.2021.736675 |
| [13] |
ALAGARASU T, BABOONSUNDARAM A, AYYARU G, et al. Influence of oral administration of Bacillus subtilis on growth performance and physiological responses in Litopenaeus vannamei cultured in low saline waters[J]. Probiotics and Antimicrobial Proteins, 2021, 13(6): 1734-1746. DOI:10.1007/s12602-021-09819-y |
| [14] |
XIE F J, ZENG W P, ZHOU Q C, et al. Dietary lysine requirement of juvenile Pacific white shrimp, Litopenaeus vannamei[J]. Aquaculture, 2012, 358/359: 116-121. DOI:10.1016/j.aquaculture.2012.06.027 |
| [15] |
DELAPORTE M, SOUDANT P, MOAL J, et al. Effect of a mono-specific algal diet on immune functions in two bivalve species-Crassostrea gigas and Ruditapes philippinarum[J]. The Journal of Experimental Biology, 2003, 206(17): 3053-3064. DOI:10.1242/jeb.00518 |
| [16] |
KALGRAFF C A K, WERGELAND H I, PETTERSEN E F. Flow cytometry assays of respiratory burst in Atlantic salmon (Salmo salar L.) and in Atlantic cod (Gadus morhua L.) leucocytes[J]. Fish & Shellfish Immunology, 2011, 31(3): 381-388. |
| [17] |
王军. 两株益生菌的鉴定及其在刺参(Apostichopus japonicus) 养殖中应用的研究[D]. 硕士学位论文. 青岛: 中国海洋大学, 2012. WANG J. Identification and application of two strains of potential probiotics associate with aquaculture of sea cucumber (Apostichopus japonicus)[D]. Master's Thesis. Qingdao: Ocean University of China, 2012. (in Chinese) |
| [18] |
WANG J Y, LI B, WANG Y G, et al. Influences of immersion bathing in Bacillus velezensis DY-6 on growth performance, non-specific immune enzyme activities and gut microbiota of Apostichopus japonicus[J]. Journal of Oceanology and Limnology, 2019, 37(4): 1449-1459. DOI:10.1007/s00343-019-8119-8 |
| [19] |
NAVINCHANDRAN M, IYAPPARAJ P, MOOVENDHAN S, et al. Influence of probiotic bacterium Bacillus cereus isolated from the gut of wild shrimp Penaeus monodon in turn as a potent growth promoter and immune enhancer in P. monodon[J]. Fish & Shellfish Immunology, 2014, 36(1): 38-45. |
| [20] |
SHYNE ANAND P S, KUMAR S, KOHLI M P S, et al. Dietary biofloc supplementation in black tiger shrimp, Penaeus monodon: effects on immunity, antioxidant and metabolic enzyme activities[J]. Aquaculture Research, 2017, 48(8): 4512-4523. DOI:10.1111/are.13276 |
| [21] |
LIU K F, CHIU C H, SHIU Y L, et al. Effects of the probiotic, Bacillus subtilis E20, on the survival, development, stress tolerance, and immune status of white shrimp, Litopenaeus vannamei larvae[J]. Fish & Shellfish Immunology, 2010, 28(5/6): 837-844. |
| [22] |
KEWCHAROEN W, SRISAPOOME P. Probiotic effects of Bacillus spp. from Pacific white shrimp (Litopenaeus vannamei) on water quality and shrimp growth, immune responses, and resistance to Vibrio parahaemolyticus (AHPND strains)[J]. Fish & Shellfish Immunology, 2019, 94: 175-189. |
| [23] |
胡毅, 谭北平, 麦康森, 等. 饲料中益生菌对凡纳滨对虾生长、肠道菌群及部分免疫指标的影响[J]. 中国水产科学, 2008, 15(2): 244-251. HU Y, TAN B P, MAI K S, et al. Effects of dietary probiotic on growth, immunity and intestinal bacteria of juvenile Litopenaeus vannamei[J]. Journal of Fishery Sciences of China, 2008, 15(2): 244-251 (in Chinese). DOI:10.3321/j.issn:1005-8737.2008.02.008 |
| [24] |
张健. 免疫增强剂对凡纳滨对虾幼虾生长、免疫及抗应激的影响[D]. 博士学位论文. 广州: 中山大学, 2012. ZHANG J. Effects of dietary immunostimulants on growth, non-specific immune response and stress resistance of juvenile pacific white shrimp, Litopenaeus vannamei[D]. Ph. D. Thesis. Guangzhou: Sun Yat-Sen University, 2012. (in Chinese) |
| [25] |
KIRAN G S, PRIYADHARSHINI S, SAJAYAN A, et al. Dietary administration of gelatinised polyhydroxybutyrate to Penaeus vannamei improved growth performance and enhanced immune response against Vibrio parahaemolyticus[J]. Aquaculture, 2020, 517: 734773. DOI:10.1016/j.aquaculture.2019.734773 |
| [26] |
ZHU X F, GUO H, LI G L, et al. Effects of dietary hydrolyzable tannins on growth performance, antioxidant capacity, intestinal microflora and resistance against Vibrio parahaemolyticus of juvenile Pacific white shrimp, Litopenaeus vannamei (Boone, 1931)[J]. Aquaculture Reports, 2021, 19: 100601. DOI:10.1016/j.aqrep.2021.100601 |
| [27] |
谢佳磊, 肖丹, 殷蝶, 等. 枯草芽孢杆菌对克氏原螯虾免疫机能的影响[J]. 淡水渔业, 2007, 37(6): 24-27. XIE J L, XIAO D, YIN D, et al. Effects of Bacillus subtilis on immune functions of Procambarus clarkii[J]. Freshwater Fisheries, 2007, 37(6): 24-27 (in Chinese). DOI:10.3969/j.issn.1000-6907.2007.06.006 |
| [28] |
王苓, 田相利, 董双林, 等. 两株芽孢杆菌对凡纳滨对虾生长和血清非特异性免疫指标的影响研究[J]. 中国海洋大学学报(自然科学版), 2017, 47(4): 14-21. WANG L, TIAN X L, DONG S L, et al. Effects of two Bacillus on growth performance and serum non-specific immunity of Litopenaeus vannamei[J]. Periodical of Ocean University of China (Natural Science Edition), 2017, 47(4): 14-21 (in Chinese). |
| [29] |
RENGPIPAT S, RUKPRATANPORN S, PIYATIRATITIVORAKUL S, et al. Immunity enhancement in black tiger shrimp (Penaeus monodon) by a probiont bacterium (Bacillus S11)[J]. Aquaculture, 2000, 191(4): 271-288. DOI:10.1016/S0044-8486(00)00440-3 |
| [30] |
SPENCER S P, FRAGIADAKIS G K, SONNENBURG J L. Pursuing human-relevant gut microbiota-immune interactions[J]. Immunity, 2019, 51(2): 225-239. DOI:10.1016/j.immuni.2019.08.002 |
| [31] |
何晶晶, 潘鲁青, 张国桃, 等. 凡纳滨对虾肠道铁载体高产菌株筛选与饲料添加应用效果的研究[J/OL]. 渔业科学进展: 1-12[2022-01-10]. https://kns.cnki.net/kcms/detail/detail.aspx?FileName=HYSC20211216000&DbName=CAPJ2021. DOI: 10.19663/j.issn2095-9869.20210528001. HE J J, PAN L Q, ZHANG G T, et al. Screening a high-yield intestinal iron carrier strain of Litopenaeus vannamei and effect of feed addition[J/OL]. Progress in Fishery Sciences: 1-12[2022-01-10]. https://kns.cnki.net/kcms/detail/detail.aspx?FileName=HYSC20211216000&DbName=CAPJ2021. DOI: 10.19663/j.issn2095-9869.20210528001.(inChinese) |
| [32] |
唐小千, 徐洪森, 战文斌. 对虾急性肝胰腺坏死综合症研究进展[J]. 海洋湖沼通报, 2016(2): 90-93. TANG X Q, XU H S, ZHAN W B. Advances in study of shrimp acute hepatopancreas necrosis syndrome[J]. Transactions of Oceanology and Limnology, 2016(2): 90-93 (in Chinese). |
| [33] |
LI J, WU Z B, ZHANG Z, et al. Effects of potential probiotic Bacillus velezensis K2 on growth, immunity and resistance to Vibrio harveyi infection of hybrid grouper (Epinephelus lanceolatus ♂×E. fuscoguttatus♀)[J]. Fish & Shellfish Immunology, 2019, 93: 1047-1055. |
| [34] |
AMOAH K, HUANG Q C, DONG X H, et al. Paenibacillus polymyxa improves the growth, immune and antioxidant activity, intestinal health, and disease resistance in Litopenaeus vannamei challenged with Vibrio parahaemolyticus[J]. Aquaculture, 2020, 518: 734563. DOI:10.1016/j.aquaculture.2019.734563 |




