2. 上海海洋大学, 农业农村部 淡水水产种质资源重点实验室, 上海 201306;
3. 上海海洋大学, 水产科学国家级实验教学示范中心, 上海 201306;
4. 九江大北农水产科技有限公司, 九江 332000;
5. 上海市奉贤区水产技术推广站, 上海 201499;
6. 上海市奉贤区奉城镇农业农村服务中心, 上海 201411
2. Key Laboratory of Freshwater Aquatic Genetic Resources, Ministry of Agriculture, Shanghai Ocean University, Shanghai 201306, China;
3. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China;
4. Jiujiang Dabei Nong Fishery Science and Technology Co., Ltd., Jiujiang 332000, China;
5. Shanghai Fengxian District Aquatic Technology Promotion Station, Shanghai 201499, China;
6. Shanghai Fengxian District Fengcheng Town Agricultural and Rural Service Center, Shanghai 201411, China
水产养殖业在过去的10年间发展迅猛,高强度的养殖对饲料资源的要求随之增加,水产动物饲料蛋白质原料资源短缺问题愈演愈烈。鱼粉因其高含量的蛋白质、平衡且齐全的氨基酸、丰富的微量元素等营养特点成为了水产动物饲料中最主要的蛋白质源,但近年来随着海洋渔业资源短缺,其价位不断攀升,鱼粉的各种掺假等问题也频繁出现,各大饲料企业和研究人员为了寻求更低的饲料成本正着力研究各种鱼粉替代物,其大致可分为两大类:动物性蛋白质源和植物性蛋白质源。豆粕因其来源广泛,价位较低,是鱼粉替代物的优选对象,但豆粕中不平衡的氨基酸和各种抗营养因子严重地影响了水产动物的健康,进而限制其在水产动物饲料中的广泛应用。而发酵豆粕相较于豆粕拥有更高的营养价值、更低的抗营养因子、更平衡的氨基酸等特点,越来越受到饲料研究者的青睐。但相较于鱼粉,发酵豆粕氨基酸平衡性较差,精氨酸就是其中一种含量偏低的氨基酸。
精氨酸是机体蛋白质的组成成分,也参与机体内分泌调节和免疫调节等[1]。精氨酸代谢产生的一氧化氮合成酶(NOS)促进一氧化氮(NO)生成,而NO自由基既能协助巨噬细胞在免疫系统中对抗病原体,又是多种免疫细胞的调节因子。有研究表明,在利用去除抗营养因子的植物蛋白质源替代鱼粉时,添加晶体或包膜氨基酸可显著提高替代效果[2-3]。研究也发现,在饲料中添加精氨酸能提高鱼类溶菌酶(LZM)活性,增强杀菌能力,提高免疫功能,抑制炎症反应,减少免疫应答时的自我损伤等[4-8]。
Toll样受体(TLRs)、免疫缺陷(IMD)和LZM基因的表达量是对虾免疫、健康能力的关键性指标。TLRs作为参与天然免疫的主要模式识别受体(PRR),在其信号通路被激活后能够诱导强烈的免疫应答,有利于机体抵抗病原微生物的感染,尤其是革兰氏阳性细菌和真菌的刺激。髓样分化因子88(mmyeloid differentiation factor 88,MyD88)是TLRs通路的下游效应因子,其表达水平直接表示机体产生炎症反应的程度。IMD途径是对虾另一个重要免疫识别信号传导通路,主要响应革兰氏阴性细菌的入侵[9]。转录激活因子4(activating transcription factor 4,ATF4)是氨基酸营养感知和代谢途径氨基酸应答信号(amino acid response signal transduction pathway,AAR)通路中的关键基因,当必需氨基酸缺乏时,ATF4基因表达上调。对于精氨酸是否通过上述基因调节水产动物的免疫和蛋白质代谢尚未见相关报道。
目前,凡纳滨对虾的营养学研究主要集中在蛋白质[10]、脂肪[11-12]、糖类[13]、维生素[14]等方面,虽有不少关于晶体氨基酸添加效果的报道[15-16],但关于凡纳滨对虾对精氨酸需求量的研究相对较少。曾雯娉[17]研究发现,凡纳滨对虾幼虾对精氨酸的需求量为2.16%(蛋白质含量5.27%)。黄凯等[18]研究认为,凡纳滨对虾幼虾需要2.43%的精氨酸才能满足其正常生长。由于不同的饲料组成会影响对虾对氨基酸的利用,因而为了达到精准营养的目的,减少饲料浪费,节约养殖成本,有必要重新评估在发酵豆粕替代鱼粉后凡纳滨对虾对精氨酸的需求量。因此,本试验主要根据生长性能、生理生化和抗应激能力评估精氨酸对凡纳滨对虾的作用效果,通过检测凡纳滨对虾鳃中TLR、LZM、IMD和肝胰腺中MyD88、ATF4基因相对表达量来探索精氨酸对凡纳滨对虾免疫和蛋白质代谢的调控机制,为发酵豆粕替代鱼粉时饲料中合理添加精氨酸提供更多的理论依据。
1 材料与方法 1.1 试验饲料以凡纳滨对虾[初重(0.62±0.10) g]为研究对象,在前期获得发酵豆粕对鱼粉最适替代量[19]的基础上,以鱼粉(22.53%)和发酵豆粕(10.00%)为主要蛋白质源,且根据已有文献报道[17]以及水产动物对植物蛋白质源性氨基酸利用率较低的情况,本试验在精氨酸水平为1.98%的基础饲料中,分别添加0(A00组)、0.2%(A02组)、0.4%(A04组)、0.6%(A06组)、0.8%(A08组)的晶体L-精氨酸(有效含量为98%),试验饲料组成及营养水平见表 1。
|
|
表 1 试验饲料组成及营养水平(风干基础) Table 1 Composition and nutrient levels of experimental diets (air-dry basis) |
养殖饲料在上海海洋大学滨海养殖基地进行,挑选初始均重为(0.62±0.10) g的健康凡纳滨对虾1 000尾,平均分成5组,每组4个重复,试验虾饲养于室内水泥池网箱(1.90 m×1.25 m×1.00 m)中,每个网箱放养50尾,共20个网箱。试验前所有网箱和池子均作消毒处理,试验虾先暂养1周,称初始体重后分组。采用限量投喂,初期投喂率为体重的8%,后期6%,投饲时间分别为06:00、10:30、16:30、22:00。养殖周期为60 d,每周根据对虾生长状况相应调节投饲量。养殖期间水温为24~32 ℃,氨氮含量 < 0.3 mg/L,pH=8.0±0.2,溶解氧含量>5 mg/L,24 h连续充氧。每2 d换1次水,保证水质环境正常。
1.3 样品采集在养殖试验结束时,所有对虾经过24 h饥饿处理后计数并称重。另从每个网箱随机取10尾虾,抽取血淋巴液于1.5 mL离心管中,4 ℃冰箱静置过夜后12 000 r/min离心15 min,取上清液于离心管中-20 ℃保存,用于后续血清生化指标的检测;去壳取其肌肉和肝胰腺于-20 ℃保存,用于测定肌肉营养成分及肝胰腺生化指标。同时取对虾鳃组织用于测定TLR、LZM、IMD的基因相对表达量,取肝胰腺用于测定MyD88、ATF4基因相对表达量,样品置于液氮速冻后,转移至-80 ℃保存。
1.4 样品检测肌肉常规检测参照AOAC(1984)[20]的方法:其中粗灰分含量在550 ℃马弗炉中测定,粗蛋白质含量采用凯氏定氮法测定,粗脂肪含量采用氯仿甲醇法测定。
肝胰腺及血清生化指标:肝胰腺中的丙二醛(MDA)含量及超氧化物歧化酶(SOD)活性,血清中的总蛋白(TP)含量及谷草转氨酶(AST)、谷丙转氨酶(ALT)、一氧化氮合成酶(NOS)活性按照南京建成生物工程研究所试剂盒测定。
免疫相关基因表达:测定低水平(A00)、中等水平(A04)和高水平(A08)精氨酸组腮中LZM、TLR、IMD[19]及肝胰腺中MyD88、ATF4基因相对表达量,设置参照基因β-肌动蛋白(β-actin),基因引物序列见表 2。ABI PRISMⓇ 7900 Sequence Detection System具体反应程序设置为:94 ℃预变性30 s,94 ℃变性5 s,60 ℃退火25 s,72 ℃延伸30 s,共40个循环。基因表达结果根据2-ΔΔCt计算法进行相对定量。
|
|
表 2 基因引物序列 Table 2 Primer sequence of genes |
养殖试验结束后,每组随机取9尾体重相似且经24 h饥饿处理、健康的对虾进行低氧胁迫试验。每次取3尾对虾放于3 L的锥形瓶中,将溶氧仪探头放入锥形瓶记录初始溶氧含量后,用液体石蜡封住瓶口,每30 min记录1次溶氧含量,直到全部对虾死亡后结束。记录从第1尾虾死亡到最后1尾虾死亡的累计时间,即为死亡耗时。试验分批进行,每次试验结束后对锥形瓶进行清洗换水,以消除批次试验之间的影响。
1.6 体外血清弧菌感染将培养好的副溶血弧菌(Vibrio parahaemolyticus)稀释至最适浓度后,取100 μL菌液加入96孔板,并加入等体积的血清,以只加入血清的微孔作为阴性对照,以只加入细菌稀释液的微孔作为阳性对照组,置于28 ℃条件下恒温培养24 h,在600 nm波长处读取吸光度(OD)值,每2 h读取1次数据,以达到稳定期的菌悬液OD值进行计算,根据Sunyer等[21]方法修改得到的计算公式为:
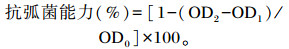
|
式中:OD0、OD1、OD2分别为阳性对照、阴性对照及试验组OD值。
1.7 结果计算

|
试验数据用平均值±标准差(mean±SD)表示。所有试验数据经方差齐性检验后用SPSS 23.0软件进行单因素方差分析(one-way ANOVA),并采用Duncan氏法进行多重比较,P < 0.05即认为有显著性差异。
2 结果 2.1 不同水平精氨酸对凡纳滨对虾生长性能及肌肉成分的影响由表 3可知,5组间成活率和饲料系数皆无显著差异(P>0.05),增重率和特定生长率在A02组出现最大值,其次为A08组,但2组差异不显著(P>0.05)。
|
|
表 3 不同水平精氨酸对凡纳滨对虾生长性能的影响 Table 3 Effects of different levels of arginine on growth performance of L.vannamei |
由表 4可知,肌肉水分、粗蛋白质和粗灰分含量在各组间并无显著差异(P>0.05),粗脂肪含量在A02组最低,显著低于A00组(P<0.05)。
|
|
表 4 不同水平精氨酸对凡纳滨对虾肌肉成分的影响(干重) Table 4 Effects of different levels of arginine on muscle composition of L.vannamei.(dry basis) |
由表 5可知,肝胰腺MDA含量最低值出现在A02组,肝胰腺SOD活性在A02组最高且显著高于其他组(P < 0.05);血清MDA含量在5组之间无显著差异(P>0.05),但A02组血清AST、ALT活性显著高于其他组(P < 0.05),A08组处于最低值,A06组血清NOS活性显著高于A02组(P < 0.05)。
|
|
表 5 不同水平精氨酸对凡纳滨对虾血清和肝胰腺生化指标的影响 Table 5 Effects of different levels of arginine on biochemical indexes in serum and hepatopancreas of L.vannamei. |
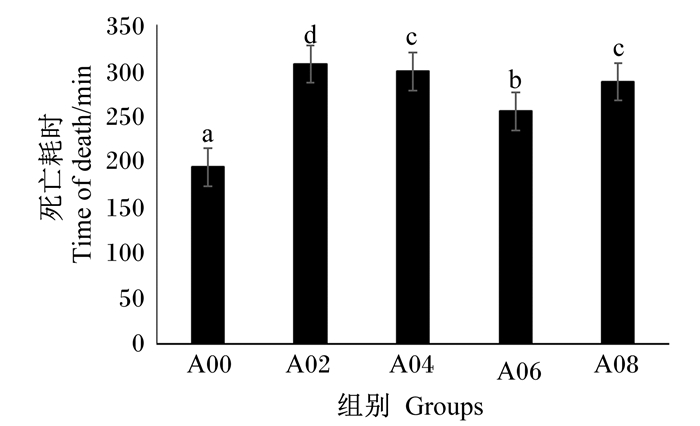
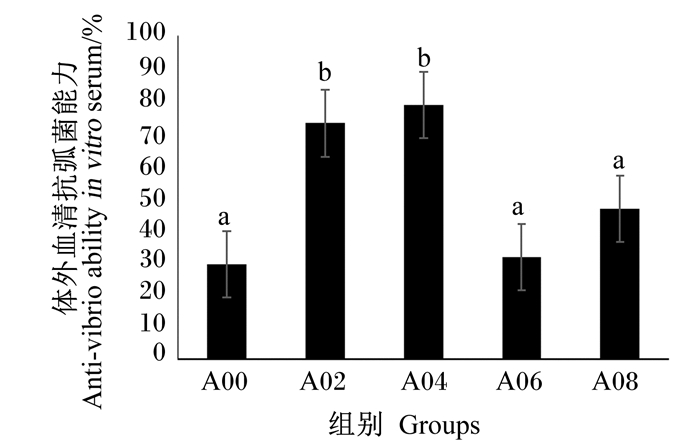
凡纳滨对虾的耐低氧能力除A04组和A08组之间无显著差异(P>0.05)外,其余组之间差异显著(P < 0.05),A00组最弱,A02组最强(图 1)。抗弧菌能力随精氨酸添加水平升高呈现先增强后变弱的趋势,峰值出现在A04组(图 2)。
|
数据柱标注不同字母表示差异显著(P < 0.05)。下图同。 Value bars with different letters mean significant difference (P < 0.05). The same as below. 图 1 不同水平精氨酸对凡纳滨对虾耐低氧能力影响 Fig. 1 Effects of different levels of arginine on low oxygen tolerance of L.vannamei. |
|
图 2 不同水平精氨酸对凡纳滨对虾体外血清抗弧菌能力的影响 Fig. 2 Effects of different levels of arginine on anti-vibiro ability in vitro serum of L.vannamei. |
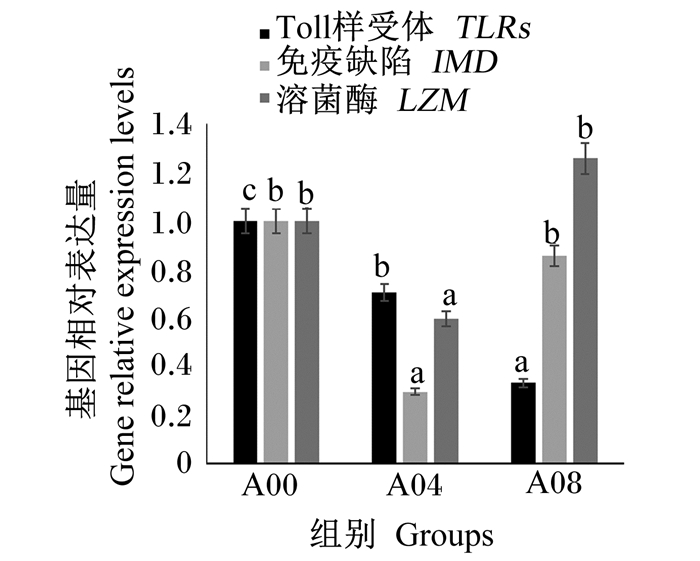
由于A02组肝胰腺受损的风险最大,A06组体外血清抗弧菌能力和耐低氧能力在4个氨基酸添加组中最弱,因此选择A00组、A04组、A08组进行免疫基因的表达分析。由图 3和图 4可知,A04组鳃IMD、LZM和肝胰腺MyD88基因相对表达量皆为最低,显著低于A00组(P < 0.05),鳃TLR基因相对表达量随着精氨酸添加水平升高而显著降低(P < 0.05),肝胰腺ATF4基因相对表达量在A00组最低。
|
图 3 不同水平精氨酸对凡纳滨对虾鳃基因表达的影响 Fig. 3 Effects of different levels of arginine on gene expression in gills of L.vannamei. |
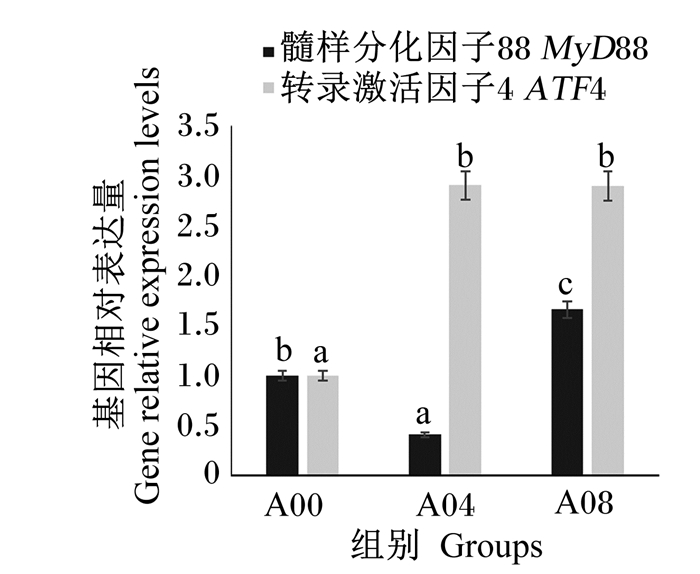
|
图 4 不同水平精氨酸对凡纳滨对虾肝胰腺基因表达的影响 Fig. 4 Effects of different levels of arginine on gene expression in hepatopancreas of L. vannamei. |
精氨酸对陆生动物生长性能的影响已有较多研究,闫伟[22]研究发现,鹅饲粮中适量增加精氨酸可以提高免疫反应能力和法氏囊指数。Lieboldt等[23]研究发现,饲粮精氨酸水平影响仔鸡淋巴器官的发育,水平过低时会导致仔鸡的胸腺和脾脏发育迟缓。近年来围绕水产动物饲料精氨酸的研究也不断被学者关注,有研究发现,虹鳟(Oncorhynchus mykiss)和斑点叉尾鮰(Ictalunes punctatus)等饲料缺少精氨酸时会造成鱼体生长缓慢、鱼鳍腐烂等现象[24];适量精氨酸则能改善鱼类的肠道组织结构,促进营养物质吸收利用[25]。但过多的精氨酸也会限制草鱼(Ctenopharyngodon idellus)、建鲤(Cyprinus carpiovar var.Jian)、团头鲂(Megalobrama amblycephala)的生长和饲料的利用[26-28],Kaushik等[29]认为高比例的精氨酸与赖氨酸发生的拮抗作用会使机体内部受到应激从而导致生长缓慢。本试验结果表明,在发酵豆粕替代鱼粉后,饲料精氨酸水平在1.98%~2.76%不会影响对虾的存活率,添加0.2%的晶体精氨酸,即饲料精氨酸水平达到2.18%时对虾增重率和特定生长率最大,而此时肌肉中粗脂肪含量最低。有研究表明,精氨酸缺乏会降低鱼类蛋白质沉积率[30];补充精氨酸能够激活哺乳动物雷帕霉素靶蛋白(mTOR)信号通路进行蛋白质代谢的调节,进而促进蛋白质的合成,并通过降低脂肪沉积,增加瘦肉率来调控机体能量的分配[31]。从以上文献结论和试验结果推测,精氨酸可通过调控肌肉中的脂肪代谢来影响对虾生长性能。但本试验中对虾生长性能并未随着饲料精氨酸水平的增加而下降,因此有必要结合对虾机体健康程度以及免疫能力来综合评估发酵豆粕替代鱼粉时精氨酸的最适添加水平。
凡纳滨对虾免疫系统与鱼类不同,以先天免疫为主,体液中没有免疫球蛋白,是无抗体介导的非特异性免疫反应,主要依靠血清中的一些免疫酶[32]。研究发现,精氨酸能显著提高草鱼鳃组织超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPx)和谷胱甘肽硫基转移酶(GST)活性及谷胱甘肽(GSH)含量[33];朱春华等[34]发现,L-精氨酸能够显著提高凡纳滨对虾NOS活性,血清中SOD和酸性磷酸酶(ACP)活性在中等剂量L-精氨酸(1%)组中显著提高,在高剂量(1.5%)和低剂量L-精氨酸(0.5%)组无显著影响。本试验结果发现,较低水平的精氨酸添加组(A02组)虽然降低了肝胰腺MDA含量,但AST和ALT活性显著高于其他组,说明其肝胰腺的损伤风险要高于其他组;在高添加水平组(A08组)中不管是表示肝胰脏损伤程度的AST和ALT活性、MDA含量,还是提高NO合成的NOS活性,均表现出比其他组更有利于对虾健康的一面。
对虾疾病主要来自对虾白斑病毒(WSSV)和弧菌感染,冀培丰[35]用WSSV病毒刺激对虾后,发现对虾血细胞和肝胰腺中NOS基因表达量和酶活性都显著下降,说明在对虾受到病毒或细菌感染时其抗应激能力和免疫机能明显下降,NOS活性高低可以体现出对虾受细菌或病毒感染的程度。本试验通过体外血清弧菌感染试验来验证精氨酸是否对凡纳滨对虾抗菌能力产生影响。结果显示,A04组抗菌能力最强,A06组最低,抗菌能力有随着精氨酸添加水平先升后降的趋势,表明过高的精氨酸水平对对虾的抗菌能力有负向作用。结合血清NOS活性结果来看,NOS活性有随着饲料精氨酸水平增加而先降后增的趋势,A06组血清NOS活性最高,但抗菌能力却最弱,并未表现出NOS活性越高,抗菌能力越强的结果,故血清中NOS活性是否能体现凡纳滨对虾抗菌能力还有待进一步研究。低溶解氧是重要的环境胁迫因子,易引起水产动物死亡。试验发现提高饲料精氨酸水平有助于增强对虾的耐低氧能力。有研究表明,在急性缺氧时,机体发生—系列病理生理变化,其中包括NO释放抑制、内皮素释放增加[36]。精氨酸是NO合成的前体物质,因而在饲料中添加精氨酸,可能通过增加体内NO的合成量来缓解缺氧产生的毒性。
精氨酸另一个重要的作用是调控炎症因子。白细胞介素-8(IL-8)是诱发炎症的主要因子,有学者发现精氨酸能够降低大西洋鲑(Salmo salar L.)和草鱼头肾组织中IL-8的表达量,进而降低其体内的炎症反应;类似的结果在建鲤上也有所报道[7-8, 37]。对于精氨酸调控免疫因子的机制,普遍认为有2种途径,即胰岛素-磷脂酰肌醇3激酶(PI-3K)/蛋白激酶B(PKB)信号途径和Toll样受体4(TLR4)通路MyD88依赖途径。胰岛素是TLRs的激活物质,MyD88是炎症免疫应答通路的关键基因;此外,精氨酸能够影响鱼类LZM基因表达[5]。IMD是对虾体内先天免疫调节的重要免疫基因[38],研究发现在凡纳滨对虾血细胞中,IMD基因能够被WSSV诱导出现表达上调[39],说明虾类IMD基因与免疫功能相关。本试验通过检测低水平(A00组)、中等水平(A04组)和高水平(A08组)精氨酸组对虾以上几种基因的表达量后,发现中等水平的精氨酸添加组肝胰腺MyD88基因相对表达量最低,说明在该精氨酸水平下对虾的炎症反应最小,此时鳃中IMD与LZM基因相对表达量最低,鳃中TLR基因相对表达量相比对照组(A00组)也显著下调,说明机体不需要通过增强免疫应答应对炎症反应;而高水平精氨酸能提高对虾肝胰腺中MyD88基因相对表达量,存在引起对虾炎症反应的风险。ATF4是氨基酸营养感知和代谢途径氨基酸应答信号(AAR)通路中的关键基因,当必需氨基酸缺乏时,ATF4基因相对表达量上调,促进氨基酸的合成与吸收,保证正常的生理机能[40]。但本试验结果表明,低水平精氨酸组肝胰腺中ATF4基因相对表达量显著低于另外2组,说明在低精氨酸水平条件下,凡纳滨对虾对氨基酸的合成与吸收能力非常有限,可能因为营养补给不足影响对虾抗菌、保护机体自身健康等作用的正常发挥。
4 结论当饲料中精氨酸水平在2.18%时,能显著提高凡纳滨对虾的生长性能;当饲料中精氨酸水平在2.37%时,对肝胰腺健康以及耐低氧和抗弧菌感染能力在转录水平的免疫调控能力更有优势,建议将2.37%作为鱼粉用量为22.53%、发酵豆粕用量为10.00%时的饲料精氨酸添加水平。
| [1] |
SHIMENO S, KUMON M, ANDON H. The growth performance and body composition of young yellowtail fed with diets containing defatted soybean for a long period[J]. Nippon Suisan Gakkaishi, 1993, 59(5): 821-825. DOI:10.2331/suisan.59.821 |
| [2] |
周歧存, 麦康森, 刘永坚, 等. 动植物蛋白源替代鱼粉研究进展[J]. 水产学报, 2005, 29(3): 404-410. ZHOU Q C, MAI K S, LIU Y J, et al. Advances in animal and plant protein sources in place of fish meal[J]. Journal of Fisheries of China, 2005, 29(3): 404-410 (in Chinese). |
| [3] |
WANG P H, LIANG J P, GU Z H, et al. Molecular cloning, characterization and expression analysis of two novel Tolls (LvToll2 and LvToll3) and three putative Spätzle-like Toll ligands (LvSpz1-3) from Litopenaeus vannamei[J]. Developmental and Comparative Immunology, 2012, 36(2): 359-371. DOI:10.1016/j.dci.2011.07.007 |
| [4] |
WEST N E, QIAN H, GUZIK T J, et al. Nitric oxide synthase (nNOS) gene transfer modifies venous bypass graft remodeling: effects on vascular smooth muscle cell differentiation and superoxide production[J]. Circulation, 2001, 104(13): 1526-1532. DOI:10.1161/hc3801.095693 |
| [5] |
CHEN G F, LIU Y, JIANG J, et al. Effect of dietary arginine on the immune response and gene expression in head kidney and spleen following infection of Jian carp with Aeromonas hydrophila[J]. Fish & Shellfish Immunology, 2015, 44(1): 195-202. |
| [6] |
COSTAS B, CONCEIÇÃO L E C, DIAS J, et al. Dietary arginine and repeated handling increase disease resistance and modulate innate immune mechanisms of Senegalese sole(Solea senegalensis Kaup, 1858)[J]. Fish & Shellfish Immunology, 2011, 31(6): 838-847. |
| [7] |
COSTAS B, RÂGO P C N P, CONCEIÇÃO L E C, et al. Dietary arginine supplementation decreases plasma cortisol levels and modulates immune mechanisms in chronically stressed turbot (Scophthalmus maximus)[J]. Aquaculture Nutrition, 2013, 19(S1): 25-38. |
| [8] |
JIANG J, SHI D, ZHOU X Q, et al. In vitro and in vivo protective effect of arginine against lipopolysaccharide induced inflammatory response in the intestine of juvenile Jian carp (Cyprinus carpio var. Jian)[J]. Fish & Shellfish Immunology, 2015, 42(2): 457-464. |
| [9] |
LEMAITRE B, HOFFMANN J. The host defense of Drosophila melanogaster[J]. Annual Review of Immunology, 2007, 25: 697-743. DOI:10.1146/annurev.immunol.25.022106.141615 |
| [10] |
陈义方. 不同规格凡纳滨对虾对蛋白质和蛋氨酸需要量研究[D]. 硕士学位论文. 上海: 上海海洋大学, 2012. CHEN Y F. Dietary protein and methionine requirements of three sizes of Litopenaeus vannamei[D]. Master's Thesis. Shanghai: Shanghai Ocean University, 2012. (in Chinese) |
| [11] |
郑昌区. 两种规格凡纳滨对虾对蛋白质和脂肪需要量的研究[D]. 硕士学位论文. 湛江: 广东海洋大学, 2012. ZHENG C Q. Study on the requirements of the dietary protein and lipid in two sizes of pacific white shrimp[D]. Master's Thesis. Zhenjiang: Guangdong Ocean University, 2012. (in Chinese) |
| [12] |
ZHANG S P, LI J F, WU X C, et al. Effects of different dietary lipid level on the growth, survival and immune-relating genes expression in Pacific white shrimp, Litopenaeus vannamei[J]. Fish & Shellfish Immunology, 2013, 34(5): 1131-1138. |
| [13] |
胡毅, 谭北平, 麦康森, 等. 不同碳水化合物水平饲料对凡纳滨对虾生长及部分生理生化指标的影响[J]. 水生生物学报, 2009, 33(2): 289-295. HU Y, TAN B P, MAI K S, et al. Influence of dietary carbohydrate levels on growth and some physiological-biochemical index in juvenile Litopenaeus vannamei[J]. Acta Hydrobiologica Sinica, 2009, 33(2): 289-295 (in Chinese). |
| [14] |
夏明宏. 凡纳滨对虾幼虾对生物素、烟酸、叶酸和胆碱需要量的研究[D]. 硕士学位论文. 宁波: 宁波大学, 2014. XIA M H. Study on the requirements of biotin, niacin, folic acid and choline for juvenile Pacific white shrimp, Litopenaeus vannamei[D]. Master's Thesis. Ningbo: Ningbo University, 2014. (in Chinese) |
| [15] |
WILLIAMS K, BARLOW C, RODGERS L. Efficacy of crystalline and protein-bound amino acids for amino acid enrichment of diets for barramundi/Asian seabass (Lates calcarifer Bloch)[J]. Aquaculture Research, 2002, 32(S1): 415-429. |
| [16] |
郭旭, 戴习林, 华雪铭, 等. 发酵豆粕部分替代鱼粉后凡纳滨对虾对赖氨酸的需求量[J]. 水产学报, 2021, 45(6): 910-919. GUO X, DAI X L, HUA X M, et al. Optimum lysine requirement of juvenile Pacific white shrimp, Litopenaeus vannamei when fermented soybean meal partially replacing fish meal in the feed[J]. Journal of Fisheries of China, 2021, 45(6): 910-919 (in Chinese). |
| [17] |
曾雯娉. 凡纳滨对虾幼虾对赖氨酸、蛋氨酸、精氨酸和苯丙氨酸需要量的研究[D]. 硕士学位论文. 湛江: 广东海洋大学, 2012. ZENG W P. Study on the requirements of lysine, methionine, arginine and phenylalanine for juvenile pacific white shrimp, Litopenaeus vannamei[D]. Master's Thesis. Zhenjiang: Guangdong Ocean University, 2012. (in Chinese) |
| [18] |
黄凯, 王武, 李春华. 南美白对虾必需氨基酸的需要量[J]. 水产学报, 2003, 27(5): 456-461. HUANG K, WANG W, LI C H. Requirement of essential amino acids for Penaeus vannamei[J]. Journal of Fisheries of China, 2003, 27(5): 456-461 (in Chinese). |
| [19] |
刘韬, 黄旭雄, 苏美英, 等. 发酵豆粕替代鱼粉对凡纳滨对虾生长、免疫相关酶及免疫相关基因表达的影响[J]. 水产学报, 2018, 42(9): 1417-1427. LIU T, HUANG X X, SU M Y, et al. Effects of fermented soybean meal replacing fish meal on the growth performance, immune-related enzymes and gene expression of Litopenaeus vannamei[J]. Journal of Fisheries of China, 2018, 42(9): 1417-1427 (in Chinese). |
| [20] |
AOAC. Official methods of analysis[M]. 14th ed. Arlington: AOAC, 1984.
|
| [21] |
SUNYER J O, TORT L. Natural hemolytic and bactericidal activities of sea bream Sparus aurata serum are effected by the alternative complement pathway[J]. Veterinary Immunology and Immunopathology, 1995, 45(3/4): 333-345. |
| [22] |
闫伟. L-精氨酸对免疫应激鹅生长性能、器官发育及血液生化指标的影响[D]. 硕士学位论文. 扬州: 扬州大学, 2010. YAN W. Effect of L-arginine on growth performance, organ development and blood biochemical measurements of Yangzhou geese after immunological stress[D]. Master's Thesis. Yangzhou: Yangzhou University, 2010. (in Chinese) |
| [23] |
LIEBOLDT M A, HALLE I, FRAHM J, et al. Effects of graded dietary L-arginine supply on organ growth in four genetically diverse layer lines during rearing period[J]. The Journal of Poultry Science, 2016, 53(2): 136-148. DOI:10.2141/jpsa.0150131 |
| [24] |
KHAN M A, ABIDI S F. Dietary arginine requirement of Heteropneustes fossilis fry (Bloch) based on growth, nutrient retention and haematological parameters[J]. Aquaculture Nutrition, 2011, 17(4): 418-428. DOI:10.1111/j.1365-2095.2010.00819.x |
| [25] |
陈娇娇. 精氨酸对草鱼幼鱼生长、肠道结构调控及机制研究[D]. 硕士学位论文. 武汉: 华中农业大学, 2017. CHEN J J. Studies on the regulation and the related mechanism of arginine on growth and intestinal structure of juvenile grass carp (Ctenopharyngodon idellus)[D]. Master's Thesis. Wuhan: Huazhong Agricultural University, 2017. (in Chinese) |
| [26] |
GAO Y J, YANG H J, GUO D Q, et al. Dietary arginine requirement of juvenile grass carp Ctenopharyngodon idella (Valenciennes in Cuvier & Valenciennes, 1844)[J]. Aquaculture Research, 2015, 46(12): 3070-3078. DOI:10.1111/are.12469 |
| [27] |
CHEN G F, FENG L, KUANG S Y, et al. Effect of dietary arginine on growth, intestinal enzyme activities and gene expression in muscle, hepatopancreas and intestine of juvenile Jian carp (Cyprinus carpio var.Jian)[J]. The British Journal of Nutrition, 2012, 108(2): 195-207. DOI:10.1017/S0007114511005459 |
| [28] |
LIANG H L, REN M C, HABTE-TSION H M, et al. Dietary arginine affects growth performance, plasma amino acid contents and gene expressions of the TOR signaling pathway in juvenile blunt snout bream, Megalobrama amblycephala[J]. Aquaculture, 2016, 461: 1-8. DOI:10.1016/j.aquaculture.2016.04.009 |
| [29] |
KAUSHIK S J, FAUCONNEAU B, TERRIER L, et al. Arginine requirement and status assessed by different biochemical indices in rainbow trout (Salmo gairdneri R.)[J]. Aquaculture, 1988, 70(1/2): 75-95. |
| [30] |
万军利, 麦康森, 艾庆辉. 鱼类精氨酸营养生理研究进展[J]. 中国水产科学, 2006, 13(4): 679-685. WAN J L, MAI K S, AI Q H. The recent advance on arginine nutritional physiology in fish[J]. Journal of Fishery Sciences of China, 2006, 13(4): 679-685 (in Chinese). DOI:10.3321/j.issn:1005-8737.2006.04.027 |
| [31] |
袁超. 精氨酸对蛋鸡采食及组织蛋白质代谢调控的机理研究[D]. 博士学位论文. 杭州: 浙江大学, 2016. YUAN C. Research on the mechanism of l-arginine on the regulation of feed intake and tissue protein metabolism in laying hens[D]. Ph. D. Thesis. Hangzhou: Zhejiang University, 2016. (in Chinese) |
| [32] |
管晓娟. 甲壳动物体液免疫相关酶及免疫因子研究概况[J]. 生命科学仪器, 2009, 7(6): 3-7. GUAN X J. Progress on the researches of humoral immunity of crustacean[J]. Life Science Instruments, 2009, 7(6): 3-7 (in Chinese). DOI:10.3969/j.issn.1671-7929.2009.06.001 |
| [33] |
YUE Y R, ZOU Z Y, ZHU J L, et al. Effects of dietary arginine on growth performance, feed utilization, haematological parameters and non-specific immune responses of juvenile Nile tilapia (Oreochromis niloticus L.)[J]. Aquaculture Research, 2015, 46(8): 1801-1809. DOI:10.1111/are.12333 |
| [34] |
朱春华, 李广丽, 吴天力, 等. L-精氨酸对凡纳滨对虾体液免疫因子的影响[J]. 海洋科学, 2009, 33(2): 55-59. ZHU C H, LI G L, WU T L, et al. Effects of L-arginine on the humoral immuning factors of Litopenaeus vannamei[J]. Marine Sciences, 2009, 33(2): 55-59 (in Chinese). |
| [35] |
冀培丰. 一氧化氮合酶及其相关因子在凡纳滨对虾免疫反应中特性的研究[D]. 硕士学位论文. 厦门: 集美大学, 2010. JI P F. The roles and characterizations of NOS and related immune factors in Litopenaeus vannamei immune response[D]. Master's Thesis. Xiamen: Jimei University, 2010. (in Chinese) |
| [36] |
ZAPOL W M, RIMAR S, GILLIS N, et al. Nitric oxide and the lung[J]. American Journal of Respiratory and Critical Care Medicine, 1994, 149(5): 1375-1380. DOI:10.1164/ajrccm.149.5.8173780 |
| [37] |
HOLEN E, ESPE M, ANDERSEN S M, et al. A co culture approach show that polyamine turnover is affected during inflammation in Atlantic salmon immune and liver cells and that arginine and LPS exerts opposite effects on p38MAPK signaling[J]. Fish & Shellfish Immunology, 2014, 37(2): 286-298. |
| [38] |
LI F H, XIANG J H. Signaling pathways regulating innate immune responses in shrimp[J]. Fish & Shellfish Immunology, 2013, 34(4): 973-980. |
| [39] |
WANG P H, GU Z H, HUANG X D, et al. An immune deficiency homolog from the white shrimp, Litopenaeus vannamei, activates antimicrobial peptide genes[J]. Molecular Immunology, 2009, 46(8/9): 1897-1904. |
| [40] |
KILBERG M S, SHAN J X, SU N. ATF4-dependent transcription mediates signaling of amino acid limitation[J]. Trends in Endocrinology and Metabolism, 2009, 20(9): 436-443. DOI:10.1016/j.tem.2009.05.008 |




