2. 中国农业科学院饲料研究所, 北京 100081
2. Beijing Institute of Animal Husbandry and Veterinary Sciences, Chinese Academy of Agricultural Sciences, Beijing 100081, China
氧化应激在高产奶牛中非常普遍。奶牛乳腺上皮细胞(bovine mammary epithelial cells, BMECs)的氧化应激和凋亡导致低产奶量、低质牛奶,甚至使奶牛产生疾病,如乳腺炎、乳房水肿和胎盘滞留[1-2]。研究表明,活性氧(reactive oxygen species,ROS)的过量产生会导致脂质过氧化物分解成丙二醛(malondialdehyde,MDA),这是氧化应激的标志[3]。作为一种有害的应激源,MDA会导致蛋白质错误折叠,并加剧氧化应激反应的严重程度[4]。在氧化应激期间,ROS还导致细胞中谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)、过氧化氢酶(catalase, CAT)和超氧化物歧化酶(superoxide dismutase, SOD)活性下降[5]。因此,任何提高抗氧化酶活性,抑制ROS和MDA产生的物质可一定程度缓解氧化应激产生的损伤。核因子E2相关因子2(nuclear factor erythroid 2 related factor 2, Nrf2)在抗氧化应激过程中扮演着重要角色,该核转录因子与多种疾病的发生发展密切相关,如炎症[6]、氧化应激[7]、代谢性疾病[8]等。目前,许多研究已将Nrf2作为抗氧化靶点。Nrf2的激活可以上调其目标抗氧化基因的表达,从而发挥抗氧化功能,如血红氧合酶-1(heme oxygenase-1, HO-1)、醌氧化还原酶1(quinone oxidoreductase 1, NQO1)、谷氨酰半胱氨酸连接酶调节亚基(glutamate cysteine ligase modifier subunit, GCLM)和谷氨酰半胱氨酸连接酶催化亚基(glutamate cysteine ligase catalytic subunit, GCLC)等均受Nrf2的调控[4]。HO-1是Nrf2下游的主要抗氧化蛋白,可以有效地介导抗氧化应激;此外,致病因子如ROS和MDA也被Nrf2激活抑制[9]。在正常生理状态下,Kelch样环氧氯丙烷相关蛋白1(Kelch-like ECH-associated protein 1, Keap1)与Nrf2共存于细胞质中,这种情况下Nrf2没有抗氧化活性。当Nrf2被激活后与Keap1解离并转移到细胞核内与核启动子结合区抗氧化反应元件(antioxidant response element, ARE)相结合,促进其下游靶基因的表达发挥抗氧化作用[7]。
壳聚糖(chitosan, CS)是一种来源广泛的具有良好生物相容性的天然高分子化合物碱性多糖,其还具有价格低廉、低致敏性、低毒、生物降解性和生物黏附性,因为它在体内滞留时间和释放时间长以及可增加机体对药物的吸收等方面有出色表现,所以已被广泛用于生物医用材料和靶向给药等领域[10-11]。作为一种衍生于牛乳铁蛋白(bovine lactoferrin, BLF)的抗菌肽[12],牛乳铁蛋白肽(bovine lactoferricin, BLfcin)含有丰富的碱性氨基酸,如精氨酸和赖氨酸,以及疏水性的色氨酸和苯丙氨酸等残基,乳铁蛋白(lactoferrin, Lf)的抗菌效果是它的1/400,除此之外,它同样具有免疫调节、抗病毒、抗菌以及抗氧化等多重生物功能[13]。BLfcin具有广谱抗菌的作用,对金黄色葡萄球菌、大肠杆菌以及无乳链球菌等有抑制作用,但它对动物肠道中的有益菌如荧光假单胞菌、双歧杆菌以及乳酸菌的杀菌作用差甚至无杀菌作用,说明BLfcin对肠道菌的抑制具有选择性[14-15]。BLfcin可与细菌在分裂或死亡时释放出的含脂多糖(lipopolysaccharide, LPS)的生物大分子结合,使其失去毒性,阻断LPS造成机体的炎症反应[16]。有研究表明,在奶牛饲粮中添加BLfcin可显著降低隐性乳房炎的发病率,同时可提高产奶量、乳脂率和乳蛋白率,改善乳品质[17]。据报道,将含有BLfcin的Lf水解物注射到隐性乳房炎奶牛的乳房中可减少患病乳区乳汁中的细菌数量[18]。刘景喜等[19]给患有隐性乳房炎奶牛灌服BLfcin,结果发现患病奶牛产奶量增加,且牛奶中的体细胞数降低,说明BLfcin对隐性乳房炎的治疗有一定的辅助效果。然而,BLfcin对奶牛乳腺组织内氧化应激的发生是否有影响,如何发挥抗氧化作用,尚未见报道。因此,本试验通过过氧化氢(hydrogen peroxide, H2O2)诱导建立BMECs氧化损伤模型,研究载牛乳铁蛋白-壳聚糖纳米粒(BLfcin-NPs)对BMECs氧化应激和凋亡的保护作用,为调控乳腺内氧化还原平衡,进而改善乳腺健康、提升原料乳质量提供理论依据,为BLfcin-NPs作为奶牛预防氧化应激的新制剂提供参考。
1 材料与方法 1.1 主要材料本试验所用BMECs为东北农业大学动物生物化学与分子生物学实验室惠赠;BLfcin-NPs为本实验室制备,制备方法参见文献[20];H2O2购自天津市光复科技发展有限公司;DMEM/F12培养基、胎牛血清(FBS)、青霉素/链霉素溶液、0.25%胰蛋白酶-乙二胺四乙酸(EDTA) 购自Gibco公司;磷酸盐缓冲液(PBS)为北京沃比森科技有限公司产品;MTT细胞增殖及细胞毒性检测试剂盒、乳酸脱氢酶细胞毒性检测试剂盒购自上海碧云天生物技术有限公司;MDA、GSH-Px、SOD、CAT检测试剂盒与二氯二氢荧光素二乙酸酯(DCFH-DA)荧光探针均购于南京建成生物工程研究所。
1.2 BMECs氧化损伤模型的构建 1.2.1 细胞分组及处理在96孔板内培养BMECs,培养12 h待细胞贴壁后,在培养基中加入100 μL浓度分别为0(对照组)、100、200、400、600、800、1 000 μmol/L的H2O2处理细胞0、2、4、6、8、12 h后进行后续试验,每组6个重复。
1.2.2 H2O2对BMECs活力的影响应用MTT试剂盒检测H2O2对BMECs活力的影响,具体方法依照试剂盒说明书进行操作。将BMECs接种于96孔板中,待细胞密度达到80%~90%后用PBS洗2遍细胞,按照分组分别加入100 μL含有不同浓度(0、100、200、400、600、800、1 000 μmol/L) H2O2的细胞培养液处理不同时间(0、2、4、6、8、12 h);之后每孔加入10 μL的MTT溶液,在细胞培养箱内继续孵育4 h,随后每孔加入100 μL Formazan溶解液,适当混匀,在细胞培养箱内再继续孵育,直至在普通光学显微镜下观察发现Formazan溶解液全部溶解,在570 nm下测定吸光度(OD)值,计算细胞活力。
1.2.3 H2O2对BMECs毒性的影响细胞分组与处理方法同1.2.1,按照乳酸脱氢酶细胞毒性检测试剂盒(碧云天生物技术有限公司生产)所述方法,使用酶标仪在490 nm波长下检测样品OD值,计算细胞毒性。
1.2.4 H2O2对BMECs凋亡的影响将BMECs接种于6孔板中,待细胞密度达到80%~90%用PBS洗涤2遍后,按分组分别加入2 mL含有不同浓度(0、400、600、800 μmol/L)H2O2的细胞培养液,培养6 h。收集细胞,冷PBS洗涤2次,70%预冷乙醇固定24 h,离心5 min后弃掉上清液,洗涤2次;200 μL缓冲液里加入5 μL AnnexinV-FITC检测液,室温黑暗条件下染色20 min,然后在4 ℃黑暗条件下染色15 min,再加入10 μL的碘化丙啶(PI),用流式细胞仪对细胞的凋亡情况进行检测。
1.2.5 细胞中ROS含量的检测细胞分组与处理方法同1.2.4,收集细胞,根据试剂盒说明书进行操作,将DCFH-DA荧光探针加入到细胞培养液中,在37 ℃黑暗中孵育20 min;用PBS冲洗后,滴加DAPI-抗荧光淬灭封片液,用正置荧光显微镜观察拍照,绿色荧光强度越强,表明ROS含量越高。
1.3 BLfcin-NPs抗氧化能力的评价 1.3.1 BLfcin-NPs对BMECs内线粒体膜电位(MMP)的影响将BLfcin-NPs溶于完全培养基中配制成浓度为500 μg/mL的BLfcin-NPs溶液[20]。将培养好的BMECs接种于六孔板中,随机分为4组,分别为对照1组(未经处理、正常培养的BMECs)、对照2组(用2 mL浓度为500 μg/mL的BLfcin-NPs溶液预处理BMECs 12 h)、损伤组(用2 mL浓度为400 μmol/L的H2O2细胞培养液处理BMECs 6 h)、保护组(用2 mL浓度为500 μg/mL的BLfcin-NPs溶液预处理BMECs 12 h后,再使用2 mL浓度为400 μmol/L的H2O2细胞培养液处理BMECs 6 h),每组3个重复。收集细胞,细胞内线粒体膜电位使用JC-1线粒体膜电位分析试剂盒进行检测,使用流式细胞仪在530 nm处测量线粒体膜电位。
1.3.2 BLfcin-NPs对BMECs内氧化应激指标的影响按照1.3.1的步骤将BMECs进行培养、分组和处理。使用细胞刮刀将处理后的细胞从6孔板壁上刮下,按照SOD、GSH-Px、CAT和MDA检测试剂盒(南京建成生物工程研究所生产)说明,使用酶标仪分别在550、420、405和532 nm的吸收波长下测定OD值,计算SOD、GSH-Px、CAT活性和MDA含量。
1.3.3 BLfcin-NPs对BMECs内抗氧化和凋亡相关基因mRNA表达的影响按照1.3.1的步骤将BMECs进行培养、分组和处理。BMECs内总RNA采用Trizol法提取,用Nanodrop分光光度计(DS-11型,北京倍辉科技有限公司)检测RNA的纯度与浓度,OD260/OD280的值在1.8~2.0可用于后续试验分析。以甘油醛-3-磷酸脱氢酶(GADPH)作为内参基因,采用实时荧光定量PCR仪检测抗氧化和凋亡相关基因的mRNA相对表达量。测定的基因主要包括Nrf2、HO-1、NQO1、B淋巴细胞瘤-2(B-cell lymphoma-2, Bcl-2)、Bcl-2相关X蛋白(Bcl-2 associated X protein, Bax)和半胱氨酸天冬氨酸蛋白酶-3(cysteine aspastic acid-specific protease-3, Caspase-3),其引物序列见表 1。试验重复测定3次,各目的基因的mRNA相对表达量用2-△△Ct法计算得出。
|
|
表 1 基因的引物序列 Table 1 Primer sequences of genes |
试验结果用平均值±标准误(mean±SE)表示。采用SPSS 17.0统计软件中的one-way ANOVA程序进行单因素方差分析,P < 0.05代表差异显著,P < 0.01代表差异极显著。
2 结果与分析 2.1 BMECs氧化损伤模型的构建 2.1.1 H2O2对BMECs活力的影响采用MTT法检测了不同浓度H2O2处理不同时间对BMECs活力的影响,结果如图 1所示。0 h时,各浓度H2O2组细胞活力与对照组相比差异均不显著(P>0.05);2 h时,除1 000 μmol/L H2O2组细胞活力较对照组显著下降(P < 0.05)外,其他浓度H2O2组细胞活力与对照组相比差异不显著(P>0.05);4 h时,200、800和1 000 μmol/L H2O2组细胞活力较对照组显著降低(P<0.05);6 h时,与对照组相比,100和200 μmol/L H2O2显著降低了细胞活力(P<0.05),400~1 000 μmol/L H2O2极显著降低了细胞活力(P<0.01);与对照组相比,所有浓度H2O2处理8或12 h时均极显著降低了细胞活力(P<0.01)。综上所述,用H2O2处理6 h时细胞活力开始出现稳定地下降趋势,H2O2浓度达到400 μmol/L时即开始极显著下降。
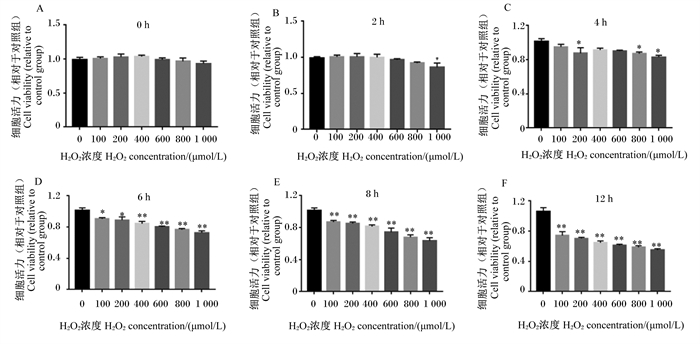
|
数据柱标注“*”表示与对照组(0 μmol/L)相比差异显著(P<0.05),标注“* *”表示与对照组相比差异极显著(P<0.01)。图 2和图 4同。 Compared with the control group (0 μmol/L), data columns with "*" mean significant difference (P < 0.05), and with "* *" mean extremely significant difference (P < 0.01). The same as Fig. 2 and Fig. 4. 图 1 不同浓度H2O2处理不同时间对BMECs活力的影响 Fig. 1 Effects of different concentrations of H2O2 treated with different time on viability of BMECs |
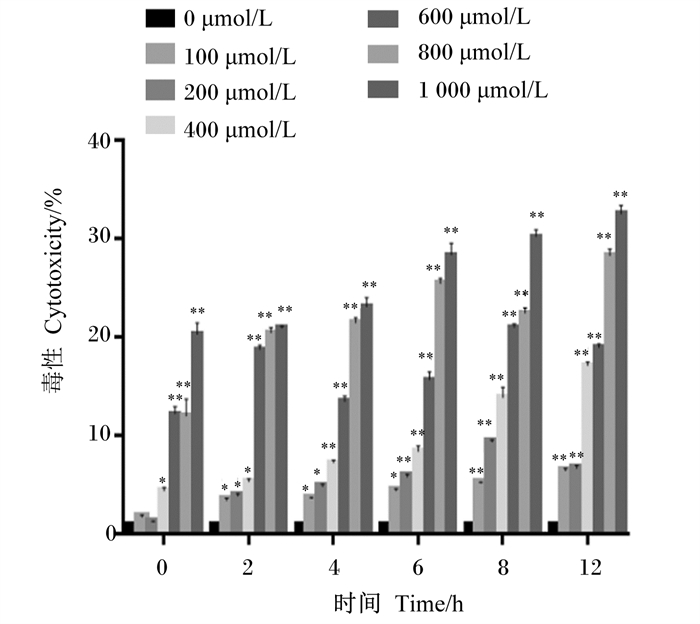
|
图 2 不同浓度H2O2处理不同时间对BMECs细胞毒性的影响 Fig. 2 Effect of different concentrations of H2O2 treated with different time on cytotoxicity of BMECs |
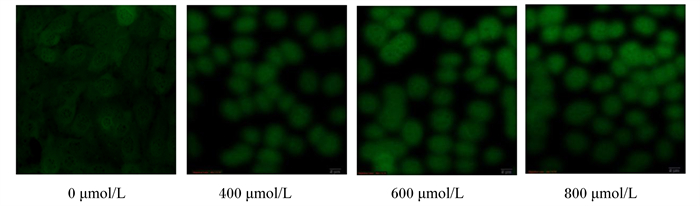
|
图 3 不同浓度H2O2对BMECs中ROS含量的影响 Fig. 3 Effects of different concentrations of H2O2 on ROS content in BMECs |
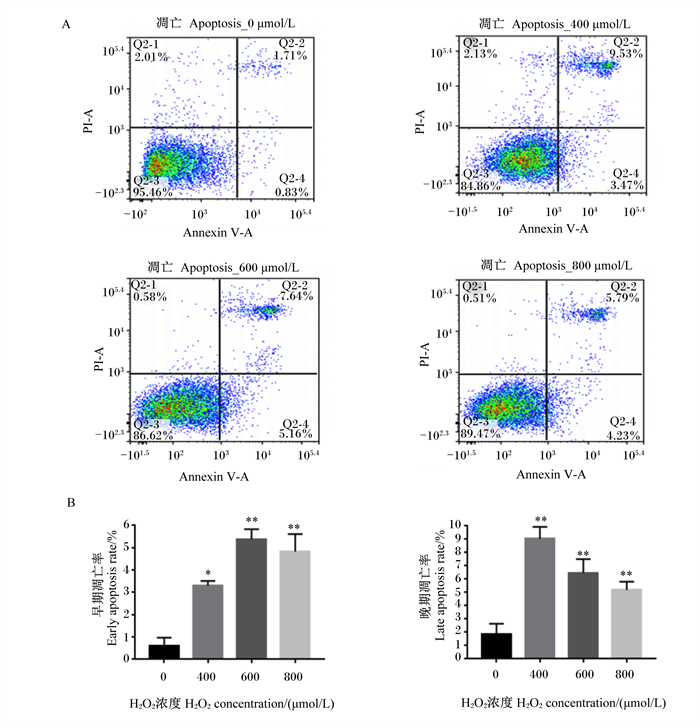
|
A:流式细胞仪检测Annexin V/PI双染结果;B:BMECs凋亡率。 A: the results of Annexin V/PI double staining by flow cytometry; B: the apoptosis rate of BMECs. 图 4 不同浓度H2O2对BMECs凋亡的影响 Fig. 4 Effects of different concentrations of H2O2 on apoptosis of BMECs |
如图 2所示,在所有作用时间和浓度下,H2O2对BMECs的细胞毒性呈现作用时间和浓度依赖式的增加。低浓度(0~200 μmol/L)的H2O2对细胞毒性作用较小,未达到10%,高浓度(1 000 μmol/L)的H2O2对细胞毒性作用较大。为防止对细胞造成不可逆转的损伤,综合MTT试验结果,后续试验选择400~800 μmol/L的H2O2处理BMECs 6 h。
2.1.3 H2O2对BMECs中ROS含量的影响为了检测H2O2对BMECs造成氧化损伤后细胞内ROS含量的变化,利用DCFH-DA探针将细胞内ROS染色并用正置荧光显微镜观察,结果如图 3所示。与0 μmol/L H2O2处理的对照组相比,用400~800 μmol/L H2O2处理BMECs后的绿色荧光强度增强,表明ROS含量增加,且呈剂量依赖性。
2.1.4 H2O2对BMECs凋亡的影响如图 4所示,与对照组相比,400~800 μmol/L H2O2处理均造成细胞凋亡。早期凋亡率,400 μmol/L H2O2组与对照组相比差异显著(P < 0.05),600和800 μmol/L H2O2组与对照组相比均差异极显著(P < 0.01);晚期凋亡率,400~800 μmol/L H2O2组与对照组相比均差异极显著(P < 0.01)。因此,后续试验选择400 μmol/L的H2O2处理BMECs 6 h构建BMECs氧化损伤模型。
2.2 BLfcin-NPs抗氧化能力的评价 2.2.1 BLfcin-NPs对BMECs内线粒体膜电位的影响如图 5所示,对照2组与对照1组相比线粒体膜电位下降比例无显著变化(P>0.05),但损伤组与对照1组相比线粒体膜电位下降比例显著升高(P < 0.05);保护组的线粒体膜电位下降比例与损伤组相比显著降低(P < 0.05)。上述结果说明BLfcin-NPs可通过降低线粒体膜电位来发挥对BMECs的保护作用。
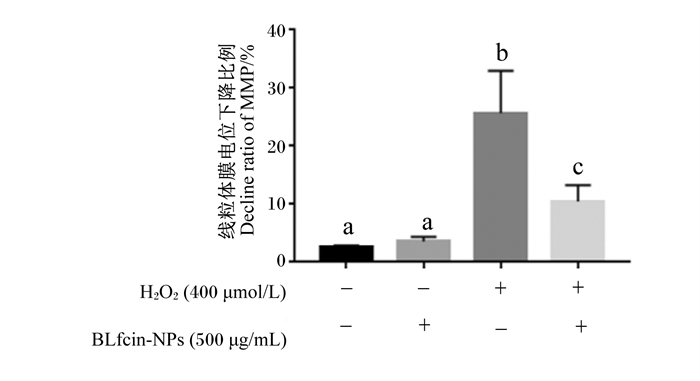
|
H2O2:过氧化氢hydrogen peroxide;BLfcin-NPs:载牛乳铁蛋白肽-壳聚糖纳米粒bovine lactoferrin chitosan nanoparticles;+:添加added;-:不添加non-added。下图同the same as below。 数据柱标注相同字母表示差异不显著(P>0.05),不同字母表示差异显著(P < 0.05)。下图同。 Data columns with the same letter mean no significant difference (P>0.05), while with different letter mean significant difference (P < 0.05). The same as below. 图 5 BLfcin-NPs对BMECs内线粒体膜电位的影响 Fig. 5 Effects of BLfcin-NPs on mitochondrial membrane potential in BMECs |
如图 6所示,对照1组和对照2组CAT、GSH-Px和SOD活性显著高于损伤组(P < 0.05),而MDA含量显著低于损伤组(P < 0.05);保护组CAT、GSH-Px和SOD活性较损伤组显著升高(P < 0.05),而保护组MDA含量与损伤组相比显著降低(P < 0.05)。图 6-A显示保护组CAT活性与对照1组和对照2组相比无显著变化(P>0.05);图 6-B显示保护组SOD活性显著低于对照1组和对照2组(P < 0.05);图 6-C显示对照1组与对照2组GSH-Px活性无显著差异(P>0.05),但对照2组GSH-Px活性显著高于保护组(P < 0.05);图 6-D显示保护组MDA含量显著高于对照1组和对照2组(P < 0.05)。
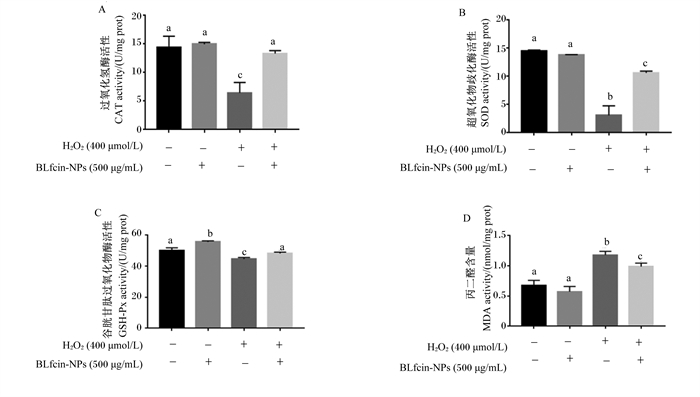
|
图 6 BLfcin-NPs对BMECs内氧化应激指标的影响 Fig. 6 Effects of BLfcin-NPs on oxidative stress indexes in BMECs |
如图 7所示,与对照1组相比,对照2组Nrf2的mRNA相对表达量显著升高(P < 0.05),但HO-1的mRNA相对表达量显著下降(P < 0.05),NQO1的mRNA相对表达量无显著变化(P>0.05);损伤组Nrf2、HO-1和NQO1的mRNA相对表达量较对照1组和对照2组均显著降低(P < 0.05);保护组的Nrf2、HO-1和NQO1的mRNA相对表达量与损伤组相比均显著升高(P < 0.05)。
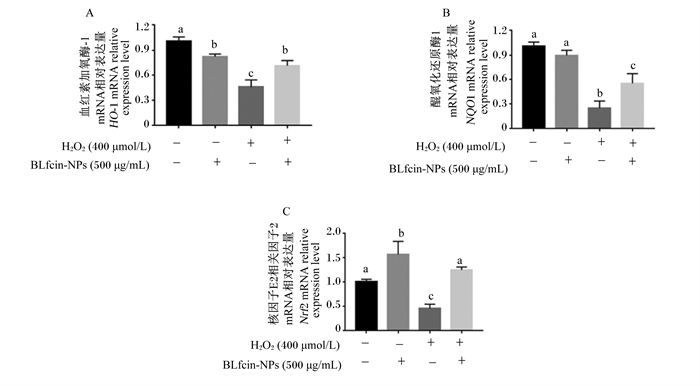
|
图 7 BLfcin-NPs对BMECs内抗氧化相关基因mRNA表达的影响 Fig. 7 Effects of BLfcin-NPs on mRNA expression of antioxidant-related genes in BMECs |
如图 8所示,对照1组与对照2组相比,损伤组Bcl2的mRNA相对表达量显著降低(P < 0.05),而保护组Bcl2的mRNA相对表达量则较损伤组显著升高(P < 0.05);损伤组Bax的mRNA相对表达量较对照1组与对照2组显著升高(P < 0.05),保护组Bax的mRNA相对表达量则较损伤组显著降低(P < 0.05);损伤组Caspase-3的mRNA相对表达量较对照1组与对照2组显著升高(P < 0.05),保护组Caspase-3的mRNA相对表达量较损伤组显著降低(P<0.05)。
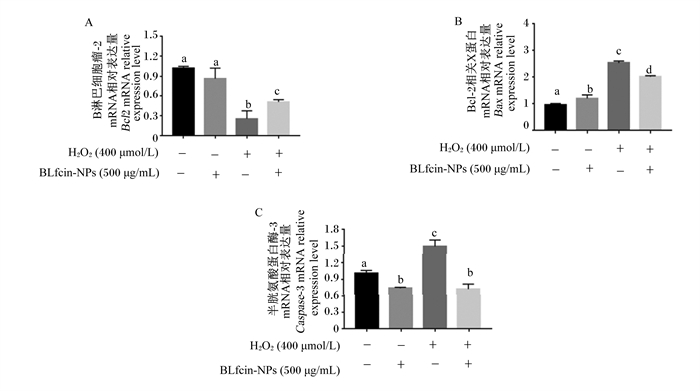
|
图 8 BLfcin-NPs对BMECs内凋亡相关基因mRNA表达的影响 Fig. 8 Effects of BLfcin-NPs on mRNA expression of apoptosis-related genes in BMECs |
代谢需求的增加使BMECs易发生氧化应激,进而导致乳腺损伤,这是导致牛奶产量和质量下降的主要原因。在BMECs发生氧化应激时,细胞内产生过量的ROS和MDA,超过阈值的MDA可以导致蛋白质错误折叠并加剧氧化应激反应的严重程度[21],甚至引起BMEC凋亡[3]。因此,抑制ROS、MDA和其他致病因子的产生是预防奶牛乳腺发生氧化应激的有效措施。SOD、CAT和GSH-Px是重要的抗氧化防御酶,可抵御细胞内由于应激造成的ROS含量升高。SOD是最重要的抗氧化酶,因为其通过将超氧阴离子自由基催化为氧和H2O2来减弱ROS的作用,之后CAT和GSH-Px将H2O2转化为氧和水[22]。抗氧化酶活性的下调导致氧化还原失衡,加剧氧化应激损伤。本研究结果发现,添加BLfcin-NPs可有效抑制BMECs内MDA的产生,并提高氧化损伤后SOD、CAT和GSH-Px的活性。由此可知,BLfcin-NPs可通过提高BMECs内抗氧化酶的活性来降低氧化损伤程度。
线粒体是细胞内产生ROS的主要细胞器同时ROS会直接影响其功能,过量的ROS会对线粒体蛋白质和结构造成氧化损伤,从而导致线粒体功能障碍[23-24]。线粒体裂变和融合的不平衡与线粒体功能障碍的若干生理指标有关,包括减少线粒体膜电位、呼吸、氧化磷酸化和ROS的生成[25]。因为过量ROS的产生会破坏呼吸链以致于增加线粒体的通透性,从而导致线粒体膜电位的下降[26-27]。本试验利用H2O2处理BMECs发生氧化损伤时,线粒体膜电位显著降低,但用BLfcin-NPs进行预处理的BMECs损伤后线粒体膜电位升高。细胞凋亡也会致使线粒体膜电位降低[28]。线粒体损伤过程中有大量的ROS和细胞色素C释放,这会加剧凋亡过程的发生[29],因此,有效预防或缓解线粒体损伤是预防细胞凋亡的主要方法。Bcl-2是一种抗凋亡蛋白,Bax是一种重要的促凋亡蛋白,这些蛋白在线粒体膜的表面定位,它们的比例被认为是线粒体渗透损伤的重要指标,反映细胞的凋亡状态[30]。Bcl-2拮抗Bax保持线粒体膜渗透性,Bcl-2有效地防止细胞色素C的释放,活化Caspase-3,抑制细胞凋亡[31-32]。本试验检测了BLfcin-NPs对Bcl-2、Bax和Caspase-3 mRNA表达的影响,结果表明,BLfcin-NPs可通过提高BMECs中Bcl-2 mRNA的表达并抑制Bax和Caspase-3 mRNA的表达,来减轻线粒体损伤,维持线粒体通透性,防止氧化损伤时细胞凋亡的发生。
Nrf2是体内调节抗氧化基因表达的重要转录调节因子[33]。Nrf2在细胞质内与Keap1偶联,这种情况下Nrf2没有抗氧化活性,当Nrf2受到应激源刺激被激活后与Keap1解离发生核移位,进入细胞核内与ARE反应原件相结合,促进其下游基因的表达[34-35]。因此,激活Nrf2-ARE信号通路中的Nrf2是防止机体产生各种应激和引发疾病的重要方法。HO-1是Nrf2下游的主要抗氧化蛋白,可有效发挥抗氧化性能。此外,Nrf2的活化也抑制了致病因子ROS和MDA的产生。ROS导致Nrf2的积累并促进其核转位启动了参与抗氧化基因的转录,BLfcin-NPs显著提高H2O2诱导产生氧化损伤的BMECs中Nrf2信号通路关键调控基因Nrf2、HO-1和NQO-1的mRNA表达,通过激活Nrf2-ARE信号通路抑制ROS生成,提高抗氧化酶活性,从而抑制H2O2诱导的BMECs氧化损伤。
4 结论BLfcin-NPs缓解了H2O2诱导的BMECs氧化损伤,增强了细胞中抗氧化酶的活性和抗氧化相关基因的表达,提高了线粒体活性并减少了细胞的凋亡。
| [1] |
RYMAN V E, PACKIRISWAMY N, SORDILLO L M. Role of endothelial cells in bovine mammary gland health and disease[J]. Animal Health Research Reviews, 2015, 16(2): 135-149. DOI:10.1017/S1466252315000158 |
| [2] |
WANG F G, ZHAO Y, CHEN S X, et al. Astragaloside Ⅳ alleviates ammonia-induced apoptosis and oxidative stress in bovine mammary epithelial cells[J]. International Journal of Molecular Sciences, 2019, 20(3): 600. DOI:10.3390/ijms20030600 |
| [3] |
FRIJHOFF J, WINYARD P G, ZARKOVIC N, et al. Clinical relevance of biomarkers of oxidative stress[J]. Antioxidants & Redox Signaling, 2015, 23(14): 1144-1170. |
| [4] |
KAN X C, LIU J X, CHEN Y S, et al. Myricetin protects against H2O2-induced oxidative damage and apoptosis in bovine mammary epithelial cells[J]. Journal of Cellular Physiology, 2021, 236(4): 2684-2695. DOI:10.1002/jcp.30035 |
| [5] |
SUN X D, JIA H D, XU Q S, et al. Lycopene alleviates H2O2-induced oxidative stress, inflammation and apoptosis in bovine mammary epithelial cells via the NFE2L2 signaling pathway[J]. Food & Function, 2019, 10(10): 6276-6285. |
| [6] |
SIVANDZADE F, PRASAD S, BHALERAO A, et al. NRF2 and NF-κB interplay in cerebrovascular and neurodegenerative disorders: molecular mechanisms and possible therapeutic approaches[J]. Redox Biology, 2019, 21: 101059. DOI:10.1016/j.redox.2018.11.017 |
| [7] |
KHADRAWY O, GEBREMEDHN S, SALILEW-WONDIM D, et al. Endogenous and exogenous modulation of Nrf2 mediated oxidative stress response in bovine granulosa cells: potential implication for ovarian function[J]. International Journal of Molecular Sciences, 2019, 20(7): 1635. DOI:10.3390/ijms20071635 |
| [8] |
WŁODARSKI A, STRYCHARZ J, WRÓBLEWSKI A, et al. The role of microRNAs in metabolic syndrome-related oxidative stress[J]. International Journal of Molecular Sciences, 2020, 21(18): 6902. DOI:10.3390/ijms21186902 |
| [9] |
吴奇, 王顺和, 程霄, 等. 神经干细胞衰老与核因子E2相关因子2/抗氧化反应元件信号通路的关系[J]. 解剖学报, 2020, 51(6): 815-820. WU Q, WANG S H, CHENG X, et al. Relationship between neural stem cells aging and nuclear factor erythroid 2 related factor 2/antioxidant response element signaling pathway[J]. Acta Anatomica Sinica, 2020, 51(6): 815-820 (in Chinese). DOI:10.16098/j.issn.0529-1356.2020.06.002 |
| [10] |
KUMARI A, YADAV S K, YADAV S C. Biodegradable polymeric nanoparticles based drug delivery systems[J]. Colloids and Surfaces B: Biointerfaces, 2010, 75(1): 1-18. DOI:10.1016/j.colsurfb.2009.09.001 |
| [11] |
谢振, 徐彭, 资鹏鹏, 等. 低相对分子质量壳聚糖及其纳米粒对三七总皂苷肠道渗透性的影响[J]. 中草药, 2020, 51(13): 3424-3432. XIE Z, XU P, ZI P P, et al. Effects of low molecular weight chitosan and its nanoparticles on intestinal permeability of Panax notoginseng saponins[J]. Chinese Traditional and Herbal Drugs, 2020, 51(13): 3424-3432 (in Chinese). DOI:10.7501/j.issn.0253-2670.2020.13.009 |
| [12] |
PEI J, XIONG L, BAO P J, et al. Secondary structural transformation of bovine lactoferricin affects its antibacterial activity[J]. Probiotics and Antimicrobial Proteins, 2021, 13(3): 873-884. DOI:10.1007/s12602-020-09726-8 |
| [13] |
BRUNI N, CAPUCCHIO M T, BIASIBETTI E, et al. Antimicrobial activity of lactoferrin-related peptides and applications in human and veterinary medicine[J]. Molecules, 2016, 21(6): 752. DOI:10.3390/molecules21060752 |
| [14] |
石璞洁, 许诗琦, 王震宇, 等. 乳铁蛋白生物活性肽及其功能机制研究进展[J]. 食品科学, 2021, 42(7): 267-274. SHI P J, XU S Q, WANG Z Y, et al. Advances in biological activity and functional mechanism of peptides from lactoferrin[J]. Food Science, 2021, 42(7): 267-274 (in Chinese). |
| [15] |
AMMONS M C, COPIÉ V. Mini-review: lactoferrin: a bioinspired, anti-biofilm therapeutic[J]. Biofouling, 2013, 29(4): 443-455. DOI:10.1080/08927014.2013.773317 |
| [16] |
LI N G, SHI Z H, TANG Y P, et al. New hope for the treatment of osteoarthritis through selective inhibition of MMP-13[J]. Current Medicinal Chemistry, 2011, 18(7): 977-1001. DOI:10.2174/092986711794940905 |
| [17] |
吕伟. 牛乳铁蛋白活性肽对奶牛隐性乳房炎的防治作用及对其生产性能的影响[J]. 中国奶牛, 2018(1): 1-3. LYU W. The effects of LFA-LFC on controlling subclinical mastitis and improving production performance in dairy cows[J]. China Dairy Cattle, 2018(1): 1-3 (in Chinese). DOI:10.19305/j.cnki.11-3009/s.2018.01.001 |
| [18] |
SHIMAZAKI K I, KAWAI K. Advances in lactoferrin research concerning bovine mastitis[J]. Biochemistry and Cell Biology, 2017, 95(1): 69-75. DOI:10.1139/bcb-2016-0044 |
| [19] |
刘景喜, 史夏斌, 靳文仲, 等. 牛乳铁蛋白肽对隐性乳房炎奶牛产奶量、体细胞及乳成分的影响[J]. 天津农业科学, 2018, 24(12): 51-54. LIU J X, SHI X B, JIN W Z, et al. Effects of bovine lactoferricin on milk production, somatic cells and milk components in recessive mastitis cows[J]. Tianjin Agricultural Sciences, 2018, 24(12): 51-54 (in Chinese). DOI:10.3969/j.issn.1006-6500.2018.12.015 |
| [20] |
蔡丽蓉. 载BLfcin壳聚糖纳米粒温敏水凝胶的制备、表征及体外抑菌作用研究[D]. 硕士学位论文. 北京: 北京农学院, 2021. CAI L R. Preparation, characterization and in vitro antibacterial activity of BLfcin loaded choisan nanoparticle thermosensitive hydrogel[D]. Master's Thesis. Beijing: Beijing University of Agriculture, 2021. (in Chinese) |
| [21] |
WANG L, ZHANG M, FANG Z X, et al. Gelation properties of myofibrillar protein under malondialdehyde-induced oxidative stress[J]. Journal of the Science of Food and Agriculture, 2017, 97(1): 50-57. DOI:10.1002/jsfa.7680 |
| [22] |
KANG Z W, LIU F H, LIU X, et al. The potential coordination of the heat-shock proteins and antioxidant enzyme genes of Aphidius gifuensis in response to thermal stress[J]. Frontiers in Physiology, 2017, 8: 976. DOI:10.3389/fphys.2017.00976 |
| [23] |
GIORGI C, MARCHI S, SIMOES I C M, et al. Mitochondria and reactive oxygen species in aging and age-related diseases[J]. International Review of Cell and Molecular Biology, 2018, 340: 209-344. |
| [24] |
VALERO T. Mitochondrial biogenesis: pharmacological approaches[J]. Current Pharmaceutical Design, 2014, 20(35): 5507-5509. DOI:10.2174/138161282035140911142118 |
| [25] |
JEŽEK J, COOPER K F, STRICH R. Reactive oxygen species and mitochondrial dynamics: the yin and yang of mitochondrial dysfunction and cancer progression[J]. Antioxidants, 2018, 7(1): 13. DOI:10.3390/antiox7010013 |
| [26] |
TONG F, ZHOU X M. The Nrf2/HO-1 pathway mediates the antagonist effect of L-arginine on renal ischemia/reperfusion injury in rats[J]. Kidney & Blood Pressure Research, 2017, 42(3): 519-529. |
| [27] |
WANG L L, BAI M G, QIN Y C, et al. Application of ionic liquid-based ultrasonic-assisted extraction of flavonoids from bamboo leaves[J]. Molecules, 2018, 23(9): 2309. DOI:10.3390/molecules23092309 |
| [28] |
SHU G, KONG F L, XU D, et al. Bamboo leaf flavone changed the community of cecum microbiota and improved the immune function in broilers[J]. Scientific Reports, 2020, 10(1): 12324. DOI:10.1038/s41598-020-69010-1 |
| [29] |
WANG H L, XING G D, QIAN Y, et al. Dihydromyricetin attenuates heat stress-induced apoptosis in dairy cow mammary epithelial cells through suppressing mitochondrial dysfunction[J]. Ecotoxicology and Environmental Safety, 2021, 214: 112078. DOI:10.1016/j.ecoenv.2021.112078 |
| [30] |
SUN Y C, LIAN M Q, LIN Y, et al. Role of p-MKK7 in myricetin-induced protection against intestinal ischemia/reperfusion injury[J]. Pharmacological Research, 2018, 129: 432-442. DOI:10.1016/j.phrs.2017.11.011 |
| [31] |
BIALA A K, KIRSHENBAUM L A. The interplay between cell death signaling pathways in the heart[J]. Trends in Cardiovascular Medicine, 2014, 24(8): 325-331. DOI:10.1016/j.tcm.2014.08.002 |
| [32] |
KATIFELIS H, LYBEROPOULOU A, MUKHA I, et al. Ag/Au bimetallic nanoparticles induce apoptosis in human cancer cell lines via P53, CASPASE-3 and BAX/BCL-2 pathways[J]. Artificial Cells, Nanomedicine, and Biotechnology, 2018, 46(Suppl.3): S389-S398. |
| [33] |
GUO W J, LIU J X, SUN J X, et al. Butyrate alleviates oxidative stress by regulating NRF2 nuclear accumulation and H3K9/14 acetylation via GPR109A in bovine mammary epithelial cells and mammary glands[J]. Free Radical Biology and Medicine, 2020, 152: 728-742. |
| [34] |
RAMA RAO K V, JAYAKUMAR A R, NORENBERG D M. Ammonia neurotoxicity: role of the mitochondrial permeability transition[J]. Metabolic Brain Disease, 2003, 18(2): 113-127. |
| [35] |
WANG P, GENG J, GAO J H, et al. Macrophage achieves self-protection against oxidative stress-induced ageing through the Mst-Nrf2 axis[J]. Nature Communications, 2019, 10(1): 755. |




