必需脂肪酸是一类维持机体功能不可缺少,但机体不能自身合成必须由食物提供的脂肪酸。被明确定义的人体必需脂肪酸有2类,一类是以α-亚麻酸(α-linolenic acid,ALA)为母体的n-3多不饱和脂肪酸(n-3 polyunsaturated fatty acids,n-3 PUFAs);另一类是以亚油酸(linoleic acid,LA)为母体的n-6多不饱和脂肪酸(n-6 polyunsaturated fatty acids,n-6 PUFAs),均为多不饱和脂肪酸(polyunsaturated fatty acids,PUFAs)。人体可将ALA转化为二十二碳六烯酸(docosahexenoic acid,DHA)和二十碳五烯酸(eicosapentaenoic acid,EPA),且DHA和EPA也属于n-3 PUFAs。随着人们对不饱和脂肪酸研究的不断深入,有研究者发现n-3 PUFAs具有促进机体修复、提升免疫功能、促进生长发育、防治心脑血管疾病及促进大脑正常发育等重要作用[1-3]。
然而,当前我国居民大多数日常食用的主要为LA含量较高的玉米油、菜籽油、大豆油,导致我国居民膳食LA摄入量严重超标,ALA摄入量严重不足,从而使人体内n-6/n-3 PUFAs比值普遍较高,远高于中国营养学会推荐值(4 ∶ 1~6 ∶ 1)[4-5]。因此,饮食中提高n-3 PUFAs摄入量对人类保持健康具有重要意义。亚麻籽是植物性ALA最丰富的来源之一,可作为深海鱼油的替代品。亚麻籽油与其他食用油相比,其ALA含量较高,占总脂肪酸的50%以上,而LA含量相对较低,约占总脂肪酸含量13%[6]。由于亚麻籽的ALA含量高,所以人们一直提倡使用亚麻籽来对抗心血管疾病[7]。
黑水虻作为一种可处理废弃物的经济昆虫,具有较高的利用价值,其脂肪和蛋白质含量丰富,常被用作饲用蛋白质资源的替代。Manangkot等[8]研究发现,黑水虻幼虫至少可替代15%的鱼粉用于饲喂肉鸡,且不会对肉鸡生长发育产生负面影响。Gariglio等[9]研究发现,饲粮中添加9%的部分脱脂黑水虻幼虫粉不会影响番鸭屠宰性状和肉品质,但会导致番鸭饱和脂肪酸含量增加。研究表明,自然条件下黑水虻在脂肪酸构成上n-3 PUFAs含量较低,幼虫n-6/n-3 PUFAs比值约为18 ∶ 1[10-11]。若能将其n-6/n-3 PUFAs比值降低到4 ∶ 1以下,可提高其经济价值。然而,目前黑水虻产业开发过程中,大部分研究主要集中在饲养、虫体加工等简单技术层面,如何更好地提高黑水虻利用价值的研究相对较少[12-13]。因此,本研究采用适当的营养调控技术,利用不同浓度亚麻籽油与蛋鸡粪复配组成饲养黑水虻基质条件,探究亚麻籽油对黑水虻幼虫生长性能、虫体营养组分及PUFAs构成影响,以期改善黑水虻幼虫n-6/n-3 PUFAs比值,使其达到推荐的n-6/n-3 PUFAs比值,为增加黑水虻的经济价值及深入开发利用奠定科学基础。
1 材料与方法 1.1 试验材料黑水虻虫卵购自贵州织金县黑水虻养殖基地。大豆油为金龙鱼精炼一级大豆油,购自浙江省杭州市余杭区。亚麻籽油为亚麻公社冷榨一级亚麻籽油,购自内蒙古乌兰察布市。37种脂肪酸混合标准品、十一碳酸甘油三酯标准品购自美国NU-CHEK公司。
1.2 试验饲粮通过在蛋鸡粪中添加不同比例亚麻籽油和大豆油,制成3种脂肪酸构成不同的试验饲粮。试验饲粮的配制方法如下:首先,使用种子法在添加的油脂中加入200 μg/g叔丁基对苯二酚(tert-butylhydroquinone,TBHQ)以防止其被氧化。每千克饲粮中分别含有0、20和50 g亚麻籽油(0、2%和5%)以及50、30和0 g大豆油(5%、3%和0)。使用水将蛋鸡粪调至含水量70%,添加含量为2%的吐温-20(Tween-20)溶液,再加入油脂制成水包油型混合物。试验饲粮配制完成后将其密封于自封袋中,在-20 ℃温度下保存至使用。试验饲粮组成见表 1。
|
|
表 1 试验饲粮组成(饲喂基础) Table 1 Composition of experimental diets (as-fed basis) |
主要仪器和设备包括DHG-9246A型鼓风干燥器、分析天平、Soxtec 8000 Extraction Unit型全自动脂肪分析仪、QPHA-500G型氢空一体机、Agilent 7890B气相色谱仪、电子天平、游标卡尺。
1.4 试验方法 1.4.1 试验设计随机选取了百虫鲜重相近、蠕动能力强的1龄黑水虻幼虫2 400只,随机分为3组(A组、B组、C组),每组4个重复,每个重复200只幼虫。A组(对照组)试验饲粮为蛋鸡粪中添加5%大豆油,B组为蛋鸡粪中添加2%亚麻籽油和3%大豆油,C组为蛋鸡粪中添加5%亚麻籽油。试验于2021年4月在天津农学院动物科学实践基地进行。
1.4.2 虫卵的孵化取500 g米糠和500 g麸皮加入养殖盒中,加水调节其湿度约80%,将虫卵均匀分散于基质表面,放入生化培养箱,保持温度28 ℃。每日观察,直至基质表面出现肉眼可见幼虫为止,孵化完成。
1.4.3 幼虫饲养装置及饲养数量使用650 mL一次性注塑餐盒作为黑水虻幼虫饲养容器,餐盒盖中间用剪刀剪出12 cm×6 cm通风口以便黑水虻幼虫呼吸。每组设置4个重复,每个重复计数200只幼虫,将幼虫与试验饲粮共同加入一次性注塑餐盒,放入生化培养箱保持28 ℃,每天通风补水,补水量以补至试验饲粮相对湿度约70%为准,饲粮分多次添加,以上一次喂料剩余约50%为参照增添饲粮。
1.5 取样和样品检测 1.5.1 取样以一次性注塑餐盒中出现第1只变黑幼虫为信号,将其一次性全部收集,利用幼虫蠕动特点将其表面残留粪便清理干净。通过24 h饥饿处理,使虫体消化道内未消化残渣排出。然后将收集到的幼虫在温度(65±5) ℃条件下,电热鼓风干燥箱中烘干6 h,除去虫体初水分并制成半干样,利用研钵研磨成粉,保存备用。
1.5.2 幼虫粗脂肪、粗蛋白质含量及生长性能的测定分别使用索氏提取法和凯氏定氮法测定幼虫粗脂肪、粗蛋白质含量。将鲜虫放入105 ℃烘箱中10 min进行灭活,采用四分法取100和50只黑水虻幼虫,分别用电子天平测定百虫鲜重和50分度游标卡尺测量体长和体宽。
1.5.3 幼虫PUFAs构成的检测根据《食品安全国家标准食品中脂肪酸的测定》(GB 5009.168—2016)对脂肪酸含量进行测定,采用气相色谱仪对脂肪酸构成进行分析。样品前处理方法采用水解-提取法,用分析天平准确称取全自动脂肪分析仪提取的虫体脂肪150 mg,准确加入2 mL十一烷酸甘油三酯(C11 ∶ 0)内标溶液。加入2% NaOH-CH3OH溶液8 mL,在80 ℃水浴回流至油滴消失,再使用15% BF3-CH3OH溶液进行脂肪酸甲酯化。取37种脂肪酸甲酯混标注入气相色谱仪定性色谱峰,观察色谱峰分离情况。
色谱条件如下。毛细管色谱柱:DB-WAX型毛细管色谱柱(Agilent,30 m×250 μm×0.25 μm),进样口温度:250 ℃,检测器温度:280 ℃。柱箱升温程序:初始温度40 ℃,持续2 min;40~171 ℃,升温速率45 ℃/min,保持25 min;171~215 ℃,升温速率10 ℃/min,保持20 min。载气:氦气,分流比10 ∶ 1,进样体积:3 μL,气体流量2 mL/min。
1.6 数据整理与分析试验数据使用SPSS 25.0软件进行单因素方差分析,并采用LSD法进行组间多重比较。P < 0.05表示差异显著,试验结果以平均值±标准误表示。
2 结果与分析 2.1 不同浓度亚麻籽油对黑水虻幼虫生长性能的影响由表 2可知,B组幼虫的百虫鲜重、体长显著高于C组(P < 0.05),A组与C组之间百虫鲜重无显著差异(P>0.05)。B组和C组幼虫的体宽显著高于A组(P < 0.05),B组和C组之间无显著差异(P>0.05)。
|
|
表 2 不同浓度亚麻籽油对黑水虻幼虫生长性能影响 Table 2 Effects of different concentrations of flaxseed oil on growth performance of Hermetia illucens larvae |
由表 3可知,各组之间试验饲粮中粗蛋白质、粗脂肪含量无显著差异(P>0.05),保证了试验的可比性。
|
|
表 3 试验饲粮中粗蛋白质、粗脂肪含量 Table 3 Contents of CP and EE in experimental diets |
由表 4可知,B组和C组幼虫中粗蛋白质含量显著低于A组(P < 0.05)。C组幼虫中粗脂肪含量显著高于A组(P < 0.05),A组与B组之间无显著差异(P>0.05)。
|
|
表 4 不同浓度亚麻籽油对黑水虻幼虫粗蛋白质、粗脂肪含量的影响 Table 4 Effects of different concentrations of flaxseed oil on contents of CP and EE in Hermetia illucens larvae |
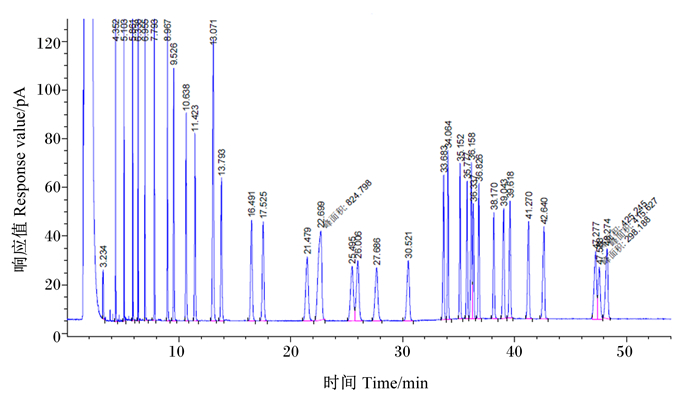
图 1为37种脂肪酸甲酯混标注入气相色谱仪定性色谱峰的各色谱峰保留时间。由图可知,本试验选取色谱柱和建立的脂肪酸含量测定的方法能有效地分离出37种脂肪酸甲酯,虽然C18 ∶ 1 cis和C18 ∶ 1 trans之间较难分离,但是对总体试验结果无影响。
|
图 1 脂肪酸混标色谱图 Fig. 1 Mixed standard chromatogram of fatty acids |
由表 5可知,随着亚麻籽油添加浓度的升高,3组试验饲粮中亚麻酸(C18 ∶ 2 trans)含量呈逐渐降低的趋势,与A组相比,B组和C组试验饲粮中亚麻酸含量显著降低(P < 0.05),且B组显著高于C组(P < 0.05);3组试验饲粮中ALA含量呈逐渐上升趋势,与A组相比,B组和C组试验饲粮中ALA含量显著提高(P < 0.05),且C组显著高于B组(P < 0.05)。
|
|
表 5 不同浓度亚麻籽油对试验饲粮脂肪酸构成的影响 Table 5 Effects of different concentrations of flaxseed oil on fatty acid composition of experimental diets |
由表 6可知,A组、B组和C组之间试验饲粮中PUFAs含量差异不显著(P>0.05)。与C组相比,A组和B组试验饲粮中n-6/n-3 PUFA比值显著提高(P < 0.05),且B组显著低于A组(P < 0.05)。
|
|
表 6 不同浓度亚麻籽油对试验饲粮PUFAs构成的影响 Table 6 Effects of different concentrations of flaxseed oil on PUFAs composition of experimental diets |
由表 7可知,与A组相比,B组和C组黑水虻幼虫亚麻酸含量显著降低(P < 0.05),且B组显著高于C组(P < 0.05)。与A组和B组相比,C组黑水虻幼虫ALA含量显著提高(P < 0.05),且B组显著高于A组(P < 0.05)。A组、B组和C组中均未检测出EPA和DHA。
|
|
表 7 不同浓度亚麻籽油对黑水虻幼虫脂肪酸构成的影响 Table 7 Effects of different concentrations of flaxseed oil on fatty acid composition of Hermetia illucens larvae |
由表 8可知,与A组相比,B组和C组黑水虻幼虫PUFAs含量显著提高(P < 0.05),且C组显著高于B组(P < 0.05)。与C组相比,A组和B组黑水虻幼虫n-6 PUFAs含量显著提高(P < 0.05),且A组与B组之间无显著差异(P>0.05)。与A组和B组相比,C组黑水虻幼虫n-3 PUFA含量显著提高(P < 0.05),且B组显著高于A组(P < 0.05)。与A组和B组相比,C组黑水虻幼虫n-6/n-3 PUFAs比值显著降低(P < 0.05),且B组显著低于A组(P < 0.05)。以上结果表明,饲粮中添加亚麻籽油能显著降低黑水虻幼虫n-6/n-3 PUFAs比例。
|
|
表 8 不同浓度亚麻籽油对黑水虻幼虫PUFAs构成的影响 Table 8 Effects of different concentrations of flaxseed oil on PUFAs composition of Hermetia illucens larvae |
亚麻籽中富含ALA、纤维、二葡萄糖苷、精氨酸等营养成分,对改善血脂血压、降低心血管发病频率有良好效果。然而已有的报道表明,亚麻籽中含有一定的亚麻素和植酸等抗营养因子,可以明显地抑制肉鸡[14-18]和猪[19]的生长。亚麻籽油作为亚麻籽提取物,其是否会影响黑水虻幼虫生长性能及营养组分尚不清楚。Star c ˇ evi c ′等[20]研究亚麻籽油饲喂牙买加蟋蟀时发现,随着添加亚麻籽油含量从3%增加到5%时,牙买加蟋蟀的生长会明显被抑制,且存活率由37%降低到了24%。此外,在猪的研究中表明,添加中添加50、100 g/kg亚麻籽油会对育肥猪的胴体和肉品质产生不良影响[21]。本试验通过测定黑水虻幼虫的百虫鲜重、体长、体宽等指标,表明添加2%的亚麻籽油后增加了百虫鲜重及体宽,而添加5%的亚麻籽油会降低百虫鲜重,这表明亚麻籽油浓度过高可能会影响虫体的生长发育。Barragan-Fonseca等[22]研究不同饲喂方式对黑水虻幼虫粗脂肪含量的影响时发现,采用定时定量的饲粮添加方式其幼虫中粗脂肪含量明显高于随意的饲粮添加方式,随意的饲粮添加方式可能会导致幼虫处于饥饿状态,还有可能导致饲粮被蝇蛆污染现象的发生。本试验采用定时定量的饲粮添加方式对黑水虻幼虫进行饲养,结果表明,随着亚麻籽油添加浓度从2%升到5%时,幼虫中粗脂肪含量也逐渐升高。另有研究表明,脂肪沉积的变化可能与脂质合成或脂质氧化的速率有关[23]。Crespo等[24]研究表明,添加亚麻籽油可以促进肉鸡的脂肪酸形成,增加粗脂肪含量。因此,推测本试验中黑水虻幼虫粗脂肪含量随着亚麻籽油添加浓度的升高而升高,可能是由于亚麻籽油促进了虫体中脂肪酸的合成过程引起的。
研究表明,在自然环境下(低n-3 PUFAs含量环境)生长的昆虫体内n-6/n-3 PUFAs比值普遍在18 ∶ 1~36 ∶ 1,如黄粉虫的n-6/n-3 PUFAs比值为19 ∶ 1[25]。该比值远远超过了目前人们饮食结构中推荐的n-6/n-3 PUFAs比值(4 ∶ 1~6 ∶ 1)[4-5]。Liput等[26]研究报道,高n-6/n-3 PUFAs比值可能导致各类慢性疾病尤其是心脑血管疾病发生率明显增高。在本试验发现,饲粮中添加2%的亚麻籽油能够将黑水虻幼虫n-6/n-3 PUFAs比值降低到2.688 ∶ 1,而且亚麻籽油添加浓度升高到5%时,幼虫n-6/n-3 PUFAs比值降低到0.851 ∶ 1。该结果表明随着亚麻籽油添加浓度的升高,幼虫n-6/n-3 PUFAs比值明显降低。
通常n-3 PUFAs主要包括ALA、EPA和DHA 3种,亚麻籽油中所含的n-3 PUFAs主要以ALA的形式存在。从本研究的结果分析,黑水虻幼虫饲粮中添加亚麻籽油降低了n-6/n-3 PUFAs比值,其变化主要是由于虫体内n-3 PUFAs含量的增加引起的。有研究报道,利用亚麻籽油对猪及肉鸡进行饲喂能显著提高肉中ALA含量,同时EPA含量也随之升高[27-28]。然而在本试验中,通过气相色谱测定脂肪酸组成时未检测到EPA和DHA,更多的是ALA含量的增加。程慧林等[29]在研究紫苏籽油对蛋雏鸡PUFAs组成的影响时,也未检测到EPA和DHA。此外,Oonincx等[30]研究发现,蟋蟀可以有选择地保留了EPA,当稀释饲粮中EPA的相对浓度时,蟋蟀体内EPA的相对浓度依旧可以保持不变。本试验显示未检测到虫体含有EPA和DHA,表明虫体内DHA、EPA含量极低。在鸡饲粮添加含有2%亚麻籽油养殖的黑水虻幼虫n-6/n-3 PUFAs比值为1.8 ∶ 1[30],本试验在含有2%亚麻籽油的蛋鸡粪上养殖的黑水虻幼虫n-6/n-3 PUFAs比值为2.688 ∶ 1,稍高于前人研究结果,其原因可能与本试验使用大豆油(低n-3 PUFAs含量)将油脂添加量统一控制在5%有关。本试验结果显示,未检测到虫体含有EPA和DHA,表明虫体内DHA、EPA含量极低。这与已发表的关于包括双翅目、直翅目、鳞翅目和鞘翅目在内的多种昆虫的数据一致,这些昆虫选择性地保留了EPA。Van Broekhoven等[25]研究了3种可食性黄粉虫在有机副产物饲粮上的生长性能和饲料转化效率,检测了多种由有机副产物养殖的黄粉虫(黄粉虫属于鞘翅目昆虫)在脂肪酸构成上的特点,其结果也符合Oonincx等[30]的研究结论,昆虫可选择性保留EPA。这能够解释本次试验黑水虻幼虫DHA和EPA含量极低。
4 结论综上所述,黑水虻幼虫饲粮中添加2%亚麻籽油可提高黑水虻幼虫的生长性能及虫体中粗脂肪含量,并且可改善虫体中n-6/n-3 PUFAs比值,在一定程度上提高了黑水虻的经济价值。
| [1] |
樊娟, 张怀蓉, 李雪莲, 等. ω-3多不饱和脂肪酸对腹部创伤术后应激和肠道功能恢复的影响[J]. 创伤外科杂志, 2021, 23(4): 266-271. FAN J, ZHANG H R, LI X L, et al. Effect of ω-3 polyunsaturated fatty acids on stress and intestinal function recovery after ab-dominal trauma[J]. Journal of Traumatic Surgery, 2021, 23(4): 266-271 (in Chinese). DOI:10.3969/j.issn.1009-4237.2021.04.007 |
| [2] |
张永, 张静, 于志盟, 等. 补充ω-3脂肪酸改善代谢综合征患者脂代谢的研究[J]. 中国食物与营养, 2020, 26(10): 60-63. ZHANG Y, ZHANG J, YU Z M, et al. Effect of ω-3 fatty acids on lipid metabolism in patients with metabolic syndrome[J]. Food and Nutrition in China, 2020, 26(10): 60-63 (in Chinese). DOI:10.3969/j.issn.1006-9577.2020.10.012 |
| [3] |
许晓青, 丁心悦, 刘开琦, 等. 营养素对人体免疫功能的影响[J]. 中华医学杂志, 2020, 100(46): 3720-3726. XU X Q, DING X Y, LIU K Q, et al. Influence of nutrients on human immunity[J]. National Medical Journal of China, 2020, 100(46): 3720-3726 (in Chinese). DOI:10.3760/cma.j.cn112137-20200728-02232 |
| [4] |
国家卫生和计划生育委员会. 中国居民膳食营养素参考摄入量第1部分: 宏量营养素: WS/T 578.1—2017[S]. 北京: 中国标准出版社, 2018. National Health and Family Planning Commission of the People's Republic of China. Chinese dietary reference intakes—part 1: macronutrient: WS/T 578.1—2017[S]. Beijing: Standards Press of China, 2018. (in Chinese) |
| [5] |
张坚, 孟丽苹, 姜元荣, 等. 中国成人膳食脂肪酸摄入和食物来源状况分析[J]. 营养学报, 2009, 31(5): 424-427. ZHANG J, MENG L P, JIANG Y R, et al. The dietary fatty acids intakes and their food sources among Chinese adults[J]. Acta Nutrimenta Sinica, 2009, 31(5): 424-427 (in Chinese). DOI:10.13325/j.cnki.acta.nutr.sin.2009.05.009 |
| [6] |
张晓霞, 尹培培, 杨灵光, 等. 不同产地亚麻籽含油率及亚麻籽油脂肪酸组成的研究[J]. 中国油脂, 2017, 42(11): 142-146. ZHANG X X, YIN P P, YANG L G, et al. Oil contents in flaxseeds from different origins and fatty acid compositions of flaxseed oils[J]. China Oils and Fats, 2017, 42(11): 142-146 (in Chinese). DOI:10.3969/j.issn.1003-7969.2017.11.032 |
| [7] |
ABDELHAMID A S, BROWN T J, BRAINARD J S, et al. Omega-3 fatty acids for the primary and secondary prevention of cardiovascular disease[J]. The Cochrane Database of Systematic Reviews, 2018, 7(7): CD003177. |
| [8] |
GARIGLIO M, DABBOU S, GAI F, et al. Black soldier fly larva in Muscovy duck diets: effects on duck growth, carcass property, and meat quality[J]. Poultry Science, 2021, 100(9): 101303. DOI:10.1016/j.psj.2021.101303 |
| [9] |
MANANGKOT H J, RONDONUWU S J, PINONTOAN O R, et al. Black soldier fly larvae manure degradation as fish meal replacer in native chicken ration[J]. Lucrǎriștiintifice-Seria Zootehnie, 2014, 62: 139-142. |
| [10] |
MURAWSKA D, DASZKIEWICZ T, SOBOTKA W, et al. Partial and total replacement of soybean meal with full-fat black soldier fly (Hermetia illucens L.) larvae meal in broiler chicken diets: impact on growth performance, carcass quality and meat quality[J]. Animals, 2021, 11(9): 2715. DOI:10.3390/ani11092715 |
| [11] |
BBOSA T, TAMALE NDAGIRE C, MUZIRA MUKISA I, et al. Nutritional characteristics of selected insects in Uganda for use as alternative protein sources in food and feed[J]. Journal of Insect Science, 2019, 19(6): 23. DOI:10.1093/jisesa/iez124 |
| [12] |
MACAVEI L I, BENASSI G, STOIAN V, et al. Optimization of Hermetia illucens (L.) egg laying under different nutrition and light conditions[J]. PLoS One, 2020, 15(4): e0232144. DOI:10.1371/journal.pone.0232144 |
| [13] |
MENEGUZ M, GASCO L, TOMBERLIN J K. Impact of pH and feeding system on black soldier fly (Hermetia illucens, L; Diptera: Stratiomyidae) larval development[J]. PLoS One, 2018, 13(8): e0202591. DOI:10.1371/journal.pone.0202591 |
| [14] |
LEE K H, OLOMU J M, SIM J S. Live performance, carcass yield, protein and energy retention of broiler chickens fed canola and flax full-fat seeds and the restored mixtures of meal and oil[J]. Canadian Journal of Animal Science, 1991, 71(3): 897-903. DOI:10.4141/cjas91-105 |
| [15] |
BOND J M, JULIAN R J, SQUIRES E J. Effect of dietary flaxseed on broiler growth, erythrocyte deformability, and fatty acid composition of erythrocyte membranes[J]. Canadian Journal of Animal Science, 1997, 77(2): 279-286. DOI:10.4141/A96-068 |
| [16] |
TREVIÑO J, RODRÍGUEZ M L, ORTIZ L T, et al. Protein quality of linseed for growing broiler chicks[J]. Animal Feed Science and Technology, 2000, 84(3/4): 155-166. |
| [17] |
NGUYEN C V, SMULIKOWSKA S, MIECZKOWSKA A. Effect of linseed and rapeseed or linseed and rapeseed oil on performance, slaughter yield and fatty acid deposition in edible parts of the carcass in broiler chickens[J]. Journal of Animal and Feed Sciences, 2003, 12(2): 271-288. DOI:10.22358/jafs/67703/2003 |
| [18] |
ANJUM F M, HAIDER M F, KHAN M I, et al. Impact of extruded flaxseed meal supplemented diet on growth performance, oxidative stability and quality of broiler meat and meat products[J]. Lipids in Health and Disease, 2013, 12: 13. DOI:10.1186/1476-511X-12-13 |
| [19] |
JUÁREZ M, DUGAN M E R, ALDAI N, et al. Increasing omega-3 levels through dietary co-extruded flaxseed supplementation negatively affects pork palatability[J]. Food Chemistry, 2011, 126(4): 1716-1723. DOI:10.1016/j.foodchem.2010.12.065 |
| [20] |
STARČEVIĆ K, GAVRILOVIĆ A, GOTTSTEIN Ž, et al. Influence of substitution of sunflower oil by different oils on the growth, survival rate and fatty acid composition of Jamaican field cricket (Gryllus assimilis)[J]. Animal Feed Science and Technology, 2017, 228: 66-71. DOI:10.1016/j.anifeedsci.2017.04.007 |
| [21] |
MATTHEWS K R, HOMER D B, THIES F, et al. Effect of whole linseed (Linum usitatissimum) in the diet of finishing pigs on growth performance and on the quality and fatty acid composition of various tissues[J]. British Journal of Nutrition, 2000, 83(6): 637-643. DOI:10.1017/S0007114500000817 |
| [22] |
BARRAGAN-FONSECA K B, DICKE M, VAN LOON J J A. Influence of larval density and dietary nutrient concentration on performance, body protein, and fat contents of black soldier fly larvae (Hermetia illucens)[J]. Entomologia Experimentalis et Applicata, 2018, 166(9): 761-770. DOI:10.1111/eea.12716 |
| [23] |
杨晓华, 张枫琳, 江青艳, 等. 氧化脂质对机体脂肪沉积的调控作用及机制[J]. 动物营养学报, 2020, 32(7): 3039-3048. YANG X H, ZHANG F L, JIANG Q Y, et al. Regulatory roles and mechanisms of oxylipins in body fat deposition[J]. Chinese Journal of Animal Nutrition, 2020, 32(7): 3039-3048 (in Chinese). |
| [24] |
CRESPO N, ESTEVE-GARCIA E. Dietary linseed oil produces lower abdominal fat deposition but higher de novo fatty acid synthesis in broiler chickens[J]. Poultry Science, 2002, 81(10): 1555-1562. DOI:10.1093/ps/81.10.1555 |
| [25] |
VAN BROEKHOVEN S, OONINCX D G A B, VAN HUIS A, et al. Growth performance and feed conversion efficiency of three edible mealworm species (Coleoptera: Tenebrionidae) on diets composed of organic by-products[J]. Journal of Insect Physiology, 2015, 73: 1-10. DOI:10.1016/j.jinsphys.2014.12.005 |
| [26] |
LIPUT K P, LEPCZYŃSKI A, OGŁUSZKA M, et al. Effects of dietary n-3 and n-6 polyunsaturated fatty acids in inflammation and cancerogenesis[J]. International Journal of Molecular Sciences, 2021, 22(13): 6965. DOI:10.3390/ijms22136965 |
| [27] |
EL-BAHR S M, SHOUSHA S, ALFATTAH M A, et al. Enrichment of broiler chickens' meat with dietary linseed oil and lysine mixtures: influence on nutritional value, carcass characteristics and oxidative stress biomarkers[J]. Foods, 2021, 10(3): 618. DOI:10.3390/foods10030618 |
| [28] |
CORINO C, ROSSI R, CANNATA S, et al. Effect of dietary linseed on the nutritional value and quality of pork and pork products: systematic review and meta-analysis[J]. Meat Science, 2014, 98(4): 679-688. DOI:10.1016/j.meatsci.2014.06.041 |
| [29] |
程慧林, 田川尧, 蔡锋隆, 等. 紫苏籽油对蛋雏鸡生长性能、免疫功能及PUFAs组成的影响[J]. 畜牧与兽医, 2020, 52(1): 68-74. CHENG H L, TIAN C Y, CAI F L, et al. Effects of perilla seed oil on the growth and development, immune function and PUFAs composition of young laying chickens[J]. Animal Husbandry & Veterinary Medicine, 2020, 52(1): 68-74 (in Chinese). |
| [30] |
OONINCX D G A B, LAURENT S, VEENENBOS M E, et al. Dietary enrichment of edible insects with omega 3 fatty acids[J]. Insect Science, 2020, 27(3): 500-509. DOI:10.1111/1744-7917.12669 |




