2020年起,我国施行饲料端禁抗[1],养殖必须遵循科学、绿色的饲养原则,开发抗生素替代物是大势所趋。已有研究证明益生菌是常规抗生素饲料添加剂的替代品,在反刍动物饲料中添加益生菌可提高胃肠道免疫功能[2-3],且同源益生菌更有利于宿主健康[4]。弯曲乳杆菌(Lactobacillus curvatus,L. curvatus)是益生菌的一种,可产生细菌素,在食物发酵工业广泛应用[5]。Jo等[6]从泡菜中分离了一株弯曲乳杆菌WiKim38,可调节免疫反应,诱导树突状细胞中抗炎细胞因子白细胞介素-10的产生,并且减轻小鼠肠道炎症性疾病;Zommiti等[7]研究发现,鸡源弯曲乳杆菌DN317可增加Caco-2细胞对白细胞介素-8和β-防御素2的分泌;此外,Jeung等[8]报道,口服弯曲乳杆菌HY7601可缓解小鼠饮食诱导的肥胖。目前国内未见弯曲乳杆菌的相关报道,且有关羊源益生菌的研究也鲜见报道。因此,本研究拟从绵羊粪便中分离出具有益生特性、口服安全且无致病性的益生菌,为未来在绵羊养殖业中的应用打下基础,以推进绵羊绿色养殖。
1 材料与方法 1.1 试验材料 1.1.1 试验动物粪便样品来源于新疆农业大学动物医学学院教学用成年雄性新疆细毛羊,饲养于新疆农业大学动物医学学院试验动物房,饲粮为精饲料和苜蓿,自由饮水,试验羊经兽医健康认定无抗生素使用史。雄性昆明种小鼠[4周龄,无特定病原体(SPF)级,体质量(20±2) g]共44只,购自新疆医科大学实验动物中心,自由采食和饮水。
1.1.2 试验试剂及供试菌MRS固体及液体培养基、CaCO3、牛胆盐、伊红和苏木素染色液为北京索莱宝科技有限公司,LB培养基、HBI乳酸菌生化鉴定条为青岛海博生物技术有限公司产品,细菌药敏纸片(批号:20172400206)为杭州滨和微生物试剂有限公司产品,4%多聚甲醛、中性树胶为Biosharp品牌,石蜡为上海懿洋仪器有限公司产品,小鼠血清谷丙转氨酶、尿素氮、总蛋白检测试剂盒为武汉伊莱瑞特生物科技有限公司产品,大肠杆菌、金黄色葡萄球菌、沙门氏菌菌株为新疆农业大学动物医学学院临床兽医学实验室保存菌株。
1.2 试验方法 1.2.1 样品采集无菌收集绵羊新鲜粪便共计13份样品。
1.2.2 乳酸菌初分离无菌称取绵羊粪便样品1 g,用9 mL灭菌生理盐水悬匀,取200 μL上清液接种于MRS液体培养基中,37 ℃下恒温培育12 h,梯度稀释,取10-4、10-5和10-6稀释度的菌液于MRS琼脂平板上涂布,于37 ℃恒温培养箱中培养36~48 h,用接种环挑取单菌落增菌,后进行划线纯化,革兰氏染色法观察乳酸菌形态,60%甘油与菌液按1 ∶ 1保菌,-20 ℃冻存。
1.2.3 分离菌的益生菌潜力筛选 1.2.3.1 耐酸性将磷酸盐缓冲液(PBS)的pH分别调为3.0、4.0、5.0、6.0、7.4备用。将冻存的乳酸菌分离株活化后,取菌液1 mL,6 000 r/min离心3 min后弃去上清,再分别加入1 mL预调的不同pH的PBS重悬,37 ℃摇床处理2 h。吸取处理后的菌液200 μL接种到5 mL MRS液体培养基中,于37 ℃摇床培养16 h,培养结束后,吸取200 μL到96孔板中,在酶标仪上测其在600 nm处的吸光度(OD600)值[9-10],样品测量一式三份,重复3次。
1.2.3.2 耐胆盐用蒸馏水配制胆盐浓度分别为0、0.1%、0.3%、0.5%、1.0%的溶液。挑选耐酸的乳酸菌分离株,取1 mL菌液离心弃上清,用1 mL配制好的不同浓度的胆盐溶液重悬,37 ℃摇床处理2 h,后续处理和检测方法同1.2.3.1。
1.2.3.3 药敏试验挑选耐酸、胆盐活性优异且稳定的分离菌,活化增菌后,采用纸片法进行药敏试验,共选用14种抗生素(青霉素G、头孢噻肟、氨苄西林、链霉素、卡那霉素、庆大霉素、四环素、环丙沙星、磺胺异恶唑、诺氟沙星、恩诺沙星、万古霉素、克林霉素、红霉素),试验结果根据欧盟药敏试验标准(2016)判定。
1.2.3.4 溶血活性分离菌活化增菌后在血平板上涂布或划线,观察菌落周围是否有溶血性环。
1.2.3.5 抗菌活性测定将病原菌(大肠杆菌、金黄色葡萄球菌和沙门氏菌)涂布于LB琼脂平板,牛津杯放置于LB琼脂平板上,杯中加入200 μL(108 CFU/mL)分离菌液体培养物,培养12 h后测定抑菌圈的直径。
1.2.4 分离菌的鉴定 1.2.4.1 生化鉴定用HBI乳酸菌生化鉴定条进行生化反应鉴定,鉴定结果与《伯杰氏系统细菌手册》对比后归类。
1.2.4.2 16S rRNA基因序列分析水煮法提取分离菌基因组总DNA,PCR扩增的引物信息见表 1,经过琼脂糖凝胶电泳检验PCR产物质量后送至生工生物工程(上海)股份有限公司测序分析,测序结果上传于NCBI网站进行序列比对,分析其种属。
|
|
表 1 引物序列 Table 1 Primer sequences |
按照1%接种量培养菌株,每隔2 h取菌液,检测OD600值和培养液pH。
1.2.6 分离菌安全性评价 1.2.6.1 灌胃20只小鼠适应环境7 d后随机分为2组,Ⅰ组(对照组)灌胃PBS(0.2 mL),Ⅱ组(试验组)灌胃108 CFU/mL弯曲乳杆菌Y15(0.2 mL),持续10 d[4, 11-12]。小鼠自由采食和饮水(不含抗生素)。每天灌胃前记录小鼠的体重和采食量变化,观察小鼠毛色、整体精神状态及分泌物、排泄物状况。饲喂结束后,摘除眼球采集抗凝血和全血,进行血液学参数(血细胞常规和血清生化指标)分析;将小鼠处死后取肝脏、脾脏、肾脏称重,计算脏器指数[脏器指数(%)=100×脏器质量(g)/体质量(g)];采集结肠组织放入4%多聚甲醛中固定,制作石蜡切片,然后用苏木精-伊红(HE)染色,并在显微镜下观察,随机选10个视野,记录杯状细胞数量[13]。
1.2.6.2 腹腔注射24只小鼠适应环境7 d后随机分为2组,Ⅲ组(对照组)腹腔注射生理盐水(0.2 mL),Ⅳ组(试验组)腹腔注射109 CFU/mL弯曲乳杆菌Y15(0.2 mL),小鼠自由采食和饮水(不含抗生素),观察7 d,记录体重以及临床状态变化。结束后将小鼠处死,解剖观察各组织器官是否存在病理变化[12]。
1.2.7 数据处理数据用SPSS 20.0进行t检验,GraphPad Prism 9作图,结果表示为平均值±标准差,P < 0.05表示差异显著。
2 结果 2.1 乳酸菌初分离共挑取在MRS固体培养基上呈乳白色,微凸起,表面光滑的单菌落55个(编号Y1~55,Y为“羊”字拼音的首字母缩写,数字为挑菌顺序)。进一步划线纯化(图 1-A),革兰氏染色后其中有5株为呈革兰氏阳性的长杆状(图 1-B)。将杆菌进一步纯化后于-20 ℃保存。
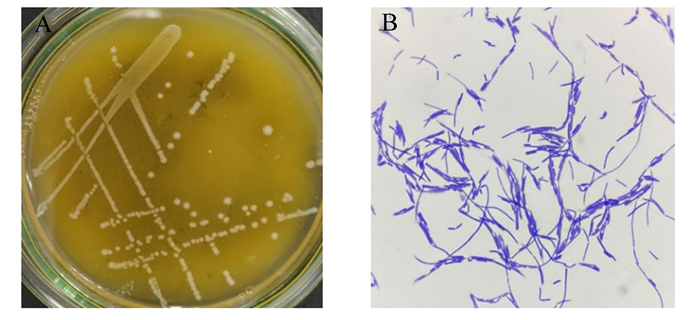
|
A:MRS 琼脂平板划线;B:革兰氏染色(100×)。 A: MRS agar plate streak; B: Gram stain (100×)。 图 1 分离菌Y15形态 Fig. 1 Morphology of isolated bacteria Y15 |
由表 2可知,受试分离菌都能够在预设的不同pH下存活,包括在pH为3时,OD600值均在1.00左右,选择对酸性耐受力相对更好的分离菌Y1、Y15、Y18用于进一步筛选试验。
|
|
表 2 分离菌经不同pH处理后存活的OD600值 Table 2 Survival OD600 values of isolated bacteria treated with different pH |
由表 3可知,分离菌株Y1、Y15、Y18耐受胆盐能力均较强。
|
|
表 3 分离菌经不同胆盐浓度处理后存活的OD600值 Table 3 Survival OD600 values of isolated bacteria treated with different bile salt concentrations |
药敏试验结果见图 2及表 4。分离菌Y1、Y15、Y18之间具有相似的抗生素耐药性和敏感性,耐受链霉素、卡那霉素、庆大霉素、环丙沙星、磺胺异恶唑、诺氟沙星、恩诺沙星、万古霉素,对青霉素G、头孢噻肟、氨苄西林和克林霉素敏感。
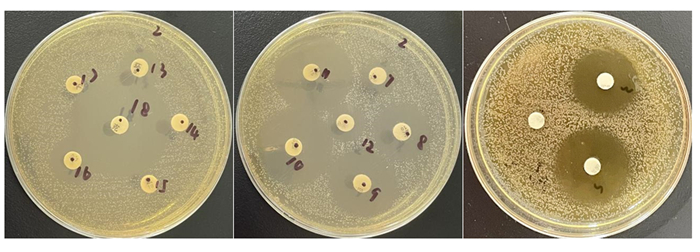
|
图 2 分离菌部分药敏试验 Fig. 2 Partial susceptibility testing of isolated bacteria |
|
|
表 4 分离菌药敏试验结果 Table 4 Drug susceptibility test results of isolated bacteria |
由图 3可知,分离菌Y1、Y15、Y18均无溶血活性。
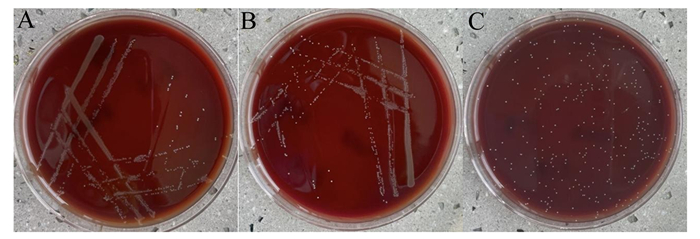
|
A: Y1;B: Y15;C: Y18。 图 3 分离菌在血琼脂平板上形态 Fig. 3 Morphology of isolate bacteria on blood agar plates |
由表 5可知,3株分离菌Y1、Y15、Y18对金黄色葡萄球菌均有一定的抑制效果,其中分离菌Y15抑制效果最佳;此外,分离菌Y15对大肠杆菌的抑制效果最佳,3株分离菌对沙门氏菌均无明显的抑制效果。
|
|
表 5 分离菌抑菌试验结果 Table 5 Bacteriostatic test results of isolated bacteria |
分离菌Y15生化结果中七叶苷、纤维二糖、麦芽糖、水杨苷、菊糖、乳糖和核糖试验为阳性,甘露醇、山梨醇、蔗糖、棉子糖和1%马尿酸钠试验为阴性,初步确定分离菌Y15为乳杆菌属的弯曲乳杆菌。
2.3.2 16S rRNA基因序列分析分离菌Y15总DNA的PCR扩增产物片段大小约为1 500 bp(图 4),测序结果制作进化树(图 5),分离菌Y15与NCBI上已发布的弯曲乳杆菌基因组序列同源性极高,因此确定该分离菌为弯曲乳杆菌,将其命名为弯曲乳杆菌Y15。
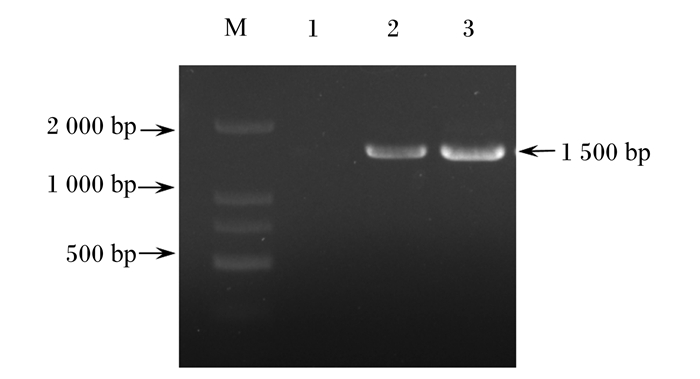
|
M:DNA分子量标准DL2000;1:阴性对照;2:阳性对照;3:Y15。 M: DNA Maker DL2000; 1: negative control; 2: positive control; 3: Y15. 图 4 分离菌Y15 16S rRNA基因扩增鉴定结果 Fig. 4 Results of 16S rRNA gene amplification and identification of isolated bacterium Y15 |

|
图 5 分离菌Y15和乳酸杆菌属关系进化树 Fig. 5 Evolutionary tree of relationship between isolate bacterium Y15 and Lactobacillus |
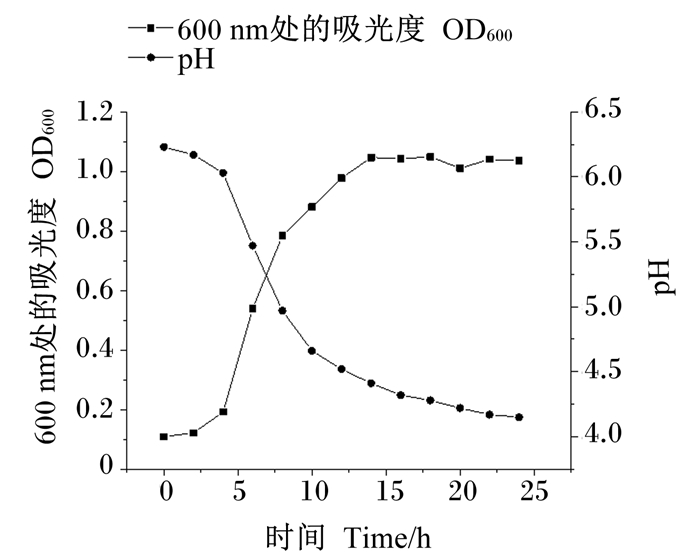
弯曲乳杆菌Y15在0~3 h为生长迟缓期,4 h开始进入对数期,直到16 h达到稳定期,后保持到24 h,自开始生长培养液pH逐渐降低,4 h开始pH迅速下降直到16 h,到24 h趋于平稳(图 6)。
|
图 6 弯曲乳杆菌Y15生长和产酸曲线 Fig. 6 Growth and acid production curves of Lactobacillus curvatus Y15 |
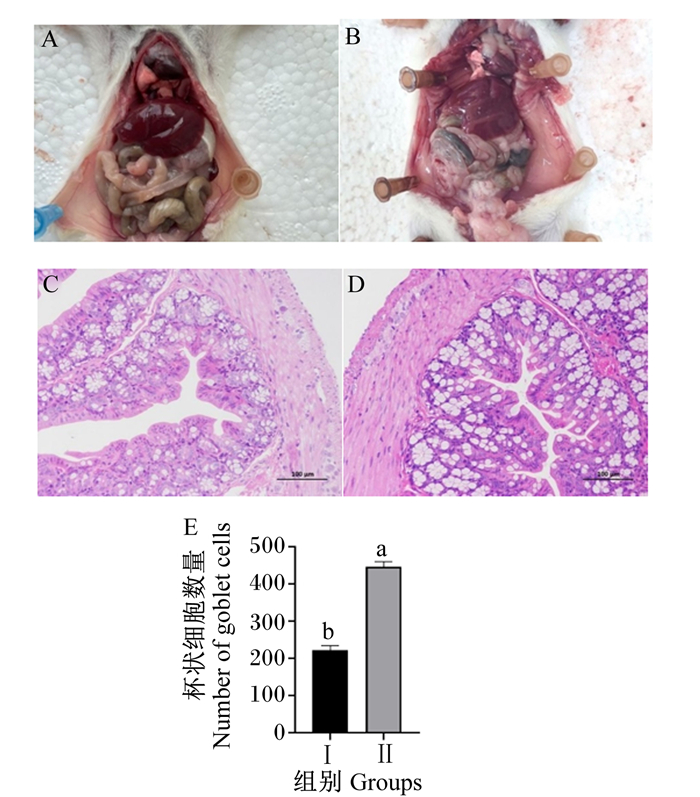
灌胃弯曲乳杆菌Y15过程中,2组小鼠毛色、精神状态和粪便均正常,口、鼻、耳及肛门处无异常分泌物。如图 7所示,剖检观察时,小鼠腹腔内主要器官均无明显肉眼可见病变,2组之间无明显眼观差异;在显微镜下观察,2组小鼠结肠组织结构完整,未观察到明显病理变化,Ⅱ组结肠组织中杯状细胞数量显著增加(P < 0.05)。
|
A:Ⅰ组剖检;B:Ⅱ组剖检;C:Ⅰ组结肠切片(200×);D:Ⅱ组结肠切片(200×);E:杯状细胞数量。 图E中数据柱形标注不同小写字母表示差异显著(P < 0.05)。 A: autopsy of group I; B: autopsy of group Ⅱ; C: colon section of group I (200×); D: colon section of group Ⅱ (200×); E: number of goblet cells. In the figure E, value columns with different small letters mean significant difference (P < 0.05). 图 7 小鼠剖检及结肠切片 Fig. 7 Autopsy and colon section of mice |
从表 6可以看出,2组小鼠的体重、平均日增重、体重增长率及平均日采食量无显著差异(P>0.05)。
|
|
表 6 灌胃弯曲乳杆菌Y15对小鼠生长性能的影响 Table 6 Effects of gavage of Lactobacillus curvatus Y15 on growth performance of mice |
从表 7可以看出,与Ⅰ组比较,灌胃弯曲乳杆菌Y15的小鼠肝脏指数明显减少(P < 0.05),对脾和肾脏指数均无显著影响(P>0.05)。
|
|
表 7 灌胃弯曲乳杆菌Y15对小鼠脏器指数的影响 Table 7 Effects of gavage of Lactobacillus curvatus Y15 on organ indexes of mice |
从表 8可以看出,2组小鼠血常规指标、血清谷丙转氨酶活性和尿素氮含量均无显著差异(P>0.05)。与Ⅰ组相比,灌胃弯曲乳杆菌Y15显著增加了小鼠血清总蛋白含量(P < 0.05)。
|
|
表 8 灌胃弯曲乳杆菌Y15对小鼠血液学参数的影响 Table 8 Effects of gavage of Lactobacillus curvatus Y15 on hematological parameters of mice |
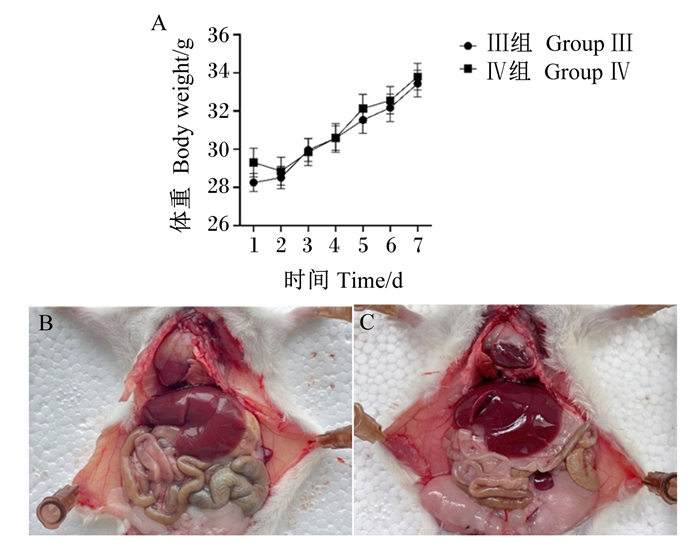
如图 8所示,腹腔注射后的7 d内观察期间Ⅲ组和Ⅳ组小鼠的体重均无显著差异(P>0.05),未见异常症状和死亡,小鼠剖检腹腔内脏器无明显眼观病理变化。
|
A:小鼠体重;B:Ⅲ组剖检;C:Ⅳ组剖检。 图A中数据点标注不同小写字母表示差异显著(P < 0.05),无字母标注表示差异不显著(P>0.05)。 A: body weight of mice; B: autopsy of group Ⅲ; C: autopsy of group Ⅳ. In the figure A, value points with different small letter mean significant difference (P < 0.05), while with no letter mean no significant difference (P>0.05). 图 8 小鼠的体重及剖检 Fig. 8 Body weight and autopsy of mice |
益生特性筛选是评估益生菌生物活性的主要方法,潜在的益生菌须具有的特性:耐酸性、胆盐耐受性、无获得性耐药、有对潜在致病菌的抗菌活性和无溶血活性[14]。据报道,从奶酪中分离的弯曲乳杆菌A61不耐酸,在pH=6.0的环境中即生长较慢[15],但本试验中分离出的弯曲乳杆菌Y15当pH从6.0下降到3.0时,菌株仍然能够保持其生长活力,说明此分离菌具有优异的耐酸性。Jo等[6]从泡菜中分离的弯曲乳杆菌DN317可在1%的胆汁中保持活性[6],本试验获得的羊源弯曲乳杆菌Y15能在胆盐浓度0.1%增加到1.0%过程中存活,对胆盐具有高耐受性,与上述试验结果一致。综合其良好的耐酸、耐胆盐的能力,本试验获得的羊源弯曲乳杆菌Y15具有可制备成口服制剂的潜力。
抗生素耐药性是评估菌株安全性的重要指标,弯曲乳杆菌DN317对氨苄西林、克林霉素和红霉素敏感[6],与本试验结果一致。Gevers等[16]研究发现,弯曲乳杆菌对四环素有耐药性,但本次分离的弯曲乳杆菌Y15对四环素表现敏感,说明其安全性高。溶血活性是判断益生菌安全性的重要标准,益生菌菌株应缺乏溶血活性[17]。本次从绵羊粪便中分离出的弯曲乳杆菌Y15不具有溶血活性,这与Jung等[17]的试验结果一致。
益生菌能够产生抗菌物质,刺激机体的免疫反应,发挥免疫调节和抗炎活性[18]。弯曲乳杆菌可产生细菌素,表现出广谱的抑菌活性[19]。Castilho等[20]发现,弯曲乳杆菌对李斯特菌具有很高的抑菌活性。本研究中,弯曲乳杆菌Y15在体外能够抑制金黄色葡萄球菌和大肠杆菌生长。
3.2 弯曲乳杆菌Y15的生长特性测定微生物生长和代谢产物生成曲线有助于选择最佳生长条件以及了解微生物的生长特性[21]。研究表明,乳酸菌37 ℃培养时,6~16 h为对数期[22],且生长过程中2~16 h能快速产酸,培养液pH可低至4[23],对数期的菌株活力较好,通常选取该时期的菌用于益生菌制剂的制备[24]。弯曲乳杆菌Y15作为一种乳酸菌,本试验结果显示其在37 ℃培养时,4 h即可进入对数期且持续时间长,生长特性与前人的研究基本一致,表明其具有用于开发益生菌制剂的潜力。
3.3 弯曲乳杆菌Y15的安全性潜在的益生菌投入使用前,需证明其食用安全性和非致病性[25]。Han等[26]通过急性和亚慢性毒性试验证明弯曲乳杆菌WiKim 38对SD大鼠无毒性作用。Choi等[27]研究了弯曲乳杆菌发酵奶对大鼠模型中牙周疾病和肠道健康的影响,Park等[28]发现弯曲乳杆菌可降低大鼠高胆固醇血症,但国内外文献少见其小鼠体内安全性评价。在其他益生菌的安全性研究中,Lazarenko等[29]给小鼠连续7 d灌胃干酪乳杆菌IMV B-728,结果显示,该菌株无毒性,并能促进肠道健康微生物群的建立,是一种安全的益生菌;王楠等[11]通过7 d的口服急性毒性试验证明了人源益生性链球菌的安全性。本试验给小鼠持续灌胃10 d羊源弯曲乳杆菌Y15,发现其对小鼠生长和饮食、循环血细胞的功能均无不良影响。有研究显示,结肠部位杯状细胞能够产生黏蛋白,对肠黏膜具有重要的保护作用,且利于粪便的排出[13]。弯曲乳杆菌Y15显著增加了结肠组织中杯状细胞的数量,说明其可增强肠道黏膜屏障功能。相对于对照组,灌胃弯曲乳杆菌Y15的小鼠肝脏指数显著降低,为4.70%,国内对SPF级昆明小鼠脏器质量的测定结果显示肝脏指数在4%~5%[30],本试验结果在此范围内,表明弯曲乳杆菌Y15未对小鼠脏器产生不良影响。此外,血清生化指标结果显示试验组的血清总蛋白含量比对照组高,但文献显示该值在正常范围内[31],其升高的原因可能是由于弯曲乳杆菌Y15诱导了免疫系统的活跃。腹腔注射是评估细菌对动物致病性的常用方法[32]。潘艳等[12]给小鼠腹腔注射109 CFU的微生态菌悬液以探究其致病性。本试验中,腹腔注射弯曲乳杆菌Y15后,7 d观察期间,小鼠的生理状态均正常,无发病和死亡,解剖后小鼠体内脏器均无异常,说明弯曲乳杆菌Y15无致病性。
4 结论羊源弯曲乳杆菌Y15具有良好的耐酸、耐胆盐特性,且在体外抑菌试验中显示出抑制金黄色葡萄球菌和大肠杆菌生长的效果,对多种常见抗生素敏感,无溶血活性,具有良好的安全性,可显著增加小鼠结肠组织中杯状细胞的数量,具有良好的益生特性。
| [1] |
侯金旺, 连丽娜, 孙寒雪, 等. 包被丁酸钠对黄羽肉鸡生长性能、屠宰性能、肉品质及血清抗氧化指标的影响[J/OL]. 动物营养学报: 1-10. http://kns.cnki.net/kcms/detail/11.5461.S.20220519.1434.076.html. HOU J W, LIAN L N, SUN H X, et al. Effects of coated sodium butyrate on growth performance, slaughter performance, meat quality and serum antioxidant indices of yellow-feathered broilers[J/OL]. Chinese Journal of Animal Nutrition: 1-10. http://kns.cnki.net/kcms/detail/11.5461.S.20220519.1434.076.html. (in Chinese) |
| [2] |
RAABIS S, LI W L, CERSOSIMO L. Effects and immune responses of probiotic treatment in ruminants[J]. Veterinary Immunology and Immunopathology, 2019, 208: 58-66. DOI:10.1016/j.vetimm.2018.12.006 |
| [3] |
ABD EL-TAWAB M M, YOUSSEF I M I, BAKR H A, et al. Role of probiotics in nutrition and health of small ruminants[J]. Polish Journal of Veterinary Sciences, 2016, 19(4): 893-906. DOI:10.1515/pjvs-2016-0114 |
| [4] |
何江波, 姚志芳, 吴国芳, 等. 羊瘤胃源乳酸菌的分离鉴定及其生物学特性分析[J]. 动物营养学报, 2021, 33(6): 3365-3379. HE J B, YAO Z F, WU G F, et al. Isolation and identification of lactic acid bacteria from sheep rumen and analysis of their biological characteristics[J]. Chinese Journal of Animal Nutrition, 2021, 33(6): 3365-3379 (in Chinese). DOI:10.3969/j.issn.1006-267x.2021.06.038 |
| [5] |
JANBEN D, EISENBACH L, EHRMANN M A, et al. Assertiveness of Lactobacillus sakei and Lactobacillus curvatus in a fermented sausage model[J]. International Journal of Food Microbiology, 2018, 285: 188-197. DOI:10.1016/j.ijfoodmicro.2018.04.030 |
| [6] |
JO S G, NOH E J, LEE J Y, et al. Lactobacillus curvatus WiKim38 isolated from kimchi induces IL-10 production in dendritic cells and alleviates DSS-induced colitis in mice[J]. Journal of Microbiology, 2016, 54(7): 503-509. DOI:10.1007/s12275-016-6160-2 |
| [7] |
ZOMMITI M, CONNIL N, HAMIDA J B, et al. Probiotic characteristics of Lactobacillus curvatus DN317, a strain isolated from chicken ceca[J]. Probiotics and Antimicrobial Proteins, 2017, 9(4): 415-424. DOI:10.1007/s12602-017-9301-y |
| [8] |
JEUNG W H, NAM W, KIM H J, et al. Oral administration of Lactobacillus curvatus HY7601 and Lactobacillus plantarum KY1032 with Cinnamomi ramulus extract reduces diet-induced obesity and modulates gut microbiota[J]. Preventive Nutrition and Food Science, 2019, 24(2): 136-143. DOI:10.3746/pnf.2019.24.2.136 |
| [9] |
程王琨, 李梅荣, 罗兰, 等. 圈养非人灵长类乳酸杆菌的分离筛选和功能鉴定[J]. 畜牧与兽医, 2018, 50(12): 37-41. CHENG W K, LI M R, LUO L, et al. Isolation, screening and functional identification of Lactobacillus from captive non-human primates[J]. Animal Husbandry & Veterinary Medicine, 2018, 50(12): 37-41 (in Chinese). |
| [10] |
田其真, 唐晨晨, 沈丹晴, 等. 3株犬源乳酸杆菌的分离鉴定与益生特性研究[J]. 河南农业科学, 2020, 49(8): 149-155. TIAN Q Z, TANG C C, SHEN D Q, et al. Isolation, identification and prebiotic characteristics of three strains of Lactobacillus from pastoral dogs[J]. Journal of Henan Agricultural Sciences, 2020, 49(8): 149-155 (in Chinese). |
| [11] |
王楠, 田晗, 张文晓, 等. 两株具有潜在益生作用的人源链球菌的安全性评价[J]. 食品与发酵工业, 2021, 47(5): 12-16. WANG N, TIAN H, ZHANG W X, et al. Safety evaluation of two strains of human Streptococcus with potential probiotics[J]. Food and Fermentation Industries, 2021, 47(5): 12-16 (in Chinese). |
| [12] |
潘艳, 贺会利, 李军, 等. 广西地区部分猪场自制微生态制剂安全性试验[J]. 黑龙江畜牧兽医, 2019(6): 47-50. PAN Y, HE H L, LI J, et al. Safety test of homemade microecological preparations in some pig farms in Guangxi[J]. Heilongjiang Animal Science and Veterinary Medicine, 2019(6): 47-50 (in Chinese). |
| [13] |
周金星, 钱兆全, 靳二辉, 等. 黄淮白山羊肠道黏膜组织结构及杯状细胞分布特点[J]. 浙江农业学报, 2018, 30(6): 946-952. ZHOU J X, QIAN Z Q, JIN E H, et al. Mucous membrane organization structure characteristics and goblet cells distribution observation of Huanghuai white goat's intestinal tract[J]. Acta Agriculturae Zhejiangensis, 2018, 30(6): 946-952 (in Chinese). DOI:10.3969/j.issn.1004-1524.2018.06.09 |
| [14] |
徐雅芫. 猪源益生菌筛选及其益生作用机理的研究[D]. 博士学位论文. 合肥: 安徽农业大学, 2017. XU Y Y. Research on screening and functional mechanism of the porcine probiotic[D]. Ph. D. Thesis. Hefei: Anhui Agricultural University, 2017. (in Chinese) |
| [15] |
AHMADOVA A, TODOROV S D, HADJI-SFAXI I, et al. Antimicrobial and antifungal activities of Lactobacillus curvatus strain isolated from homemade Azerbaijani cheese[J]. Anaerobe, 2013, 20: 42-49. DOI:10.1016/j.anaerobe.2013.01.003 |
| [16] |
GEVERS D, HUYS G, DEVLIEGHERE F, et al. Isolation and identification of tetracycline resistant lactic acid bacteria from pre-packed sliced meat products[J]. Systematic and Applied Microbiology, 2000, 23(2): 279-284. DOI:10.1016/S0723-2020(00)80015-6 |
| [17] |
JUNG J I, KIM Y G, KANG C H, et al. Effects of Lactobacillus curvatus MG5246 on inflammatory markers in Porphyromonas gingivalis lipopolysaccharide-sensitized human gingival fibroblasts and periodontitis rat model[J]. Food Science and Biotechnology, 2022, 31(1): 111-120. DOI:10.1007/s10068-021-01009-4 |
| [18] |
MANDAL S M, PATI B R, CHAKRABORTY R, et al. New insights into the bioactivity of peptides from probiotics[J]. Frontiers in Bioscience(Elite Edition), 2016, 8(3): 450-459. |
| [19] |
GHALFI H, ALLAOUI A, DESTAIN J, et al. Bacteriocin activity by Lactobacillus curvatus CWBI-B28 to inactivate Listeria monocytogenes in cold-smoked salmon during 4 degrees C storage[J]. Journal of Food Protection, 2006, 69(5): 1066-1071. DOI:10.4315/0362-028X-69.5.1066 |
| [20] |
CASTILHO N P A, COLOMBO M, DE OLIVEIRA L L, et al. Lactobacillus curvatus UFV-NPAC1 and other lactic acid bacteria isolated from calabresa, a fermented meat product, present high bacteriocinogenic activity against Listeria monocytogenes[J]. BMC Microbiology, 2019, 19(1): 63. DOI:10.1186/s12866-019-1436-4 |
| [21] |
STEVENSON K, MCVEY A F, CLARK I B N, et al. General calibration of microbial growth in microplate readers[J]. Scientific Reports, 2016, 6(1): 38828. DOI:10.1038/srep38828 |
| [22] |
王明艳. 犬源植物乳杆菌、枯草芽孢杆菌的分离鉴定及其对犬腹泻的防治效果初探[D]. 硕士学位论文. 北京: 中国农业科学院, 2020. WANG M Y. Isolation, identification of canine-derived Lactobacillus plantarum and Bacillus subtilis and preliminary exploration of the prevention effects on canine diarrhea[D]. Master's Thesis. Beijing: Chinese Academy of Agricultural Sciences, 2020. (in Chinese) |
| [23] |
韦庆旭, 张建鹏, 梁煜晨, 等. 青贮用乳酸菌的分离鉴定及生物学特性评价[J/OL]. 动物营养学报: 1-13. http://kns.cnki.net/kcms/detail/11.5461.S.20220317.1338.102.html. WEI Q X, ZHANG J P, LIANG Y C, et al. Isolation, identification and biological characteristics evaluation of lactic acid bacteria for silage[J/OL]. Chinese Journal of Animal Nutrition: 1-13. http://kns.cnki.net/kcms/detail/11.5461.S.20220317.1338.102.html. (in Chinese) |
| [24] |
苏馨. 嗜酸乳杆菌的体外筛选及优良菌株的高密度发酵研究[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2021. SU X. Screening of Lactobacillus acidophilus in vitro and study on high density fermentation of excellent strain[D]. Master's Thesis. Hohhot: Inner Mongolia Agricultural University, 2021. (in Chinese) |
| [25] |
SENOK A C, ISMAEEL A Y, BOTTA G A. Probiotics: facts and myths[J]. Clinical Microbiology and Infection, 2005, 11(12): 958-966. |
| [26] |
HAN J S, BACK S M, CHO J W, et al. Genotoxicity and subchronic general toxicity assessments of Lactobacillus curvatus WiKim 38 using Sprague-Dawley rats[J]. Food and Chemical Toxicology, 2021, 152: 112199. |
| [27] |
CHOI Y, PARK E, KIM S, et al. Fermented milk with Lactobacillus curvatus SMFM2016-NK alleviates periodontal and gut inflammation, and alters oral and gut microbiota[J]. Journal of Dairy Science, 2021, 104(5): 5197-5207. |
| [28] |
PARK M Y, KIM J, KIM S, et al. Lactobacillus curvatus KFP419 and Leuconostoc mesenteroides subsp. mesenteroides KDK411 isolated from kimchi ameliorate hypercholesterolemia in rats[J]. Journal of Medicinal Food, 2018, 21(7): 647-653. |
| [29] |
LAZARENKO L M, BABENKO L P, GICHKA S G, et al. Assessment of the safety of Lactobacillus casei IMV B-7280 probiotic strain on a mouse model[J]. Probiotics and Antimicrobial Proteins, 2021, 13(6): 1644-1657. |
| [30] |
詹纯列, 肖育华, 许达, 等. 无特异病原KM小鼠脏器重量脏器系数的测定与比较[J]. 畜牧兽医科技信息, 2010(11): 31-32. ZHAN C L, XIAO Y H, XU D, et al. Determination and comparison of organ weight organ coefficients in KM mice without specific pathogens[J]. Chinese Journal of Animal Husbandry and Veterinary Medicine, 2010(11): 31-32 (in Chinese). |
| [31] |
田辉, 樊柏林, 刘瑶, 等. SPF级Wistar大鼠血液学及血生化指标正常值范围探讨[J]. 实验动物科学, 2007, 24(2): 1-4. TIAN H, FAN B L, LIU Y, et al. An approach to normal range of blood routine and biochemical indexes of SPF Wistar rats[J]. Laboratory Animal Science, 2007, 24(2): 1-4 (in Chinese). |
| [32] |
杜秀嫒, 曲志强, 王文青, 等. 三种李氏杆菌的SigmaB基因分析及动物致病性试验[J]. 动物医学进展, 2019, 40(3): 14-19. DU X A, QU Z Q, WANG W Q, et al. Sigma B gene analysis and animal pathogenic test of three species of listeria[J]. Progress in Veterinary Medicine, 2019, 40(3): 14-19 (in Chinese). |




