2. 吉林农业大学动物科技学院, 长春 133118;
3. 山东宠之优品宠物食品有限公司, 潍坊 262218
2. College of Animal Science and Technology, Jilin Agricultural University, Changchun 133118, China;
3. Shandong Chongzhiyoupin Pet Food Co., Ltd., Weifang 262218, China
作为欧亚灰狼和野猫的后代,犬和猫都是人工驯化较早的动物之一[1-2]。大约从一万年前开始驯化,如今已经选择出多种适合人类饲养的犬、猫品种,并在全球范围内繁衍至数亿只。随着犬、猫角色由“看家护院”到“情感陪伴”的转变,其社会角色也转变成伴侣动物或家庭成员,越来越多的宠物主愿意为宠物的健康和改善宠物福利付出更多的时间和金钱。犬、猫已经从自己猎食和简单的喂养转变成追求科学化、精细化、健康化的饲粮模式,犬、猫的食品研发已经向营养均衡和保证动物健康的方向发展[3]。
哺乳动物胃肠道(gastrointestinal tract,GIT)中居住着生物圈中最复杂和最多样化的微生物群落之一,即肠道菌群,其中含有1010~1014个微生物,主要由细菌、真菌、原生动物和病毒等组成[4-6]。肠道菌群具有调节肠道内分泌、促进宿主消化食物、清除内毒素和为宿主提供营养物质等功能[7]。犬、猫肠道中也含有大量的微生物菌群,即犬、猫肠道菌群,与其他哺乳动物的肠道菌群发挥着相同的作用[8]。研究发现,犬、猫肠道菌群在新陈代谢、免疫和神经行为等多种生命过程中发挥重要的功能,包括降解不可消化的碳水化合物、产生短链脂肪酸(short chain fatty acid,SCFAs)等代谢产物,能够为结肠细胞提供能量,在维持肠道上皮屏障的完整性中起关键作用[7, 9]。
动物福利通常是指动物处于康乐的状态,在此状态下,动物健康快乐,物质条件能满足基本需求。近年来,不断有宠物食品被爆出存在安全问题,如三聚氰胺污染、霉菌毒素污染、维生素B1缺乏和维生素D中毒等,这不仅危害了动物的健康,也不符合动物福利的要求,同时也导致宠物主对一些宠物食品产生了质疑。但这些也使得人们逐渐意识到饲粮对犬、猫健康和福利的重要性[10]。犬、猫肠道菌群通过发酵将未被肠道消化酶消化的食糜中的营养物质分解,来调控自身生长和繁殖,菌群的代谢产物也会对宿主的一些生理功能产生重要影响,进一步维持犬、猫健康肠道稳态[11]。也就是说,为犬、猫提供能够维持健康肠道稳态的饲粮,是保证动物健康的关键因素之一,这也符合动物福利的要求。
尽管犬、猫肠道菌群发挥着多种重要的生理功能,但与已取得重大科学进展的人类肠道菌群研究相比,对犬、猫肠道菌群的了解还是不深入、不全面的。本文概述了犬、猫肠道菌群的组成,饲粮对犬、猫肠道菌群影响的研究进展,并介绍了益生菌(probiotics)等几种功能性食品添加剂在犬、猫饲粮中应用的新成果。
1 犬、猫肠道菌群的组成犬、猫与其他哺乳动物相同,沿着消化道从胃到结肠菌群的丰度和多样性逐渐增加[12]。厌氧菌主要分布在肠道远端(回肠),而在肠道近端(空肠)好氧菌和厌氧菌分布较为均匀[13]。厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)和放线菌门(Actinobacteria)是犬、猫肠道中的优势菌群,但丰度存在较大的个体差异性。在一项研究中,使用基于16S rRNA基因扩增子的Sanger测序技术在6只健康猎犬的结肠中鉴定出4种主要的系统发育谱系:厚壁菌门(47.7%)、变形菌门(23.3%)、梭杆菌门(Fusobacteria,16.6%)和拟杆菌门(12.4%)[14]。
1.1 厚壁菌门厚壁菌门包含多种微生物。其中,梭状芽孢杆菌属(Clostridium)是犬、猫肠道中厚壁菌门的优势菌属,以Ⅳ簇[例如瘤胃球菌科(Ruminococcaceae)、普拉梭菌(Faecalibacterium prausnitzii)]、ⅩⅠ簇[例如消化链球菌科(Peptostreptococcaceae)]和ⅩⅣ簇[例如布劳特氏菌属(Blautia)]为主[7, 15-16]。Ⅳ簇和ⅩⅣa簇包含了许多产生SCFAs的菌群[(例如毛螺菌属(Lachnospira)、瘤胃球菌属(Ruminococcus)、粪杆菌属(Faecalibacterium)]。SCFAs作为部分肠道微生物的代谢产物,在动物肠道中主要参与营养物质的吸收和代谢,参与调控细胞增殖、分化和细胞凋亡等重要的生理调控过程,在维持宿主肠道健康方面发挥着重要作用。
厚壁菌门中的乳杆菌属(Lactobacillus)在犬、猫肠道中分布也极其广泛,数量通常在104~108 CFU/mL。据报道,发酵乳杆菌(L. fermentum)、鼠李糖乳杆菌(L. rhamnosus)和唾液乳杆菌(L. salivarius)是健康犬肠道菌群的重要组成部分[17]。在猫肠道中发现的乳杆菌属主要是嗜酸乳杆菌(L. acidophilus)、唾液乳杆菌(L. salivarius)、约翰逊乳杆菌(L. johnsonii)、罗伊氏乳杆菌(L. reuteri)和清酒乳杆菌(L. sakei),这与人类肠道菌群的研究结果[18]相似。
1.2 拟杆菌门拟杆菌门中的拟杆菌属(Bacteroides)和普雷沃氏菌属(Prevotella)是犬、猫肠道中的优势菌[19-22]。研究发现,普雷沃氏菌属和拟杆菌属的丰度受个体差异性的影响变化较大[16]。值得注意的是,普雷沃氏菌属的丰度与梭杆菌属(Fusobacterium)的丰度呈负相关,这表明它们可能占据相同的生态位[17]。
1.3 梭杆菌门梭杆菌门中的梭杆菌属是犬、猫肠道中的优势菌,相对于犬而言,在猫的肠道内丰度较低[19-23]。在人类肠道菌群研究中,梭杆菌属被认为与炎症性肠病的发生具有相关性。梭杆菌属中的核梭杆菌(Fusobacterium nucleatum)被认为与人类结、直肠癌发生有关,具有潜在致癌性[24-26]。然而,在犬、猫中尚未报道过这种负面影响。研究发现,在健康犬、猫的肠道菌群中梭杆菌属丰度较高,在其他食肉动物肠道菌群中也比较常见,这可能和宿主的饲粮喜好相关[19-22, 26]。
1.4 变形菌门和放线菌门变形菌门和放线菌门也是犬、猫肠道的优势菌群[27-28]。变形菌门中,萨特氏菌属(Sutterella)、琥珀酸弧菌属(Succinivibrio)、厌氧螺菌属(Anaerobiospirillum)和大肠埃氏菌属-志贺氏菌属(Escherichia-Shigella)是优势菌属[27]。大肠埃氏菌属-志贺氏菌属和沙门氏菌属(Salmonella)都属于肠杆菌科(Enterobacteriaceae),一般被认为是胃肠道疾病的病原菌之一[28]。红蝽菌科(Coriobacteriaceae)是放线菌门的优势菌科,柯林斯菌属(Collinsella)和斯莱克氏菌属(Slackia)是犬放线菌门的优势菌属,迟缓埃格特菌属(Eggerthella)和欧陆森氏菌属(Olsenella)是猫放线菌门的优势菌属[29]。
研究发现,不同肠道区域内的微生物菌群丰度存在着差异。犬、猫十二指肠中的微生物数量通常为102~105 CFU/g。然而,也有报道发现在健康的犬、猫十二指肠中的微生物数量可达到109 CFU/g[28-29]。而结肠中微生物数量在109~1011 CFU/g。梭状芽孢杆菌属在十二指肠中占主导地位,梭杆菌属和拟杆菌属在结肠中丰度比较高[17-18, 30]。犬、猫肠道主要优势菌群见表 1。
随着科技手段不断的进步,动物肠道菌群多样性的研究更加深入,但是它们之间的相互作用对宿主的影响以及在引起疾病中的作用还尚未明确。由于从犬、猫胃肠道不同部位收集样品难度较高且不符合动物福利的要求,大多数研究集中在犬、猫粪便菌群上。Scanlan等[32]通过荧光原位杂交分析了健康的人类和犬的粪便DNA,结果显示,其中约98%是细菌,真菌和古细菌合计占比少于2%。Swanson等[33]使用454焦磷酸测序法对犬的粪便进行分析,结果发现约98%是细菌,古细菌占比约1%。
Johnston等[34]研究发现,与人类和犬相比,猫的小肠中含有更多的细菌,并且专性厌氧菌占比较高。Minamoto等[35]详细地总结了猫的肠道菌群组成和功能。越来越多的研究表明,之前研究认为“微生物群发育是动物出生时才开始的”这种说法是值得商榷的。Rautava等[36]和Jiménez等[37]研究发现,人类和小鼠在子宫内肠道菌群就已经开始定植。虽然在犬、猫上还没有分娩前微生物定植的相关研究,但是不能排除这种可能性,因为犬、猫都是哺乳动物,并且与人类有着相似的生理和解剖模式。现有的猫科动物肠道菌群的研究主要集中在短毛猫品种上,今后还需要更详细地研究其他品种猫的肠道菌群组成和功能,来补充和完善猫的肠道菌群数据库[38]。
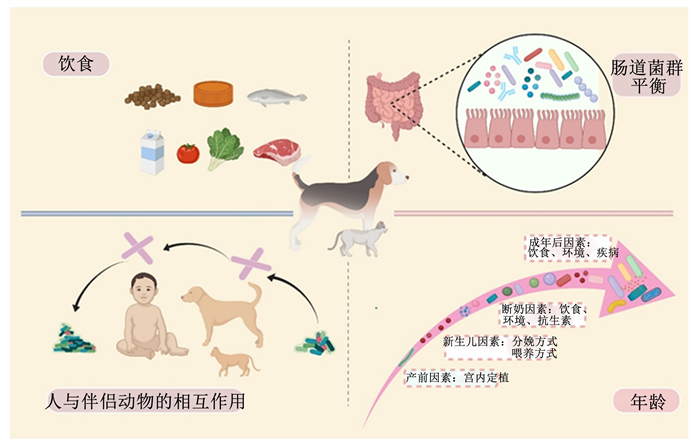
尽管优势菌普遍存在于健康的犬、猫肠道中,但是受到一些因素的影响还是会发生丰度的变化(图 1)。
|
图 1 影响犬、猫肠道菌群的主要因素 Fig. 1 Major factors affecting gut microbiota in dogs and cats[9] |
尽管犬分类学上属于食肉目,但目前还是认为犬偏向于杂食性。除了添加肉类,犬的饲粮中一般还含有谷物、水果和蔬菜等原料,都能被动物较好的消化和利用。
Bresciani等[39]研究发现,饲喂健康犬相近营养水平的植物蛋白质膨化饲粮和传统膨化饲粮(动植物混合蛋白质饲粮),犬的肠道菌群组成并没有发生显著变化,说明保证饲粮提供满足犬需要的蛋白质前提下,蛋白质来源对犬肠道菌群组成的影响并不大,但还需要进行更多的试验来消除个体差异。Hang等[40]评估了高碳水化合物饲粮、高蛋白质饲粮和商品饲粮对5只雄性比格犬粪便菌群的影响,采集比格犬新鲜粪便进行鸟嘌呤-胞嘧啶含量特异性分析和16S rRNA基因扩增,结果显示,采食商品饲粮的比格犬粪便中梭状芽孢杆菌属、乳杆菌属、球孢杆菌属(Bacillus globigii)和拟杆菌属的丰度高于其他饲粮;高碳水化合物饲粮提高了犬粪便中丹毒丝菌目(Erysipelotrichales)的丰度,高蛋白质饲粮提高了犬粪便中梭杆菌属的丰度。Mori等[41]评估了减肥饲粮、低脂饲粮、肾脏饲粮和过敏性饲粮4种不同功能饲粮对健康犬肠道菌群多样性的影响,结果发现,饲喂高蛋白质、高纤维的减肥饲粮的犬肠道菌群变化较大,其中拟杆菌属、普雷沃氏菌属和粪杆菌属的丰度显著提高;饲喂低脂饲粮的犬肠道中粪杆菌属的丰度显著提高;饲喂减肥饲粮(28.1%纤维)和低脂饲粮(8.6%纤维)的犬肠道中均含有可溶性膳食纤维和不溶性膳食纤维,因此这2种饲粮中粪杆菌属丰度的提高可能与饲粮中纤维含量及纤维类型的不同有关。
Kerr等[42]探究饲粮中添加25%煮熟白芸豆对健康成年犬粪便菌群的影响,饲喂4周后,收集犬的新鲜粪便进行16S rRNA测序分析,结果显示,饲喂煮熟白芸豆组犬的粪便菌群与对照组无显著差异,说明煮熟白芸豆可作为犬饲粮的原料来提供蛋白质和纤维;饲粮干预4周后的犬与试验开始前犬的微生物菌群组成存在着显著差异,饲粮干预后犬的厚壁菌门的丰度显著提高,放线菌门和梭杆菌门的丰度显著降低。
近年来,超重和肥胖已逐渐成为宠物犬中的“流行病”。能量摄入与消耗之间的不平衡是引起犬肥胖的主要原因之一。还需要更深入的研究来分析不同营养成分对犬肠道菌群的影响,进而通过饲粮干预来调节犬的肠道菌群和体重,来改善犬的健康和福利。
2.2 饲粮组成对猫肠道菌群的影响传统的商业猫粮通常分为2类:干粮或湿粮[43]。Bermingham等[44]采用交叉分组随机饲喂16只成年猫干粮或湿粮,饲喂5周,结果显示,饲喂湿粮(41.87%粗蛋白质、42.39%粗脂肪和1.62%粗纤维,干物质基础)的猫粪便中放线菌门的丰度显著降低,梭杆菌门和变形菌门的丰度显著提高;试验共检测到46个菌属,其中有30个菌属因饲粮的改变发生了显著变化;饲喂干粮(32.91%粗蛋白质、11.05%粗脂肪和1.88%粗纤维)的猫粪便中乳杆菌属、巨球型菌属(Megasphaera)和欧陆森氏菌属的丰度较高,拟杆菌属和布劳特氏菌属的丰度较低,说明改变饲粮短时间内(5周)就能引起猫肠道菌群的变化,但这种变化不能归因于任何特定的营养物质,因为试验中几种营养物质的含量并不相同。Young等[45]采用宏基因组测序探究断奶前、后饲喂颗粒饲粮(35.3%粗蛋白质、20.2%粗脂肪和1.8%粗纤维)和罐头(45.3%粗蛋白质、37.6%粗脂肪和1.5%粗纤维,干物质基础)对幼猫粪便菌群组成和功能的影响,结果表明,饲喂颗粒饲粮的幼猫粪便中乳杆菌属、双歧杆菌和柯林斯菌的丰度高于饲喂罐头的幼猫;断奶后饲粮干预影响了幼猫肠道功能基因的富集,饲喂罐头的幼猫肠道中参与维生素生物合成、代谢和运输的相关基因组显著富集,尤其是维生素K和B族维生素,表明断奶后饲粮干预可以影响机体维生素的生物合成功能。这说明通过调节饲粮来调控猫肠道菌群的丰度和功能可能是改善犬、猫健康的重要途径之一。值得注意的是,相较于犬,猫对微生物合成的B族维生素(如硫铵素和烟酸)需求更高,因此断奶后的饲粮干预对幼猫来说更加重要。
Hooda等[46]选择14只雄性短毛幼猫来探究蛋白质与碳水化合物比例对断奶幼猫肠道菌群的影响,结果显示,饲喂中等水平蛋白质、中等水平碳水化合物饲粮(34.34%粗蛋白质和6.88%总膳食纤维)的幼猫放线菌门的丰度提高,梭杆菌门的丰度降低;在属水平上,小杆菌属(Dialister)、氨基酸球菌属(Acidaminococcus)、双歧杆菌属(Bifidobacterium)、巨球型菌属和光岗菌属(Mitsuokella)的丰度显著提高;饲喂高水平蛋白质、低水平碳水化合物饲粮(52.88%粗蛋白质和2.01%膳食纤维)的幼猫粪杆菌属、瘤胃球菌属、布劳特氏菌属和真杆菌属(Eubacterium)的丰度显著提高。Vester等[47]研究了中等蛋白质水平饲粮和高蛋白质水平饲粮对断奶幼猫肠道菌群的影响,结果表明,饲喂中等蛋白质水平饲粮的幼猫与饲喂高蛋白质水平饲粮的幼猫相比,乳酸杆菌、双歧杆菌和大肠杆菌(Escherichia coli)的丰度较低;幼猫的肠道菌群在断奶后会发生变化,并且饲粮中蛋白质含量会影响幼猫肠道菌群中大肠杆菌、双歧杆菌和乳酸杆菌的丰度。Lubbs等[48]选择8只短毛猫来探究不同蛋白质水平饲粮对成年猫肠道菌群的影响,试验开始时先饲喂4周基础饲粮(37.57%粗蛋白质),再分为2组分别饲喂中等蛋白质水平饲粮(34.34%粗蛋白质)和高蛋白质水平饲粮(53.88%粗蛋白质)8周,结果表明,饲喂中等蛋白质水平饲粮的猫肠道中双歧杆菌的丰度显著提高;饲喂高蛋白质水平饲粮的猫肠道中产气荚膜梭菌(Clostridium perfringens)的丰度显著提高,但双歧杆菌的丰度显著降低。产气荚膜梭菌是猫科动物胃肠道病原微生物之一,虽然试验中饲喂高蛋白质水平饲粮的猫肠道中产气荚膜梭菌的丰度显著提高,但试验过程中并未观察到猫的健康状态受到影响。与大多数梭菌属物种相反,双歧杆菌是一种对宿主健康有益的微生物,因为它们产生的代谢物可以抑制有害微生物的生长,试验中饲喂高蛋白质水平饲粮的猫肠道中双歧杆菌的丰度显著降低,被认为是由于饲喂高蛋白质水平饲粮的猫肠道微生物由分解碳水化合物向分解蛋白质转变,导致了肠道中双歧杆菌的丰度发生改变。
以上研究表明,短期改变饲粮就可以影响猫肠道菌群的组成和功能,这可能会影响到猫对饲粮中营养物质的消化吸收,进而影响到宿主和肠道菌群之间的相互作用,也说明了通过饲粮调节肠道菌群的组成可能是改善猫健康与福利的重要途径之一。
2.3 生肉饲粮对犬、猫肠道菌群的影响生肉饲粮是指以生肉为基础的饲粮,原料主要包括家畜、家禽或鱼类的内脏和骨骼等,以及未经高温消毒的牛奶和生鸡蛋[49]。尽管研究人员致力于开发营养全面且适口性好的犬、猫饲粮,以保证犬、猫能摄入安全且营养物质丰富的饲粮,但以饲喂生肉饲粮为主的喂养方式在犬、猫饲粮中变得越来越流行[50]。也有研究发现,生肉饲粮能改善犬、猫的健康,包括清新口气、提高免疫力、缓解关节炎,并起到美毛和健齿的作用[49]。
Kim等[51]研究发现,与饲喂商品饲粮的犬相比,饲喂生肉饲粮的犬肠道微生物组成更多样化,但也发现饲喂生肉饲粮的犬患感染疾病的风险更高。Schmidt等[52]研究发现,与饲喂商品饲粮的犬相比,饲喂生肉饲粮的犬肠道中乳杆菌目(Lactobacillales)、肠杆菌属、梭杆菌属和梭状芽孢杆菌属的丰度更高;饲喂商品饲粮的犬肠道中梭菌科(Clostridiaceae)、韦荣球菌科(Erysipelotrichaceae)、微菌科和毛螺菌科(Lachnospiraceae)的丰度更高;2组犬的肠道菌群α多样性无显著差异,但β多样性之间显著差异,这可能是因为2种饲粮的营养组成不同,与全价商品饲粮相比,生肉饲粮中粗蛋白质和粗脂肪的含量较高,碳水化合物和粗纤维的含量较低。
Butowski等[53]选择12只家猫探究不同饲粮对猫肠道菌群的影响,随机分组分别饲喂生肉饲粮,生肉+纤维饲粮和粗磨饲粮,结果表明,有31种肠道微生物受饲粮的干预丰度发生了显著变化;普雷沃氏菌属是饲喂粗磨饲粮家猫肠道中的优势菌群,梭状芽孢杆菌属和梭杆菌属是饲喂生肉饲粮家猫肠道中的优势菌群,未分类的消化链球菌科(unclassified Peptostreptococcaceae)和普雷沃氏菌属是饲喂生肉+纤维饲粮家猫肠道中的优势菌群;与饲喂生肉饲粮相比,饲喂生肉+纤维饲粮的家猫肠道中双歧杆菌和乳酸杆菌的丰度较高。Kerr等[54]给家猫饲喂膨化饲粮(38.9%粗蛋白质)和生肉饲粮(71.4%粗蛋白质),结果显示饲喂生肉饲粮的家猫肠道中消化球菌属(Peptococcus)、假丁酸弧菌属(Pseudobutyrivibrio)和毛螺菌属的丰度更高;饲喂膨化饲粮的家猫肠道中粪杆菌属和琥珀酸弧菌属的丰度更高;饲喂膨化饲粮的猫肠道中检测到乳酸杆菌和双歧杆菌,但饲喂生肉饲粮的猫肠道中未检出这2种菌。根据上述这2项研究,猜想高蛋白质饲粮可能会降低猫肠道中双歧杆菌和乳酸杆菌的丰度,但还需要更多的试验来验证。
Sandri等[55]将8只健康斗牛犬随机分成2组,分别饲喂膨化饲粮和生肉饲粮,饲喂2周后将2组饲粮互换,再饲喂2周,分别收集第0天、第14天和第28天犬的粪便进行测序分析,结果显示,与饲喂膨化饲粮相比,饲喂生肉饲粮的犬门水平上放线菌门、梭杆菌门和变形菌门的丰度显著提高;科水平上乳杆菌科(Lactobacillaceae)的丰度显著降低,梭菌科、梭杆菌科(Fusobacteriaceae)和拟杆菌科(Bacteroidaceae)的丰度显著提高。Alessandri等[20]给51个品种共169只犬饲喂商品饲粮和生肉饲粮,结果显示,拟杆菌门、梭杆菌门、厚壁菌门、变形菌门和放线菌门是犬肠道菌群的优势菌门,包含43个共有菌属,其中梭杆菌属的丰度最高;有14个菌属受饲粮干预丰度发生了改变;饲喂商品饲粮的犬肠道中普雷沃菌属、粪杆菌属和萨特氏菌属的丰度提高;饲喂生肉饲粮的犬肠道中梭杆菌门和放线菌门的丰度提高,拟杆菌门的丰度降低,且与氨基酸和脂肪酸/脂质降解途径相关的基因组富集更丰富。Algya等[56]将8只成年雌性比格犬随机分成2组,分别饲喂生肉饲粮和膨化颗粒饲粮,结果显示,饲粮干预会影响比格犬粪便微生物的多样性,与饲喂膨化颗粒饲粮相比,饲喂生肉饲粮的犬肠道微生物α多样性降低,放线菌门和厚壁菌门的丰度显著降低,拟杆菌门、梭杆菌门和变形菌门的丰度显著提高。
有些研究发现,饲喂生肉饲粮不仅不能保证摄入均衡的营养物质,而且增加了人畜共患病和病原微生物感染的风险,包括弯曲杆菌属(Campylobacter)、沙门氏菌属、耶尔森氏菌属(Yersinia)和致病大肠杆菌(pathogenic Escherichia coli),这可能会威胁到宠物同伴及宠物主的健康[50-51]。因此,给宠物饲喂生肉一定要保证新鲜、干净、无病原微生物污染,同时还要注意补充蔬果等富含膳食纤维和维生素的食物,以保证宠物营养摄入均衡。
3 功能性食品对犬、猫肠道菌群的影响随着犬、猫数量的增多,宠物食品的种类也越来越丰富多样。除主粮外,还有一些功能性宠物食品可供宠物主为宠物选择。添加这些功能性成分的主要目的是提高有益肠道微生物的丰度,主要包括益生菌、益生元(prebiotics)、合生元(synbiotics)和后生元(postbiotics)等。
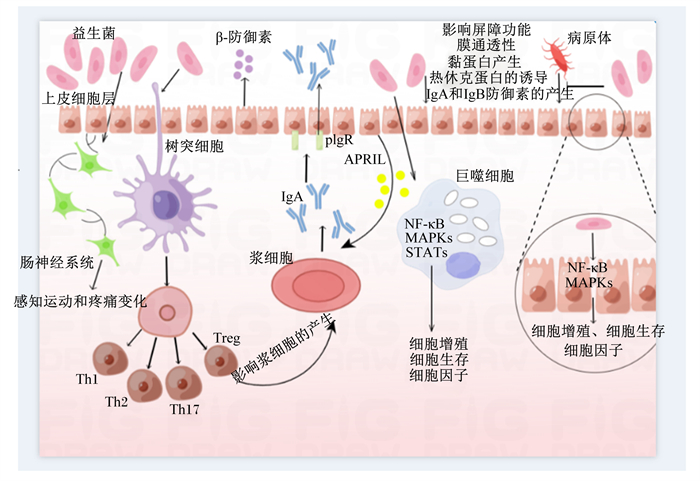
3.1 益生菌益生菌被定义为“食用足够数量时,对宿主健康产生有益作用的活体微生物”[57]。益生菌通过直接或间接抑制或激活关键信号通路,参与机体的代谢调节,具有增强肠上皮细胞功能、减少应激反应、调节细胞因子分泌、影响T淋巴细胞群和促进抗体分泌等生理功能[58]。益生菌已经被证明具有治疗疾病的潜力(图 2)。
Strompfová等[59]探究在饲粮中添加犬源益生菌——乳酸杆菌CCM7421对健康犬和患胃肠道疾病犬的影响,结果显示,添加益生菌可提高犬肠道中乳杆菌属的丰度,降低梭状芽孢杆菌属的丰度,并减少了腹泻的发生率。White等[60]探究混合益生菌对患炎性肠病犬肠道菌群的影响,34只患病犬被随机饲喂混合益生菌或泼尼松(激素类),饲喂8周,结果显示,饲喂混合益生菌或泼尼松都改变了犬的肠道微生物丰度,饲喂泼尼松的犬双歧杆菌的丰度显著提高,饲喂益生菌的犬乳酸杆菌的丰度显著提高,钙黏蛋白-E、闭锁蛋白和连蛋白表达显著上调,这表明饲喂益生菌可能有利于患有炎性肠病犬维持肠道稳态。Marshall-Jones等[61]探究饲喂嗜酸乳杆菌DSM1324对健康成年猫肠道菌群的影响,试验持续5周,结果显示,饲喂益生菌的猫肠道中乳杆菌属的丰度提高,梭状芽孢杆菌属和粪肠球菌属的丰度降低;饲喂益生菌降低了猫粪便pH和血浆内毒素含量,说明嗜酸乳杆菌DSM13241具有改善猫肠道健康的潜力。
|
Treg:调节性T细胞regulatory T cell;IgA:免疫球蛋白A immunoglobulin A;IgB:免疫球蛋白B immunoglobulin B;APRIL:增殖诱导配体a proliferation-inducing ligand;plgR:多聚免疫球蛋白受体recombinant polymeric immunoglobulin receptor;NF-κB:核因子-κB nuclear factor-κB;MAPKs:丝裂原活化蛋白激酶mitogen-activated protein kinases;STATs:信号传导及转录激活蛋白signal transducer and activator of transcriptions;Th:辅助性T淋巴细胞T-helper lymphocyte。 图 2 益生菌的作用机制 Fig. 2 Mechanism of action of probiotics[58] |
有研究指出,使用来自宿主物种肠道的益生菌才是最理想的选择[31, 62]。然而,对于目前市场上绝大多数犬、猫的益生菌产品来说,情况并非如此,并且没有将来自犬或猫肠道的益生菌功效与市场上销售的来自其他物种的益生菌进行比较研究。我们还需要进行更多的试验来探究如何选择和使用益生菌才能对犬、猫的健康能产生最佳效果[31, 63]。
3.2 益生元益生元被定义为“能被宿主肠道微生物选择性利用,影响宿主肠道菌群的组成和/或活动,对机体健康产生有益作用的物质”,比较常见的有:果寡糖(fructooligosaccharide,FOS)、甘露寡糖(mannan oligosaccharide,MOS)、半乳低聚糖(galacto-oligosaccharides,GOS)和菊粉等[64-65]。
Zentek等[66]在成年犬饲粮中添加来自菊粉的非消化性低聚糖(non digestible oligosaccharides,NDOs),结果显示,补充NDOs组犬粪便pH降低,粪便评分更高,双歧杆菌的丰度提高,产气荚膜梭菌(Clostridium perfringens)的丰度降低。Middelbos等[67]给健康的成年犬分别饲喂低纤维饲粮和补充膳食纤维(7.5%甜菜浆)饲粮,结果显示,添加甜菜浆会降低犬肠道中梭杆菌门的丰度,提高厚壁菌门的丰度,说明饲粮中添加少量的膳食纤维可以影响犬肠道菌群的组成。Beloshapka等[68]将菊粉或酵母细胞壁提取物添加到生肉饲粮中饲喂给健康成年比格犬,结果显示,添加菊粉会提高比格犬肠道中乳酸杆菌的丰度,添加酵母细胞壁提取物会提高比格犬肠道中双歧杆菌的丰度。
在猫饲粮中添加益生元也会对肠道菌群产生积极影响。在成年公猫的饲粮中添加4.0%果胶会提高产气荚膜梭菌和乳酸杆菌的丰度;在饲粮中补充添加4.0% FOS会提高双歧杆菌的丰度,降低大肠杆菌的丰度;虽然门水平上不同菌群比例发生了显著变化,但猫肠道菌群总数未出现显著变化,主要是因为优势菌群没有受到不同纤维来源的影响,无论饲粮纤维来源如何,肠道菌群在发挥功能方面都是高度保守的[69]。Barry等[70-71]研究指出,猫虽然是食肉动物,但其肠道菌群系统发育与杂食动物具有相似性,由于该研究的试验个体较少且个体间肠道菌群组成差异较大,因而还需有更多的可重复性试验来验证。
以上研究结果表明,在犬、猫饲粮中添加益生元可以维持宿主的健康肠道稳态,减少肠道菌群紊乱的发生。这说明益生元是犬、猫饲料添加剂产品中一种有应用前景的功能性添加剂。
3.3 合生元合生元的定义为:由具有活性的微生物和可被宿主微生物选择性利用的底物组成的混合物,并且对宿主的健康有益[72]。
Rose等[73]研究发现,将屎肠球菌(Enterococcus faecium)NCIMB104154b1707、FOS和阿拉伯树胶制成合生元添加到犬的饲粮中,可以降低犬的饲养成本,减少犬腹泻的发生率,改善动物健康。Tanprasertsuk等[74]募集了3个月内没有被饲喂过益生元、益生菌和抗生素的犬51只,随机分成2组,对照组饲喂安慰剂,试验组饲喂2 g/d合生元,合生元由菊粉和罗伊氏乳杆菌(犬源)、乳酸片球菌(犬源)、屎肠球菌(犬源)、嗜酸乳杆菌、双歧杆菌、发酵乳杆菌和鼠李糖乳杆菌共7种混合益生菌组成,试验持续4周,结果显示,饲喂合生元的犬肠道中乳酸杆菌的丰度显著提高,大肠杆菌的丰度显著降低,β多样性发生显著变化,同时降低了犬腹泻的发生率;在停止饲喂合生元2周后,肠道菌群β多样性回到最初水平,合生元中的7种益生菌有6种丰度也恢复到最初水平,但嗜酸乳杆菌的丰度仍处于优势,说明嗜酸乳杆菌相对于其他菌种可在犬肠道中定植更久。
Garcia-Mazcorro等[75]研究指出,将屎肠球菌NCIMB30183和植物乳杆菌(L. plantarum)NCIMB30187等7种益生菌、低聚果糖和阿拉伯半乳聚糖混合制成合成元,饲喂给健康的犬、猫(各12只),试验持续3周,结果显示,在饲喂合生元期间有10只犬和11只猫粪便中检测到了合生元中含有的益生菌,同时肠球菌属(Enterococcus)和链球菌属(Streptococcus)的丰度显著提高,但微生物门水平丰度无显著变化,这表明虽然添加合生元的犬、猫微生物门水平丰度无显著变化,但是补充合生元可以使健康犬、猫粪便中益生菌的丰度提高。Biagi等[76]探究将假小链双歧杆菌(B. pseudocatenulatum)和GOS制成合生元饲喂给健康的猫,结果显示,饲喂合生元的猫双歧杆菌的丰度显著提高,对宿主肠道健康产生了积极影响。
不可否认,添加益生元、益生菌和合生元能改变犬、猫的肠道菌群组成,但研究中使用的方法还存在一些局限性。其一,大多数试验动物都是健康的动物,而不是用易受肠道菌群紊乱影响的新生、老年或患病动物为试验动物,健康动物的肠道菌群相对稳定,这种在健康动物上的研究是否同样适用于易感动物,还需要进一步的试验探究。其二,不同研究中使用的益生菌来源、菌株种类和含量皆有很大的差异,这使得难以对不同研究的结果进行对比分析。因此,还需要更多的试验对易感犬、猫进行临床导向的宏基因组研究,以进一步揭开几种功能性添加剂对犬、猫肠道菌群变化的影响。
3.4 后生元Di Gioia等[77]研究表明,益生菌的活力并不是其发挥作用的唯一因素。Martín等[78]和Taverniti等[79]提出了“灭活或无活力的益生菌及其代谢产物均能为宿主的健康提供益处”的观点。由此提出了一个新概念——后生元。
后生元是指“对宿主有益的无生命微生物和/或其成分的制剂”,主要包括磷壁酸、SCFAs、有机酸、肽和维生素等[80-81]。后生元具有促进宿主消化代谢、调节肠道菌群平衡、保护肠道黏膜屏障、提高免疫力和调控肠-脑轴等生理功能[82]。因为其保质期长、安全性高、稳定性好、能发挥益生菌活菌相似甚至更优的作用,而被医学和食品等领域推广使用,已经成为调节肠道菌群的新研究热点之一。
Grzes′kowiak等[83-84]研究发现,将3种犬源益生菌以活菌或灭活后饲喂给犬,发现灭活的益生菌也具有保护肠道黏膜屏障的作用,表明其也具有益生的潜力。Kanasugi等[85]在给健康犬饲喂灭活的粪肠球菌FK-23后,发现灭活后的粪肠球菌可以通过刺激体内非特异性免疫应答来提高宿主免疫力。
关于后生元对犬、猫肠道菌群影响的研究还比较少。未来还需要结合转录组、蛋白组和代谢组等研究方法来探究后生元-宿主-肠道菌群的相关信号通路和潜在机制,为后生元作为功能性食品添加剂在犬、猫领域推广使用提供理论基础。同时要解决后生元规模化生产的工艺流程及相关技术,来保证其能有效地发挥作用。
4 小结关于饲粮和功能性食品添加剂对犬、猫肠道菌群影响的研究大多数都是短期的试验,很少有中长期的研究,也缺少对个体差异性的研究,这些局限性为未来的研究指明了研究方向。随着微生物测序技术和宏基因组技术的发展,还需要组合多种技术来获得更详细、准确的信息,来探究饲粮-宿主-肠道菌群之间是如何相互作用的,尤其是肠道菌群的代谢产物和功能性食品添加剂是如何影响宿主肠道菌群,又是如何进一步影响宿主健康的。探究并了解这些新知识可以帮助我们更好地理解肠道菌群-宿主-营养代谢-疾病等之间的关联,并为通过饲粮调节宿主健康提供新的可能性,也为保证犬、猫健康,预防和治疗常见疾病提供更多的理论依据和新方法。同时,犬、猫也是研究饮食-人类-肠道菌群相互作用和机制的模型,相关研究也可以辅助我们了解肠道菌群对人类健康的影响。
| [1] |
SYKES N, BEIRNE P, HOROWITZ A, et al. Humanity's best friend: a dog-centric approach to addressing global challenges[J]. Animals, 2020, 10(3): 502. DOI:10.3390/ani10030502 |
| [2] |
HU Y W, HU S M, WANG W L, et al. Earliest evidence for commensal processes of cat domestication[J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(1): 116-120. DOI:10.1073/pnas.1311439110 |
| [3] |
CLEMENS R. The humanization of pet food[J]. Food Technology, 2014, 68(8): 20. |
| [4] |
MONDO E, MARLIANI G, ACCORSI P A, et al. Role of gut microbiota in dog and cat's health and diseases[J]. Open Veterinary Journal, 2019, 9(3): 253-258. DOI:10.4314/ovj.v9i3.10 |
| [5] |
FRANK D N, ST AMAND A L, FELDMAN R A, et al. Molecular-phylogenetic characterization of microbial community imbalances in human inflammatory bowel diseases[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(34): 13780-13785. DOI:10.1073/pnas.0706625104 |
| [6] |
SUCHODOLSKI J S, DOWD S E, WESTERMARCK E, et al. The effect of the macrolide antibiotic tylosin on microbial diversity in the canine small intestine as demonstrated by massive parallel 16S rRNA gene sequencing[J]. BMC Microbiology, 2009, 9: 210. DOI:10.1186/1471-2180-9-210 |
| [7] |
HANDL S, DOWD S E, GARCIA-MAZCORRO J F, et al. Massive parallel 16S rRNA gene pyrosequencing reveals highly diverse fecal bacterial and fungal communities in healthy dogs and cats[J]. FEMS Microbiology Ecology, 2011, 76(2): 301-310. DOI:10.1111/j.1574-6941.2011.01058.x |
| [8] |
FAN Y, PEDERSEN O. Gut microbiota in human metabolic health and disease[J]. Nature Reviews Microbiology, 2021, 19(1): 55-71. DOI:10.1038/s41579-020-0433-9 |
| [9] |
ALESSANDRI G, ARGENTINI C, MILANI C, et al. Catching a glimpse of the bacterial gut community of companion animals: a canine and feline perspective[J]. Microbial Biotechnology, 2020, 13(6): 1708-1732. DOI:10.1111/1751-7915.13656 |
| [10] |
WEETH L P. Focus on nutrition: home-prepared diets for dogs and cats[J]. Compendium (Yardley, PA), 2013, 35(3): E3. |
| [11] |
OH S F, PRAVEENA T, SONG H, et al. Host immunomodulatory lipids created by symbionts from dietary amino acids[J]. Nature, 2021, 600(7888): 302-307. DOI:10.1038/s41586-021-04083-0 |
| [12] |
BUDDINGTON R K. Postnatal changes in bacterial populations in the gastrointestinal tract of dogs[J]. American Journal of Veterinary Research, 2003, 64(5): 646-651. DOI:10.2460/ajvr.2003.64.646 |
| [13] |
MENTULA S, HARMOINEN J, HEIKKILÄ M, et al. Comparison between cultured small-intestinal and fecal microbiotas in beagle dogs[J]. Applied and Environmental Microbiology, 2005, 71(8): 4169-4175. DOI:10.1128/AEM.71.8.4169-4175.2005 |
| [14] |
DENG P, SWANSON K S. Gut microbiota of humans, dogs and cats: current knowledge and future opportunities and challenges[J]. The British Journal of Nutrition, 2015, 113(S1): S6-17. DOI:10.1017/S0007114514002943 |
| [15] |
VÁZQUEZ-BAEZA Y, HYDE E R, SUCHODOLSKI J S, et al. Dog and human inflammatory bowel disease rely on overlapping yet distinct dysbiosis networks[J]. Nature Microbiology, 2016, 1: 16177. DOI:10.1038/nmicrobiol.2016.177 |
| [16] |
GARCIA-MAZCORRO J F, DOWD S E, POULSEN J, et al. Abundance and short-term temporal variability of fecal microbiota in healthy dogs[J]. MicrobiologyOpen, 2012, 1(3): 340-347. DOI:10.1002/mbo3.36 |
| [17] |
BEASLEY S S, MANNINEN T J K, SARIS P E J. Lactic acid bacteria isolated from canine faeces[J]. Journal of Applied Microbiology, 2006, 101(1): 131-138. DOI:10.1111/j.1365-2672.2006.02884.x |
| [18] |
RITCHIE L E, STEINER J M, SUCHODOLSKI J S. Assessment of microbial diversity along the feline intestinal tract using 16S rRNA gene analysis[J]. FEMS Microbiology Ecology, 2008, 66(3): 590-598. DOI:10.1111/j.1574-6941.2008.00609.x |
| [19] |
ALESSANDRI G, MILANI C, MANCABELLI L, et al. The impact of human-facilitated selection on the gut microbiota of domesticated mammals[J]. FEMS Microbiology Ecology, 2019, 95(9): fiz121. DOI:10.1093/femsec/fiz121 |
| [20] |
ALESSANDRI G, MILANI C, MANCABELLI L, et al. Metagenomic dissection of the canine gut microbiota: insights into taxonomic, metabolic and nutritional features[J]. Environmental Microbiology, 2019, 21(4): 1331-1343. DOI:10.1111/1462-2920.14540 |
| [21] |
ALESSANDRI G, OSSIPRANDI M C, MACSHARRY J, et al. Bifidobacterial dialogue with its human host and consequent modulation of the immune system[J]. Frontiers in Immunology, 2019, 10: 2348. DOI:10.3389/fimmu.2019.02348 |
| [22] |
ALESSANDRI G, MILANI C, MANCABELLI L, et al. Deciphering the bifidobacterial populations within the canine and feline gut microbiota[J]. Applied and Environmental Microbiology, 2020, 86(7): e02875-19. |
| [23] |
SUCHODOLSKI J S, CAMACHO J, STEINER J M. Analysis of bacterial diversity in the canine duodenum, jejunum, ileum, and colon by comparative 16S rRNA gene analysis[J]. FEMS Microbiology Ecology, 2008, 66(3): 567-578. DOI:10.1111/j.1574-6941.2008.00521.x |
| [24] |
NG C, LI H J, WU W K K, et al. Genomics and metagenomics of colorectal cancer[J]. Journal of Gastrointestinal Oncology, 2019, 10(6): 1164-1170. DOI:10.21037/jgo.2019.06.04 |
| [25] |
GETHINGS-BEHNCKE C, COLEMAN H G, JORDAO H W T, et al. Fusobacterium nucleatum in the colorectum and its association with cancer risk and survival: a systematic review and meta-analysis[J]. Cancer Epidemiology Biomarkers & Prevention, 2020, 29(3): 539-548. |
| [26] |
LEY R E, HAMADY M, LOZUPONE C, et al. Evolution of mammals and their gut microbes[J]. Science, 2008, 320(5883): 1647-1651. DOI:10.1126/science.1155725 |
| [27] |
MOON C D, YOUNG W, MACLEAN P H, et al. Metagenomic insights into the roles of Proteobacteria in the gastrointestinal microbiomes of healthy dogs and Cats[J]. MicrobiologyOpen, 2018, 7(5): e00677. DOI:10.1002/mbo3.677 |
| [28] |
GERMAN A J, DAY M J, RUAUX C G, et al. Comparison of direct and indirect tests for small intestinal bacterial overgrowth and antibiotic-responsive diarrhea in dogs[J]. Journal of Veterinary Internal Medicine, 2003, 17(1): 33-43. DOI:10.1111/j.1939-1676.2003.tb01321.x |
| [29] |
JOHNSTON K, LAMPORT A, BATT R M. An unexpected bacterial flora in the proximal small intestine of normal cats[J]. Veterinary Record, 1993, 132(14): 362-363. DOI:10.1136/vr.132.14.362 |
| [30] |
HAND D, WALLIS C, COLYER A, et al. Pyrosequencing the canine faecal microbiota: breadth and depth of biodiversity[J]. PLoS One, 2013, 8(1): e53115. DOI:10.1371/journal.pone.0053115 |
| [31] |
GRZEŚKOWIAK Ł, ENDO A, BEASLEY S, et al. Microbiota and probiotics in canine and feline welfare[J]. Anaerobe, 2015, 34: 14-23. DOI:10.1016/j.anaerobe.2015.04.002 |
| [32] |
SCANLAN P D, MARCHESI J R. Micro-eukaryotic diversity of the human distal gut microbiota: qualitative assessment using culture-dependent and -independent analysis of faeces[J]. The ISME Journal, 2008, 2(12): 1183-1193. DOI:10.1038/ismej.2008.76 |
| [33] |
SWANSON K S, DOWD S E, SUCHODOLSKI J S, et al. Phylogenetic and gene-centric metagenomics of the canine intestinal microbiome reveals similarities with humans and mice[J]. The ISME Journal, 2011, 5(4): 639-649. DOI:10.1038/ismej.2010.162 |
| [34] |
JOHNSTON K L, SWIFT N C, FORSTER-VAN HIJFTE M, et al. Comparison of the bacterial flora of the duodenum in healthy cats and cats with signs of gastrointestinal tract disease[J]. Journal of the American Veterinary Medical Association, 2001, 218(1): 48-51. DOI:10.2460/javma.2001.218.48 |
| [35] |
MINAMOTO Y, HOODA S, SWANSON K S, et al. Feline gastrointestinal microbiota[J]. Animal Health Research Reviews, 2012, 13(1): 64-77. DOI:10.1017/S1466252312000060 |
| [36] |
RAUTAVA S, LUOTO R, SALMINEN S, et al. Microbial contact during pregnancy, intestinal colonization and human disease[J]. Nature Reviews Gastroenterology & Hepatology, 2012, 9(10): 565-576. |
| [37] |
JIMÉNEZ E, FERNÁNDEZ L, MARÍN M L, et al. Isolation of commensal bacteria from umbilical cord blood of healthy neonates born by cesarean section[J]. Current Microbiology, 2005, 51(4): 270-274. DOI:10.1007/s00284-005-0020-3 |
| [38] |
JIA J, FRANTZ N, KHOO C, et al. Investigation of the faecal microbiota associated with canine chronic diarrhoea[J]. FEMS Microbiology Ecology, 2010, 71(2): 304-312. DOI:10.1111/j.1574-6941.2009.00812.x |
| [39] |
BRESCIANI F, MINAMOTO Y, SUCHODOLSKI J S, et al. Effect of an extruded animal protein-free diet on fecal microbiota of dogs with food-responsive enteropathy[J]. Journal of Veterinary Internal Medicine, 2018, 32(6): 1903-1910. DOI:10.1111/jvim.15227 |
| [40] |
HANG I, RINTTILA T, ZENTEK J, et al. Effect of high contents of dietary animal-derived protein or carbohydrates on canine faecal microbiota[J]. BMC Veterinary Research, 2012, 8: 90. DOI:10.1186/1746-6148-8-90 |
| [41] |
MORI A, GOTO A, KIBE R, et al. Comparison of the effects of four commercially available prescription diet regimens on the fecal microbiome in healthy dogs[J]. The Journal of Veterinary Medical Science, 2019, 81(12): 1783-1790. DOI:10.1292/jvms.19-0055 |
| [42] |
KERR K R, FORSTER G, DOWD S E, et al. Effects of dietary cooked navy bean on the fecal microbiome of healthy companion dogs[J]. PLoS One, 2013, 8(9): e74998. DOI:10.1371/journal.pone.0074998 |
| [43] |
VILLAVERDE C, FASCETTI A J. Macronutrients in feline health[J]. The Veterinary Clinics of North America Small Animal Practice, 2014, 44(4): 699-717. DOI:10.1016/j.cvsm.2014.03.007 |
| [44] |
BERMINGHAM E N, YOUNG W, KITTELMANN S, et al. Dietary format alters fecal bacterial populations in the domestic cat (Felis catus)[J]. MicrobiologyOpen, 2013, 2(1): 173-181. DOI:10.1002/mbo3.60 |
| [45] |
YOUNG W, MOON C D, THOMAS D G, et al. Corrigendum: pre-and post-weaning diet alters the faecal metagenome in the cat with differences in vitamin and carbohydrate metabolism gene abundances[J]. Scientific Reports, 2017, 7: 41198. DOI:10.1038/srep41198 |
| [46] |
HOODA S, VESTER BOLER B M, KERR K R, et al. The gut microbiome of kittens is affected by dietary protein: carbohydrate ratio and associated with blood metabolite and hormone concentrations[J]. The British Journal of Nutrition, 2013, 109(9): 1637-1646. DOI:10.1017/S0007114512003479 |
| [47] |
VESTER B M, DALSING B L, MIDDELBOS I S, et al. Faecal microbial populations of growing kittens fed high-or moderate-protein diets[J]. Archives of Animal Nutrition, 2009, 63(3): 254-265. DOI:10.1080/17450390902860000 |
| [48] |
LUBBS D C, VESTER B M, FASTINGER N D, et al. Dietary protein concentration affects intestinal microbiota of adult cats: a study using DGGE and qPCR to evaluate differences in microbial populations in the feline gastrointestinal tract[J]. Journal of Animal Physiology and Animal Nutrition, 2009, 93(1): 113-121. DOI:10.1111/j.1439-0396.2007.00788.x |
| [49] |
FREEMAN L M, CHANDLER M L, HAMPER B A, et al. Current knowledge about the risks and benefits of raw meat-based diets for dogs and cats[J]. Journal of the American Veterinary Medical Association, 2013, 243(11): 1549-1558. DOI:10.2460/javma.243.11.1549 |
| [50] |
VAN BREE F P J, BOKKEN G C A M, MINEUR R, et al. Zoonotic bacteria and parasites found in raw meat-based diets for cats and dogs[J]. The Veterinary Record, 2018, 182(2): 50. DOI:10.1136/vr.104535 |
| [51] |
KIM J, AN J U, KIM W, et al. Differences in the gut microbiota of dogs (Canis lupus familiaris) fed a natural diet or a commercial feed revealed by the Illumina MiSeq platform[J]. Gut Pathogens, 2017, 9: 68. DOI:10.1186/s13099-017-0218-5 |
| [52] |
SCHMIDT M, UNTERER S, SUCHODOLSKI J S, et al. The fecal microbiome and metabolome differs between dogs fed bones and raw food (BARF) diets and dogs fed commercial diets[J]. PLoS One, 2018, 13(8): e0201279. DOI:10.1371/journal.pone.0201279 |
| [53] |
BUTOWSKI C F, THOMAS D G, YOUNG W, et al. Addition of plant dietary fibre to a raw red meat high protein, high fat diet, alters the faecal bacteriome and organic acid profiles of the domestic cat (Felis catus)[J]. PLoS One, 2019, 14(5): e0216072. DOI:10.1371/journal.pone.0216072 |
| [54] |
KERR K R, DOWD S E, SWANSON K S. Faecal microbiota of domestic cats fed raw whole chicks v.an extruded chicken-based diet[J]. Journal of Nutritional Science, 2014, 3: e22. DOI:10.1017/jns.2014.21 |
| [55] |
SANDRI M, MONEGO S D, CONTE G, et al. Raw meat based diet influences faecal microbiome and end products of fermentation in healthy dogs[J]. BMC Veterinary Research, 2017, 13(1): 65. |
| [56] |
ALGYA K M, CROSS T W L, LEUCK K N, et al. Apparent total-tract macronutrient digestibility, serum chemistry, urinalysis, and fecal characteristics, metabolites and microbiota of adult dogs fed extruded, mildly cooked, and raw diets[J]. Journal of Animal Science, 2018, 96(9): 3670-3683. DOI:10.1093/jas/sky235 |
| [57] |
Indian Council of Medical Research Task Force, Co-ordinating Unit ICMR, Co-ordinating Unit DBT. ICMR-DBT guidelines for evaluation of probiotics in food[J]. The Indian Journal of Medical Research, 2011, 134(1): 22-25. |
| [58] |
THOMAS C M, VERSALOVIC J. Probiotics-host communication: modulation of signaling pathways in the intestine[J]. Gut Microbes, 2010, 1(3): 148-163. DOI:10.4161/gmic.1.3.11712 |
| [59] |
STROMPFOVÁ V, KUBAŠOVÁ I, LAUKOVÁ A. Health benefits observed after probiotic Lactobacillus fermentum CCM 7421 application in dogs[J]. Applied Microbiology and Biotechnology, 2017, 101(16): 6309-6319. DOI:10.1007/s00253-017-8425-z |
| [60] |
WHITE R, ATHERLY T, GUARD B, et al. Randomized, controlled trial evaluating the effect of multi-strain probiotic on the mucosal microbiota in canine idiopathic inflammatory bowel disease[J]. Gut Microbes, 2017, 8(5): 451-466. DOI:10.1080/19490976.2017.1334754 |
| [61] |
MARSHALL-JONES Z V, BAILLON M L A, CROFT J M, et al. Effects of Lactobacillus acidophilus DSM13241 as a probiotic in healthy adult cats[J]. American Journal of Veterinary Research, 2006, 67(6): 1005-1012. DOI:10.2460/ajvr.67.6.1005 |
| [62] |
SUEZ J, ELINAV E. The path towards microbiome-based metabolite treatment[J]. Nature Microbiology, 2017, 2(6): 17075. DOI:10.1038/nmicrobiol.2017.75 |
| [63] |
DORON S, SNYDMAN D R. Risk and safety of probiotics[J]. Clinical Infectious Diseases, 2015, 60(Suppl.2): S129-S134. |
| [64] |
GIBSON G R, HUTKINS R, SANDERS M E, et al. Expert consensus document: the international scientific association for probiotics and prebiotics (ISAPP) consensus statement on the definition and scope of prebiotics[J]. Nature Reviews Gastroenterology & Hepatology, 2017, 14(8): 491-502. |
| [65] |
GIBSON G R, SCOTT K P, RASTALL R A, et al. Dietary prebiotics: current status and new definition[J]. Food Science & Technology Bulletin Functional Foods, 2010, 7(1): 1-19. |
| [66] |
ZENTEK J, MARQUART B, PIETRZAK T, et al. Dietary effects on bifidobacteria and Clostridium perfringens in the canine intestinal tract[J]. Journal of Animal Physiology and Animal Nutrition, 2003, 87(11/12): 397-407. |
| [67] |
MIDDELBOS I S, VESTER BOLER B M, QU A, et al. Phylogenetic characterization of fecal microbial communities of dogs fed diets with or without supplemental dietary fiber using 454 pyrosequencing[J]. PLoS One, 2010, 5(3): e9768. DOI:10.1371/journal.pone.0009768 |
| [68] |
BELOSHAPKA A N, DOWD S E, SUCHODOLSKI J S, et al. Fecal microbial communities of healthy adult dogs fed raw meat-based diets with or without inulin or yeast cell wall extracts as assessed by 454 pyrosequencing[J]. FEMS Microbiology Ecology, 2013, 84(3): 532-541. DOI:10.1111/1574-6941.12081 |
| [69] |
BARRY K A, MIDDELBOS I S, VESTER BOLER B M, et al. Effects of dietary fiber on the feline gastrointestinal metagenome[J]. Journal of Proteome Research, 2012, 11(12): 5924-5933. DOI:10.1021/pr3006809 |
| [70] |
BARRY K A, WOJCICKI B J, MIDDELBOS I S, et al. Dietary cellulose, fructooligosaccharides, and pectin modify fecal protein catabolites and microbial populations in adult cats[J]. Journal of Animal Science, 2010, 88(9): 2978-2987. DOI:10.2527/jas.2009-2464 |
| [71] |
BARRY K A, WOJCICKI B J, BAUER L L, et al. Adaptation of healthy adult cats to select dietary fibers in vivo affects gas and short-chain fatty acid production from fiber fermentation in vitro[J]. Journal of Animal Science, 2011, 89(10): 3163-3169. DOI:10.2527/jas.2010-3445 |
| [72] |
SWANSON K S, GIBSON G R, HUTKINS R, et al. The international scientific association for probiotics and prebiotics (ISAPP) consensus statement on the definition and scope of synbiotics[J]. Nature Reviews Gastroenterology & Hepatology, 2020, 17(11): 687-701. |
| [73] |
ROSE L, ROSE J, GOSLING S, et al. Efficacy of a probiotic-prebiotic supplement on incidence of diarrhea in a dog shelter: a randomized, double-blind, placebo-controlled trial[J]. Journal of Veterinary Internal Medicine, 2017, 31(2): 377-382. DOI:10.1111/jvim.14666 |
| [74] |
TANPRASERTSUK J, JHA A R, SHMALBERG J, et al. The microbiota of healthy dogs demonstrates individualized responses to synbiotic supplementation in a randomized controlled trial[J]. Animal Microbiome, 2021, 3(1): 36. DOI:10.1186/s42523-021-00098-0 |
| [75] |
GARCIA-MAZCORRO J F, LANERIE D J, DOWD S E, et al. Effect of a multi-species synbiotic formulation on fecal bacterial microbiota of healthy cats and dogs as evaluated by pyrosequencing[J]. FEMS Microbiology Ecology, 2011, 78(3): 542-554. DOI:10.1111/j.1574-6941.2011.01185.x |
| [76] |
BIAGI G, CIPOLLINI I, BONALDO A, et al. Effect of feeding a selected combination of galacto-oligosaccharides and a strain of Bifidobacterium pseudocatenulatum on the intestinal microbiota of cats[J]. American Journal of Veterinary Research, 2013, 74(1): 90-95. DOI:10.2460/ajvr.74.1.90 |
| [77] |
DI GIOIA D, BIAVATI B. Probiotics and prebiotics in animal health and food safety: conclusive remarks and future perspectives[M]. Cham: Springer International Publishing, 2018: 269-273.
|
| [78] |
MARTÍN R, LANGELLA P. Emerging health concepts in the probiotics field: streamlining the definitions[J]. Frontiers in Microbiology, 2019, 10: 1047. DOI:10.3389/fmicb.2019.01047 |
| [79] |
TAVERNITI V, GUGLIELMETTI S. The immunomodulatory properties of probiotic microorganisms beyond their viability (ghost probiotics: proposal of paraprobiotic concept)[J]. Genes & Nutrition, 2011, 6(3): 261-274. |
| [80] |
MARCO M L, SANDERS M E, GÄNZLE M, et al. The international scientific association for probiotics and prebiotics (ISAPP) consensus statement on fermented foods[J]. Nature Reviews Gastroenterology & Hepatology, 2021, 18(3): 196-208. |
| [81] |
MARCO M L, HEENEY D, BINDA S, et al. Health benefits of fermented foods: microbiota and beyond[J]. Current Opinion in Biotechnology, 2017, 44: 94-102. DOI:10.1016/j.copbio.2016.11.010 |
| [82] |
SHARMA M, SHUKLA G. Metabiotics: one step ahead of probiotics; an insight into mechanisms involved in anticancerous effect in colorectal cancer[J]. Frontiers in Microbiology, 2016, 7: 1940. |
| [83] |
GRZEŚKOWIAK Ł, COLLADO M C, BEASLEY S, et al. Pathogen exclusion properties of canine probiotics are influenced by the growth media and physical treatments simulating industrial processes[J]. Journal of Applied Microbiology, 2014, 116(5): 1308-1314. DOI:10.1111/jam.12477 |
| [84] |
GRZEŚKOWIAK Ł, ENDO A, COLLADO M C, et al. The effect of growth media and physical treatments on the adhesion properties of canine probiotics[J]. Journal of Applied Microbiology, 2013, 115(2): 539-545. DOI:10.1111/jam.12235 |
| [85] |
KANASUGI H, HASEGAWA T, GOTO Y, et al. Single administration of enterococcal preparation (FK-23) augments non-specific immune responses in healthy dogs[J]. International Journal of Immunopharmacology, 1997, 19(11/12): 655-659. |




