家禽的胴体质量是影响养禽业经济效益的主要指标之一,而腹部、皮肤和肌肉内脂肪是影响鸡胴体质量的三大决定因素。过多的脂肪沉积会降低饲料利用率、提高生产成本、降低肉品质等[1]。因此,研究鸡的脂肪生成及调控机制对提高养鸡业经济效益具有重要意义。除此以外,基因组序列比对结果表明,鸡的基因组与人类存在相似性,60%的鸡基因与人类基因高度相似[2]。因此,研究鸡的脂肪代谢与调控机制对预防人类肥胖及肥胖并发疾病也有参考意义。本文对鸡体内的脂肪生成过程及分子水平上的调控机制进行综述,以期为鸡脂肪代谢研究提供参考。
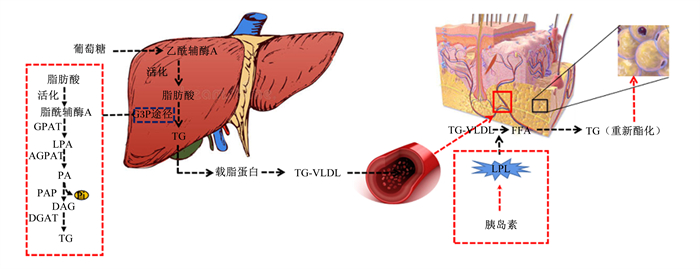
1 鸡脂肪生成过程动物机体内的脂肪生成是脂肪酸的从头合成到以甘油三酯(TG)形式在机体内沉积的过程。对大多数哺乳动物而言,脂肪组织是脂肪酸从头合成的主要场所,但家禽与哺乳动物不同,其脂质(脂肪酸、TG、胆固醇等)生成的主要场所在肝脏[3]。所以,鸡的脂肪生成过程主要包括了鸡肝脏内脂肪酸的从头合成、肝脏内TG的合成、脂蛋白的分泌和降解以及TG再合成(图 1)。
|
TG:甘油三酯triglyceride;GPAT:磷酸甘油转酰基酶glycerol-3-phosphate acvltransferase;LPA:溶血磷脂酸lysophosphatidic acid;AGPAT:酰基磷酸甘油转酰基酶1-acylglycerol-3-phosphate acyltransferase:PA:磷脂酸phosphatidic acid;PAP:磷脂酸磷酸酶phosphatidic acid phosphohydrolase;DAG:二酰基甘油diacylglycerol;DGAT:二酰基甘油酰基转移酶diacylglycerol acyltransferase;VLDL:极低密度脂蛋白very low density lipoprotein;FFA:游离脂肪酸Free fatty acid;LPL:脂蛋白脂肪酶lipoprotein lipase;G3P:甘油-3-磷酸glycerol-3-phosphate。 图 1 鸡脂肪生成过程 Fig. 1 Fat production process of chickens |
肉鸡饲粮中摄入的碳水化合物是肝脏内脂肪酸从头合成原料的主要来源[4]。摄入的碳水化合物(葡萄糖)经糖代谢途径可以转化为乙酰辅酶A,作为原料合成脂肪酸[5-6]。脂肪酸合成之后,在鸡的肝脏内主要通过甘油-3-磷酸(G3P)途径合成TG[3]。合成的TG不溶于水,其在血液运输过程中无法以游离态存在,所以需要通过与载脂蛋白结合起来,以脂蛋白的形式在血液中运转。与哺乳动物一样,在鸡肝脏细胞内从头合成的TG通过与载脂蛋白结合形成极低密度脂蛋白(VLDL)分泌到血浆[7]。鸡肝脏细胞内分泌的脂蛋白进入血浆后会流经脂肪和肌肉等组织,胰岛素可以激活毛细血管内皮细胞上的脂蛋白脂肪酶(LPL)水解VLDL中的TG,释放出脂肪酸进入组织细胞中[8]。在组织细胞中,脂肪酸与甘油-3-磷酸再次合成TG并沉积[7]。
2 鸡脂肪生成的调控及其作用机制鸡的脂肪生成与机体多种代谢活动密切相关,具有复杂的分子调控网络。大量的基因、转录因子、转录后水平调控的miRNA、一些脂肪代谢相关的激素以及体外营养因素都对鸡的脂肪生成过程具有调控作用。
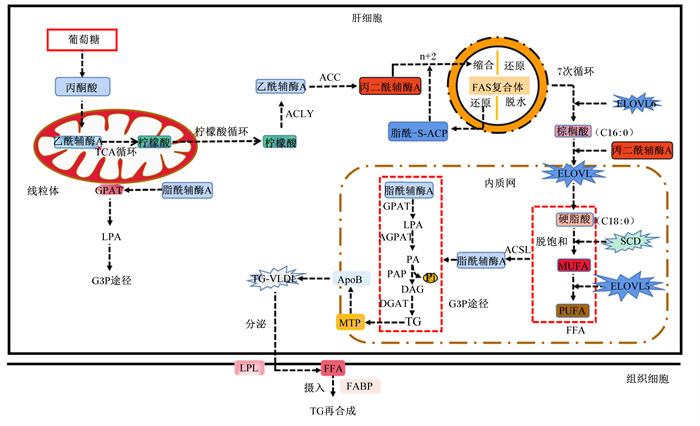
2.1 基因的调控脂肪生成的各个阶段均存在许多基因编码的酶和蛋白参与调控。编码乙酰辅酶A羧化酶(ACC,基因名ACACA)、脂肪酸合酶(FAS,基因名FASN)、硬脂酰辅酶A去饱和酶(SCD,基因名SCD)、超长链脂肪酸延伸酶6(ELOVL6,基因名ELOVL6)和柠檬酸裂解酶(ACLY,基因名ACLY)的基因在鸡的脂肪酸从头合成中发挥了重要调控作用[9-13]。鸡脂肪酸从头合成的2个最关键的调控基因是ACACA和FASN,前者编码的ACC可以催化乙酰辅酶A活化,转化为丙二酰辅酶A才能作为底物参与脂肪酸的从头合成[14];而后者编码的FAS则催化底物丙二酰辅酶A进入脂肪酸合成反应,每进行1次合成反应可以在乙酰基的基础上实现2个碳原子的延长,经7次循环后最终生成棕榈酸[15]。由于FAS对碳链长度的专一性,在鸡体内脂肪酸的合成步骤仅限于生成棕榈酸,脂肪酸碳链的延长需要超长链脂肪酸延伸酶(ELOVL)基因的参与。ELOVL基因家族共有7个成员组成,分别为ELOVL1~7。ELOVL6基因编码的ELOVL6是唯一参与脂肪酸从头合成的延伸酶[16],其为长链脂酰基延长反应的关键限速酶,可以促进C12、C14、C16脂肪酸的延长,并且负责饱和脂肪酸合成的最后一步,最后形成C16棕榈酸或C18硬脂酸。组织中对胰岛素敏感性尤其重要的C18与C16脂肪酸的比率也由其活性控制[16-17]。另外,ELOVL5在鸡体内长链不饱和脂肪酸的合成中具有重要作用,参与ω-3和ω-6多不饱和脂肪酸(PUFA)的合成,所以鸡肉也被视为ω-3PUFA中二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)的重要来源[3]。SCD基因编码的SCD也是脂肪酸合成的关键调节酶,控制着机体不饱和脂肪酸的合成。机体内产生的不饱和脂肪酸主要为棕榈油酸和油酸,两者是棕榈酸和硬脂酸在SCD作用下脱饱和而产生[11]。
脂肪酸在鸡肝脏内合成之后还需要经过脂肪酸的激活、TG的合成、脂蛋白的组装等一系列反应才能以脂蛋白形式分泌出去。在这些反应中,长链脂酰辅酶A合成酶(ACSL)基因家族、磷酸甘油转酰基酶(GPAT)基因家族、酰基磷酸甘油转酰基酶(AGPAT)基因家族、磷脂酸磷酸酶(PAP)基因家族、二酰基甘油酰基转移酶(DGAT)基因家族和微粒体甘油三酯转移蛋白(MTP)基因家族等均发挥了重要调控作用。脂肪酸在与甘油-3-磷酸合成TG之前需先进行活化,也就是脂肪酸激活,催化这一过程的是ACSL基因家族编码的ACSL。目前的研究表明,ACSL有5个成员(ACSL1、ACSL3~6)[18],各个成员在不同的组织发挥特定作用。在鸡的肝脏中主要由ACSL1参与到脂肪酸的活化,催化长链脂肪酸转化为脂酰辅酶A,参与TG的合成[19]。GPAT基因家族、AGPAT基因家族、脂素(LPIN)基因家族、DGAT基因家族则通过编码对应的酶直接调控鸡肝脏内TG的合成[20-21]。GPAT共有4个亚型(GPAT1~4),其中GPAT1、2位于线粒体外膜,GPAT3、4则位于内质网上,调控磷酸甘油途径的第1步,催化脂酰辅酶A和甘油-3-磷酸合成为溶血磷脂酸(LPA)[21]。TG合成的第2步主要由AGPAT调控。AGPAT也有多个亚型,其中AGPAT1~5位于内质网上,可以催化脂酰辅酶A和LPA合成磷脂酸(PA)[22-23]。磷脂酸需要在位于内质网上的PAP(包括PAP1~3)[24]催化下脱磷酸生成二酰基甘油(DAG),DAG再经内质网上DGAT(包括亚型DGAT1、2)催化下与脂酰辅酶A合成TG[25](图 2)。MTP基因编码的MTP则负责内质网囊泡中新生成TG的转运。内质网囊泡中生成的TG需要在MTP的帮助下进行转运才能与载脂蛋白结合。目前的研究表明,MTP协助脂质分子在囊泡间的转运是通过其穿梭机制实现的,其结构内包含与脂质高亲和及低亲和的2个结合位点,脂质高亲和位点为脂质转运区,可与脂质结合;脂质低亲和位点则与内质网膜相关联,参与MTP在囊泡间的转运,为膜上关联区;囊泡内新生的TG先与MTP结合,通过其囊泡穿梭机制转移出囊泡,然后被释放至内质网腔中,与内质网腔中的新生载脂蛋白B(ApoB)结合组成VLDL释放[26]。
|
TG:甘油三酯triglyceride;GPAT:磷酸甘油转酰基酶glycerol-3-phosphate acvltransferase;LPA:溶血磷脂酸lysophosphatidic acid;AGPAT:酰基磷酸甘油转酰基酶1-acylglycerol-3-phosphate acyltransferase:PA:磷脂酸phosphatidic acid;PAP:磷脂酸磷酸酶phosphatidic acid phosphohydrolase;DAG:二酰基甘油diacylglycerol;DGAT:二酰基甘油酰基转移酶diacylglycerol acyltransferase;VLDL:极低密度脂蛋白very low density lipoprotein;FFA:游离脂肪酸Free fatty acid;LPL:脂蛋白脂肪酶lipoprotein lipase;G3P:甘油-3-磷酸glycerol-3-phosphate;ACLY:柠檬酸裂解酶citrate lyase;ACC:乙酰辅酶A羧化酶acetyl-CoA-carboxylase;FAS:脂肪酸合酶fatty acid synthase;ELOVL:超长链脂肪酸延伸酶elongase of verylong chain fatty acid;SCD:硬脂酰辅酶A去饱和酶stearoyl-CoA desaturease;MUFA:单不饱和脂肪酸monounsaturated fatty acid;PUFA:多不饱和脂肪酸polyunsaturated fatty acids;ACSL:长链脂酰辅酶A合成酶long-chain acyl-CoA synthetase;MTP:微粒体甘油三酯转移蛋白microsomal triglyceride transfer protein;ApoB:载脂蛋白B apolipoprotein B;FABP:脂肪酸转运蛋白fatty acid-binding protein。 图 2 基因编码的蛋白对鸡脂肪生成的调控 Fig. 2 Regulation of protein encoded by genes on chicken adipogenesis |
脂蛋白结合的TG在LPL的作用下水解,释放出脂肪酸,组织细胞需要将这些释放的脂肪酸摄入胞内重新激活,然后与甘油-3-磷酸合成TG并沉积于组织中[7]。水解生成的脂肪酸在ACSL的作用下再次激活,其需要经脂肪酸转运蛋白的协助下才能被组织细胞摄入。鸡体内编码鸡脂肪酸转运蛋白的主要基因为脂肪酸结合蛋白(FABP)基因家族,这些基因编码的FABP通过调控脂肪酸的转运来调控脂肪生成的过程[27]。目前已知的FABP家族成员至少有10个(FABP1~9、12),其主要功能是参与脂肪酸转运、脂质运输及应答。脂肪酸是疏水性物质,不能直接进入组织细胞中被利用,必须与细胞中特殊蛋白质组成亲水分子基团才能在细胞内运输,而FABP可以与脂肪酸疏水配体结合,将脂肪酸摄入组织细胞并运输至胞内内质网重新酯化成TG或磷脂[28]。其中,FABP5与脂肪酸结合后还可以从胞质转移到细胞核,激活调控脂肪代谢的转录因子过氧化物酶体增殖物激活受体(PPAR)β/δ,从而促进鸡脂肪细胞向成熟脂肪细胞的转化[29]。
2.2 转录因子的调控在动物机体的代谢活动中,一些特定转录因子对代谢过程具有非常重要的调控作用。在鸡的脂肪生成过程中,甾醇调节元件结合蛋白(SREBP)、过氧化物酶体增殖物激活受体(PPAR)、肝脏X受体(LXR)是参与脂肪生成过程调控的主要转录因子[30-31]。
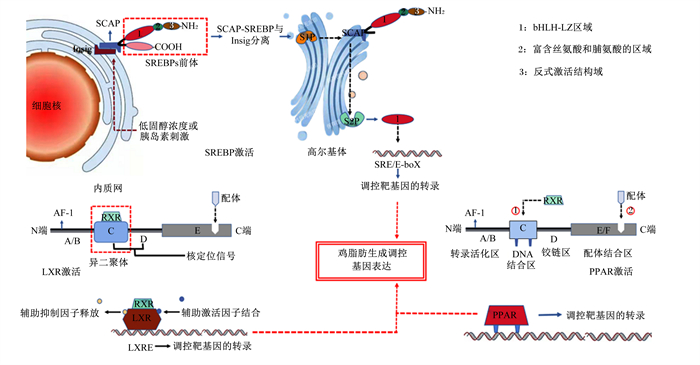
SREBP属于碱性螺旋环-螺旋亮氨酸拉链(basic helix-loop-helix leucine-zipper,bHLH-LZ)转录因子,是一个转录因子家族,通过控制内源性胆固醇、脂肪酸、TG和磷脂合成所需的一系列酶的表达来调节脂质稳态[32]。SREBP主要在肝脏以及脂肪组织表达,目前已知的成员有3个,即SREBP-1a、SREBP-1c、SREBP-2。其中SREBP-2主要调控胆固醇代谢,在鸡肝脏内调节脂肪生成的关键转录因子为SREBP-1a和SREBP-1c,但SREBP-1a表达量很低,所以SREBP-1c起主要调控作用[30]。其调控机制为:当鸡肝细胞受到其内源性激活剂胆固醇的刺激,SREBP与SREBP裂解结合蛋白(SREBP-cleavage activating protein,SCAP)结合生成SCAP/SREBP复合物,SCAP可与胰岛素诱导基因(Insig)相互作用,后者将SCAP/SREBP复合物保留在内质网隔室中。在适当的条件下(低胆固醇或胰岛素浓度刺激),Insig和SCAP之间的相互作用减少,SCAP/SREBP复合物进入到高尔基体,经位点1蛋白酶(S1P)和位点2蛋白酶(S2P)切割后,位于氨基(NH2)末端SREBPs结构域(nSREBPs)被释放。这个包含bHLH-LZ区域的结构然后被转移到细胞核,在那里它将作为同源二聚体结合靶基因启动子的甾醇调节元件(SRE)或E-box序列,从而调控其表达[33]。目前的研究指出,脂肪合成的相关基因如ACC、FAS、SCD等都为SREBP-1c调控的靶基因(图 3);由此可见,SREBP-1c通过直接靶向调控脂肪合成基因表达的方式,参与鸡肝脏内脂肪合成的调控[33-34]。
|
SREBP:甾醇调节元件结合蛋白sterol regulatory element binding protein;SCAP:甾醇调节元件结合蛋白裂解结合蛋白SREBP-cleavage activating protein;bHLH-LZ:碱性螺旋环-螺旋亮氨酸拉链basic helix-loop-helix leucine-zipper;S1P:位点1蛋白酶site 1 protease;S2P:位点2蛋白酶site 2 protease;RXR:维甲酸X受体retinoid X receptor;LXR:肝脏X受体liver x receptor;PPAR:过氧化物酶体增殖物激活受体peroxisome proliferator-activated receptors;SRE:甾醇调节元件sterol regulatory element;Insig:胰岛素诱导基因insulin inducible gene;AF-1:转录激活域-1 activation function-1。 图 3 转录因子的调控机制 Fig. 3 Regulatory mechanism of transcription factors |
PPAR为Ⅱ型核受体超家族一员,是一类可由配体激活的核受体,其包括3个亚型,分别为PPARα、PPARβ/δ、PPARγ。PPARα在肝脏、肾脏、心脏等组织高表达,PPARβ/δ在机体内各组织分布广泛,PPARγ则在脂肪组织内高表达[30]。PPAR具有A、B、C、D、E、F 6个结构域,共4个功能区,其中A、B为N端转录活化区,活化区内含非配体依赖性转录激活域-1(AF-1),其内有1个丝氨酸磷酸化位点,其磷酸化可以调节PPAR的活性。C区则包含2个锌指结构,由70多个氨基酸残基形成,为DNA结合区(DBD)。DBD也是与PPAR共激活受体相结合的部位,如维甲酸X受体(RXR),两者结合可形成异源二聚体。D区为铰链区,可以与转录辅助因子互作后改变其构象,从而调节其转录活性。E、F为配体结合区(LBD),在PPAR发挥其转录活性的过程中起关键作用。LBD可以与配体特异性结合,激活PPAR转录活性[35]。PPAR发挥调控作用的机制为:DBD先与共激活受体结合形成异二聚体,在配体与LBD结合后,异二聚体构象发生改变,与靶基因启动子区PPAR响应原件(PPRE)结合,从而调控靶基因转录[36](图 3)。PPAR对脂肪生成过程中的多个调控基因具有靶向调控的作用。研究表明,PPARα在细胞脂肪酸β氧化、摄取、激活中起到关键作用,其主要通过调控脂肪酸摄取和激活相关基因的表达来调控鸡脂肪生成[3]。PPARα可以靶向调控肝细胞质脂肪酸结合蛋白(L-FABP)、脂肪酸转运蛋白(FATP)、ACSL的表达,从而对脂肪生成起重要调控作用[37]。关于PPARβ/δ的研究表明,其主要刺激脂肪酸氧化并以三磷酸腺苷(ATP)形式和解偶联形式产生的能量增加,虽然其对鸡的脂肪合成过程没有直接调控,但PPARβ/δ促进鸡脂肪细胞向成熟脂肪细胞转化,是脂肪形成过程中脂质积累所必须的[29]。PPARγ则是脂肪代谢调控的必要转录因子,其不仅是脂肪细胞分化过程所必须的转录调控因子,还可通过调控FAS、SCD、FABP、LPL、ACS、FATP、PAP等一系列脂肪代谢特异性基因的表达来影响鸡脂肪生成过程[38]。
LXR也是参与脂质代谢调节的重要核受体,共具有2种亚型,分别为LXRα和LXRβ。LXR也是由结构域组成,含A、B、C、D、E 5个结构域;其中N端为A、B区,含1个非配体依赖性的AF-1,可调控LXR转录活性;C区为DBD,介导LXR与DNA的结合;D区为铰链区,C区和D区之间存在核定位信号肽;C端为E区,为LBD,介导配体和LXR的结合[39]。LXR的激活同样也需要与RXR形成异二聚体,然后再被配体激活发挥转录活性,其作用机制为:LXR在激活过程中DBD先与RXR结合成异二聚体,之后配体与LBD特异性结合,异二聚体构象改变,与LXR靶基因调控区的肝脏X受体响应元件(LXRE)相互作用,与LXRE相互作用后,与异二聚体结合的辅助抑制因子释放,而辅助激活因子聚集,从而介导靶基因转录[40](图 3)。LXR在机体内对脂肪代谢的调控具有重要作用,其对鸡脂肪生成过程的调控体现在对鸡肝脏内胆固醇转化为脂肪酸及脂肪合成过程的调控。LXR一方面可以促进机体逆向运输到肝脏的胆固醇转化为脂肪酸,另一方面可以促进肝脏内SREBP-1c、ACC、FAS、SCD的表达从而促进脂肪的合成,为胆固醇的酯化提供基板[41]。
2.3 转录后水平的调控随着对动植物基因组的了解深入,研究发现,动植物的基因组中存在一系列编码大小为22 bp左右的非编码RNA,称为miRNA,其可以与靶mRNA互补序列配对,通过抑制mRNA转录或使其降解,从而在转录后水平对基因的表达进行调控[42-44]。研究表明,在鸡的脂肪生成过程中也有许多miRNA参与了调控(表 1),但对于调控miRNA表达及其在机体不同生理阶段发挥调控作用的上游信号传导还有待探究。
|
|
表 1 调控鸡脂肪生成的主要miRNA Table 1 Main miRNAs regulating chicken lipogenesis |
鸡肝脏内miRNA通过调控脂肪生成过程中不同靶基因的表达来发挥其特定的调控作用。miR-122是鸡肝内表达量最高的miRNA,其在脊椎动物中高度保守,在胆固醇和脂肪合成中起重要调节作用[44]。研究表明,miR-122可以下调鸡肝脏泛酰巯基乙胺酶1基因(VNN1)的表达,后者为PPARα靶基因,对肝脏脂肪代谢有重要作用;miR-122通过负调节VNN1的表达参与到鸡肝脏脂肪代谢[45]。另外,miR-122通过直接或间接调控肝脏内脂肪合成相关酶的表达,如:丙酮酸激酶、FABP5、FAS、SCD、ACC等,对鸡肝脏脂肪合成进行调控[46]。miR-33家族为熟知的脂肪代谢调控miRNA,在对胚胎小鸡肝脏发育阶段中肝脏miRNA表达的研究发现,新型miR-33(nc-miR-33)是参与肝脏FAS基因表达调控的miRNA之一[47]。另外,miR-33还可以靶向脂肪酸氧化的相关基因来减少脂肪酸降解[48]。miR-5也是胚胎小鸡肝脏中表达的miRNA之一,可以靶向环磷酸腺苷反应元件结合蛋白(cAMP response element binding protein,CREB)调节CREB介导的肝细胞生长,还可以作为PPARα共激活剂,从而对鸡脂肪生成过程进行调控[47]。对蛋鸡肝脏内miRNA分析发现,miRNA-22-3p可以靶向参与脂肪酸代谢的几个基因,包括ACSL5、ELOVL6和脂滴包被蛋白2(PLIN2),从而调控鸡的脂肪生成过程[49]。miR-146b-5p是另一种鸡肝脏脂质代谢调控的miRNA,研究表明,相较于产蛋前期(20周龄)蛋鸡,脂肪生成更旺盛的产蛋高峰期(30周龄)蛋鸡miR-146b-5p的表达量是产蛋前期的8.5倍[49];另有报道指出miR-146b-5p可以促进鸡胸肌肉内脂肪生成,所以miR-146b-5p也是调控鸡脂肪生成的miRNA之一[50]。miR-218-5p也是调控鸡脂肪生成过程的一种重要miRNA,Zhang等[51]报道,与产蛋前母鸡相比,ELOVL5在产蛋高峰期母鸡的肝脏中高表达;而miR-218-5p的表达水平与母鸡肝脏中ELOVL5的mRNA表达水平呈负相关,说明ELOVL5为miR-218-5p的靶基因之一。还有研究指出,在长链多不饱和脂肪酸生物合成过程中发挥重要作用的脂肪酸去饱和酶1(FADS1)也是miR-218-5p的靶基因,miR-218-5p通过对ELOVL5和FADS1等基因表达的调控来调控鸡脂肪生成[49]。除上述miRNA之外,miR-101-2-5p也被报道在蛋鸡肝脏中的表达与ApoB的表达呈负相关,在产蛋前期和产蛋后期,蛋鸡肝脏内miR-101-2-5p和ApoB的表达分别显著下调和上调[51]。ApoB是参与TG装配和分泌的重要载脂蛋白,miR-101-2-5p可能通过负调控参与脂质代谢中ApoB的表达,从而影响鸡脂肪生成[52]。
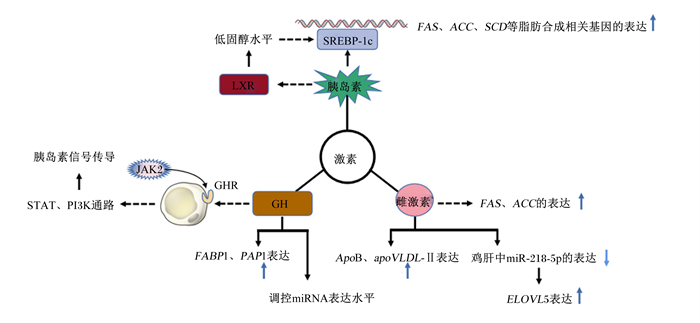
2.4 激素的调控在鸡脂肪生成的复杂调控网络中,激素也是其中非常重要的一环。研究表明,胰岛素、生长激素(GH)、雌激素等在鸡的脂肪生成过程中均发挥着重要的调控作用(图 4)。
|
SREBP-1c:甾醇调节元件结合蛋白-1c sterol regulatory element binding protein-1c;FAS:脂肪酸合酶fatty acid synthase;ACC:乙酰辅酶A羧化酶acetyl-CoA-carboxylase;SCD:硬脂酰辅酶A去饱和酶stearoyl-CoA desaturease;LXR:肝脏X受体liver X receptor;GH:生长激素growth hormone;GHR:生长激素受体growth hormone receptor;JAK:Janus激酶Janus kinases;STAT:信号传导及转录激活蛋白signal transducer and activator of transcription;PI3K:磷酯酰肌醇-3-激酶phosphatidylinositol 3 kinase;apoVLDL-Ⅱ:载脂蛋白极低密度脂蛋白-Ⅱ apolipoprotein VLDL-Ⅱ;FABP1:脂肪酸结合蛋白1 fatty acid binding protein 1;PAP1:磷脂酸磷酸酶1 phosphatidic acid phosphohydrolase 1;ELOVL5:超长链脂肪酸延伸酶5 elongase of verylong chain fatty acid 5。 图 4 激素对鸡脂肪生成的调控 Fig. 4 Regulation of hormone on chicken fat production |
对于动物来说,胰岛素是调控体内血糖水平的重要激素,但其对机体脂肪代谢也有重要调控作用[53]。胰岛素不仅可以激活LPL将脂蛋白中的TG水解释放出脂肪酸[14],还参与了鸡脂肪生成的调控。Zhang等[54]报道,胰岛素可以通过诱导SREBP-1c磷酸化来调控SREBP-1c的活性,胰岛素可以在翻译后水平增加鸡胚细胞中SREBP-1c的核形式表达量,影响SREBP-1c下游基因的表达,从而影响鸡的脂肪生成。Alvarenga等[7]报道,胰岛素可以刺激编码鸡脂肪生成中的重要酶基因表达,包括SCD、FASN和LPL等。此外,胰岛素可以调控禽类肝脏TG合成。符自英[55]报道,50~150 nmol/L胰岛素处理可以使四川鹅和朗德鹅肝脏原代细胞以胰岛素剂量依赖式增加SREBP-1c、FAS、ACC和LPL的mRNA相对表达水平,从而增加TG集聚。从上述研究可知,胰岛素通过调控肝脏内TG合成相关基因的表达在鸡的脂肪生成过程中具有重要的调控作用。
GH也是调控鸡肝中脂肪合成的重要激素。GH由垂体前叶分泌,主要调控动物生长发育,对动物脂肪代谢也有重要影响[56]。由于与GH结合的生长激素受体(GHR)自身不具备酪氨酸激酶活性,因此GH自垂体前叶分泌与靶细胞GHR结合后,还需通过募集非受体酪氨酸激酶来介导GHR磷酸化,从而激活其下游通路;如Janus激酶2(JAK2),JAK2的募集可以使GHR磷酸化从而激活信号传导及转录激活蛋白(STAT)、磷酯酰肌醇-3-激酶(PI3K)等通路,二者是调控胰岛素信号传导的重要通路[57-58]。另外,GH通过调节靶向脂质代谢相关基因的miRNA表达,可以调节鸡肝脏中的脂肪生成。Wang等[48]用500 ng/mL GH处理雌鸡肝脏原代细胞,RNA测序(RNA-seq)分析结果表明,GH处理显著增加肝细胞中脂肪合成相关基因FABP1和LPIN1的表达,上调gga-miR-455-3p、gga-miR-193a、gga-miR-190、gga-miR-15b和下调gga-miR-1724等与鸡肝脏原代细胞脂肪生成密切相关的miRNA表达水平。
研究表明,性激素在鸡的脂肪生成调节中至关重要,其中雌激素对鸡脂肪生成过程中的很多重要基因都有重要调控作用[59]。田卫华等[60]报道,分别用不同浓度(0.5、1.0、2.0 mg/kg)17β-雌二醇给10周龄卢氏绿壳蛋鸡注射和用不同浓度(20、50、100 nmol/L)17β-雌二醇处理蛋鸡肝脏原代细胞,可以显著提高蛋鸡肝脏内和原代细胞内脂肪合成的关键酶ACC和FAS的表达。任俊晓[61]报道,雌激素处理显著增加鸡肝脏组织内的ApoB和载脂蛋白极低密度脂蛋白-Ⅱ(apoVLDL-Ⅱ)的表达。Li等[62]报道,apoVLDL-Ⅱ启动子内具有雌激素反应元件,雌激素可以直接调控其表达量。apoVLDL-Ⅱ是母鸡体内特殊脂蛋白卵黄蛋白的前体之一,卵黄蛋白的另一个前体物质卵黄蛋白原(VTG)的表达也受雌激素的调控;卵黄蛋白可将肝脏内形成的脂肪直接运输到卵巢形成蛋黄[13]。也有研究表明,雌激素可以通过调控miRNA的表达来调控鸡肝脏脂肪生成,如雌激素通过下调产蛋鸡肝脏中miR-218-5p的表达增加其靶基因ELOVL5的表达,从而增强肝脏n-3和n-6长链多不饱和脂肪酸(LCPUFA)的合成[51]。
2.5 营养因素的调控除了机体自身对脂肪生成存在调控网络外,外部营养因素对鸡脂肪生成同样具有重要调控作用。国内外也有许多关于不同营养物质水平对鸡脂肪代谢影响的研究,包括不同碳水化合物水平、蛋白质水平、脂肪酸组成及油脂种类等多种营养调控手段。
在鸡饲粮中,碳水化合物是最主要的组成部分,也是鸡能量供给的主要来源。饲粮中碳水化合物水平的变化对脂肪生成具有重要影响[63]。碳水化合物作用的转录调控因子碳水化合物反应元件结合蛋白(ChREBP)是调控糖脂代谢的重要转录因子,在肝脏内大量表达。ChREBP可以被葡萄糖激活,直接调控参与糖酵解途径和脂肪合成基因的表达,如肝型丙酮酸激酶(L-PK)、FAS、ACC等,将肝脏摄入过多的碳水化合物通过糖酵解和脂肪合成途径转变为脂肪[64]。相关的研究也表明,饲粮高碳水化合物水平可以促进脂肪合成的关键酶FAS、ACC的表达。Dankel等[63]报道,高碳水饮食的大鼠肝脏FAS和ACC的表达强烈上调,并且表现出高8倍的FAS活性和高1倍的ACC活性。Wang等[65]报道高碳水化合物水平营养条件下,生长鸡肝脏ACC的表达显著上调,脂肪合成增加。综上所述,当鸡饲粮中碳水化合物的水平过高时,其促进肝脏脂肪合成的可能机制为:饲粮高碳水化合物水平条件下,鸡肝脏内摄入的葡萄糖增加,肝脏内葡萄糖含量的上升可以激活ChREBP从而调控下游L-PK、FAS、ACC的表达,使肝脏内糖酵解反应和脂肪合成增强。
饲粮蛋白质水平对鸡的生长和体脂含量也具有重要影响,饲粮高蛋白质水平可以使肉鸡腹部脂肪含量减少,体重增加,胸肌产量增加[1]。Jlali等[66]报道,饲粮高水平蛋白质(23%)可以提高鸡的生长性能,降低腹脂沉积;低蛋白质水平(17%)相较于高蛋白质水平腹脂沉积显著增加。Mohiti-Asil等[67]报道,蛋鸡饲粮高蛋白质水平(17.4%)相较于低蛋白质水平(14.5%),可以显著降低蛋鸡腹部脂肪沉积及肝脏和血浆中TG含量,并且使蛋鸡血浆中苹果酸酶活性降低18.5%,肝脏血浆中苹果酸酶活性降低11.8%。苹果酸酶在脂肪合成的过程中具有重要作用,可以通过控机体脂质合成的最主要还原剂烟酰胺腺嘌呤二核苷酸磷酸(NADPH)的生成,其活性降低可以抑制机体脂质合成[68]。Adams等[69]报道,鸡肝脏苹果酸酶活性随饲粮蛋白质水平的变化而变化,给肉鸡饲喂低蛋白质水平(13%)饲粮,自由采食6、24 h后,检测到鸡肝脏内苹果酸酶活性、mRNA表达量和总脂含量相较于高蛋白质水平(40%)饲粮组、基础蛋白质水平饲粮(22%)组显著升高;自由采食24 h后,基础蛋白质水平(22%)饲粮组肝脏苹果酸酶活性、mRNA表达量和总脂含量显著高于高蛋白质水平(40%)饲粮组。饲粮蛋白质水平改变对鸡脂肪生成的直接调控机制尚未有研究报道,其对肝脏内苹果酸酶的表达和活性的影响可能是饲粮蛋白质水平改变影响鸡脂肪生成的重要原因。
肉鸡饲粮脂肪水平较低,但其对及脂肪代谢存在重要影响,这可能归因于不同饲粮脂肪来源的脂肪酸组成不同[65]。不同油脂种类(脂肪来源)的脂肪酸组成存在差异,主要包括饱和脂肪酸和不饱和脂肪酸2种类型,这2种脂肪酸的占比对于肉鸡的脂肪生成有显著影响。简宗辉等[1]报道,蛋鸡饲粮中添加饱和脂肪酸可以促进蛋鸡脂肪合成及腹脂沉积,并形成脂肪肝。而饲粮中添加富含不饱和脂肪酸的脂肪来源时,可以减少鸡的脂肪沉积,降低腹脂重。Sanz等[70]报道,肉仔鸡饲粮中使用葵花籽油(富含不饱和脂肪酸)较于饲粮中使用牛油或猪油(富含饱和脂肪酸),肉仔鸡腹脂重显著降低。另外,Ferrini等[71]报道鸡饲粮中添加亚麻籽油(不饱和脂肪酸)相较于添加牛油,可以使鸡的腹脂沉积减少,脂肪β氧化增强。由此可见,不同油脂种类及其脂肪酸饱和程度也是调控鸡脂肪生成的关键因素。一方面,与脂肪酸饱和程度影响脂肪消化率及氧化率相关,饲粮中富含不饱和脂肪酸可以使机体脂肪氧化率变高,使充当脂肪合成原料的脂肪酸减少[72];另一方面,脂肪酸本身充当脂肪代谢介质,对脂肪代谢活动有重要调控作用[67]。目前,不同脂肪酸直接调控鸡脂肪生成的分子机制还不明确,有待进一步研究。
3 小结与展望综上所述,鸡的脂肪生成具有复杂的调控网络,在基因、转录因子、转录后miRNA、激素水平、营养调控方面都涉及到复杂的调控机制。我国家禽养殖业体量日渐增加,如何降低鸡非必要脂肪沉积、提高产业经济效益等问题愈发受到行业关注。在此背景下,研究鸡脂肪生成过程的代谢调控机制,可以对如何降低鸡的腹脂沉积、提高饲料利用率等行业关注问题提供理论指导。现有的研究已经构建了鸡脂肪生成的调控网络,但还有许多需要深入研究的方面:1)随着对脂肪代谢调控的研究,一些脂肪生成相关的调控基因和miRNA新成员陆续被发现,针对这些新成员的功能特性和调控机制需要进一步探究;2)鸡的物种多样性较为丰富,不同品种鸡的脂肪代谢基因组成和序列存在差异,脂肪合成的相关蛋白和酶的表达也存在差异,建立和完善不同品种鸡的基因库对鸡脂肪代谢的研究具有重要意义;3)激素的调节相较于酶对鸡脂肪生成的调控更加复杂,涉及许多信号通路的激活,其调控网络的构建还需更多的相关研究进行探究;4)目前对鸡脂肪生成营养调控的研究较为表观,探究营养调控手段对鸡脂肪生成的直接调控机制还需进一步系统和深入地探究。
| [1] |
简宗辉, 徐焘杰, 孙帅, 等. 肉鸡脂肪代谢分子机理研究进展[J]. 中国家禽, 2021, 43(7): 1-9. JIAN Z H, XU T J, SUN S, et al. Research progress in molecular mechanism of fat metabolism in chicken[J]. China Poultry, 2021, 43(7): 1-9 (in Chinese). DOI:10.16372/j.issn.1004-6364.2021.07.001 |
| [2] |
ABDALLA B A, CHEN J, NIE Q H, et al. Genomic insights into the multiple factors controlling abdominal fat deposition in a chicken model[J]. Frontiers in Genetics, 2018, 9: 262. DOI:10.3389/fgene.2018.00262 |
| [3] |
NEMATBAKHSH S, PEI PEI C, SELAMAT J, et al. Molecular regulation of lipogenesis, adipogenesis and fat deposition in chicken[J]. Genes, 2021, 12(3): 414. DOI:10.3390/genes12030414 |
| [4] |
POORGHASEMI M, SEIDAVI A, QOTBI A A A, et al. Evaluating dietary fat sources on blood biochemical profile of broilers[J]. Research Opinions in Animal & Veterinary Sciences, 2015, 5(7): 300-303. |
| [5] |
SAED C T, TABATABAEI DAKHILI S A, USSHER J R. Pyruvate dehydrogenase as a therapeutic target for nonalcoholic fatty liver disease[J]. ACS Pharmacology & Translational Science, 2021, 4(2): 582-588. |
| [6] |
VON WETTSTEIN-KNOWLES P, OLSEN J G, MCGUIRE K A, et al. Fatty acid synthesis.Role of active site histidines and lysine in Cys-His-His-type beta-ketoacyl-acyl carrier protein synthases[J]. The FEBS Journal, 2006, 273(4): 695-710. DOI:10.1111/j.1742-4658.2005.05101.x |
| [7] |
ALVARENGA R R, ZANGERONIMO M G, PEREIRA L J, et al. Lipoprotein metabolism in poultry[J]. World's Poultry Science Journal, 2011, 67(3): 431-440. DOI:10.1017/S0043933911000481 |
| [8] |
WANG G Q, KIM W K, CLINE M A, et al. Factors affecting adipose tissue development in chickens: a review[J]. Poultry Science, 2017, 96(10): 3687-3699. DOI:10.3382/ps/pex184 |
| [9] |
HU G, WANG S Z, TIAN J W, et al. Epistatic effect between ACACA and FABP2 gene on abdominal fat traits in broilers[J]. Journal of Genetics and Genomics, 2010, 37(8): 505-512. DOI:10.1016/S1673-8527(09)60070-9 |
| [10] |
MARRUBE G, ROZEN F, PINTO G B, et al. New polymorphism of FASN gene in chicken[J]. Journal of Applied Genetics, 2004, 45(4): 453-455. |
| [11] |
罗华伦. 鸭SCD-1基因对子宫上皮细胞Ca2+的效应及其启动子活性研究[D]. 硕士学位论文. 贵阳: 贵州大学, 2019: 2-6. LUO H L. Effect of duck SCD-1 gene on Ca2+ in uterine epithelial cells and its promoter activity research[D]. Master's Thesis. Guiyang: Guizhou University, 2019: 2-6. (in Chinese) |
| [12] |
MATSUZAKA T, SHIMANO H. Elovl6:a new player in fatty acid metabolism and insulin sensitivity[J]. Journal of Molecular Medicine, 2009, 87(4): 379-384. DOI:10.1007/s00109-009-0449-0 |
| [13] |
ENACHE L S. ATP citrate lyase-biology and implication in human pathology[J]. Revista Românǎ de Medicinǎ de Laborator, 2008, 12(3): 17-29. |
| [14] |
LALIOTIS G P, BIZELIS I, ROGDAKIS E. Comparative approach of the de novo fatty acid synthesis (lipogenesis) between ruminant and non-ruminant mammalian species: from biochemical level to the main regulatory lipogenic genes[J]. Current Genomics, 2010, 11(3): 168-183. DOI:10.2174/138920210791110960 |
| [15] |
DESERT C, BAÉZA E, AITE M, et al. Multi-tissue transcriptomic study reveals the main role of liver in the chicken adaptive response to a switch in dietary energy source through the transcriptional regulation of lipogenesis[J]. BMC Genomics, 2018, 19(1): 187. DOI:10.1186/s12864-018-4520-5 |
| [16] |
李翠翠. 鸡超长链脂肪酸延伸酶(ELOVL) 家族的生物学特性和表达调控研究[D]. 硕士学位论文. 郑州: 河南农业大学, 2018: 4-9. LI C C. Biological characterization and expression regulation of elongases of very long chain fatty acids (ELOVL) gene family in chicken (Gallus gallus)[D]. Master's Thesis. Zhengzhou: Henan Agricultural University, 2018: 4-9. (in Chinese) |
| [17] |
MATSUZAKA T. Role of fatty acid elongase Elovl6 in the regulation of energy metabolism and pathophysiological significance in diabetes[J]. Diabetology International, 2021, 12(1): 68-73. DOI:10.1007/s13340-020-00481-3 |
| [18] |
LOPES-MARQUES M, CUNHA I, REIS-HENRIQUES M A, et al. Diversity and history of the long-chain acyl-CoA synthetase (Acsl) gene family in vertebrates[J]. BMC Evolutionary Biology, 2013, 13: 271. DOI:10.1186/1471-2148-13-271 |
| [19] |
李庆岗, 陶著, 杨玉增, 等. 长链脂酰CoA合成酶(ACSL)的研究进展[J]. 中国畜牧兽医, 2012, 39(6): 137-140. LI Q G, TAO Z, YANG Y Z, et al. Research progress of long chain acyl-CoA synthetase[J]. China Animal Husbandry & Veterinary Medicine, 2012, 39(6): 137-140 (in Chinese). DOI:10.3969/j.issn.1671-7236.2012.06.034 |
| [20] |
TAKEUCHI K, REUE K. Biochemistry, physiology, and genetics of GPAT, AGPAT, and lipin enzymes in triglyceride synthesis[J]. American Journal of Physiology.Endocrinology and Metabolism, 2009, 296(6): E1195-E1209. DOI:10.1152/ajpendo.90958.2008 |
| [21] |
田增有, 李开济, 门秀丽, 等. 甘油-3-磷酸酰基转移酶(GPATs)的研究进展[J]. 生理科学进展, 2015, 46(2): 103-107. TIAN Z Y, LI K J, MEN X L, et al. Research progress of glycerol-3-phosphate acyltransferases (GPATs)[J]. Progress in Physiological Sciences, 2015, 46(2): 103-107 (in Chinese). |
| [22] |
PRASAD S S, GARG A, AGARWAL A K. Enzymatic activities of the human AGPAT isoform 3 and isoform 5:localization of AGPAT5 to mitochondria[J]. Journal of Lipid Research, 2011, 52(3): 451-462. DOI:10.1194/jlr.M007575 |
| [23] |
AGARWAL A K, SUKUMARAN S, CORTÉS V A, et al. Human 1-acylglycerol-3-phosphate O-acyltransferase isoforms 1 and 2:biochemical characterization and inability to rescue hepatic steatosis in Agpat2-/- gene lipodystrophic mice[J]. Journal of Biological Chemistry, 2011, 286(43): 37676-37691. DOI:10.1074/jbc.M111.250449 |
| [24] |
文荣, 贾彦彬, 周成江, 等. LPIN1基因的最新研究进展[J]. 包头医学院学报, 2015, 31(4): 140-142. WEN R, JIA Y B, ZHOU C J, et al. Latest research progress of LPIN1 gene[J]. Journal of Baotou Medical College, 2015, 31(4): 140-142 (in Chinese). |
| [25] |
TURCHETTO-ZOLET A C, MARASCHIN F S, DE MORAIS G L, et al. Evolutionary view of acyl-CoA diacylglycerol acyltransferase (DGAT), a key enzyme in neutral lipid biosynthesis[J]. BMC Evolutionary Biology, 2011, 11: 263. DOI:10.1186/1471-2148-11-263 |
| [26] |
刘黎, 欧阳冬生. 微粒体甘油三酯转移蛋白的功能及临床意义[J]. 国际病理科学与临床杂志, 2009, 29(2): 152-155. LIU L, OUYANG D S. Function and clinical significance of microsomal triglyceride transfer proteins[J]. Journal of International Pathology and Clinical Medicine, 2009, 29(2): 152-155 (in Chinese). |
| [27] |
王启贵. 鸡FABP基因克隆、表达特性及功能研究[D]. 博士学位论文. 哈尔滨: 东北农业大学, 2004: 6-18. WANG Q G. Cloning, expression and function of chicken FABP genes[D]. Ph. D. Thesis. Harbin: Northeast Agricultural University, 2004: 6-18. (in Chinese) |
| [28] |
李萍. FABP5调节奶牛乳腺上皮细胞乳脂肪合成机理研究[D]. 博士学位论文. 哈尔滨: 东北农业大学, 2018: 12-15. LI P. Regulatory mechanism of FABP5 on milk fat synthesis of bovine mammary epithelial cells[D]. Ph. D. Thesis. Harbin: Northeast Agricultural University, 2018: 12-15. (in Chinese) |
| [29] |
TAN N S, SHAW N S, VINCKENBOSCH N, et al. Selective cooperation between fatty acid binding proteins and peroxisome proliferator-activated receptors in regulating transcription[J]. Molecular and Cellular Biology, 2002, 22(14): 5114-5127. DOI:10.1128/MCB.22.14.5114-5127.2002 |
| [30] |
李姣, 胡群, 罗佩, 等. 肝脏脂质代谢关键转录因子研究进展[J]. 动物医学进展, 2016, 37(4): 90-93. LI J, HU Q, LUO P, et al. Progress on key transcription factors in liver lipid metabolism[J]. Progress in Veterinary Medicine, 2016, 37(4): 90-93 (in Chinese). DOI:10.3969/j.issn.1007-5038.2016.04.020 |
| [31] |
陈兴勇, 郭立平, 张成, 等. 过氧化物酶体增殖物激活受体γ参与鸡脂质代谢调控的机理[J]. 中国家禽, 2020, 42(7): 1-5. CHEN X Y, GUO L P, ZHANG C, et al. Mechanism of peroxisome proliferator-activated receptor γ participated in the regulation of chicken lipid metabolism[J]. China Poultry, 2020, 42(7): 1-5 (in Chinese). DOI:10.16372/j.issn.1004-6364.2020.07.001 |
| [32] |
HORTON J D, GOLDSTEIN J L, BROWN M S. SREBPs: activators of the complete program of cholesterol and fatty acid synthesis in the liver[J]. The Journal of Clinical Investigation, 2002, 109(9): 1125-1131. DOI:10.1172/JCI0215593 |
| [33] |
EBERLÉ D, HEGARTY B, BOSSARD P, et al. SREBP transcription factors: master regulators of lipid homeostasis[J]. Biochimie, 2004, 86(11): 839-848. DOI:10.1016/j.biochi.2004.09.018 |
| [34] |
FANG D L, WAN Y, SHEN W, et al. Endoplasmic reticulum stress leads to lipid accumulation through upregulation of SREBP-1c in normal hepatic and hepatoma cells[J]. Molecular and Cellular Biochemistry, 2013, 381(1/2): 127-137. |
| [35] |
宋淑珍, 吴建平, 高良霜, 等. 过氧化物酶体增殖物激活受体γ信号通路调控脂质代谢的研究进展[J]. 动物营养学报, 2020, 32(4): 1473-1483. SONG S Z, WU J P, GAO L S, et al. Research advance on lipid metabolism regulated by preoxisome proliferator-activated receptor gamma signal pathway[J]. Chinese Journal of Animal Nutrition, 2020, 32(4): 1473-1483 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.04.002 |
| [36] |
BERGER J, MOLLER D E. The mechanisms of action of PPARs[J]. Annual Review of Medicine, 2002, 53: 409-435. DOI:10.1146/annurev.med.53.082901.104018 |
| [37] |
RAKHSHANDEHROO M, SANDERSON L M, MATILAINEN M, et al. Comprehensive analysis of PPARalpha-dependent regulation of hepatic lipid metabolism by expression profiling[J]. PPAR Research, 2007, 2007: 26839. |
| [38] |
TONTONOZ P, SPIEGELMAN B M. Fat and beyond: the diverse biology of PPARgamma[J]. Annual Review of Biochemistry, 2008, 77: 289-312. DOI:10.1146/annurev.biochem.77.061307.091829 |
| [39] |
KISS M, CZIMMERER Z, NAGY L. The role of lipid-activated nuclear receptors in shaping macrophage and dendritic cell function: from physiology to pathology[J]. The Journal of Allergy and Clinical Immunology, 2013, 132(2): 264-286. DOI:10.1016/j.jaci.2013.05.044 |
| [40] |
NAGY L, SZANTO A, SZATMARI I, et al. Nuclear hormone receptors enable macrophages and dendritic cells to sense their lipid environment and shape their immune response[J]. Physiological Reviews, 2012, 92(2): 739-789. DOI:10.1152/physrev.00004.2011 |
| [41] |
赵慧佳, 李玲, 魏婉慧, 等. 肝X受体的基因多态性与代谢类疾病的相关性[J]. 中国临床药理学与治疗学, 2017, 22(6): 713-720. ZHAO H J, LI L, WEI W H, et al. Relativity between the gene polymorphisms of LXR and metabolic syndrome[J]. Chinese Journal of Clinical Pharmacology and Therapeutics, 2017, 22(6): 713-720 (in Chinese). |
| [42] |
BARTEL D P. MicroRNAs: target recognition and regulatory functions[J]. Cell, 2009, 136(2): 215-233. DOI:10.1016/j.cell.2009.01.002 |
| [43] |
AMBROS V. The functions of animal microRNAs[J]. Nature, 2004, 431(7006): 350-355. DOI:10.1038/nature02871 |
| [44] |
XU H T, WANG X B, DU Z L, et al. Identification of microRNAs from different tissues of chicken embryo and adult chicken[J]. FEBS Letters, 2006, 580(15): 3610-3616. DOI:10.1016/j.febslet.2006.05.044 |
| [45] |
LI Y Y, WANG X G, YU J F, et al. MiR-122 targets the vanin 1 gene to regulate its expression in chickens[J]. Poultry Science, 2016, 95(5): 1145-1150. DOI:10.3382/ps/pew039 |
| [46] |
WANG X G, SHAO F, YU J F, et al. MicroRNA-122 targets genes related to liver metabolism in chickens[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2015, 184: 29-35. DOI:10.1016/j.cbpb.2015.02.002 |
| [47] |
HICKS J A, TRAKOOLJUL N, LIU H C. Discovery of chicken microRNAs associated with lipogenesis and cell proliferation[J]. Physiological Genomics, 2010, 41(2): 185-193. DOI:10.1152/physiolgenomics.00156.2009 |
| [48] |
WANG X G, YANG L, WANG H J, et al. Growth hormone-regulated mRNAs and miRNAs in chicken hepatocytes[J]. PLoS One, 2014, 9(11): e112896. DOI:10.1371/journal.pone.0112896 |
| [49] |
LI H, MA Z, JIA L J, et al. Systematic analysis of the regulatory functions of microRNAs in chicken hepatic lipid metabolism[J]. Scientific Reports, 2016, 6: 31766. DOI:10.1038/srep31766 |
| [50] |
FU S Y, ZHAO Y L, LI Y F, et al. Characterization of miRNA transcriptome profiles related to breast muscle development and intramuscular fat deposition in chickens[J]. Journal of Cellular Biochemistry, 2018, 119(8): 7063-7079. DOI:10.1002/jcb.27024 |
| [51] |
ZHANG M, LI C C, LI F, et al. Estrogen promotes hepatic synthesis of long-chain polyunsaturated fatty acids by regulating ELOVL5 at post-transcriptional level in laying hens[J]. International Journal of Molecular Sciences, 2017, 18(7): 1405. DOI:10.3390/ijms18071405 |
| [52] |
MA Z, LI H, ZHENG H, et al. MicroRNA-101-2-5p targets the ApoB gene in the liver of chicken (Gallus gallus)[J]. Genome, 2017, 60(8): 673-678. DOI:10.1139/gen-2017-0020 |
| [53] |
WONG R H F, SUL H S. Insulin signaling in fatty acid and fat synthesis: a transcriptional perspective[J]. Current Opinion in Pharmacology, 2010, 10(6): 684-691. DOI:10.1016/j.coph.2010.08.004 |
| [54] |
ZHANG Y Q, HILLGARTNER F B. Starvation and feeding a high-carbohydrate, low-fat diet regulate the expression sterol regulatory element-binding protein-1 in chickens[J]. The Journal of Nutrition, 2004, 134(9): 2205-2210. DOI:10.1093/jn/134.9.2205 |
| [55] |
符自英. 胰岛素和葡萄糖对鹅肝细胞TG含量及脂肪代谢相关基因表达的调控[D]. 硕士学位论文. 雅安: 四川农业大学, 2008: 1-4. FU Z Y. The effect of glucose and insulin on gene expression related to lipids metabolism and TG accumulation in goose hepatocyte[D]. Master's Thesis. Ya'an: Sichuan Agricultural University, 2008: 1-4. (in Chinese) |
| [56] |
曹棨, 米佳. 生长激素与脂肪组织及脂肪因子的关系研究[J]. 检验医学与临床, 2020, 17(13): 1939-1942, 1948. CAO Q, MI J. Study on the relationship between growth hormone and adipose tissue and adipokines[J]. Laboratory Medicine and Clinic, 2020, 17(13): 1939-1942, 1948 (in Chinese). DOI:10.3969/j.issn.1672-9455.2020.13.049 |
| [57] |
CHILTON B S, HEWETSON A. Prolactin and growth hormone signaling[J]. Current Topics in Developmental Biology, 2005, 68: 1-23. |
| [58] |
WATERS M J, HOANG H N, FAIRLIE D P, et al. New insights into growth hormone action[J]. Journal of Molecular Endocrinology, 2006, 36(1): 1-7. DOI:10.1677/jme.1.01933 |
| [59] |
PELLEGRINI M, PALLOTTINI V, MARIN R, et al. Role of the sex hormone estrogen in the prevention of lipid disorder[J]. Current Medicinal Chemistry, 2014, 21(24): 2734-2742. DOI:10.2174/0929867321666140303123602 |
| [60] |
田卫华, 杨丽玉, 李红, 等. 蛋鸡脂肪代谢相关基因ACACA和FASN表达及调控特性[J]. 农业生物技术学报, 2019, 27(2): 280-288. TIAN W H, YANG L Y, LI H, et al. Expression and regulation characteristics of lipid metabolism-related ACACA and FASN genes in laying hens (Gallus gallus)[J]. Journal of Agricultural Biotechnology, 2019, 27(2): 280-288 (in Chinese). |
| [61] |
任俊晓. 雌激素处理鸡肝脏转录组分析及候选基因受雌激素调控的分子机制研究[D]. 硕士学位论文. 郑州: 河南农业大学, 2017: 4-6. REN J X. Study on estrogen treated chicken liver transcriptome and estrogen regulation molecular mechanism on the candidate genes[D]. Master's Thesis. Zhengzhou: Henan Agricultural University, 2017: 4-6. (in Chinese) |
| [62] |
LI J, LEGHARI I H, HE B, et al. Estrogen stimulates expression of chicken hepatic vitellogenin Ⅱ and very low-density apolipoprotein Ⅱ through ER-α[J]. Theriogenology, 2014, 82(3): 517-524. DOI:10.1016/j.theriogenology.2014.05.003 |
| [63] |
DANKEL S N, BJØRNDAL B, LINDQUIST C, et al. Hepatic energy metabolism underlying differential lipidomic responses to high-carbohydrate and high-fat diets in male Wistar rats[J]. The Journal of Nutrition, 2021, 15(9): 2610-2621. |
| [64] |
UYEDA K, REPA J J. Carbohydrate response element binding protein, ChREBP, a transcription factor coupling hepatic glucose utilization and lipid synthesis[J]. Cell Metabolism, 2006, 4(2): 107-110. DOI:10.1016/j.cmet.2006.06.008 |
| [65] |
WANG G Q, KIM W K, CLINE M A, et al. Factors affecting adipose tissue development in chickens: a review[J]. Poultry Science, 2017, 96(10): 3687-3699. DOI:10.3382/ps/pex184 |
| [66] |
JLALI M, GIGAUD V, MÉTAYER-COUSTARD S, et al. Modulation of glycogen and breast meat processing ability by nutrition in chickens: effect of crude protein level in 2 chicken genotypes[J]. Journal of Animal Science, 2012, 90(2): 447-455. DOI:10.2527/jas.2011-4405 |
| [67] |
MOHITI-ASLI M, SHIVAZAD M, ZAGHARI M, et al. Dietary fibers and crude protein content alleviate hepatic fat deposition and obesity in broiler breeder hens[J]. Poultry Science, 2012, 91(12): 3107-3114. DOI:10.3382/ps.2011-02040 |
| [68] |
罗娅, 齐先梅, 王婧. 苹果酸酶1及其对疾病调控的研究进展[J]. 生理科学进展, 2021, 52(3): 181-186. LUO Y, QI X M, WANG J. Advances in malic enzyme 1 and its functions on disease regulation[J]. Progress in Physiological Sciences, 2021, 52(3): 181-186 (in Chinese). DOI:10.3969/j.issn.0559-7765.2021.03.004 |
| [69] |
ADAMS K A, DAVIS A J. Dietary protein concentration regulates the mRNA expression of chicken hepatic malic enzyme[J]. The Journal of Nutrition, 2001, 131(9): 2269-2274. DOI:10.1093/jn/131.9.2269 |
| [70] |
SANZ M, FLORES A, LOPEZ-BOTE C J. The metabolic use of energy from dietary fat in broilers is affected by fatty acid saturation[J]. British Poultry Science, 2000, 41(1): 61-68. DOI:10.1080/00071660086411 |
| [71] |
FERRINI G, MANZANILLA E G, MENOYO D, et al. Effects of dietary n-3 fatty acids in fat metabolism and thyroid hormone levels when compared to dietary saturated fatty acids in chickens[J]. Livestock Science, 2010, 131(2/3): 287-291. |
| [72] |
AO X, KIM I H. Effects of dietary lipid sources on growth performance and carcass traits in Pekin ducks[J]. Poultry Science, 2020, 99(1): 499-504. DOI:10.3382/ps/pez558 |




