2. 北京食品营养与人类健康高精尖创新中心, 北京 100083;
3. 吉林农业大学动物科学技术学院, 长春 130118;
4. 安徽古特生物科技有限公司, 安庆 246000
2. Beijing Advanced Innovation Center for Food Nutrition and Human Health, Beijing 100083, China;
3. College of Animal Science and Technology, Jilin Agricultural University, Changchun 130118, China;
4. Anhui Gute Biotechnology Co., Ltd., Anqing 246000, China
谷胱甘肽(glutathione,GSH)是细胞内含量最丰富的低分子质量硫醇化合物,它主要以还原型的形式存在于真核细胞内,但也可以被氧化为谷胱甘肽二硫化物(GSSG)或与其他分子结合,如GSSG-辅酶A和GSSG-半胱氨酸。在细胞内,约90%的GSH分布在胞浆中,还有少量分布在亚细胞器中,如线粒体、细胞核和内质网[1],在细胞外间隙也可以发现相对较低含量的GSH[2-3]。细胞内GSH的稳态水平取决于GSSG的合成、水解、循环以及细胞内还原态、氧化态之间的平衡[2, 4]。GSH失衡会在多种病理条件下观察到,包括心脏代谢和心血管疾病、结核病、艾滋病、糖尿病、神经退行性疾病、阿尔茨海默氏病、不孕不育和癌症[5-7]。在一些动物试验研究中发现,GSH具有抵抗氧化应激、解毒、提高免疫能力、促进生长发育等功效,被添加到饲料中将有利于动物的健康养殖。
目前,GSH在医药、食品及化妆品领域已有广泛应用,但在动物保健领域的应用尚处于起步阶段,市场前景良好。本文就GSH的生理功能、发酵生产及其在动物生长与健康养殖中的应用和研究作以综述,旨在为动物的科学养殖与饲料生产提供参考。
1 GSH的生理功能 1.1 抗氧化作用活性氧(ROS)是细胞正常代谢的产物,参与机体的正常生理生化过程。因此,平衡ROS的产生和消除多余ROS,对于维持良好的生理环境是至关重要的[8]。氧化应激是由于正常的氧化平衡状态被破坏时所引起的一种生理现象。通常情况下,细胞可以应对轻微的氧化应激,而超过细胞自身抗氧化能力所导致的严重氧化应激会对DNA、蛋白质和脂质造成损伤,甚至导致细胞死亡。GSH是哺乳动物细胞中含量丰富的非酶类抗氧化剂,是细胞内抵御氧化应激的重要机制,也是对抗ROS的重要抗氧化系统防御线。
GSH在细胞内的合成有2个依赖ATP的步骤:首先,γ-谷氨酰半胱氨酸合成酶(γ-GCS)连接L-半胱氨酸(L-Cys)和谷氨酸(Glu)形成γ-谷氨酰半胱氨酸(γ-glutamylcysteine);然后,谷胱甘肽合成酶(GS)将甘氨酸(Gly)加到这个中间体上,完成最终产物的合成。GSH生理功能的基础主要是由于半胱氨酸的侧链基团上有1个活性巯基,它具有很强的供电子性。当电子丢失时,被氧化形成GSSG[9]。虽然细胞内GSH主要以还原性的形式存在,但严重的氧化应激可以降低细胞将GSSG还原为GSH的能力,从而导致GSSG的积累[10]。细胞的氧化还原状态通常指氧化型辅酶Ⅰ(NAD+)/还原型辅酶Ⅰ(NADH)、氧化型辅酶Ⅱ(NADP+)/还原型辅酶Ⅱ(NADPH)和GSH/GSSG的平衡。谷胱甘肽过氧化物酶(GSH-Px)将过氧化氢(H2O2)和脂质过氧化物(lipid peroxides,Lipid-OOH)分别转化为水和脂醇(lipid alcohols,Lipid-OH),GSH被氧化为GSSG,谷胱甘肽还原酶(GR)依赖于NADPH将GSSG还原为GSH,从而形成氧化还原循环,避免氧化损伤[9]。GSH在细胞内的氧化还原过程如图 1所示。
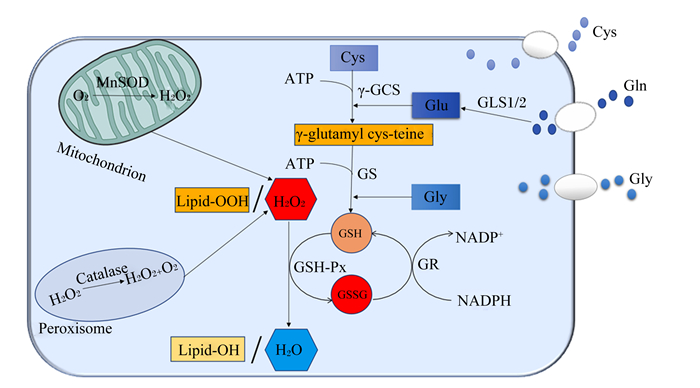
|
Mitochondrion:线粒体;Peroxisome:过氧化物酶体;MnSOD:锰超氧化物歧化酶 manganese superoxide dismutase;Catalase:过氧化氢酶;H2O2:过氧化氢 hydrogen peroxide;H2O:水 water;O2:氧气 oxygen;Cys:半胱氨酸 cysteine;Gln:谷氨酰胺 glutamine;GLS1/2:谷氨酰胺酶1/2 glutaminase 1/2;Glu:谷氨酸 glutamate;γ-GCS:γ-谷氨酰半胱氨酸合成酶 γ-glutamyl cys-teine synthetase;γ-glutamylcysteine:γ-谷氨酰半胱氨酸;ATP:三磷酸腺苷 adenosine triphosphate;GS:谷胱甘肽合成酶 glutathione synthase;Gly:甘氨酸 glycine;GSH-Px:谷胱甘肽过氧化物酶 glutathione peroxidase;GR:谷胱甘肽还原酶 glutathione reductase;NADP+:氧化型辅酶Ⅱ oxidized coenzyme Ⅱ;NADPH:还原型辅酶Ⅱ reduced coenzyme Ⅱ;GSH:谷胱甘肽 glutathione;GSSG:谷胱甘肽二硫化物 glutathione disulfide。 图 1 细胞内谷胱甘肽的合成及抗氧化作用 Fig. 1 Synthesis and antioxidation of intracellular glutathione[9] |
当免疫细胞向病原体发起进攻时,会释放出一些强氧化性的化学成分,这些化学成分对机体细胞是有害的,而GSH可以中和这些强氧化性的化学成分,从而保护免疫细胞[11]。GSH的免疫作用可以通过以下3种途径进行:1)直接参与免疫系统的抗感染和炎症反应;2)促进免疫细胞如淋巴细胞、白细胞、单核细胞等的增殖;3)通过调节免疫因子如白细胞介素、抗肿瘤坏死因子、溶菌酶来发挥作用。在机体的免疫系统中,GSH的消耗主要有2个途径:一是中和自由基,二是促进免疫细胞的增长。类似的研究还表明,免疫系统可以通过不同的细胞来抵抗感染和其他威胁,而这些细胞的健康生长和活力与GSH的含量有关[12]。
1.3 解毒作用组织中GSH含量最高的是肝脏,在肝脏有2个阶段的解毒过程。第1阶段主要是将脂溶性的有害化合物化学转化为中间体;第2阶段将中间体转化为水溶性物质,这些物质可以通过肠道或肾脏排泄。如果没有足够的GSH来产生第2阶段的酶,毒素将在肝脏中积累并产生危险[13]。一些外源物质如重金属、异生物质等,由于其具有吸引电子的能力,会引起氧化应激,甚至导致细胞、组织和器官的损伤。GSH在金属的运输、储存和代谢过程中发挥着重要作用,它主要通过以下途径发挥作用:1)在配体之间动员和运送金属;2)跨细胞膜运输金属;3)作为金属结合的半胱氨酸的来源;4)在涉及金属的氧化还原反应中作为还原剂或辅因子[14-15]。除此之外,GSH的半胱氨酸部分的巯基对金属有很高的亲和力,可以与几种金属如汞、银、镉、砷、铅、金、锌和铜等形成热力学稳定的硫醇[16-19]。在哺乳动物中,GSH结合物通常在肠道或肾脏通过水解和N-乙酰化进一步代谢,产生巯基尿酸,从尿液中排出。在细胞内发生的无论是酶促还是非酶促反应,与GSH结合都是一种非常重要的解毒手段[20]。在临床上,GSH也可作为解毒剂,用于丙烯腈、氟化物、一氧化碳、重金属、黄曲霉毒素及有机溶剂等中毒的解毒[21]。
2 GSH生产现状目前,生产GSH的方法主要存在4种途径:直接萃取法、化学合成法、酶转化法和微生物发酵法。直接萃取法的原理是利用有机溶剂从一些谷物的胚芽中萃取出GSH,但存在着纯度低、得率低等缺点[22]。化学合成法是以3种氨基酸为前体物质并在人工干预的条件下合成GSH[23],但是此法操作复杂,成本高昂。酶转化法制取GSH是一种效率比较高的方法,它的关键技术在于控制底物、ATP、GSH合成酶系的酶活性[24],但由于存在酶活性限制、ATP价格昂贵等不利因素,因此仍处于研究阶段,还没有实现工业生产。目前,生产GSH最主要的方法是微生物发酵法。微生物发酵法是以廉价的微生物原料为底物,利用微生物本身的反应体系来生产GSH。微生物发酵法不仅成本较低,而且避免了环境的污染,是如今生产GSH的较热门方法[25]。目前,也有尝试利用合成生物学技术在体外建立ATP循环技术耦合酶促生产GSH[26],该技术的应用有可能取代传统的微生物发酵法生产工艺,有望推动GSH的广泛应用。
3 微生物发酵法生产GSH微生物发酵法最常用的微生物菌种有2类:酵母和大肠杆菌。通常情况下,为了提高微生物发酵法的GSH产量,可以采用基因修饰改造菌株及对菌种的发酵条件进行优化。
3.1 基因修饰随机突变是最早应用的基因修饰技术之一。这项技术是基于应用诱变剂以提高微生物中发生的自然突变率,在突变体中筛选出优质菌株。在紫外诱变酿酒酵母后,突变体积累的GSH含量比野生型亲本菌株高出数倍[27]。Shao等[28]采用紫外和γ射线复合诱变技术,将产朊假丝酵母CCTCCM209298通过紫外线和γ射线进行复合诱变,并进一步优化培养基组分,最终积累的GSH含量比初始时提高了2.4倍。
随着基因工程、代谢工程、合成生物学等学科领域的发展,通过分子生物学手段将代谢流引向目的产物的合成逐渐取代了传统的诱变育种。在原核生物中,由谷胱甘肽合成酶基因(gsh1和gsh2)编码的基因可以合成GSH的2种酶:γ-GCS和GS,这2种基因在大肠杆菌中的表达水平影响GSH的产生[29]。由于GSH对γ-GCS的反馈抑制,从而限制了细胞内GSH的过度积累。Chen等[30]将对GSH的反馈抑制不敏感的嗜热链球菌编码的双功能酶和ATP调控系统成功地导入大肠杆菌BL21中,发酵后GSH含量是对照菌株的3倍。由于GSH的合成是高耗能反应,为提高合成酶活性,Xu等[31]通过基因组整合构建产朊假丝酵母的ATP6突变体;提高了ATP合成酶的活性,突变株的GSH含量提高了28.7%。蒋秋琪[32]在毕赤酵母突变菌株GS115-M7的基础上,将携带gsh1和gsh2基因的重组质粒整合在目标菌株基因组,最终获得1株稳定遗传的高产菌株GS115-M710,产量较重组前菌株提高了45.5%。
3.2 发酵条件优化通过基因修饰对菌种进行选育可以提高单个菌体合成GSH的能力,但还需要进一步提高单位体积细胞的数量。GSH发酵优化主要集中在培养条件、3种前体氨基酸添加量、辅因子ATP方面。高宇豪[33]在添加氨基酸前体的条件下,优化了柠檬酸钠的添加量,最终摇瓶中GSH含量最高可达(371.12±8.47) mg/L。Schmacht等[34]研究了酿酒酵母Sa-07346生产GSH的最佳生长条件,通过在发酵后期连续添加半胱氨酸,结果发现GSH含量与没有添加半胱氨酸的对照组相比增加了253%。
4 GSH在动物生产中的应用GSH是一种能提高动物机体免疫功能、节约饲料、促进动物生长和改善肉品质的新型饲料添加剂。饲粮中添加GSH可以促进畜禽的健康养殖,降低抗生素的用量,改善肉制品的质量和安全,具有很好的应用前景。饲粮中添加GSH对不同物种的功能及机制见表 1。
|
|
表 1 饲粮中添加GSH对不同物种的功能及机制 Table 1 Function of dietary glutathione supplementation in different species and its mechanism |
在养殖业中,饲粮添加适量的GSH对动物的生长发育有积极的影响,能促进动物生长,节约饲料,降低生产成本。在正常范围内,它会增加动物生长激素含量,以及软骨和骨骼的生长。周艳玲[42]研究发现,饲料中添加GSH可以提高黄颡鱼幼鱼的生长性能及全鱼粗脂肪和粗蛋白质含量;但随着GSH添加量的增加,黄颡鱼的生长性能会呈现出先升高后下降的变化趋势。在给中华绒螯蟹[43]喂食不同含量的GSH 10周后,随着饲料中GSH含量从0增加到900 mg/kg,中华绒螯蟹的体重增加率和存活率显著增加。从已有的对鱼类的一些研究发现,GSH在鱼类饲料中的适宜添加量为350~380 mg/kg[44]。过高的GSH添加量会损伤鱼体,从而降低鱼体的健康状况和生长性能。这说明GSH的添加量有一个适宜的范围,不然就可能对养殖动物产生不利的影响。
在对一些哺乳动物的研究中也发现了GSH的促进生长作用,郑梦奇等[45]研究发现,饲粮中添加GSH可以提高育肥猪的日增重、胴体瘦肉率和饲料利用率。刘平祥[46]研究发现,饲粮中添加适宜剂量的GSH可以促进断奶仔猪的生长。同样,宋增廷等[47]研究发现,饲粮中添加GSH提高了育肥羊的饲料利用率和增重率。
4.2 增强动物抵抗氧化应激能力为了应对氧化应激产生的不良影响,许多养殖动物自身拥有一套包括酶和非酶机制的抗氧化防御系统[48]。GSH作为细胞中重要的抗氧化剂,可以抵抗动物养殖过程中所产生的不良应激。冯具攀等[49]在饲料中添加GSH饲喂克氏原螯虾后,结果显示,高温应激下,与对照组相比,添加0.24和0.30 g/kg GSH显著提高了血淋巴中总抗氧化能力(T-AOC)及总超氧化物歧化酶(T-SOD)、过氧化氢酶(CAT)、GSH-Px活性,显著降低了丙二醛(MDA)含量;生长性能方面,添加0.18、0.24、0.30 g/kg GSH显著提高了增重率,其中添加0.30 g/kg GSH时增重率最高;这表明饲喂GSH能有效增强克氏原螯虾的抗氧化能力。张延涛[50]研究发现,饲粮中添加适量GSH可显著提高仔猪血清GSH-Px活性,对仔猪断奶产生的应激造成的氧化损伤有一定的保护和缓解作用。在草鱼的饲料中添加适量GSH能显著提高肝脏和血清抗氧化酶活性,并能降低肝脏和血清MDA含量。在饲料中添加407.45 mg/kg GSH能提高草鱼对微囊藻毒素(MC-LR)暴露下的天然免疫能力、抗氧化应激能力和解毒功能;相反,饲料中添加过量的GSH可能会促进氧化,从而产生负面影响;以上试验数据表明,适宜的GSH添加量可以有效防止草鱼的氧化损伤,饲料中添加过量的GSH可能会产生超氧阴离子,导致氧化应激损伤[36]。
4.3 提高动物的免疫能力动物需要提高免疫力以应对流行性疾病的到来。以往的研究表明,饲粮中添加GSH可以改善动物的生长性能,提高免疫能力和抗氧化能力,达到增强免疫力的作用。Ming等[51]研究发现,饲料中添加适量的GSH能促进幼草鱼的生长,提高成活率,降低饲料转化率,提高非特异性免疫能力、抗氧化能力以及肝脏胰岛素样生长因子-Ⅰ(IGF-Ⅰ)和热休克蛋白70(HSP70) mRNA的表达水平,增强对病原菌侵染的抵抗力。然而,饲料中添加过量的GSH对鱼类有负面影响。罗斌等[52]在用陈化玉米喂养仔猪后,仔猪的免疫能力和抗氧化能力下降,而添加GSH酵母粉可以改善陈化玉米所带来的负面效应。刘玫珊等[53]通过鸡球虫卵囊感染健康雏鸡,并用马来酸二乙酯降低雏鸡血浆GSH含量,来观察GSH所发挥的免疫能力,结果表明,谷脱甘肤能提高机体的抗病力,其机理主要是通过细胞免疫途径起作用。这些研究结果为GSH提高动物的免疫能力提供了科学依据。
4.4 缓解毒性影响GSH具有重要的解毒作用,当机体摄入有毒有害物质时,GSH能与有毒化物质结合,形成巯基尿酸并使其排泄出体外,从而起到解毒的作用[54]。董桂芳等[55]对饲喂了蓝藻粉饲料的黄颡鱼研究中发现,在饲料中添加500~800 mg/kg GSH时,黄颡鱼组织中微囊藻毒素含量显著降低,说明GSH对毒性效应起到了一定的缓解作用。但此处GSH的适宜添加量与草鱼[36]的研究结果有些冲突,这个添加量对草鱼是有害的。分析有2个可能性:一是由于鱼的种类不同;二是黄颡鱼长期饲喂蓝藻粉饲料并补充GSH,在此期间GSH与微囊藻毒素可能形成了复合物来降低毒性,从而需要更高剂量的GSH达到更好的解毒效果;而Ming等[36]是先补充GSH,然后短期注射微囊藻毒素刺激,周期短,GSH的消耗量相对较少。任胜杰等[56]研究还原性GSH对异育银鲫生长及辛硫磷中毒后的解毒效果,急性攻毒后试验组的死亡率均显著低于对照组,且添加量越高死亡率越低,各试验组鱼肝脏中辛硫磷残留量均显著低于对照组,得出适宜的GSH添加量为400 mg/kg,从而为GSH对鱼类生长及辛硫磷中毒的解毒效果提供了基础数据。Conners等[57]通过使用GSH合成的抑制剂丁硫氨酸亚砜胺(BSO),研究了GSH耗竭对铜暴露下牡蛎的金属硫蛋白表达、溶酶体膜失稳和脂质过氧化的影响;在暴露于铜的牡蛎中,金属硫蛋白的诱导受到抑制,细胞的应激反应高于单独暴露于铜的牡蛎。这些结果表明,导致GSH耗竭的条件会增大污染物的不利影响。
5 小结与展望目前的研究结果显示,GSH对动物的健康养殖有良好的前景。然而,市场上GSH的售价偏高,限制了其在畜禽养殖中的应用。因此,应采取科学而高效的研究来降低GSH的生产成本,并将GSH作为饲料添加剂开展更深入的研究。相信GSH在畜禽养殖、水产养殖等领域将得到更广泛的应用,对动物的健康养殖产生更积极的影响。
| [1] |
SCIRÈ A, CIANFRUGLIA L, MINNELLI C, et al. Glutathione compartmentalization and its role in glutathionylation and other regulatory processes of cellular pathways[J]. BioFactors, 2019, 45(2): 152-168. DOI:10.1002/biof.1476 |
| [2] |
AQUILANO K, BALDELLI S, CIRIOLO M R. Glutathione: new roles in redox signaling for an old antioxidant[J]. Frontiers in Pharmacology, 2014, 5: 196. |
| [3] |
BANERJEE R. Redox outside the box: linking extracellular redox remodeling with intracellular redox metabolism[J]. Journal of Biological Chemistry, 2012, 287(7): 4397-4402. DOI:10.1074/jbc.R111.287995 |
| [4] |
ESPINOSA-DIEZ C, MIGUEL V, MENNERICH D, et al. Antioxidant responses and cellular adjustments to oxidative stress[J]. Redox Biology, 2015, 6: 183-197. DOI:10.1016/j.redox.2015.07.008 |
| [5] |
BAJIC V P, VAN NESTE C, OBRADOVIC M, et al. Glutathione"redox homeostasis"and its relation to cardiovascular disease[J]. Oxidative Medicine and Cellular Longevity, 2019, 2019: 5028181. |
| [6] |
ADEOYE O, OLAWUMI J, OPEYEMI A, et al. Review on the role of glutathione on oxidative stress and infertility[J]. JBRA Assisted Reproduction, 2018, 22(1): 61-66. |
| [7] |
TESKEY G, ABRAHEM R, CAO R Q, et al. Glutathione as a marker for human disease[J]. Advances in Clinical Chemistry, 2018, 87: 141-159. |
| [8] |
GORRINI C, HARRIS I S, MAK T W. Modulation of oxidative stress as an anticancer strategy[J]. Nature Reviews Drug Discovery, 2013, 12(12): 931-947. DOI:10.1038/nrd4002 |
| [9] |
LV H H, ZHEN C X, LIU J Y, et al. Unraveling the potential role of glutathione in multiple forms of cell death in cancer therapy[J]. Oxidative Medicine and Cellular Longevity, 2019, 2019: 3150145. |
| [10] |
MINICH D M, BROWN B I. A review of dietary (phyto) nutrients for glutathione support[J]. Nutrients, 2019, 11(9): 2073. DOI:10.3390/nu11092073 |
| [11] |
DRÖGE W, BREITKREUTZ R. Glutathione and immune function[J]. Proceedings of the Nutrition Society, 2000, 59(4): 595-600. DOI:10.1017/S0029665100000847 |
| [12] |
GHEZZI P. Role of glutathione in immunity and inflammation in the lung[J]. International Journal of General Medicine, 2011, 4: 105-113. |
| [13] |
GRANT D M. Detoxification pathways in the liver[J]. Journal of Inherited Metabolic Disease, 1991, 14(4): 421-430. DOI:10.1007/BF01797915 |
| [14] |
BECKER A, SOLIMAN K F A. The role of intracellular glutathione in inorganic mercury-induced toxicity in neuroblastoma cells[J]. Neurochemical Research, 2009, 34(9): 1677-1684. DOI:10.1007/s11064-009-9962-3 |
| [15] |
ZEEVALK G D, BERNARD L P, GUILFORD F T. Liposomal-glutathione provides maintenance of intracellular glutathione and neuroprotection in mesencephalic neuronal cells[J]. Neurochemical Research, 2010, 35(10): 1575-1587. DOI:10.1007/s11064-010-0217-0 |
| [16] |
VAN BLADEREN P J, BREIMER D D, ROTTEVEEL-SMIJS G M, et al. The relation between the structure of vicinal dihalogen compounds and their mutagenic activation via conjugation to glutathione[J]. Carcinogenesis, 1981, 2(6): 499-505. DOI:10.1093/carcin/2.6.499 |
| [17] |
RANNUG U. Genotoxic effects of 1, 2-dibromoethane and 1, 2-dichloroethane[J]. Mutation Research/Reviews in Genetic Toxicology, 1980, 76(3): 269-295. DOI:10.1016/0165-1110(80)90020-2 |
| [18] |
RANNUG U, SUNDVALL A, RAMEL C. The mutagenic effect of 1, 2-dichloroethane on Salmonella typhimurium Ⅰ.Activation through conjugation with glutathion in vitro[J]. Chemico-Biological Interactions, 1978, 20(1): 1-16. DOI:10.1016/0009-2797(78)90076-5 |
| [19] |
赵凤. 砷—谷胱甘肽复合物的降解及含砷化合物对谷胱甘肽清除自由基的影响[D]. 硕士学位论文. 天津: 天津大学, 2012. ZHAO F. Study on the degradation of arsenic-glutathione and the influence of arsenicals for free radical scavenging by glutathione[D]. Master's Thesis. Tianjin: Tianjin University, 2012. (in Chinese) |
| [20] |
KETTERER B, COLES B, MEYER D J. The role of glutathione in detoxication[J]. Environmental Health Perspectives, 1983, 49: 59-69. DOI:10.1289/ehp.834959 |
| [21] |
袁尔东, 郑建仙. 功能性食品基料——谷胱甘肽的研究进展[J]. 食品与发酵工业, 1999(5): 52-57. YUAN E D, ZHENG J X. Development of functional food ingredient——glutathione[J]. Food and Fermentation Industries, 1999(5): 52-57 (in Chinese). DOI:10.3321/j.issn:0253-990X.1999.05.012 |
| [22] |
徐丽萍, 王鑫, 邢超. 溶剂法纯化还原型谷胱甘肽工艺的研究[J]. 食品工业科技, 2011, 32(12): 348-350. XU L P, WANG X, XING C. Study on the purification process of reduced glutathione with the method of solvent[J]. Science and Technology of Food Industry, 2011, 32(12): 348-350 (in Chinese). |
| [23] |
HARINGTON C R, MEAD T H. Synthesis of glutathione[J]. The Biochemical Journal, 1935, 29(7): 1602-1611. |
| [24] |
张星, 崔向伟, 李宗霖, 等. 基于能量循环再生系统酶法生产谷胱甘肽[J]. 华东理工大学学报(自然科学版), 2020, 46(5): 688-693. ZHANG X, CUI X W, LI Z L, et al. Enzymatic synthesis of glutathione based on energy regeneration system[J]. Journal of East China University of Science and Technology (Natural Science Edition), 2020, 46(5): 688-693 (in Chinese). |
| [25] |
SCHMACHT M, LORENZ E, SENZ M. Microbial production of glutathione[J]. World Journal of Microbiology & Biotechnology, 2017, 33(6): 106. |
| [26] |
ZHANG X, WU H, HUANG B, et al. One-pot synthesis of glutathione by a two-enzyme cascade using a thermophilic ATP regeneration system[J]. Journal of Biotechnology, 2017, 241: 163-169. |
| [27] |
NISAMEDTINOV I, KEVVAI K, ORUMETS K, et al. Metabolic changes underlying the higher accumulation of glutathione in Saccharomyces cerevisiae mutants[J]. Applied Microbiology and Biotechnology, 2011, 89(4): 1029-1037. |
| [28] |
SHAO N, WANG D H, WEI G Y, et al. Screening of Candida utilis and medium optimization for co-production of S-adenosylmethionine and glutathione[J]. Korean Journal of Chemical Engineering, 2010, 27(6): 1847-1853. |
| [29] |
LIAO X Y, SHEN W, CHEN J, et al. Improved glutathione production by gene expression in Escherichia coli[J]. Letters in Applied Microbiology, 2006, 43(2): 211-214. |
| [30] |
CHEN Y W, CAO Y T, KONG W Z, et al. Enhanced glutathione production by bifunctional enzyme coupling with ydaO-based ATP regulating system in Escherichia coli[J]. Journal of Functional Foods, 2020, 75: 104211. |
| [31] |
XU R Y, WANG D H, WANG C L, et al. Improved S-adenosylmethionine and glutathione biosynthesis by heterologous expression of an ATP6 gene in Candida utilis[J]. Journal of Basic Microbiology, 2018, 58(10): 875-882. |
| [32] |
蒋秋琪. 改造毕赤酵母提高谷胱甘肽的合成效率[D]. 硕士学位论文. 无锡: 江南大学, 2020. JIANG Q Q. Modification of Pichia pastoris to increase glutathione synthesis efficiency[D]. Master's Thesis. Wuxi: Jiangnan University, 2020. (in Chinese) |
| [33] |
高宇豪. 高产谷胱甘肽毕赤酵母工程菌的构建与发酵优化[D]. 硕士学位论文. 无锡: 江南大学, 2021. GAO Y H. Construction and fermentation optimization of engineered Pichia pastoris for improved glutathione production[D]. Master's Thesis. Wuxi: Jiangnan University, 2021. (in Chinese) |
| [34] |
SCHMACHT M, LORENZ E, STAHL U, et al. Medium optimization based on yeast's elemental composition for glutathione production in Saccharomyces cerevisiae[J]. Journal of Bioscience and Bioengineering, 2017, 123(5): 555-561. |
| [35] |
XIA Z Q, WU S J. Effects of glutathione on the survival, growth performance and non-specific immunity of white shrimps (Litopenaeus vannamei)[J]. Fish & Shellfish Immunology, 2018, 73: 141-144. |
| [36] |
MING J H, YE J Y, ZHANG Y X, et al. Dietary optimal reduced glutathione improves innate immunity, oxidative stress resistance and detoxification function of grass carp (Ctenopharyngodon idella) against microcystin-LR[J]. Aquaculture, 2019, 498: 594-605. |
| [37] |
XUE S Q, CHEN S M, GE Y X, et al. Regulation of glutathione on growth performance, biochemical parameters, non-specific immunity, and related genes of common carp (Cyprinus carpio) exposed to ammonia[J]. Aquaculture, 2022, 546: 737241. |
| [38] |
SCHAUER R J, GERBES A L, VONIER D, et al. Glutathione protects the rat liver against reperfusion injury after prolonged warm ischemia[J]. Annals of Surgery, 2004, 239(2): 220-231. |
| [39] |
MA X Y, TIAN Z M, CUI Y Y, et al. Effects of glutathione on growth performance and intestinal health of piglets[J]. Journal of Animal Science, 2019, 97(Suppl.3): 19. |
| [40] |
刘丽, 韦建福, 傅伟龙, 等. 还原型谷胱甘肽对肉鸡生长及血清IGF-1水平、组织IGF-1 mRNA表达的影响[J]. 中国兽医学报, 2008, 28(8): 982-986. LIU L, WEI J F, FU W L, et al. Effects of dietary supplementation of reduced glutathione on growth and IGF-1 level in serum and IGF-1 mRNA expression in tissues of broilers[J]. Chinese Journal of Veterinary Science, 2008, 28(8): 982-986 (in Chinese). |
| [41] |
姜宁, 张爱忠, 宋增廷, 等. 谷胱甘肽对育肥羊生长性能及生长激素/胰岛素样生长因子-Ⅰ轴调控作用的研究[J]. 动物营养学报, 2009, 21(3): 312-318. JIANG N, ZHANG A Z, SONG Z T, et al. Manipulation of glutathione on growth performance and growth hormone/insulin-like growth factor-Ⅰ axis in fattening sheep[J]. Chinese Journal of Animal Nutrition, 2009, 21(3): 312-318 (in Chinese). |
| [42] |
周艳玲. 谷胱甘肽对黄颡鱼生长性能和抗氧化功能的影响[D]. 硕士学位论文. 武汉: 华中农业大学, 2018. ZHOU Y L. Effects of glutathione on growth performance and antioxidant function of yellow catfish, Pelteobagrus fulvidraco[D]. Master's Thesis. Wuhan: Huazhong Agricultural University, 2018. (in Chinese) |
| [43] |
LIU J D, LIU W B, ZHANG D D, et al. Dietary reduced glutathione supplementation can improve growth, antioxidant capacity, and immunity on Chinese mitten crab, Eriocheir sinensis[J]. Fish & Shellfish Immunology, 2020, 100: 300-308. |
| [44] |
姚晨阳, 刘敬, 张启美, 等. 谷胱甘肽在水产养殖中的应用研究进展[J]. 山东科学, 2016, 29(1): 105-109. YAO C Y, LIU J, ZHANG Q M, et al. Application advances of glutathione in aquaculture[J]. Shandong Science, 2016, 29(1): 105-109 (in Chinese). |
| [45] |
郑梦奇, 应志豪, 蔡志军. 育肥猪日粮中添加谷胱甘肽的使用效果试验[J]. 畜牧与兽医, 2009, 41(8): 46-47. ZHENG M Q, YING Z H, CAI Z J. Effects of glutathione supplementation on diet of finishing pigs[J]. Animal Husbandry & Veterinary Medicine, 2009, 41(8): 46-47 (in Chinese). |
| [46] |
刘平祥. 谷胱甘肽对断奶仔猪的促生长作用及其机制[D]. 博士学位论文. 广州: 华南农业大学, 2002. LIU P X. Effects of glutathione on growth promotion of weaner piglets and its mechanism[D]. Ph. D. Thesis. Guangzhou: South China Agricultural University, 2002. (in Chinese) |
| [47] |
宋增廷, 姜宁, 张爱忠, 等. 谷胱甘肽对肉羊生长性能、屠宰性能及肉品质的影响[J]. 畜牧与兽医, 2008, 40(11): 14-17. SONG Z T, JIANG N, ZHANG A Z, et al. Effect of glutathione on growth performance, carcass traits and meat quality in sheep[J]. Animal Husbandry & Veterinary Medicine, 2008, 40(11): 14-17 (in Chinese). |
| [48] |
DEPONTE M. Glutathione catalysis and the reaction mechanisms of glutathione-dependent enzymes[J]. Biochimica et Biophysica Acta, 2013, 1830(5): 3217-3266. |
| [49] |
冯具攀, 魏开金, 徐进, 等. 谷胱甘肽对克氏原螯虾生长和抗高温应激的影响[J]. 淡水渔业, 2021, 51(4): 95-100. FENG J P, WEI K J, XU J, et al. Effect of glutathione on the growth and resistance to high temperature stress of Procambarus clarkii[J]. Freshwater Fisheries, 2021, 51(4): 95-100 (in Chinese). |
| [50] |
张延涛. 谷胱甘肽对断奶仔猪生长与免疫的影响[D]. 硕士学位论文. 广州: 华南农业大学, 2001. ZHANG Y T. Effects of glutathione on growth and immunity of weaned piglets[D]. Master's Thesis. Guangzhou: South China Agricultural University, 2001. (in Chinese) |
| [51] |
MING J H, YE J Y, ZHANG Y X, et al. Effects of dietary reduced glutathione on growth performance, non-specific immunity, antioxidant capacity and expression levels of IGF-Ⅰ and HSP70 mRNA of grass carp (Ctenopharyngodon idella)[J]. Aquaculture, 2015, 438: 39-46. |
| [52] |
罗斌, 乐科明, 陈代文, 等. 陈化玉米及谷胱甘肽酵母粉对断奶仔猪生长性能、养分表观消化率、血清抗氧化和免疫指标的影响[J]. 动物营养学报, 2019, 31(4): 1574-1584. LUO B, LE K M, CHEN D W, et al. Effects of aging maize and glutathione yeast on growth performance, nutrient apparent digestibility, serum antioxidant and immune indices of weaning piglets[J]. Chinese Journal of Animal Nutrition, 2019, 31(4): 1574-1584 (in Chinese). |
| [53] |
刘玫珊, 胡建民, 孙宝贵, 等. 鸡谷胱甘肽水平与抗病力的相关性研究[J]. 辽宁畜牧兽医, 1994(2): 11-13. LIU M S, HU J M, SUN B G, et al. Study on the correlation between glutathione level and disease resistance in chicken[J]. Liaoning Journal of Animal Husbandry and Veterinary Medicine, 1994(2): 11-13 (in Chinese). |
| [54] |
周艳玲, 孙育平, 黄燕华, 等. 水产动物谷胱甘肽营养生理作用的研究进展[J]. 饲料研究, 2016(19): 38-43, 53. ZHOU Y L, SUN Y P, HUANG Y H, et al. Research progress on nutritional and physiological effects of glutathione in aquatic animals[J]. Feed Research, 2016(19): 38-43, 53 (in Chinese). |
| [55] |
董桂芳, 朱晓鸣, 杨云霞, 等. 黄颡鱼饲料中添加谷胱甘肽降低藻毒素毒性作用的研究[J]. 水生生物学报, 2010, 34(4): 722-730. DONG G F, ZHU X M, YANG Y X, et al. Dietary supplemental glutathione (GSH) could reduce the toxicity of microsystins on yellow catfish (Pelteobagrus fulvidraco Richardson)[J]. Acta Hydrobiologica Sinica, 2010, 34(4): 722-730 (in Chinese). |
| [56] |
任胜杰, 郑曙明, 宋艳, 等. 谷胱甘肽对异育银鲫生长及辛硫磷解毒的影响[J]. 西南农业学报, 2016, 29(12): 3009-3014. REN S J, ZHENG S M, SONG Y, et al. Effect of dietary glutathione on Carassius auratus gibelio growth performance and phoxim poisoning[J]. Southwest China Journal of Agricultural Sciences, 2016, 29(12): 3009-3014 (in Chinese). |
| [57] |
CONNERS D E, RINGWOOD A H. Effects of glutathione depletion on copper cytotoxicity in oysters (Crassostrea virginica)[J]. Aquatic Toxicology, 2000, 50(4): 341-349. |




