2. 河南新仰韶生物科技有限公司, 三门峡 472400
2. Henan New Yangshao Biotechnology Co., Ltd., Sanmenxia 472400, China
产蛋后期蛋鸡的生理机能逐渐退化,同时由于集约化养殖环境中各种应激因素的影响,鸡群常处于氧化应激状态,产蛋性能降低,肠道组织形态变差,肠道微生物群落失调,利用年限缩短。因此,研究高效绿色饲料添加剂对产蛋后期蛋鸡产蛋性能、肠道组织形态以及肠道微生物的影响对于提高蛋鸡养殖的经济效益有重要意义。随着全面禁抗时代的到来,寻找抗生素的有效替代品成为研究的热点,其中酶制剂是很好的抗生素替代品之一。葡萄糖氧化酶(GOD)是一种氧化还原酶,在有氧条件下能将β-D-葡萄糖分解为葡萄糖酸和过氧化氢,反应消耗氧气和产生葡萄糖酸为肠道有益菌提供有利生存环境,无毒无害,其提高蛋鸡生产性能、改善蛋鸡肠道健康的作用已经在前人的研究中得到证实。王恒毅等[1]研究发现,在饲粮中添加0.2%的GOD可提高蛋鸡的产蛋率,降低采食量、料蛋比及死淘率,节约生产成本。Wu等[2]研究发现,对于21日龄的肉仔鸡,添加GOD组与添加抗生素生长促进剂组相比,肉仔鸡盲肠中细菌多样性显著增加,但与对照组相比没有显著差异;此外,Alpha多样性指数如AEC、Chao1、Shannon和Simpson指数也没有发现显著性变化。但是目前关于GOD对盲肠微生物的研究只关注几种常见菌种,本试验旨在系统探究GOD对蛋鸡盲肠微生物的影响,为蛋鸡肠道微生物的研究提供数据。
1 材料与方法 1.1 试验设计及饲养管理选取270只产蛋率相近的70周龄海兰褐蛋鸡,随机分为3组,每组6个重复,每个重复15只鸡。经统计学分析,各组产蛋率无显著差异(P>0.05)。对照组饲喂基础饲粮,试验Ⅰ组、试验Ⅱ组分别在基础饲粮中添加150、300 mg/kg活性为1 000 U/g的GOD。预试期7 d,正试期50 d。饲养试验在河南省洛阳市新安县红雨养殖场进行。试验蛋鸡采用3层阶梯式笼养,每笼3只蛋鸡。试验蛋鸡的饲养管理与本鸡场的饲养管理相同,鸡舍采用自然光照加人工补光(16 h/d,光照程序控制器控制),鸡舍温度为(20±2) ℃,相对湿度为50%~60%,自然通风结合纵向负压通风。试验蛋鸡自由采食,每天07:00、14:00及18:00各喂料1次,每天匀料3次,保证料槽中料量均匀;乳头式饮水器自由饮水。每天15:30清1次粪,16:00收蛋。基础饲粮参照NRC(1994)营养需要配制成粉状配合饲粮,其组成及营养水平参见文献[3]。
1.2 产蛋性能测定每天17:00收集蛋,以每组各重复为单位记录每天的产蛋数、蛋重、破蛋数及蛋鸡死淘数;每周统计采食量,计算全期的产蛋率、平均日产蛋重、平均日采食量、料蛋比及破蛋率。
1.3 肠道组织形态测定饲养试验结束后,每个重复随机选取1只鸡屠宰,分别采集每只鸡的十二指肠、空肠和回肠中段2 cm[4],将取下的组织放在新鲜的4%多聚甲醛中固定24 h以上,以备制作肠道组织石蜡切片,观察肠道组织形态。在制备的肠道组织切片上选取6个典型视野,用CaseViewer图像分析软件测量绒毛高度(villous height,VH)、隐窝深度(crypt depth,CD)、肠壁厚度(intestinal wall thickness),并计算绒隐比(VH/CD)[5]。
1.4 盲肠微生物多样性检测盲肠样品的采集:在屠宰试验鸡的同时,分别从对照组、300 mg/kg GOD组宰杀的鸡中随机在相同部位截取4段相同长度的盲肠样品,将截取下来的8个盲肠样品放入EP管中,并快速放进液氮中保存,最后放入-80 ℃冰箱中保存,以备检测其微生物多样性及结构。盲肠样品进行16S rDNA V3~V4区扩增与高通量测序分析。
1.5 数据分析产蛋性能、肠道组织形态的数据均以平均值±标准差表示,用统计软件SPSS 22.0进行单因素方差分析(one-way ANOVA),差异显著时,用Duncan氏法进行多重比较检验[4]。盲肠微生物多样性采用Alpha多样性分析,相关指数用统计软件SPSS 22.0进行独立样本t检验,群落结构采用层级聚类分析和物种丰度circos分析,对照组和300 mg/kg GOD组的8个样本中不同种类微生物相对丰度的数据采用SPSS 22.0进行独立样本t检验。P < 0.05为差异显著,P < 0.01为差异极显著。
2 结果与分析 2.1 GOD对蛋鸡产蛋性能的影响由表 1可知,150 mg/kg GOD组、300 mg/kg GOD组产蛋率显著高于对照组(P < 0.05);300 mg/kg GOD组平均日产蛋重显著高于对照组与150 mg/kg GOD组(P < 0.05),150 mg/kg GOD组与对照组无显著差异(P>0.05);300 mg/kg GOD组料蛋比显著低于对照组(P < 0.05),150 mg/kg GOD组与对照组无显著差异(P>0.05);各试验组平均日采食量与破蛋率与对照组均无显著差异(P>0.05)。
|
|
表 1 GOD对蛋鸡产蛋性能的影响 Table 1 Effects of GOD on laying performance of laying hens |
由表 2可知,与对照组相比,150 mg/kg GOD组和300 mg/kg GOD组蛋鸡十二指肠、空肠和回肠绒毛高度显著提高(P < 0.05);300 mg/kg GOD组蛋鸡十二指肠绒隐比显著提高(P < 0.05)。
|
|
表 2 GOD对蛋鸡肠道组织形态的影响 Table 2 Effects of GOD on intestinal morphology of laying hens |
由表 3可知,在产蛋后期蛋鸡饲粮中添加300 mg/kg GOD对盲肠微生物操作分类单元(OTU)数目以及反映物种多样性的Shannon、Chao1、PD指数均无显著影响(P>0.05)。
|
|
表 3 Alpha多样性指数 Table 3 Alpha diversity indexes |
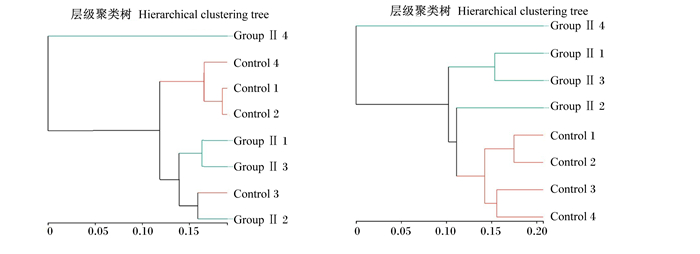
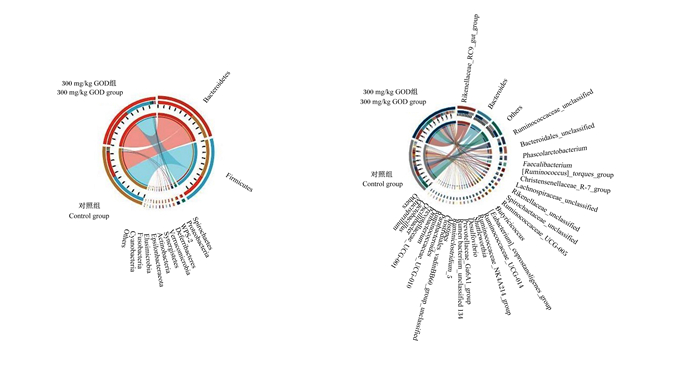
如图 1所示,根据层级聚类分析的结果在门水平上可将8个样本分为4个类群,即Group Ⅱ 4为一个类群,Control 1、Control 2、Control 4为一个类群,Group Ⅱ 1、Group Ⅱ 3为一个类群,Control 3和Group Ⅱ 2为一个类群,并不能表现出对照组和300 mg/kg GOD组间物种组成差异;在属的水平上8个样本也是分为4个类群,即Group Ⅱ 4为一个类群,Group Ⅱ 1、Group Ⅱ 3为一个类群,Group Ⅱ 2为一个类群,Control 1、Control 2、Control 3、Control 4为一个类群,这表明在属的水平上300 mg/kg GOD组与对照组物种组成存在差异。在门水平和属水平上的物种丰度见图 2。如表 4所示,在门水平上,饲粮中添加300 mg/kg GOD可以极显著增加螺旋菌门(Spirochaetes)、迷踪菌门(Elusimicrobia)的相对丰度(P < 0.01),显著降低蓝藻菌门(Cyanobacteria)的相对丰度(P < 0.05),极显著降低疣微菌门(Verrucomicrobia)的相对丰度(P < 0.01);同时,还可以增加拟杆菌门(Bacteroidetes)的相对丰度,降低厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)的相对丰度,但差异均未达显著水平(P>0.05)。如表 5所示,在属水平上,饲粮中添加300 mg/kg GOD可以显著增加拟杆菌属(Bacteroides)、未分类的瘤胃球菌科(Ruminococcaceae_unclassified)的相对丰度(P < 0.05),极显著增加瘤胃球菌科NK4A214群(Ruminococcaceae_NK4A214_group)的相对丰度(P < 0.01),显著降低普雷沃氏菌科UCG-001(Prevotellaceae_UCG-001)的相对丰度(P < 0.05);同时,还可以增加未分类的拟杆菌目(Bacteroidales_unclassified)、乳杆菌属(Lactobacillus)、瘤胃球菌科UCG-010(Ruminococcaceae_UCG-010)的相对丰度,降低粪便杆菌属(Faecalibacterium)、未分类的毛螺菌科(Lachnospiraceae_unclassified)、瘤胃球菌科UCG-014(Ruminococcaceae_UCG-014)、克里斯滕森菌科R7群(Christensenellaceae_R-7_group)、瘤胃球菌科UCG-005(Ruminococcaceae_UCG-005)、副杆菌属(Parabacteroides)、脱硫弧菌属(Desulfovibrio)的相对丰度,但差异均未达到显著水平(P>0.05)。
|
Control 1、Control 2、Control 3和Control 4为对照组的4个样本,Group Ⅱ 1、Group Ⅱ 2、Group Ⅱ 3、Group Ⅱ 4为300 mg/kg GOD组的4个样本。 Control 1, Control 2, Control 3 and Control were 4 samples from the control group, and Group Ⅱ 1, Group Ⅱ 2, Group Ⅱ 3 and Group Ⅱ 4 were 4 samples from the 300 mg/kg GOD group. 图 1 在门(左)和属(右)水平上的层级聚类图 Fig. 1 Hierararchical cluster diagram at phylum level (left) and on genus level (right) |
|
Bacteroidetes:拟杆菌门;Firmicutes:厚壁菌门;Spirochaetes:螺旋菌门;Proteobacteria:变形菌门;Deferribacteres:脱铁杆菌门;Verrucomicrobia:疣微菌门;Synergistetes:互养菌门;Actinobacteria:放线菌门;Elusimicrobia:迷踪菌门;Fusobacteria:梭杆菌门;Cyanobacteria:蓝藻菌门;Rikenellaceae_RC9_gut_group:理研菌科RC9肠道群;Bacteroides:拟杆菌属;Ruminococcaceae_unclassified:未分类的瘤胃球菌科;Bacteroidales_unclassified:未分类的拟杆菌目;Phascolarctobacterium:考拉杆菌属;Faecalibacterium:粪便杆菌属;[Ruminococcus]_torques_group:瘤胃球菌属扭链群;Christensenellaceae_R-7_group:克里斯滕森菌科R-7群;Lachnospiraceae_unclassified:未分类的毛螺菌科;Rikenellaceae_unclassified:未分类的理研菌科;Spirochaetaceae_unclassified:未分类的螺旋体科;Ruminococcaceae_UCG-005:瘤胃球菌科UCG-005;Butyricicoccus:丁球菌属;[Eubacterium]_coprostanoligenes_group:产粪甾醇真杆菌;Ruminococcaceae_UCG-014:瘤胃球菌科UCG-014;Ruminococcaceae_NK4A214_group: 瘤胃球菌科NK4A214群;Desulfovibrio:脱硫弧菌属;Prevotellaceae_Ga6A1_group:普雷沃氏菌科Ga6A1群;Rumen bacterium_unclassified 134:未分类的瘤胃细菌134;Ruminiclostridium_5:瘤胃梭菌属5;Alistipes:另枝菌属;Clostridiales_vadinBB60_group_unclassified:未分类的梭菌目vadinBB60群;Parabacteroides:副杆菌属;Ruminococcaceae_UCG-010:瘤胃球菌科UCG-010;Oribacterium:颤杆菌克属;Prevotellaceae_UCG-001:普雷沃氏菌科UCG-001;Oscillibacter:颤杆菌属;Lactobacillus:乳杆菌属;Mucispirillum:脱铁杆菌属;Others: 其他。 图 2 在门水平(左)和属水平(右)的物种丰度circos图 Fig. 2 Species richness circus circos graph at phylum level (left) and on genus level (right) |
|
|
表 4 门水平盲肠微生物相对丰度 Table 4 Cecal microorganism relative abundances at phylum level |
|
|
表 5 属水平盲肠微生物相对丰度 Table 5 Cecal microorganism relative abundances on genus level |
GOD能改善饲粮的适口性,在养殖动物出现厌食的情况时,添加GOD可以让养殖动物恢复正常采食[5]。李嘉辉等[6]研究了GOD对产蛋后期蛋种鸡产蛋性能、孵化性能及抗氧化能力的影响,结果显示,GOD可以缓解产蛋后期蛋种鸡的氧化应激状态,延缓蛋鸡机体衰老和卵巢功能退化,从而提高蛋鸡产蛋后期的产蛋性能。赵必迁等[7]在产蛋后期罗曼粉壳蛋鸡饲粮中添加300 mg/kg的GOD,发现显著提高了产蛋率和显著降低了料蛋比,极显著降低了死亡率和破壳率。曲浩杰等[8]在产蛋后期海兰褐蛋鸡饲粮中添加博落回提取物和GOD,发现显著提高了产蛋率,显著降低了料蛋比。本研究结果表明饲粮中添加150、300 mg/kg GOD可使处于产蛋后期蛋鸡的产蛋率显著提高,添加300 mg/kg GOD可使料蛋比显著降低。生产实践发现,在蛋鸡饲粮中添加GOD确实能使产蛋率提高2%左右,但是产蛋率并不是随着GOD添加量的增加而直线上升,而是以3%的添加量产蛋率最高,超过这个添加量产蛋率不但提高不明显,由于生产成本的提高,反而使经济效益受到了影响[9]。因此,大型养殖场从经济角度出发,在考虑添加时期的同时也应结合所用GOD市场价格,考虑添加量,不能盲目在蛋鸡饲粮中添加GOD。
3.2 GOD对产蛋后期蛋鸡肠道组织形态的影响小肠是营养物质吸收的重要场所,肠绒毛高度越大,肠黏膜与食糜接触面积越大,小肠消化和吸收能力越强[10]。隐窝深度能反映细胞的增殖率,隐窝深度变浅说明肠上皮细胞成熟率上升,对营养物质的吸收能力增强。因此,绒隐比可综合反映小肠功能,绒隐比越高,小肠消化吸收功能越强,绒隐比减小说明肠黏膜受损,影响小肠对营养物质的消化吸收。肠壁厚度能反映肠道组织结构的完整性,特别是肠壁内肌层厚度的增加,能使小肠蠕动增强,可以提高其消化吸收能力,从而提高生产性能[11-14]。随着养殖蛋鸡养殖周期的延长,蛋鸡的死淘率快速上升,这与蛋鸡肠道健康有着密不可分的关系。宋海彬等[15]研究发现,饲粮中添加GOD可提高肉鸡十二指肠和空肠绒毛高度,降低隐窝深度,增加绒毛膜高度/隐窝深度。崔细鹏等[16]研究发现,饲粮添加GOD对肉鸡十二指肠、空肠和回肠的绒毛高度、隐窝深度、绒毛膜高度/隐窝深度均无显著影响。本试验结果发现,饲粮中添加150或300 mg/kg GOD均可显著提高产蛋后期蛋鸡十二指肠、空肠和回肠绒毛高度;饲粮中添加300 mg/kg GOD可显著提高十二指肠的绒隐比。Gu等[17]研究表明,若动物应激较大,其肠道微生物区系就会发生改变,进而影响肠道的形态结构。据研究表明,由葡萄糖酸发酵生成的乙酸、丙酸、丁酸等挥发性短链脂肪酸(SCFA)主要是肠道微生物产生的,且极易在肠道内被上皮细胞吸收[18]。而经研究发现,短链脂肪酸可以明显提高肠绒毛高度、黏膜厚度及绒毛面积,降低隐窝深度[15, 19]。此外,随着蛋鸡饲养周期的延长,体内会产生大量自由基,破坏肠道上皮细胞。而GOD具有氧化还原作用,可以有效清除自由基,保护肠道组织结构的完整性[20]。以上这些对GOD作用机理的研究增加了本试验的可信度。至于与崔细鹏等[16]的试验结果存在的偏差,猜测是GOD添加量不同引起的。
3.3 GOD对产蛋后期蛋鸡盲肠微生物的影响产蛋后期蛋鸡产蛋性能慢慢降低,蛋壳变薄易碎,破损率大幅度增加;免疫力和抵抗力减弱,易发生应激反应。而这些均与蛋鸡在产蛋后期体内代谢变化和肠道内微生态变化等密切相关[10]。高通量测序技术目前已经成为很多研究不可缺少的工具。通过这个技术,可以深入地了解肠道菌群的组成情况与动态,帮助研究者查清楚宿主与细菌间的相互影响关系[21]。另外,细菌16S rDNA基因包含9个高变区,这些高变区可以用来检测并分类细菌[22-23]。由于16S rDNA V3~V4区拥有高分类一致性,所以本试验选择对蛋鸡盲肠V3~V4区进行细菌16S rDNA分析。有研究表明GOD可以影响盲肠微生物多样性,王前光等[24]在GOD对1~6周龄临武鸭生长性能、血清生化和抗氧化指标、肠道形态结构和微生物多样性影响的研究中发现,饲粮中添加30 g/t GOD时,临武鸭盲肠微生物丰富度指数显著高于对照组,与本试验结果不一致,这可能与试验动物不同有关。而Wu等[2]在肉仔鸡上的研究结果与本试验是一致的。研究表明,脱硫弧菌属具有很高的纤维降解能力[25],拟杆菌门能够降解非纤维性碳水化合物、蛋白质,促进胃肠道免疫系统发育[26-27];厚壁菌门与纤维分解、碳水化合物代谢有关[28];此外,家禽盲肠中厚壁菌门的相对丰度与体增重[29]和产蛋性能[30]存在正相关。本试验结果发现,饲粮中添加300 mg/kg GOD可以降低厚壁菌门的相对丰度,提高拟杆菌门的相对丰度,降低脱硫弧菌属的相对丰度,提高拟杆菌属的相对丰度。拟杆菌门和厚壁菌门相对丰度的改变在目前研究中存在争议,黄婧溪[30]研究表明, GOD降低拟杆菌门相对丰度,高晶萍等[31]研究表明, GOD极显著提高拟杆菌门的含量,Wu等[2]研究提到GOD组厚壁菌门丰度显著增加。综上所述, 本试验验证了高晶萍等[31]的试验结果。变形菌门包括大量的革兰氏阴性菌,如大肠杆菌,它们通过细胞壁上的脂多糖(LPS)诱导炎症反应[32],副杆菌属可以通过诱导抗炎因子的产生以及抑制炎症因子的分泌减少肠道炎症反应,维持肠道正常功能[33]。普雷沃氏菌属具有多种作用,包括减轻炎症,消化纤维素,产生乙酸、丁酸以及少量异丁酸[34];作为一种常见的肠道有益菌,乳杆菌属可以通过下调一些炎症因子如肿瘤坏死因子-α(TNF-α)的表达来缓解结肠炎模型大鼠的肠道炎症反应[35];此外,乳杆菌属可以与弯曲杆菌等病原菌争夺黏膜结合位点来防止肠道病原体感染,保护肠道健康[36]。本试验发现,饲粮中添加300 mg/kg GOD可以降低变形菌门和副杆菌属的相对丰度,提高普雷沃氏菌UCG-001和乳杆菌属的相对丰度,说明GOD可能通过提高普雷沃氏菌_UCG-001属的相对丰度来降低蛋鸡炎症的发生。瘤胃球菌科NK4A214群、粪便杆菌属、未分类的毛螺菌科可以在肠道中产生短链脂肪酸。在庞凯悦等[37]的研究中发现,瘤胃球菌科UCG-014、瘤胃球菌科UCG-005、瘤胃球菌科UCG-010、克里斯滕森菌科R7群与一些牛瘤胃的一些短链脂肪酸有显著的正相关或者负相关关系。短链脂肪酸是调节肠道功能和肠道免疫的关键性因子,对宿主有多种有益作用,包括维持肠道屏障功能和抗炎作用。本试验中,饲粮中添加300 mg/kg GOD使瘤胃球菌科NK4A214群的相对丰度极显著上升,未分类的毛螺菌科、瘤胃球菌科UCG-014、瘤胃球菌科UCG-005、瘤胃球菌科UCG-010、克里斯滕森菌科R7群、粪便杆菌属的相对丰度没有显著变化,这表明GOD有可能通过增加瘤胃球菌科NK4A214群的相对丰度来增加肠道中短链脂肪酸的含量,进而增强肠道免疫功能。疣微菌门中的嗜黏蛋白阿克曼氏菌(Akkermansia muciniphila)由于在黏蛋白降解过程中的特殊性能而成为肠腔与宿主细胞间黏膜界面的关键生物,和炎症性肠病、肥胖、酒精肝、孤独症、结肠炎、2型糖尿病、1型糖尿病及其他代谢紊乱等密切相关[38]。饲粮中添加300 mg/kg GOD后疣微菌门的相对丰度极显著降低,由于不能够确定本试验测序的是疣微菌门中哪一种,故不能够确定此菌门增加的相关效应。蓝藻菌门在动物肠道中研究还很少,不能确定蓝藻菌门相对丰度的增加对蛋鸡肠道调节有无影响。有研究表明梭杆菌门对动物具有毒害作用,300 mg/kg GOD组梭杆菌门的相对丰度较对照组略有下降,故不会对蛋鸡造成危害。
4 结论① 饲粮中添加150或300 mg/kg GOD均能显著提高产蛋后期蛋鸡的产蛋率;添加300 mg/kg GOD还能显著提高平均日产蛋重、显著降低料蛋比,在一定程度上改善了产蛋后期蛋鸡的产蛋性能。
② 饲粮中添加150或300mg/kg GOD均显著提高了蛋鸡十二指肠、空肠和回肠的绒毛高度;添加300 mg/kg GOD还显著提高了蛋鸡十二指肠绒隐比,利于蛋鸡的肠道健康和机体免疫。
③ 饲粮中添加300 mg/kg GOD有利于优化蛋鸡盲肠微生物群落结构组成。
| [1] |
王恒毅, 马义国. 饲粮中添加葡萄糖氧化酶对蛋鸡生产性能的影响[J]. 家禽科学, 2020(1): 20-22. WANG H Y, MA Y G. Effects of glucose oxidase on performance of laying hens[J]. Poultry Science, 2020(1): 20-22 (in Chinese). DOI:10.3969/j.issn.1673-1085.2020.01.005 |
| [2] |
WU S R, CHEN X D, LI T H, et al. Changes in the gut microbiota mediate the differential regulatory effects of two glucose oxidases produced by Aspergillus niger and Penicillium amagasakiense on the meat quality and growth performance of broilers[J]. Journal of Animal Science and Biotechnology, 2020, 11(1): 73. DOI:10.1186/s40104-020-00480-z |
| [3] |
朱艳芝, 马文锋, 张耀文, 等. 虫草多糖对蛋鸡产蛋后期生产性能、蛋品质和肠道形态结构的影响[J]. 动物营养学报, 2019, 31(5): 2323-2329. ZHU Y Z, MA W F, ZHANG Y W, et al. Effects of cordyceps polysaccharide on performance, egg quality and intestinal morphology of laying hens during later laying period[J]. Chinese Journal of Animal Nutrition, 2019, 31(5): 2323-2329 (in Chinese). DOI:10.3969/j.issn.1006-267x.2019.05.039 |
| [4] |
张耀文, 马文峰, 张志丹, 等. 女贞子粉对蛋鸡产蛋后期生产性能、蛋品质及肠道组织形态的影响[J]. 家畜生态学报, 2019, 40(7): 38-43, 74. ZHANG Y W, MA W F, ZHANG Z D, et al. Effects of Ligustrum lucidum on laying performance, egg quality and intestinal morphology of hens during the late laying period[J]. Acta Ecologae Animalis Domastici, 2019, 40(7): 38-43, 74 (in Chinese). DOI:10.3969/j.issn.1673-1182.2019.07.008 |
| [5] |
卢俊鑫, 邝哲师. 葡萄糖氧化酶在动物生产中的应用[J]. 饲料博览, 2019(8): 10-13. LU J X, KUANG Z S. Application of glucose oxygenase in animal production[J]. Feed Review, 2019(8): 10-13 (in Chinese). DOI:10.3969/j.issn.1001-0084.2019.08.003 |
| [6] |
李嘉辉, 李生杰, 龚建刚, 等. 葡萄糖氧化酶对产蛋后期蛋种鸡产蛋性能、孵化性能及抗氧化能力的影响[J]. 动物营养学报, 2021, 33(10): 5617-5626. LI J H, LI S J, GONG J G, et al. Effects of glucose oxidase on laying performance, hatching performance and antioxidant capacity of laying breeders during later laying period[J]. Chinese Journal of Animal Nutrition, 2021, 33(10): 5617-5626 (in Chinese). DOI:10.3969/j.issn.1006-267x.2021.10.021 |
| [7] |
赵必迁, 李学海. 葡萄糖氧化酶对产蛋后期蛋鸡生产性能的影响[J]. 广东饲料, 2016, 25(10): 22-24. ZHAO B Q, LI X H. Effects of glucose oxidase on performance of laying hens during late laying period[J]. Guangdong Feed, 2016, 25(10): 22-24 (in Chinese). DOI:10.3969/j.issn.1005-8613.2016.10.005 |
| [8] |
曲浩杰, 孙广超, 朱应波, 等. 博落回提取物和葡萄糖氧化酶联合使用对产蛋后期蛋鸡生产性能的影响[J]. 家禽科学, 2020(5): 11-15. QU H J, SUN G C, ZHU Y B, et al. Effects of Macleaya cordata extract combined with glucose oxidase enzyme on production performance during late period of laying[J]. Poultry Science, 2020(5): 11-15 (in Chinese). DOI:10.3969/j.issn.1673-1085.2020.05.003 |
| [9] |
樊长林, 周曙光. 葡萄糖氧化酶的作用机理及在养鸡生产中的应用[J]. 畜牧业环境, 2021(16): 50. FAN C L, ZHOU S G. Mechanism of glucose oxidase and its application in chicken production[J]. Animal Industry and Environment, 2021(16): 50 (in Chinese). |
| [10] |
黄晨轩, 岳巧娴, 徐静, 等. 复合微生态制剂对产蛋后期蛋鸡养分消化率、免疫功能和肠道菌群的影响[J]. 中国家禽, 2018, 40(6): 24-28. HUANG C X, YUE Q X, XU J, et al. Effects of compound probiotics on nutrient utilization, immune function and intestinal microflora of laying hens at late laying period[J]. China Poultry, 2018, 40(6): 24-28 (in Chinese). |
| [11] |
GHEN Z, XIE J, HU M Y, et al. Protective effects of γ-aminobutyric acid (GABA) on the small intestinal mucosa in heat-stressed Wenchang chicken[J]. The Journal of Animal and Plant Sciences, 2015, 25(1): 78-87. |
| [12] |
KOTUNIA A, WOLIÑSKI J, LAUBITZ D, et al. Effect of sodium butyrate on the small intestine development in neonatal piglets fed[correction of feed] by artificial sow[J]. Journal of Physiology and Pharmacology, 2004, 55(Suppl 2): 59-68. |
| [13] |
李青竹, 李润航, 郑艳秋, 等. 不同纤维源对吉林白鹅肠道形态学发育的影响[J]. 畜牧兽医学报, 2014, 45(4): 596-602. LI Q Z, LI R H, ZHENG Y Q, et al. Effect of different sources of fiber on intestinal morphological development of Jilin white geese[J]. Acta Veterinaria et Zootechnica Sinica, 2014, 45(4): 596-602 (in Chinese). |
| [14] |
郑娟善, 王谢忠, 张立成, 等. β-1, 3/1, 6葡聚糖对海东鸡种鸡生产性能、肠道形态学和组织学的研究[J]. 中国饲料, 2017(5): 27-30. ZHENG J S, WANG X Z, ZHANG L C, et al. Effects of dextran on performance, intestinal morphology and histology of Haidong breeders[J]. China Feed, 2017(5): 27-30 (in Chinese). |
| [15] |
宋海彬, 赵国先, 刘彦慈, 等. 葡萄糖氧化酶对肉鸡肠道形态结构和消化酶活性的影响[J]. 中国畜牧杂志, 2010, 46(23): 56-59. SONG H B, ZHAO G X, LIU Y C, et al. Effect of glucose oxidase on intestinal morphology and digestive enzyme activity in broilers[J]. Chinese Journal of Animal Science, 2010, 46(23): 56-59 (in Chinese). |
| [16] |
崔细鹏, 王敏. 葡萄糖氧化酶对白羽肉仔鸡生长性能、养分代谢的影响[J]. 广东饲料, 2018, 27(10): 31-35. CUI X P, WANG M. Effect of glucose oxidase on growth performance, nutrients metabolism of white feather chick[J]. Guangdong Feed, 2018, 27(10): 31-35 (in Chinese). DOI:10.3969/j.issn.1005-8613.2018.10.008 |
| [17] |
GU X H, LI D F, SHE R P. Effect of weaning on small intestinal structure and function in the piglet[J]. Archiv Fur Tierernahrung, 2002, 56(4): 275-286. DOI:10.1080/00039420214345 |
| [18] |
TSUKAHARA T, KOYAMA H, OKADA M, et al. Stimulation of butyrate production by gluconic acid in batch culture of pig cecal digesta and identification of butyrate-producing bacteria[J]. The Journal of Nutrition, 2002, 132(8): 2229-2234. DOI:10.1093/jn/132.8.2229 |
| [19] |
李可洲, 李宁, 黎介寿, 等. 短链脂肪酸对大鼠移植小肠作用的研究[J]. 肠外与肠内营养, 2002, 7(3): 159-161. LI K Z, LI N, LI J S, et al. The effect of short-chain fatty acids (SCFA) on graft morphology and absorption after rat small bowel transplantation[J]. Parenteral & Enteral Nutrition, 2002, 7(3): 159-161 (in Chinese). DOI:10.16151/j.1007-810x.2000.03.014 |
| [20] |
胡亚奇. 葡萄糖氧化酶在鸡生产上的应用[J]. 中兽医学杂志, 2018(1): 76. HU Y Q. Application od glucose oxidase in chicken production[J]. Chinese Journal of Traditional Veterinary Science, 2018(1): 76 (in Chinese). |
| [21] |
张亚楠, 魏单平, 韩瑞丽, 等. 高产期不同产蛋水平蛋鸡肠道微生物群落特征[J]. 中国兽医学报, 2017, 37(6): 1179-1185. ZHANG Y N, WEI D P, HAN R L, et al. The character of the intestinal microbiota associated with laying performance in hens[J]. Chinese Journal of Veterinary Science, 2017, 37(6): 1179-1185 (in Chinese). |
| [22] |
VAN DE PEER Y, CHAPELLE S, DE WACHTER R. A quantitative map of nucleotide substitution rates in bacterial rRNA[J]. Nucleic Acids Research, 1996, 24(17): 3381-3391. DOI:10.1093/nar/24.17.3381 |
| [23] |
KIM H B, BOREWICZ K, WHITE B A, et al. Longitudinal investigation of the age-related bacterial diversity in the feces of commercial pigs[J]. Veterinary Microbiology, 2011, 153(1/2): 124-133. |
| [24] |
王前光, 李闯, 黄璇, 等. 葡萄糖氧化酶对1~6周龄临武鸭生长性能、血清生化和抗氧化指标、肠道形态结构和微生物多样性的影响[J]. 动物营养学报, 2020, 32(8): 3605-3614. WANG Q G, LI C, HUANG X, et al. Effects of glucose oxidase on growth performance, serum biochemical and antioxidant indexes, intestinal morphology and microbial diversity of 1 to 6-week-old Linwu ducks[J]. Chinese Journal of Animal Nutrition, 2020, 32(8): 3605-3614 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.08.019 |
| [25] |
王佳婧. 厌氧复合菌系的筛选及含纤维素原料预处理复合菌剂的研究[D]. 硕士学位论文. 成都: 中国科学院成都生物研究所, 2009. WANG J J. Screening of anaerobic compound bacteria and study on pretreating compound bacteria with cellulose[D]. Master's Thesis. Chengdu: Chengdu Institute of Biology, Chinese Academy of Sciences, 2009. (in Chinese) |
| [26] |
HOOPER L V. Bacterial contributions to mammalian gut development[J]. Trends in Microbiology, 2004, 12(3): 129-134. DOI:10.1016/j.tim.2004.01.001 |
| [27] |
OAKLEY B B, LILLEHOJ H S, KOGUT M H, et al. The chicken gastrointestinal microbiome[J]. FEMS Microbiology Letters, 2014, 36(2): 100-112. |
| [28] |
AHIR V B, KORINGA P G, BHATT V D, et al. Metagenomic analysis of poultry gut microbes[J]. Indian Journal of Poultry Science, 2010, 45(2): 111-114. |
| [29] |
ZHANG L, LI J, YUN T T, et al. Effects of pre-encapsulated and pro-encapsulated Enterococcus faecalis on growth performance, blood characteristics, and cecal microflora in broiler chickens[J]. Poultry Science, 2015, 94(11): 2821-2830. |
| [30] |
黄婧溪. 葡萄糖氧化酶对黄羽肉鸡生长性能、肠道微生物区系及肠道免疫的影响[D]. 硕士学位论文. 广州: 华南农业大学, 2018. HUANG J X. Effects of glucose oxidase on performance, intestinal microflora and intestinal immunity of yellow feather broilers[D]. Master's Thesis. Guangzhou: South China Agricultural University, 2018. (in Chinese) |
| [31] |
高晶萍, 李龙飞, 孙嘉咛, 等. 葡萄糖氧化酶与乳酸菌联合应用对肉鸡肠道形态及微生物菌群的影响[J]. 饲料研究, 2022, 45(2): 34-39. GAO J P, LI L F, SUN J N, et al. Effect of glucose oxidase combined with Lactobacillus on intestinal morphology and microbial flora of broilers[J]. Feed Research, 2022, 45(2): 34-39 (in Chinese). |
| [32] |
YANG Z Q, ZHANG C H, WANG J P, et al. Characterization of the intestinal microbiota of broiler breeders with different egg laying rate[J]. Frontiers in Veterinary Science, 2020, 7: 599337. |
| [33] |
LI J, SUNG C Y J, LEE N, et al. Probiotics modulated gut microbiota suppresses hepatocellular carcinoma growth in mice[J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(9): E1306-E1315. |
| [34] |
CUEVAS-SIERRA A, RIEZU-BOJ J I, GURUCEAGA E, et al. Sex-specific associations between gut Prevotellaceae and host genetics on adiposity[J]. Microorganisms, 2020, 8(6): 938. |
| [35] |
PERAN L, CAMUESCO D, COMALADA M, et al. Lactobacillus fermentum, a probiotic capable to release glutathione, prevents colonic inflammation in the TNBS model of rat colitis[J]. International Journal of Colorectal Disease, 2006, 21(8): 737-746. |
| [36] |
SAVADOGO A, OUATTARA C A T, BASSOLE I H N, et al. Bacteriocins and lactic acid bacteria-a minireview[J]. African Journal of Biotechnology, 2006, 5(9): 678-683. |
| [37] |
庞凯悦, 戴东文, 杨英魁, 等. 不同饲养方式对牦牛瘤胃发酵参数及微生物菌群的影响[J]. 动物营养学报, 2022, 34(3): 1667-1682. PANG K Y, DAI D W, YANG Y K, et al. Effects of different feeding methods on rumen fermentation parameters and microbial flora of yaks[J]. Chinese Journal of Animal Nutrition, 2022, 34(3): 1667-1682 (in Chinese). |
| [38] |
韩伟, 王超, 李晓敏, 等. 肠道中Akkermansia muciniphila数量影响因素的研究进展[J]. 中国微生态学杂志, 2019, 31(3): 356-359, 364. HAN W, WANG C, LI X M, et al. The factors influencing the quantity of Akkermansia muciniphila in the intestines: research progress[J]. Chinese Journal of Microecology, 2019, 31(3): 356-359, 364 (in Chinese). |




