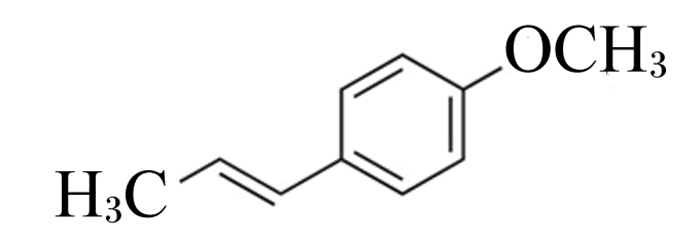
在自然界中存在顺式和反式2种茴香脑(anethole)异构体,2种异构体的活性和香气不同,顺式茴香脑(cis-anethole)具有高毒性以及酸味、辛辣味、樟脑味等刺激性气味,在生产中常被当作废料弃去。反式茴香脑(trans-anethole, AN)又称茴香烯,属苯丙素类化合物(化学式C10H12O, 图 1),无毒且具有香甜的特殊气味,可从大茴香(AN含量为75.2%~96.1%)、小茴香(AN含量为58.1%~92.5%)、八角(AN含量为71.2%~91.8%)等植物精油中提取[1]。
|
图 1 AN的化学结构 Fig. 1 Chemical structure of AN |
AN具有多种生物学活性,被广泛用于食品和制药行业。据研究报道,AN对炎症相关的癌症、糖尿病和神经系统疾病等慢性疾病都有疗效,而这些疗效与其抗氧化活性、抑制脂质过氧化和清除自由基的功能有关[2-4]。AN的抗氧化活性在体内外试验中已被证实。硫代巴比妥酸反应物比色法证明以AN为主要成分的小茴香精油显示出了良好的抗氧化活性,可减少脂质过氧化产生的氢过氧化物和次级氧化产物,具有一定的抗氧化能力[5]。Luís等[6]采用1, 1-二苯基-2-苦基肼(DPPH)自由基清除试验评估八角精油的抗氧化活性,试验结果证实八角精油具有很强的抗氧化活性[半抑制浓度(IC50)=3.46%],并推测八角精油的抗氧化活性与包括AN在内的高苯丙素含量(92.2%)有关。余炜等[7]在对八角茴香油抗氧化能力的研究中发现,八角茴香油发挥抗氧化作用可能与其中的主要活性成分AN和茴香醛有关,AN和茴香醛可通过清除油脂氧化过程中产生的自由基缓减机体的氧化损伤。AN及其衍生物茴香硫醚已被证明能增加细胞内抗氧化代谢产物谷胱甘肽和谷胱甘肽巯基转移酶的活性,通过提高机体清除羟自由基的能力抑制脂质过氧化、提高机体抗氧化能力[8-11]。然而,茴香精油的成分复杂,除苯丙素类的AN外,萜类、黄酮和酚类等成分都具有抗氧化活性,目前有关AN纯品的抗氧化能力的研究鲜有报道。因此,本试验旨在通过AN纯品在肉鸡体内外抗氧化能力的比较,以期为AN作为抗氧化剂在饲粮中的科学应用提供依据与参考。
1 材料与方法 1.1 主要试剂AN(纯度>98%)购于南京某医药科技有限公司;DPPH、2, 2′-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)、三吡啶基三嗪(TPTZ)和二丁基羟基甲苯(BHT)(纯度>99%)购于上海某生物科技有限公司;无水乙醇等其他试剂均为国产分析纯,购于上海某化学技术有限公司。
1.2 AN的体外抗氧化能力 1.2.1 DPPH自由基清除率参考文献[12]的方法,测定DPPH自由基的清除率。用无水乙醇作为溶剂配制0.04 mg/mL DPPH溶液,在96孔板中加入不同浓度(5、10、15、20、25、30 mg/mL)以无水乙醇为溶剂配制的样品溶液100 μL,DPPH溶液100 μL,室温避光反应60 min,于517 nm波长处测量各孔吸光度值(A1)。无水乙醇替代DPPH作为样本空白(A2),无水乙醇替代样品作为试剂空白(A3),其他条件不变。每个浓度组平行测量3次。以BHT为阳性对照。按照以下公式计算DPPH自由基清除率:
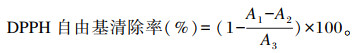
|
参考文献[13]的方法,测定ABTS自由基清除率。配制7.4 mmol/L ABTS水溶液、2.45 mmol/L K2S2O8水溶液,以上2种溶液1 ∶ 1混合后室温避光12~16 h配制成ABTS原液,在使用前用无水乙醇对ABTS原液进行稀释,使其吸光度值为0.70±0.05。在96孔板中加入不同浓度(0.91、1.81、2.72、3.63、4.54、5.45 mg/mL)以无水乙醇为溶剂配制的样品溶液20 μL,ABTS稀释液200 μL,室温避光反应30 min,于734 nm波长处测量各孔吸光度值(A1)。无水乙醇替代ABTS作为样本空白(A2),无水乙醇替代样品作为试剂空白(A3),其他条件不变。每个浓度组平行测量3次。以BHT为阳性对照。按照以下公式计算ABTS自由基的清除率:
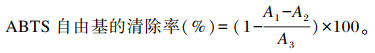
|
参考文献[14]的方法,测定羟自由基清除率。配制9 mmol/L乙醇水杨酸溶液,9 mmol/L FeSO4溶液,8.8 mmol/L过氧化氢溶液。在96孔板中加入不同浓度(5.5、11.0、16.5、22.0、27.5、33.0 mg/mL)以无水乙醇为溶剂配制的样品溶液110 μL,FeSO4溶液30 μL,乙醇水杨酸溶液30 μL,最后加入30 μL过氧化氢溶液启动反应,37 ℃避光反应30 min,于510 nm波长处测量各孔吸光度值(A1)。无水乙醇替代过氧化氢作为样本空白(A2),无水乙醇替代样品作为试剂空白(A3),其他条件不变。每个浓度组平行测量3次。以BHT为阳性对照。按照以下公式计算羟自由基的清除率:
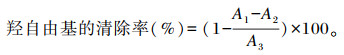
|
参考文献[15]的方法,测定铁离子还原能力。配制40 mmol/L盐酸水溶液,20 mmol/L FeCl3水溶液,0.3 mol/L醋酸盐溶液。以40 mmol/L盐酸水溶液为溶剂配制10 mmol/L TPTZ水溶液。在使用开始前将0.3 mol/L醋酸盐溶液、10 mmol/L TPTZ水溶液和20 mmol/L FeCl3水溶液按照体积比10 ∶ 1 ∶ 1均匀混合配制成FRAP应用液,并于37 ℃水浴30 min。在96孔板中加入不同浓度(0.5、1.0、1.5、2.0、2.5、3.0 mg/mL)以无水乙醇为溶剂配制的样品溶液10 μL,预热的FRAP应用液180 μL,37 ℃避光反应5 min,于593 nm波长处测量各孔吸光度值。以不同浓度的FeSO4制作标准曲线,以样品抗氧化活性达到同样的吸光度值为1个FRAP的值。以BHT为阳性对照,每个浓度组平行测量3次。
1.3 AN的体内抗氧化能力 1.3.1 试验动物与分组试验选取同批孵化、初始体重相近的健康1日龄爱拔益加(AA)肉鸡256只(购于山东峰祥畜牧种业科技有限公司),采用单因素完全随机试验设计,将鸡群分为4个组,每组8个重复,每个重复8只鸡。试验期间,在4组肉鸡基础饲粮中分别添加水平为0、200、400和600 mg/kg的AN(分别为AN 0、AN 200、AN 400和AN 600组)。试验期分为2个生长阶段,分别为生长前期(1~21日龄)和生长后期(22~42日龄),共计42 d,全期自由采食、饮水,按常规免疫程序免疫。基础饲粮组成及营养水平参照《肉鸡饲养标准》(NY/T 33—2004)配制,其组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of basal diets (air-dry basis) |
于肉鸡21和42日龄,每组随机选取8只肉鸡,每个重复1只。通过颈静脉采血,室温放置2 h后,在高速冷冻离心机4 ℃、3 000 r/min条件下离心15 min,然后收集上层血清保存于-20 ℃待测。肉鸡放血致死后,解剖分离出肝脏和胸肌组织,用提前准备好的生理盐水冲洗干净,在肝脏相同位置切取部分样品放于2 mL的冻存管中保存于-80 ℃,在左侧胸肌相同位置取适量样品保存于-80 ℃,用于抗氧化酶活性和基因相对表达量的分析。
1.3.3 生长性能的测定于肉鸡20和41日龄当天21:00分别停饲12 h后,于次日09:00以重复为单位称量各组试验鸡活重、剩余料重,并以重复为单位计算各组试验鸡的平均日采食量(ADFI)、平均日增重(ADG)和料重比(F/G)。
1.3.4 血清抗氧化能力的测定血清中各项指标分别采用比色法测定谷胱甘肽过氧化物酶(GSH-Px)活性,钼酸铵法测定过氧化氢酶(CAT)活性,ABTS法测定总抗氧化能力(T-AOC),羟胺法测定超氧化物歧化酶(T-SOD)活性,硫代巴比妥酸法测定丙二醛(MDA)含量。所有试剂盒购于南京建成生物工程研究所,严格按照说明书步骤进行试验操作。
1.3.5 肝脏和胸肌抗氧化能力的测定称取0.4 g肝脏或胸肌组织于5 mL无酶离心管,按照1 ∶ 9(重量/体积)的比例加入预冷的0.9%生理盐水,加入镐珠后置振动研磨仪上匀浆,将匀浆液在4 ℃、4 000 r/min条件下离心10 min,吸取上清液用于测定各项指标。测定指标与试剂盒同1.3.4。
1.3.6 肝脏和胸肌抗氧化相关基因表达量的测定按照Trizol(南京诺唯赞生物科技股份有限公司)说明书提取21、42日龄肝脏、42日龄胸肌中总RNA,紫外微量分光光度计检测浓度后将总RNA稀释至统一浓度,利用反转录试剂盒(南京诺唯赞生物科技股份有限公司)将总RNA反转录为cDNA,以cDNA为模板,以β-肌动蛋白(β-actin)为内参,对肝脏、胸肌的过氧化氢酶(CAT)、超氧化物歧化酶1(SOD1)、血红素加氧酶-1(HO-1)、核因子E2相关因子2(Nrf2)和谷胱甘肽过氧化物酶1(GPx1)的基因相对表达量进行实时荧光定量PCR测定,引物均由上海生工生物工程技术服务有限公司合成。引物序列见表 2。使用ChamQ SYBR qPCR Master Mix试剂盒(南京诺唯赞生物科技股份有限公司)在QuantStudioTM 7 Flex实时荧光定量PCR仪(赛默飞世尔科技公司, 美国)上进行实时荧光定量PCR反应,反应总体系为20 μL,包含:10 μL 2×ChamQ SYBR qPCR Master Mix、0.4 μL上游引物、0.4 μL下游引物、0.4 μL的ROX Reference Dye、2 μL互补DNA模板、6.8 μL无菌无酶水。反应程序如下:95 ℃持续30 s,95 ℃持续10 s,60 ℃持续30 s,共40个循环,95 ℃持续15 s,60 ℃持续60 s,95 ℃持续15 s。采用2-ΔΔCt法计算目的基因相对表达量。
|
|
表 2 实时荧光定量PCR所用引物序列 Table 2 Primer sequences used for quantitative real-time PCR |
试验数据采用SPSS 25.0软件进行单因素方差分析(one-way ANOVA),通过Duncan氏法进行组间多重比较,采用正交多项式法对不同浓度AN的添加效果进行线性(linear)和二次曲线(quadratic)回归分析。结果以平均值、均值标准误和P值表示。采用Graphpad Prism 8.0计算体外IC50值,并绘图。P < 0.05表示差异显著,0.05≤P < 0.10表示有差异趋势。
2 结果与分析 2.1 AN的体外抗氧化能力 2.1.1 DPPH自由基的清除率由图 2可知,随着AN浓度的增加,对DPPH自由基的清除效果随之增强,当AN浓度为30 mg/kg时,清除率达到59.57%,而阳性对照BHT在不同的浓度水平下清除率均大于95%,AN对DPPH的清除效果弱于阳性对照BHT。通过计算得到AN对DPPH自由基清除的IC50值为16.26 mg/mL。
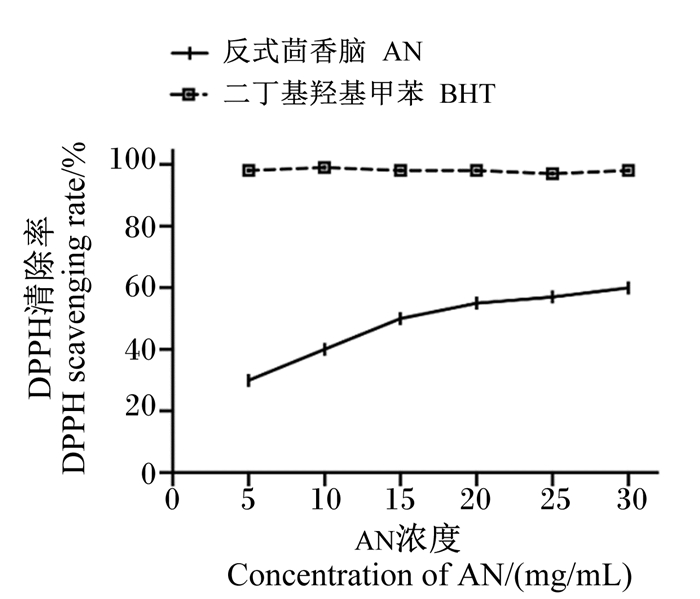
|
图 2 AN对DPPH自由基的清除率 Fig. 2 DPPH free radical scavenging rate of AN |
由图 3可知,AN对ABTS的清除效果与添加浓度呈正相关,即随着AN浓度的增加,ABTS的清除率也相应提高。当浓度达到5.45 mg/mL时,清除率为43.67%;但是在不同的浓度水平下,阳性对照BHT对ABTS自由基的清除率远远大于AN且不同浓度阳性对照组的ABTS清除率均无限接近100%。通过计算得到AN对ABTS自由基的IC50值为6.98 mg/mL。
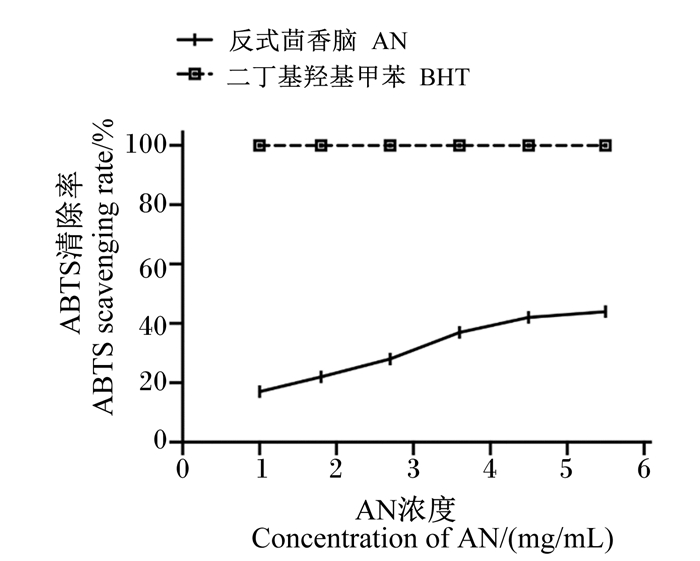
|
图 3 AN对ABTS自由基的清除率 Fig. 3 ABTS free radical scavenging rate of AN |
由图 4可知,在测定浓度范围内,AN对羟自由基的清除效果与添加浓度呈正相关,但增加幅度较小。且在不同浓度下AN对羟自由基的清除率均优于阳性对照BHT。当AN浓度为33.0 mg/mL时,对羟自由基的清除率为61.87%。通过计算得到AN对羟自由基的IC50值为7.82 mg/mL。
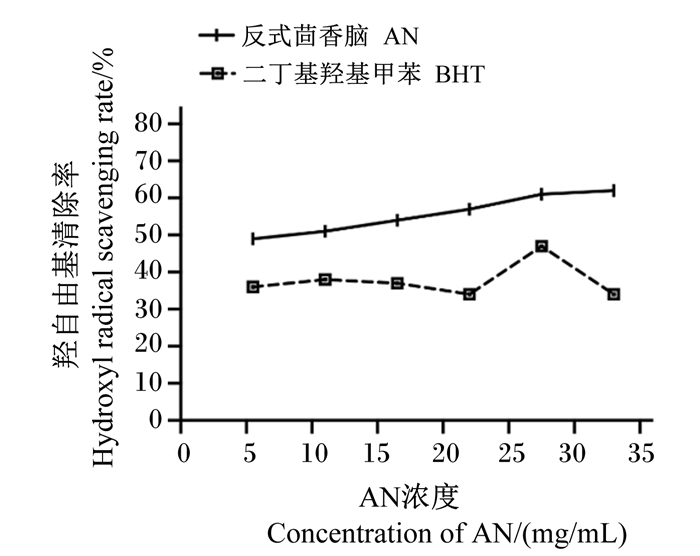
|
图 4 AN对羟自由基的清除率 Fig. 4 Hydroxyl radical scavenging rate of AN |
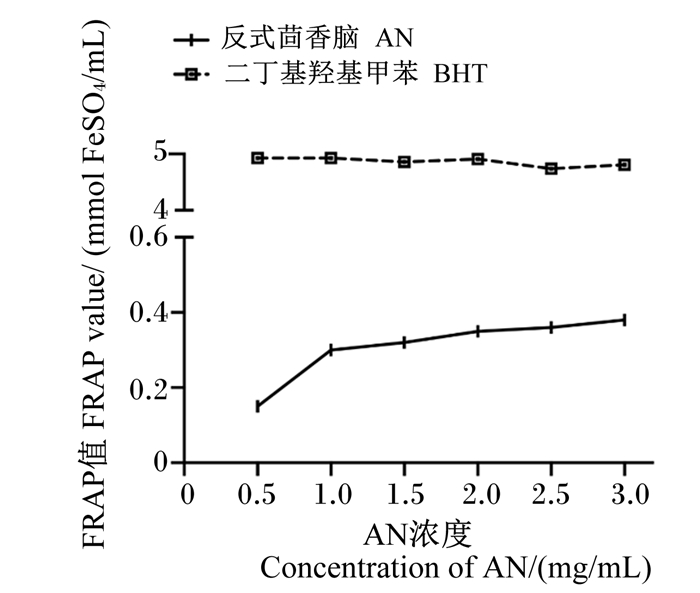
以吸光度值为纵坐标,不同浓度的FeSO4标准溶液为横坐标进行线性拟合,得到线性回归方程为y=0.743x+0.101 4,R2=0.999 4,如图 5所示。根据绘制的标准曲线计算不同浓度样品的FRAP值,结果如图 6所示,AN的FRAP值增加幅度平缓,当AN浓度达到3 mg/mL时FRAP值为0.38 mmol/L FeSO4/mL。而阳性对照BHT在不同浓度下的FRAP值均远大于AN。
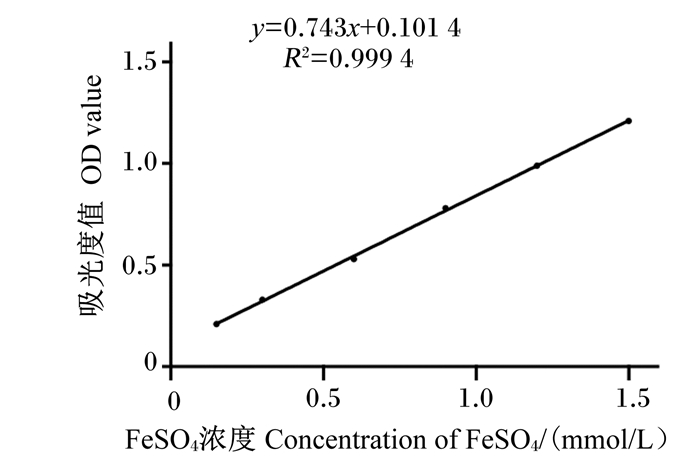
|
图 5 FeSO4标准曲线 Fig. 5 Linearity calibration curve of FeSO4 |
|
图 6 AN的还原力 Fig. 6 Reduction ability of AN |
由表 3可知,与AN 0组相比,饲粮中添加AN对1~21日龄和22~42日龄AA肉鸡ADG和F/G没有显著影响(P>0.05),但AN 400组22~42日龄ADFI显著提高(P < 0.05),且随着AN添加水平的提高,AFDI呈显著二次曲线变化(P < 0.05);AN 200组生长全期的ADFI显著提高(P < 0.05)。
|
|
表 3 AN对AA肉鸡生长性能的影响 Table 3 Effects of AN on growth performance of AA broilers |
由表 4可知,21日龄时,与AN 0组相比,饲粮中添加AN对血清中GSH-Px活性和T-AOC无显著影响(P>0.05),但AN 200、AN 400和AN 600组血清T-SOD活性均显著高于AN 0组(P < 0.05),AN 400和AN 600组血清MDA含量显著低于AN 0组(P < 0.05),且随着AN添加水平的提高,血清T-SOD活性呈显著线性或二次曲线变化(P < 0.05),MDA含量呈显著线性下降(P < 0.05)。方差分析结果表明,饲粮中添加AN对血清CAT活性无显著影响(P>0.05),但趋势分析显示,随着AN添加水平的提高,血清CAT活性呈先升高后降低的二次曲线变化趋势(P=0.089)。42日龄时,与AN 0组相比,饲粮中添加AN对血清GSH-Px、CAT、T-SOD活性和MDA含量无显著影响(P>0.05),但AN 400和AN 600组血清T-AOC显著高于AN 0组(P < 0.05),且随着AN添加水平的提高,血清T-AOC呈显著线性升高(P < 0.05)。
|
|
表 4 AN对AA肉鸡血清抗氧化能力的影响 Table 4 Effects of AN on serum antioxidant capacity of AA broilers |
由表 5可知,21日龄时,AN 600组肝脏CAT活性显著高于AN 0组(P < 0.05),AN 200和AN 400组肝脏T-SOD活性显著高于AN 0组(P < 0.05),且随着AN添加水平的提高,肝脏CAT活性呈显著线性或二次曲线升高(P < 0.05),肝脏T-SOD的活性呈先升高后降低的显著二次曲线变化(P < 0.05)。方差分析结果表明,饲粮中添加AN虽然对肝脏GSH-Px活性、T-AOC和MDA含量均无显著影响(P>0.05),但趋势分析显示,随着AN添加水平的提高,肝脏GSH-Px活性呈先升高后降低的二次曲线变化趋势(P=0.053),肝脏T-AOC呈显著线性升高(P=0.049),肝脏MDA含量呈线性下降趋势(P=0.092),且呈现出显著二次曲线变化趋势(P=0.027)。42日龄时,与AN 0组相比,饲粮中添加AN对肝脏T-AOC、MDA含量、GSH-Px和T-SOD活性无显著影响(P>0.05),但AN 200和AN 400组肝脏CAT活性显著高于AN 0组(P < 0.05),且随着AN添加水平的提高,肝脏CAT活性呈先升高后降低的显著二次曲线变化(P < 0.05)。
|
|
表 5 AN对AA肉鸡肝脏抗氧化能力的影响 Table 5 Effects of AN on liver antioxidant capacity of AA broilers |
由表 6可知,与AN 0组相比,饲粮中添加AN对胸肌MDA含量与CAT和T-SOD活性无显著影响(P>0.05),但AN 200组胸肌GSH-Px活性、T-AOC显著高于AN 0组(P < 0.05),且随着AN添加水平的提高,胸肌GSH-Px活性呈先升高后降低的显著二次曲线变化(P < 0.05)。
|
|
表 6 AN对42日龄AA肉鸡胸肌抗氧化能力的影响 Table 6 Effects of AN on breast antioxidant capacity of AA broilers aged 42 days |
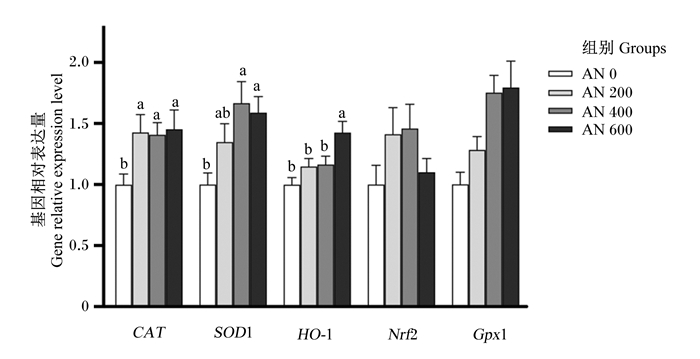
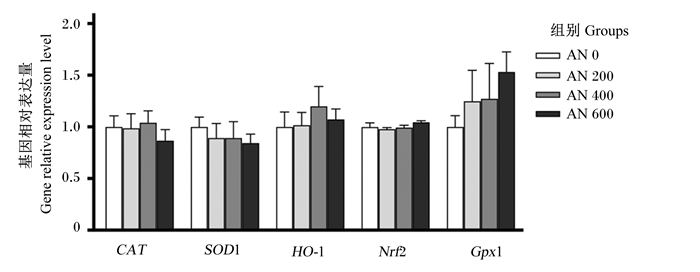
由图 7和图 8可知,21日龄时,AN 200、AN 400和AN 600组肝脏CAT的基因相对表达量显著高于AN 0组(P < 0.05),AN 400和AN 600组肝脏SOD1的基因相对表达量显著高于AN 0组(P < 0.05),AN 600组肝脏HO-1的基因相对表达量显著高于AN 0组(P < 0.05),且随着AN添加水平的提高,肝脏CAT、SOD1和HO-1的基因相对表达量呈显著线性升高(P < 0.05)。方差分析结果表明,饲粮中添加AN对肝脏Nrf2和GPx1的基因相对表达量均无显著影响(P>0.05),但趋势分析显示,随着AN添加水平的提高,肝脏Nrf2的基因相对表达量呈先升高后降低的显著二次曲线变化(P=0.038),肝脏GPx1的基因相对表达量呈显著线性升高(P < 0.001)。42日龄时,方差分析结果表明,饲粮中添加AN对肝脏CAT、SOD1、HO-1、Nrf2和GPx1的基因相对表达量均无显著影响(P>0.05)。
|
CAT:过氧化氢酶 catalase;SOD1:超氧化物歧化酶1 superoxide dismutase 1;HO-1:血红素加氧酶-1 heme oxygenase-1;Nrf2:核因子E2相关因子2 nuclear factor erythroid derived 2 like 2;GPx1:谷胱甘肽过氧化物酶1 glutathione peroxidase 1。 数据柱形标注不同小写字母表示差异显著(P < 0.05)。Value columns with different small letters mean significant difference (P < 0.05)。下图同 the same as below。 图 7 AN对21日龄AA肉鸡肝脏抗氧化相关基因表达量的影响 Fig. 7 Effects of AN on liver antioxidant related gene expression levels of AA broilers aged 21 days |
|
图 8 AN对42日龄AA肉鸡肝脏抗氧化相关基因表达量的影响 Fig. 8 Effects of AN on liver antioxidant related gene expression levels of AA broilers aged 42 days |
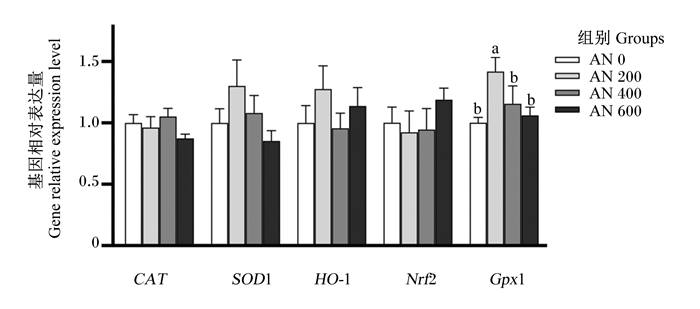
由图 9可知,AN 200组胸肌GPx1的基因相对表达量显著高于AN 0组(P < 0.05),且随着AN添加水平的提高,胸肌GPx1的基因相对表达量呈先升高后降低的显著二次曲线变化(P < 0.05)。方差分析表明,饲粮中添加AN对胸肌CAT、SOD1、HO-1和Nfr2的基因相对表达量均无显著影响(P>0.05),但趋势分析显示,随着AN添加水平的提高,胸肌SOD1的基因相对表达量呈先升高后降低的显著二次曲线变化(P=0.079)。
|
图 9 AN对42日龄AA肉鸡胸肌抗氧化相关基因表达量的影响 Fig. 9 Effects of AN on breast antioxidant related gene expression levels of AA broilers aged 42 days |
生物体内过量的自由基会氧化脂质以及蛋白质等分子,导致氧化损伤[16]。在饲粮中添加抗氧化剂可以保持机体自身氧化还原状态的稳定与平衡,Singh等[17]在AN含量为90.10%的洋茴香精油清除自由基试验中发现,该茴香精油对DPPH、ABTS的清除效果显著。与该结果相似,在Anwar等[18]的研究中,小茴香精油(AN含量为69.87%)对DPPH自由基具有良好的清除效果,IC50值为32.32 μg/mL,表现出较强的抗氧化活性。然而,与以上试验结果相反,Kfoury等[19]通过DPPH法测定了7种苯丙素类化合物的抗氧化能力,结果显示AN与DPPH的化学动力学行为明显低于其他苯丙素类化合物,AN与DPPH几乎没有反应。本试验取得了类似的结果,30 mg/mL AN对DPPH清除率为59.97%,5.45 mg/mL AN对ABTS清除率为43.67%,计算得到2种自由基的IC50值较高,分别为16.26、6.98 mg/mL。本研究结果发现,AN纯品对自由基清除作用显示出了剂量依赖性,清除效果随着浓度的增加而增强,且高浓度下表现出了一定的自由基的清除能力,但仍低于阳性对照BHT。众所周知,不同品种的茴香其遗传潜力、生长土壤和气候条件、提纯工艺、存储条件都可能会影响植物提取物的抗氧化活性[20-21]。另外,由于试验设计方案不同,不同反应体系的溶液组成差异也会影响到化合物的溶解度,进而影响提取物的抗氧化活性。更重要的是,茴香精油成分复杂,除了含量最多的AN,还有爱脑草、雌二醇和柠檬烯等其他成分,许多天然抗氧化化合物间具有协同作用,产生广谱的抗氧化活性[22],这可能是以上报道与采用AN纯品的本试验结果存在差异的主要原因。
Pavela等[23]FRAP试验结果表明,黄皮属茴香精油(AN含量为64.60%)对氯化铁的氧化还原能力表现出了较弱的作用,这一结果在本试验中也有体现:3 mg/mL AN纯品的FRAP值为0.38 mmol/L FeSO4/mL,但相同浓度下阳性对照BHT的FRAP值为4.81 mmol/L FeSO4/mL,说明AN纯品对三价铁的还原能力一般。在羟自由基清除率试验中,AN纯品的IC50值为7.82 mg/mL,比阳性对照BHT具有更好的清除效果。苯丙烯类化合物的抗氧化活性与其羟基化程度有关[19],然而鉴于分子结构的差异,AN没有游离的羟自由基[24],供氢供电子能力较差,这可能是AN的体外抗氧化活性低于BHT原因之一,然而AN结构中包含1个烷氧基和1个甲基,虽比羟基的供电子能力弱,但也属于供电子基团,据此推测高浓度的AN纯品对羟自由基、DPPH和ABTS自由基仍具有清除作用可能是得益于烷氧基和甲基。
3.2 AN对AA肉鸡生长性能的影响近年来八角茴香在家禽生产中的应用研究逐渐变多,Al-Sagan等[25]研究结果显示,在19~41日龄期间给罗斯308肉鸡饲喂茴香籽粉末可提高其生长速度并有效改善慢性热应激下的肌肉发红的现象,同时茴香籽粉末的添加可以降低肉鸡的体温,提高肉鸡在慢性热应激条件下的耐受性。然而,关于八角茴香对动物生长性能的研究结果并不完全一致。Buǧdaycl等[26]在鹌鹑饲粮中添加茴香籽对体重、采食量、日产蛋量和蛋重均没有显著影响,另外,茴香籽也无法有效改善热应激状态下蛋鸡的采食量[27]。以上这些不同的结果可能是由于动物种类、饲粮配方、各种精油的种类及其活性成分AN的含量不同。本试验结果显示,在AA肉鸡饲粮中添加200 mg/kg的AN显著提高了肉鸡生长全期的平均日采食量,添加水平为400 mg/kg的AN显著提高了肉鸡生长后期的平均日采食量,对肉鸡生长前期的生长性能指标和各时期料重比没有明显的改善作用,结果提示AN并不总是会对AA肉鸡的各项生长性能指标产生积极的影响。八角茴香精油中的多种挥发性成分具有宜人的芳香气味,在畜牧行业可被用于增加饲料的香味,改善饲粮的适口性,刺激动物食欲,提高动物的采食量和饲料转化率[28-30]。在AA肉鸡生长后期,机体消化系统逐渐发育完全,AA肉鸡对AN特殊的香甜气味会变得更加敏感而增强食欲[31],本试验中AA肉鸡生长后期采食量有所体提高可能得益于此。
3.3 AN对AA肉鸡抗氧化酶活性的影响在现代集约化养殖模式中,高密度饲养会导致肉鸡生理压力升高,如果营养或环境卫生等方面管理不当,将加剧肉鸡体内氧自由基的产生,从而引发氧化应激,严重影响肉鸡的健康生长及其肉品质。因此,无论是在正常生理状况下,还是在应激条件下,通过抗氧化防御系统维持氧化还原平衡都至关重要[32]。AN的主要生理功能之一是其抗氧化活性,大量研究结果表明,AN可维持动物体内多种组织的氧化还原平衡。在经大肠杆菌处理的无特定病原的白来航肉鸡肝脏的氧化损伤增加,而补充八角油(AN含量为93.16%)可通过激活核因子E2相关因子2-抗氧化反应元件(Nrf2-ARE)信号通路,提高试验鸡群应对氧化应激的能力,有效缓解试验鸡群因大肠杆菌感染造成的氧化应激及肝脏功能受损[33]。本试验结果表明,在肉鸡饲粮中添加AN,42日龄肉鸡血清和胸肌的T-AOC显著升高,Yu等[34]试验也有类似结果,与未添加八角油相比,饲粮中施加400、600 mg/kg八角油(AN含量为91.66%)显著提高了56日龄蛋鸡的血清和肝脏的T-AOC,有效地增强了蛋鸡血清和肝脏中T-SOD和GSH-Px活性并减少了MDA的产生。SOD能催化超氧化物歧化为氧气(O2)和过氧化氢(H2O2)发挥清除超氧化物作用[35],GSH-Px含有硒作为辅因子可催化H2O2转化为水[36],CAT可通过减少H2O2和羟自由基的产生,保护细胞成分免受活性氧自由基(ROS)攻击[37]。本试验在饲粮中,添加AN后AA肉鸡21日龄血清和肝脏T-SOD活性、21和42日龄肝脏CAT活性、42日龄胸肌GSH-Px活性均有显著提高,这些抗氧化酶可通过降低反应中间体的毒性,为细胞提供保护机制,维持细胞内的化学稳态[38],从而增强机体抵抗氧化应激的能力。脂质过氧化会使自由基过度产生、加速细胞膜氧化,导致细胞氧化损伤而凋亡,MDA的含量可监测脂质过氧化程度[39]。本试验中,添加AN后显著降低了肉鸡21日龄血清和42日龄肝脏的MDA含量,证实了AN是一种脂质过氧化抑制剂,提示AN在一定程度上缓解了肉鸡的脂质过氧化,可作为一种营养调控剂改善肉鸡抗氧化防御机制,有望在禽肉商品化生产中延长禽肉产品的保质期。
3.4 AN对AA肉鸡抗氧化相关基因表达量的影响植物苯丙烷类化合物已被证实可激活不同细胞中Nrf2/ARE信号通路,被认为是预防氧化应激和抗癌的化学候选物之一[40-42]。Sun等[43]研究发现,小茴香的添加可以减少ROS的产生,提高胞内还原型谷胱甘肽的含量,缓解因中波紫外线照射导致的成纤维细胞(NHDFs)的氧化损伤,在本试验中,100 μg/mL的小茴香显著提高了NHDFs核内Nrf2的蛋白表达,Nrf2入核后可与抗氧化反应原件ARE结合,进而激活抗氧化防御系统;Sun等[43]认为小茴香对氧化损伤保护机制可能是通过激活Nrf2/ARE信号通路,从而促进与之相关的一系列抗氧化基因的转录。Sallam等[44]发现茴香籽油可上调Nrf2及其靶蛋白HO-1和谷氨酰半胱氨酸连接酶(GCL)的表达,对扑热息痛诱导的小鼠肝毒性表现出护肝作用。本试验中,随着AN添加水平的提高,21日龄肉鸡肝脏Nrf2的基因相对表达量呈先升高后降低的显著二次曲线变化,GPx1的基因相对表达量呈显著线性升高,CAT、SOD、HO-1的基因相对表达量显著升高,42日龄胸肌GPx1 基因相对表达量显著提高,SOD1的基因相对表达量呈先升高后降低的显著二次曲线变化,这些基因的变化与抗氧化酶活性的变化趋势相一致,提示这些抗氧化酶可以在转录水平上被调控,进一步说明了AN的抗氧化活性可能是由于其激活了Nrf2/ARE信号通路。
AN的体内外抗氧化活性的试验结果缺乏一致性并不奇怪。在氧化还原生物学领域,通过生物标志物检测结果可以快速、准确、清楚有效地反映生物的状况,表征植物源化合物的抗氧化能力[45-46]。体外生物标志物自由基和还原能力的检测属于化学反应,DPPH与ABTS自由基仅在人工试验条件下存在,它们与生物系统没有相似之处,属于较弱的生物标志物。此外,植物提取物发挥抗氧化的保护作用可能是多重种不同机制的总和[47]。因此,是否可以将体外化学试验结果顺推到动物体内还有待进一步论证。在本试验研究中,AN纯品的体外化学抗氧化能力一般,而提高肉鸡抗氧化能力效果显著,究其原因可能是AN可直接影响特定的分子靶标或作为影响代谢途径的稳定结合物间接激活内源性的抗氧化防御系统,从而提高动物体的抗氧化能力,发挥其积极的抗氧化作用。
4 结论体外试验结果表明,AN清除羟自由基能力良好,但清除DPPH自由基、清除ABTS自由基能力与FRAP较弱,总体抗氧化作用弱于BHT。AA肉鸡体内试验结果表明,饲粮中添加200~600 mg/kg AN可不同程度地提高AA肉鸡血清、肝脏和胸肌抗氧化能力,减少血清和肝脏MDA的生成。本试验条件下,AN作为抗氧化剂在AA肉鸡饲粮中的适宜添加水平为400 mg/kg。
| [1] |
DOSOKY N S, SETZER W N. Maternal reproductive toxicity of some essential oils and their constituents[J]. International Journal of Molecular Sciences, 2021, 22(5): 2380. DOI:10.3390/ijms22052380 |
| [2] |
DRUKARCH B, FLIER J, JONGENELEN C A M, et al. The antioxidant anethole dithiolethione inhibits monoamine oxidase-B but not monoamine oxidase A activity in extracts of cultured astrocytes[J]. Journal of Neural Transmission, 2006, 113(5): 593-598. DOI:10.1007/s00702-005-0350-0 |
| [3] |
RYU S, SEOL G H, PARK H, et al. Trans-anethole protects cortical neuronal cells against oxygen-glucose deprivation/reoxygenation[J]. Neurological Sciences, 2014, 35(10): 1541-1547. DOI:10.1007/s10072-014-1791-8 |
| [4] |
DONGARE V, KULKARNI C, KONDAWAR M, et al. Inhibition of aldose reductase and anti-cataract action of trans-anethole isolated from Foeniculum vulgare Mill.fruits[J]. Food Chemistry, 2012, 132(1): 385-390. DOI:10.1016/j.foodchem.2011.11.005 |
| [5] |
AAZZA S, LYOUSSI B, MIGUEL M G. Antioxidant and antiacetylcholinesterase activities of some commercial essential oils and their major compounds[J]. Molecules, 2011, 16(9): 7672-7690. DOI:10.3390/molecules16097672 |
| [6] |
LUÍS Â, SOUSA S, WACKERLIG J, et al. Star anise (Illicium verum Hook.f.) essential oil: antioxidant properties and antibacterial activity against Acinetobacter baumannii[J]. Flavour and Fragrance Journal, 2019, 34(4): 260-270. DOI:10.1002/ffj.3498 |
| [7] |
余炜, 田玉红, 张英, 等. 八角和肉桂油抗油脂氧化性能研究[J]. 东北农业大学学报, 2011, 42(8): 34-39. YU W, TIAN Y H, ZHANG Y, et al. Protective effect against lipid oxidation of anise oil and cinnamon oil[J]. Journal of Northeast Agricultural University, 2011, 42(8): 34-39 (in Chinese). DOI:10.3969/j.issn.1005-9369.2011.08.007 |
| [8] |
SWANSON A B, CHAMBLISS D D, BLOMQUIST J C, et al. The mutagenicities of safrole, estragole, eugenol, trans-anethole, and some of their known or possible metabolites for Salmonella typhimurium mutants[J]. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis, 1979, 60(2): 143-153. DOI:10.1016/0027-5107(79)90178-7 |
| [9] |
MARON D M, AMES B N. Revised methods for the Salmonella mutagenicity test[J]. Mutation Research/Environmental Mutagenesis and Related Subjects, 1983, 113(3/4): 173-215. |
| [10] |
MOHAN R S, WHALEN D L. Acid-catalyzed hydrolysis of cis- and trans-anethole oxides: discrete carbocation intermediates and syn/anti hydration ratios[J]. The Journal of Organic Chemistry, 1993, 58(10): 2663-2669. DOI:10.1021/jo00062a006 |
| [11] |
PARK K K, LIEM A, STEWART B C, et al. Vinyl carbamate epoxide, a major strong electrophilic, mutagenic and carcinogenic metabolite of vinyl carbamate and ethyl carbamate (urethane)[J]. Carcinogenesis, 1993, 14(3): 441-450. DOI:10.1093/carcin/14.3.441 |
| [12] |
BOFFA L, BINELLO A, BOSCARO V, et al. Commiphora myrrha (Nees) Engl. extracts: evaluation of antioxidant and antiproliferative activity and their ability to reduce microbial growth on fresh-cut salad[J]. International Journal of Food Science & Technology, 2016, 51(3): 625-632. |
| [13] |
HICHRI F, OMRI HICHRI A, MAHA M, et al. Chemical composition, antibacterial, antioxidant and in vitro antidiabetic activities of essential oils from Eruca vesicaria[J]. Chemistry & Biodiversity, 2019, 16(8): e1900183. |
| [14] |
GIESE E C, GASCON J, ANZELMO G, et al. Free-radical scavenging properties and antioxidant activities of botryosphaeran and some other β-D-glucans[J]. International Journal of Biological Macromolecules, 2015, 72: 125-130. DOI:10.1016/j.ijbiomac.2014.07.046 |
| [15] |
CHEN T S, LIOU S Y, WU H C, et al. New analytical method for investigating the antioxidant power of food extracts on the basis of their electron-donating ability: comparison to the ferric reducing/antioxidant power (FRAP) assay[J]. Journal of Agricultural and Food Chemistry, 2010, 58(15): 8477-8480. DOI:10.1021/jf9044292 |
| [16] |
LI S, TAN H Y, WANG N, et al. The role of oxidative stress and antioxidants in liver diseases[J]. International Journal of Molecular Sciences, 2015, 16(11): 26087-26124. DOI:10.3390/ijms161125942 |
| [17] |
SINGH G, KAPOOR I P S, DE HELUANI C S, et al. Chemical composition and antioxidant potential of essential oil and oleoresins from anise seeds (Pimpinella anisum L.)[J]. International Journal of Essential Oil Therapeutics, 2008, 2: 122-130. |
| [18] |
ANWAR F, ALI M, HUSSAIN A I, et al. Antioxidant and antimicrobial activities of essential oil and extracts of fennel (Foeniculum vulgare Mill.) seeds from Pakistan[J]. Flavour and Fragrance Journal, 2009, 24(4): 170-176. DOI:10.1002/ffj.1929 |
| [19] |
KFOURY M, LANDY D, AUEZOVA L, et al. Effect of cyclodextrin complexation on phenylpropanoids' solubility and antioxidant activity[J]. Beilstein Journal of Organic Chemistry, 2014, 10: 2322-2331. DOI:10.3762/bjoc.10.241 |
| [20] |
ORAV A, RAAL A, ARAK E. Essential oil composition of Pimpinella anisum L. fruits from various European countries[J]. Natural Product Research, 2008, 22(3): 227-232. DOI:10.1080/14786410701424667 |
| [21] |
ZHELJAZKOV V D, CANTRELL C L, EBELHAR M W, et al. Productivity, oil content, and oil composition of sweet basil as a function of nitrogen and sulfur fertilization[J]. HortScience, 2008, 43(5): 1415-1422. DOI:10.21273/HORTSCI.43.5.1415 |
| [22] |
KAMAL-ELDIN A, APPELQVIST L A. The chemistry and antioxidant properties of tocopherols and tocotrienols[J]. Lipids, 1996, 31(7): 671-701. DOI:10.1007/BF02522884 |
| [23] |
PAVELA R, MAGGI F, LUPIDI G, et al. Clausena anisata and Dysphania ambrosioides essential oils: from ethno-medicine to modern uses as effective insecticides[J]. Environmental Science and Pollution Research, 2018, 25(11): 10493-10503. DOI:10.1007/s11356-017-0267-9 |
| [24] |
KFOURY M, LOUNÈS-HADJ SAHRAOUI A, BOURDON N, et al. Solubility, photostability and antifungal activity of phenylpropanoids encapsulated in cyclodextrins[J]. Food Chemistry, 2016, 196: 518-525. DOI:10.1016/j.foodchem.2015.09.078 |
| [25] |
AL-SAGAN A A, KHALIL S, HUSSEIN E O S, et al. Effects of fennel seed powder supplementation on growth performance, carcass characteristics, meat quality, and economic efficiency of broilers under thermoneutral and chronic heat stress conditions[J]. Animals, 2020, 10(2): 206. DOI:10.3390/ani10020206 |
| [26] |
BUǦDAYCI K E, OǦUZ F K, OǦUZ M N, et al. Effects of fennel seed supplementation of ration on performance, egg quality, serum cholesterol, and total phenol content of egg yolk of laying quails[J]. Revista Brasileira de Zootecnia, 2018, 47: e20170160. |
| [27] |
GHARAGHANI H, SHARIATMADARI F, TORSHIZI M. Effect of fennel (Foeniculum Vulgare Mill.) used as a feed additive on the egg quality of laying hens under heat stress[J]. Brazilian Journal of Poultry Science, 2015, 17(2): 199-207. DOI:10.1590/1516-635x1702199-208 |
| [28] |
BAYRAM I, CETINGUL I S, AKKAYA B, et al. Effects of aniseed (Pimpinella anisum L.), on egg production, quality, cholesterol levels, hatching results and the antibody values in blood of laying quails (Coturnix coturnix japonica)[J]. Archiva Zootechnica, 2007, 10: 73-77. |
| [29] |
黄冠庆, 杜炳旺. 香辛型中草药添加剂对肉仔鸡生长和屠宰性能的影响[J]. 中国家禽, 2004, 26(14): 17-18. HUANG G Q, DU B W. Effect of spice Chinese herbal additives on growth and slaughter performance of broiler chicks[J]. China Poultry, 2004, 26(14): 17-18 (in Chinese). DOI:10.3969/j.issn.1004-6364.2004.14.006 |
| [30] |
王攀攀. 反式茴香醚对SPF鸡免疫机能和养分利用率的影响[D]. 硕士学位论文. 泰安: 山东农业大学, 2020. WANG P P. Effects of trans-anisole on immune function and nutrient utilization of SPF chickens[D]. Master's Thesis. Tai'an: Shandong Agricultural University, 2020. (in Chinese) |
| [31] |
WANG G Y, YANG C W, YANG Z B, et al. Effects of dietary star anise (Illicium verum Hook f.) supplementation during gestation and lactation on the performance of lactating multiparous sows and nursing piglets[J]. Animal Science Journal, 2015, 86(4): 401-407. DOI:10.1111/asj.12300 |
| [32] |
ABDEL-MONEIM A M E, SHEHATA A M, KHIDR R E, et al. Nutritional manipulation to combat heat stress in poultry-a comprehensive review[J]. Journal of thermal Biology, 2021, 98: 102915. DOI:10.1016/j.jtherbio.2021.102915 |
| [33] |
丁晓. 反式茴香醚对动物的抗氧化作用及机理研究[D]. 博士学位论文. 泰安: 山东农业大学, 2020. DING X. The antioxidant capacity of trans-anethole and the potential mechanism in animals[D]. Ph. D. Thesis. Tai'an: Shandong Agricultural University, 2020. (in Chinese) |
| [34] |
YU C Y, WEI J D, YANG C W, et al. Effects of star anise (Illicium verum Hook.f.) essential oil on laying performance and antioxidant status of laying hens[J]. Poultry Science, 2018, 97(11): 3957-3966. DOI:10.3382/ps/pey263 |
| [35] |
BATINIĆ-HABERLE I, REBOUÇAS J S, SPASOJEVIĆ I. Superoxide dismutase mimics: chemistry, pharmacology, and therapeutic potential[J]. Antioxidants & Redox Signaling, 2010, 13(6): 877-918. |
| [36] |
NAZIROǦLU M, MUHAMAD S, PECZE L. Nanoparticles as potential clinical therapeutic agents in Alzheimer's disease: focus on selenium nanoparticles[J]. Expert Review of Clinical Pharmacology, 2017, 10(7): 773-782. DOI:10.1080/17512433.2017.1324781 |
| [37] |
袁秀康. 牛磺酸对鸡生产性能与抗氧化性能的影响[D]. 硕士学位论文. 泰安: 山东农业大学, 2021. YUAN X K. Effect of taurine on the performance and antioxidative capacity of chicken[D]. Master's Thesis. Tai'an: Shandong Agricultural University, 2021. (in Chinese) |
| [38] |
KWAK M K, EGNER P A, DOLAN P M, et al. Role of phase 2 enzyme induction in chemoprotection by dithiolethiones[J]. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis, 2001, 480/481: 305-315. DOI:10.1016/S0027-5107(01)00190-7 |
| [39] |
LEE Y S, CHO I J, KIM J W, et al. Hepatoprotective effects of blue honeysuckle on CCl4-induced acute liver damaged mice[J]. Food Science & Nutrition, 2019, 7(1): 322-338. |
| [40] |
SURH Y J, KUNDU J K, NA H K. Nrf2 as a master redox switch in turning on the cellular signaling involved in the induction of cytoprotective genes by some chemopreventive phytochemicals[J]. Planta Medica, 2008, 74(13): 1526-1539. DOI:10.1055/s-0028-1088302 |
| [41] |
GIUDICE A, ARRA C, TURCO M C. Review of molecular mechanisms involved in the activation of the Nrf2-ARE signaling pathway by chemopreventive agents[J]. Methods in Molecular Biology, 2010, 647: 37-74. |
| [42] |
CHUN K S, KUNDU J, KUNDU J K, et al. Targeting Nrf2-Keap1 signaling for chemoprevention of skin carcinogenesis with bioactive phytochemicals[J]. Toxicology Letters, 2014, 229(1): 73-84. DOI:10.1016/j.toxlet.2014.05.018 |
| [43] |
SUN Z W, PARK S Y, HWANG E, et al. Dietary Foeniculum vulgare Mill extract attenuated UVB irradiation-induced skin photoaging by activating of Nrf2 and inhibiting MAPK pathways[J]. Phytomedicine, 2016, 23(12): 1273-1284. DOI:10.1016/j.phymed.2016.06.008 |
| [44] |
SALLAM N A, KHALIL S R, SAID H M. Effects of fennel seed oil on Nrf2 pathway in paracetamol-induced hepatoxicity in rats[C]//Proceedings for Annual Meeting of the Japanese Pharmacological Society, 2018: WCP2018-OR21-4.
|
| [45] |
VESKOUKIS A, KERASIOTI E, PRIFTIS A, et al. A battery of translational biomarkers for the assessment of the in vitro and in vivo antioxidant action of plant polyphenolic compounds: the biomarker issue[J]. Current Opinion in Toxicology, 2019, 13: 99-109. DOI:10.1016/j.cotox.2018.10.001 |
| [46] |
MARGARITELIS N V, COBLEY J N, PASCHALIS V, et al. Going retro: oxidative stress biomarkers in modern redox biology[J]. Free Radical Biology and Medicine, 2016, 98: 2-12. DOI:10.1016/j.freeradbiomed.2016.02.005 |
| [47] |
CALABRESE V, CORNELIUS C, MANCUSO C, et al. Cellular stress response: a novel target for chemoprevention and nutritional neuroprotection in aging, neurodegenerative disorders and longevity[J]. Neurochemical Research, 2008, 33(12): 2444-2471. DOI:10.1007/s11064-008-9775-9 |




