2. 江西好实沃生物技术有限公司, 宜春 336000;
3. 东光县农业农村局, 东光 061600
2. Jiangxi Haoshiwo Biotechnology Co., Ltd., Yichun 336000, China;
3. Dongguang County Agricultural and Rural Bureau, Dongguang 061600, China
近年来,随着我国饲料行业禁抗政策的相继出台,使得高效、安全绿色饲料添加剂的应用研究尤为迫切。灭活植物乳杆菌和未灭活植物乳杆菌的主要区别在于植物乳杆菌灭活后不能够继续繁殖、增殖,但是含有灭活的菌体细胞、细胞壁多糖、细胞内容物以及代谢产生的有机酸和细菌素等多种代谢产物。灭活植物乳杆菌不是依靠植物乳酸菌的生长繁殖发挥作用,而是靠菌体的竞争排斥和其代谢产物中含有的有机酸等发挥作用[1]。植物乳杆菌属于革兰氏阳性菌,它的主要成分是脂类物质和肽聚糖,其中脂蛋白和肽聚糖可以让植物乳杆菌对肉鸡的肠道具备强黏附功能。植物乳杆菌经过80 ℃的精准高温灭活以后,可以让其表面的肽聚糖彻底裸露出来,从而拥有更强的肠道黏附作用和竞争排斥性。此外,灭活的植物乳杆菌具有耐胃酸、耐胆汁和耐高温等优点,安全性更高更稳定,如果采用活菌,生产高温制粒或者动物采食以后,植物乳杆菌在此过程中不一定能够存活下来,稳定性差,所以灭活植物乳杆菌相比较而言更有优势。另外,灭活植物乳杆菌及其代谢产物中含有丰富的乳酸、乳酸菌素,可以有效地抑制或杀灭肉鸡肠道中的致病菌[2]。相比较活菌,灭活植物乳杆菌的安全性更高,并且在吸附毒素、黏附病原菌、增强肠黏膜屏障功能以及调节肠道菌群等方面发挥重要作用,在动物生产中具有很大的应用潜力。这些具有促进健康功效的灭活菌和代谢产物均属于后生元的范畴,为了统一后生元的定义,2021年5月,国际益生菌和益生元科学协会(ISAPP)发表了后生元的共识声明:后生元是指对宿主健康有益的无生命微生物和/或其成分的制剂[3]。但是,目前植物乳杆菌后生元在我国畜牧行业中的应用较少,尚不明确在饲粮中的适宜添加量[1]。因此,本试验在饲粮中添加不同剂量的植物乳杆菌后生元(postbiotics Lactobacillus plantarum, PLP),研究其对肉鸡生长性能、屠宰性能、十二指肠消化酶活性、盲肠微生物组成与多样性的影响,以期确定PLP在肉鸡饲粮中的适宜添加量,为PLP在肉鸡生产中应用提供理论数据。
1 材料与方法 1.1 试验材料试验所用PLP购自某生物技术有限公司,含灭活植物乳杆菌数≥5.0×1010个/g;代谢产物主要成分为乳酸、短链脂肪酸及细菌素(分子质量10 kD),灭活菌数≥5.0×109个/g,总酸(以乳酸计)含量≥2.5%,总蛋白含量≥1%。其中植物乳杆菌菌株为HEW-A911;灭活植物乳杆菌数采用血球计数法测定;代谢产物细菌素分子质量是将发酵液进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)(上样量10 μL,电泳时间20 min)后测定;总酸含量按照GB 12456—2021中的酸碱指示剂滴定法测定;总蛋白含量按照GB 5009.5—2016中凯氏定氮法测定。植物乳杆菌的发酵条件:温度36.5~37.5 ℃,发酵罐转速50~80 r/min,发酵时间16~18 h,然后80 ℃灭活处理。
1.2 试验设计与试验饲粮选取当日10:00出雏的1日龄健康并且体重接近的爱拔益加(AA)雄性肉仔鸡600只,随机分为5组,各组间平均体重差异不显著(P>0.05),每组各设6个重复,每个重复有20只鸡。A组为对照组,饲喂基础饲粮;B、C、D、E组为试验组,在基础饲粮的基础上分别添加200、400、600和800 g/t的PLP。试验期42 d,分为前期(1~14日龄)、中期(15~28日龄)、后期(29~42日龄)3个阶段。每个组提前按照试验设计的添加量将PLP添加加到肉仔鸡的基础饲粮中。3个阶段的基础饲粮组成及营养水平见表 1。肉仔鸡采用的饲粮前期是破碎料,中期和后期是粉料加粒料。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of basal diets (air-dry basis) |
肉鸡在试验期间采用自由饮水和采食的方法。严格按照《AA肉仔鸡饲养管理手册》进行操作,然后执行正常的防疫流程和消毒处理程序。鸡舍管理完全按照沈阳农业大学的饲养管理程序进行管理。本试验应用3层笼养的饲养方式,饮水应用自动饮水线,08:00和18:00分别人工添料1次。鸡舍使用具有智能恒温系统的暖风炉进行保温供暖,温度设定严格按照肉鸡的饲养温度标准进行定期调整,鸡舍保证良好的通风。
1.4 测定指标及方法 1.4.1 生长性能在试验期间,每日记录加料量和剩余料量,计算每组每日的喂料量,每日记录各组鸡的淘汰和死亡数量,并在试验开始及饲养天数达到14、28和42 d时对所有组肉鸡挨个进行空腹称重,同时计算每个阶段和整个饲养期间的平均日增重(ADG)、平均日采食量(ADFI)、料重比(F/G)和死淘率(MER),并计算欧洲效益指数(EPI)。

|
饲养试验结束后,为确保采样时间相同,根据饲养试验综合结果,选取的ADG、F/G和出栏重与对照组差异显著的600 g/t组进一步探讨PLP对肉鸡屠宰性能、十二指肠消化酶活性和盲肠微生物组成及多样性。随机从对照组和600 g/t组的每个重复内抽取1只控食(期间自由饮水)12 h后的肉鸡,完全按照《家禽生产性能名词术语和度量统计方法》(NY/T 823—2004)测定肉鸡的屠宰率、胸肌率、腿肌率、腹脂率、半净膛率和全净膛率。
1.4.3 十二指肠消化酶活性试验鸡屠宰后,剪取约2 cm的十二指肠组织放在冻存管中,以备检测消化酶活性。使用江苏宝莱生物科技有限公司生产的消化酶活性测定试剂盒,按照试剂盒的操作说明测定淀粉酶、脂肪酶和胰蛋白酶活性。
1.4.4 盲肠微生物组成及多样性试验鸡屠宰后,在无菌条件下采集盲肠内容物,送至深圳微科盟科技集团有限公司进行后续的DNA提取以及16S rDNA扩增子测序分析,根据Novaseq PE250测序平台,使用单端测序的方法来构建一个小片段文库。经过切割、分析后读取来取得最后的有效数据。在这些有效数据的基础上,将所有序列聚类形成具备97%同源性的操作分类单元(OTUs),然后利用这些OTUs序列跟Greengenes数据库分别进行物种注释分析。依据这些物种的注释,通过计算微生物的α多样性和β多样性,对照各组之间的差别,从而显示出不同处理条件下群落结构之间的差异性。通过OTUs数量来计算出α多样性指数(Shannon、Simpson、Chao1、ACE指数)。使用LEfSe分析方法来分析不同群体之间群落结构的差异,即β多样性。
1.5 数据处理与统计分析饲养试验的生长性能数据结果应用Excel 2010进行初步整理,然后使用SPSS 25.0软件进行统计分析。先采用单因素方差(one-way ANOVA)程序进行方差分析,再采用LSD法进行多重比较,所有结果均使用平均值±标准差表示,如果P<0.05则表示差异显著,如果P<0.01则表示差异极显著。
屠宰性能采样及粪样分析结果应用Excel 2010进行初步整理,然后使用SPSS 25.0软件进行独立样本t检验,假设方差不相等,P < 0.05表明数据之间差异有显著性,方差齐性不一致;假设方差相等,P>0.05表明数据之间差异没有显著性,方差齐性一致。所有结果均用平均值±标准差表示。
2 结果与分析 2.1 PLP对肉鸡生长性能的影响由表 2可知,在饲养试验前期阶段,600 g/t PLP组的末重与对照组相比显著增加(P < 0.05),800 g/t PLP组与对照组相比极显著增加(P < 0.01);400和600 g/t PLP组的ADG与对照组相比显著提高(P < 0.05),800 g/t PLP组与对照组相比极显著提高(P < 0.01);400 g/t PLP组的ADFI与对照组相比显著提高(P < 0.05),800 g/t PLP组与对照组相比极显著提高(P < 0.01);各组间F/G和MER差异不显著(P>0.05)。
|
|
表 2 PLP对肉鸡各阶段生长性能的影响 Table 2 Effects of PLP on growth performance of broilers at different stages |
|
|
表 3 PLP对肉鸡屠宰性能的影响 Table 3 Effects of PLP on slaughter performance of broilers |
在饲养试验中期阶段,400 g/t PLP组的末重及ADG与对照组相比极显著提高(P < 0.01),同时F/G极显著低于对照组(P < 0.01);其他PLP组的末重、ADG、ADFI和F/G与对照组相比差异均不显著(P>0.05);各组间MER差异不显著(P>0.05)。
在饲养试验的后期阶段,400和600 g/t PLP组的末重与对照组相比显著提高(P < 0.05),其他PLP组的末重与对照组相比均无显著差异(P>0.05);各组间ADG、ADFI、F/G和MER差异不显著(P>0.05)。
饲养试验全期(1~42日龄),400和600 g/t PLP组的末重、ADG和EPI与对照组相比显著提高(P < 0.05),F/G与对照组相比显著降低(P < 0.05);各组间ADFI和MER差异均不显著(P>0.05)。
综合试验全期的结果表明,饲粮中PLP添加量为400~600 g/t时可以显著提高肉鸡的出栏重和ADG,显著降低F/G,显著提高EPI。
对表 2中试验全期的末重、ADG、ADFI、F/G、MER和EPI数据进行曲线拟合,结果可知:末重、ADG、F/G和EPI与梯度变化符合二次曲线变化规律(P<0.05),因此对本试验的生长性能指标进行二次曲线拟合计算出PLP在肉鸡饲粮中的最适添加量,回归方程如下:ADG回归方程为y=-0.000 013 679x2+0.012 583x+50.306,R2=0.921 6,极值为460;末重回归方程为y=-0.000 549 71x2+0.515 35x+2 156.3,R2=0.860,极值为469;F/G回归方程为y=0.000 000 410 7x2-0.000 373 6x+1.692 9,R2=0.980 5,极值为455;EPI回归方程为y=-0.000 152 16x2+0.148 99x+ 289.36,R2=0.929 3,极值为490。综合以上二次拟合分析结果,PLP在肉鸡饲粮中的适宜添加量在455~490 g/t。
2.2 PLP对肉鸡屠宰性能的影响选取生长性能与对照组差异显著且MER最低的600 g/t PLP组进行屠宰试验,结果显示其屠宰率、半净膛率、全净膛率与对照组相比均得到显著提高(P < 0.05),证明肉鸡饲粮中添加PLP后可以显著提高肉鸡的屠宰率、半净膛率和全净膛率。
2.3 PLP对肉鸡十二指肠消化酶活性的影响由表 4可知,600 g/t PLP组的十二指肠淀粉酶活性与对照组相比极显著提高(P < 0.01),胰蛋白酶和脂肪酶活性与对照组相比显著提高(P < 0.05),由此说明饲粮中添加PLP可以使肉鸡十二指肠的淀粉酶、胰蛋白酶和脂肪酶活性得到提高。
|
|
表 4 PLP对肉鸡十二指肠消化酶活性的影响 Table 4 Effects of PLP on activities of digestive enzymes in duodenum of broilers |
图 1左侧展示了42日龄肉鸡盲肠微生物门水平上相对丰度排行前20位的菌门。从图中可以明显见到,对照组和600 g/t PLP组的盲肠菌群都是以拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、柔膜菌门(Tenericutes)、放线菌门(Actinobacteria)、疣微菌门(Verrucomicrobia)、未分类菌门(unclassified)、酸杆菌门(Acidobacteria)、广古菌门(Euryarchaeota)、芽单胞菌门(Gemmatimonadetes)、互养菌门(Synergistetes)、蓝藻门(Cyanobacteria)、绿弯菌门(Chloroflexi)和硝化菌门(Nitrospirae)为主。在盲肠微生物中,拟杆菌门和厚壁菌门是优势菌门,二者相对丰度之和占微生物群落总丰度的85%以上。
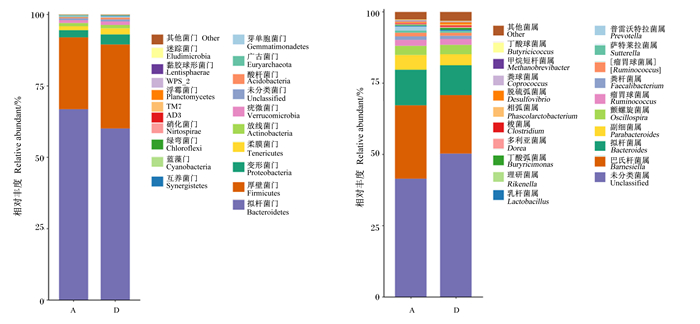
|
A:对照组;D:600 g/t PLP组。下图同。 A: control group; D: 600 g/t PLP group. The same as below. 图 1 42日龄肉鸡盲肠微生物在门和属水平上的相对丰度(前20位)柱形图 Fig. 1 Column chart of relative abundance of microorganisms (top 20) at phylum and genus levels in cecum of 42-day-old broilers |
图 1右侧展示了42日龄肉鸡盲肠微生物属水平相对丰度排行前20位的菌属。从图中可以看出,这20个菌属的相对丰度大约占微生物群落总丰度的90%,对照组和600 g/t PLP组在属水平上相对丰度超过1%的有巴氏杆菌属(Barnesiella)、拟杆菌属(Bacteroides)、副细菌属(Parabacteroides)、颤螺旋菌属(Oscillospira)、瘤胃球菌属(Ruminococcus)、粪杆菌属(Faecalibacterium)、普雷沃菌属(Prevotella)。对照组乳酸杆菌属(Lactobacillus)相对丰度为0.316%,600 g/t PLP组乳酸杆菌属相对丰度为0.367%,方差分析虽然显示2组间差异不显著(P>0.05),但是600 g/t PLP组较对照组提高了16.06%。
2.4.2 PLP对肉鸡盲肠微生物α多样性的影响由表 5可知,600 g/t PLP组的操作分类单元(OTUs)数量以及Chao1和ACE指数显著高于对照组(P<0.05),说明饲粮中添加600 g/t PLP可以提高肉鸡盲肠微生物的丰富度;600 g/t PLP组的Shannon指数显著高于对照组(P<0.05),Simpson指数与对照组差异不显著(P>0.05),说明饲粮中添加600 g/t PLP可以提高肉鸡盲肠微生物的多样性。
|
|
表 5 PLP对肉鸡盲肠微生物α多样性的影响 Table 5 Effects of PLP on α diversity of cecal microorganisms of broilers |
从LEfSe分析柱形图展示了LDA评分高于设定值(默认值是2)的微生物种类,也就是各组间具有统计学差异的生物标志物(biomaker),图中柱形图长度越长代表该微生物对盲肠内微生物群落的影响越大。由图 2可知,600 g/t PLP组与对照组存在显著差异的物种有17个,其中相对丰度显著升高的物种有13个,分别为变形菌门(Proteobacteria)、嗅杆菌科(Odoribacteraceae)、丁酸弧菌属(Butyricimonas)、黄单目(Xanthomonadales)、黄单胞菌科(Xanthomonadaceae)、代拉属(Dyella)、厌氧菌属(Anaerotruncus)、类芽孢杆菌属(Paenibacillus)、热单胞菌属(Thermomonas)、戴沃斯氏属(Devosia)、甲基杆菌科(Methylobacteriaceae)、甲基杆菌属(Methylobacterium)、类芽孢杆菌科(Paenibacillaceae),相对丰度降低的有4个,分别为无色杆菌属(Achromobacter)、Terrimonas、偶氮螺菌属(Azospirillun)、鲁内拉属(Runella)。
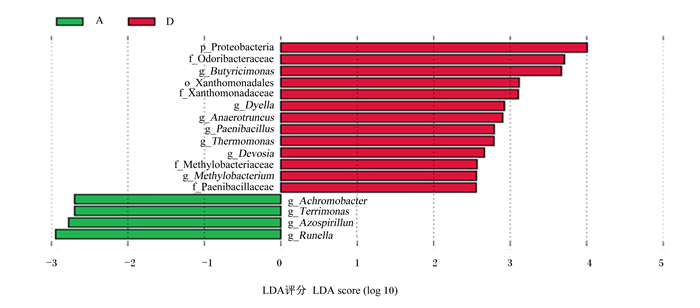
|
Proteobacteria:变形菌门;Odoribacteraceae:嗅杆菌科;Butyricimonas:丁酸弧菌属;Xanthomonadales:黄单胞菌目;Xanthomonadaceae:黄单胞菌科;Dyella:代拉属;Anaerotruncus:厌氧菌属;Paenibacillus:类芽孢杆菌属;Thermomonas:热单胞菌属;Devosia:戴沃斯氏属;Methylobacteriaceae:甲基杆菌科;Methylobacterium:甲基杆菌属;Paenibacillaceae:类芽孢杆菌科;Achromobacter:无色杆菌属;Azospirillum:偶氮螺菌属;Runella:鲁内拉属。 图 2 42日龄肉鸡盲肠微生物LEfSe分析柱形图 Fig. 2 Column chart of LEfSe analysis of cecal microorganisms of 42-day-old broilers |
本试验证实,饲粮中添加PLP有促进肉鸡生长的作用,主要表现为ADFI和ADG提高,说明饲粮中添加PLP可以增加饲粮适口性和提高增重。在饲粮中添加PLP对肉鸡1~14日龄、15~28日龄、29~42日龄以及1~42日龄肉鸡的ADG有明显的提高,其中添加量为400~600 g/t时效果较好。Kalavathy等[4]研究结果显示,饲粮中添加0.1%的鸡源性乳酸菌混合物可以显著降低对肉仔鸡前期(1~21日龄)的F/G,显著提高肉鸡前期的ADG;易先国[5]研究表明,肉鸡饲粮中添加10 mg/kg热灭活植物乳杆菌可以显著提高肉鸡5~22日龄的ADG,降低F/G。赵巍等[6]研究表明,饲粮中添加6.4‰的热灭活植物乳杆菌培养物可以显著提高肉鸡前期的ADG。本试验结果与上述研究结果相一致,饲粮中添加PLP后饲养试验前期(1~14日龄)和中期(15~28日龄)肉鸡的ADG均得到显著提高,可能是前期和中期肉鸡的免疫机能尚未发育完善,抵抗力差,PLP能够提高肉鸡的机体免疫力[7],缓解了外界应激,从而使ADG得到提高。饲养试验后期(29~42日龄)饲粮中添加PLP对肉鸡ADG提高效果不显著,但是也有提高趋势,对F/G的改善效果显著,可能是因为肉鸡前期和中期免疫机能在PLP的协助下能够快速发育完善,保障后期肠道更加健康,从而提高肉鸡的ADG,同时降低F/G,提高肉鸡的生长性能。易先国[5]的研究表明,热灭活植物乳杆菌可以显著提高42日龄肉鸡的出栏重、ADG,显著降低F/G,结合前期、中期的显著优势和后期的改善趋势,综合导致肉鸡的全期ADG显著提高,F/G显著降低,本试验结果与该报道结果一致。张辉华等[8]的研究结果显示,热灭活植物乳杆菌微生态制剂对肉鸡的ADG、F/G具有很大的改善作用,并且这都体现在肉鸡生长的前、中期,但是在肉鸡生长的后期效果不理想,本试验结果与此观点相一致。
3.2 PLP对肉鸡屠宰性能的影响衡量肉鸡肉用性能的关键指标就是屠宰性能,这与肉品质量息息相关。黄金华等[9]研究显示,将含有植物乳杆菌的复合益生菌添加到肉鸡饲粮中可使肉鸡的半净膛率和全净膛率得到显著提高,这与本研究所得结果相类似,即PLP可以使肉鸡的屠宰率、半净膛率和全净膛率得到显著提高,说明PLP保留了植物乳杆菌的部分功能。黄金华等[9]研究结果表明,添加0.1%和0.2%含植物乳杆菌的复合益生菌到肉鸡饲粮中可以显著降低肉鸡的腹脂率,但是本试验结果显示肉鸡的腿肌率、腹脂率、胸肌率与对照组相比较差异不显著,这与前人的研究结果不一样,说明PLP对肉鸡屠宰性能的影响机理需要进一步深入研究。
3.3 PLP对肉鸡十二指肠消化酶活性的影响脂肪酶、淀粉酶和胰蛋白酶是肉鸡体内非常重要的3种消化酶,其活性的高低直接反映了其对营养物质利用水平的高低,同时也反映了肠道分泌功能的正常与否和肠道结构的完整与否。十二指肠内的这些消化酶活性的高低将对肉鸡的生长性能产生至关重要的影响。王志祥等[10]的研究结果显示,在饲粮中添加0.25%乳酸杆菌饲喂仔猪6周,可以使得猪胰脏和十二指肠食糜的脂肪酶和淀粉酶活性得到显著提高。王恒月[11]的研究结果显示,在饲粮中添加乳酸杆菌属培养物饲喂肉鸡,可以使得肉鸡小肠淀粉酶活性得到显著提高。本试验结果表明,饲粮中添加PLP可以让肉鸡十二指肠淀粉酶、胰蛋白酶和脂肪酶活性得到显著提高,这与之前的报道试验结果基本相同。十二指肠淀粉酶、脂肪酶和胰蛋白酶活性的提高会相应地提高肉鸡对饲粮中营养物质的消化吸收能力,进而提高肉鸡的ADG和出栏重并且降低肉鸡的F/G。
3.4 PLP对肉鸡盲肠微生物组成的影响保持动物机体健康与否关键在于动物肠道内的微生物区系是否平衡。肠道是动物机体内非常重要的消化吸收器官,与此同时肠道内也有大量的细菌聚集于此,这些细菌在动物机体内经过漫长的进化,最终与机体的内环境构成稳定的微生物系统。大肠杆菌、双歧杆菌和乳酸杆菌是肉鸡盲肠中最常见的菌群,双歧杆菌及乳酸杆菌是肉鸡肠道中的主要优势菌群,大约占90%,对肉鸡胃肠道的微生态平衡至关重要。Jin等[12]的试验结果显示,饲粮中添加乳酸杆菌可以使肉鸡盲肠内的乳酸杆菌数量得到显著提高,同时可以有效抑制盲肠内大肠杆菌的繁殖和增殖。陈佳等[13]研究表明,在饲粮中加入产共轭亚油酸(CLA)乳杆菌代谢产物可以减少盲肠中大肠杆菌的数量,显著增加盲肠中乳酸杆菌的数量。本试验结果表明,在肉鸡饲粮中添加PLP能够提高其盲肠内乳酸杆菌数量,是因为灭活植物乳杆菌代谢产物中含有乳酸等有机酸和改善短链脂肪酸代谢水平的乳酸菌素,能够有效降低肠道内的pH,有害菌大肠杆菌和沙门氏菌等对酸性环境不耐受,所以被抑制,而有益菌乳酸杆菌和双歧杆菌在酸性环境下有利于增殖,这与朱广素等[14]报道的结果相一致。本试验结果还表明,42日龄肉鸡盲肠微生物中的优势菌门是拟杆菌门和厚壁菌门,二者相对丰度之和占微生物群落总丰度的85%以上,这与黄强等[15]研究结果基本相同,肉鸡盲肠微生物在门水平上大部分是拟杆菌门和厚壁菌门,它们在能量产生和代谢中起着至关重要的作用[16-18]。值得一提的是,有报道指出肉鸡盲肠微生物中相对丰度最高的菌门是厚壁菌门[19-20],但是也有其他报道称,肉鸡盲肠微生物中相对丰度最高的菌门是拟杆菌门[18, 21]。本试验中,肉鸡盲肠微生物中相对丰度最高的菌门是拟杆菌门。
3.5 PLP对肉鸡盲肠微生物多样性的影响肉鸡盲肠微生物多样性通常使用α多样性和β多样性来表示,但是这2个多样性的侧重点有所区别。微生物的α多样性通常用在分析样本内的微生物群落多样性上[22]。通过对单样本进行多样性分析,可以反映样本内的微生物群落的丰富度和多样性。β多样性是对不同样本间的微生物群落构成进行分析比较,其可以通过多种指标进行反映。其中的LEfSe分析是一种用于发现和诠释高维度数据生物标识(基因、通路和分类单元等)的分析工具,它可以进行2个分组或者多个分组之间的比较,它强调的是统计意义和生物相关性,能够在组与组之间寻找到有统计学差异的生物标志物。本试验结果显示,饲粮中添加PLP的组肉鸡盲肠微生物的α多样性与对照组相比有显著提高,盲肠微生物α多样性越高,其肠道的消化吸收能力也越强。此外,本试验显示600 g/t PLP组肉鸡盲肠微生物中丁酸弧菌属的相对丰度显著高于对照组,丁酸弧菌属可以产生丁酸,丁酸可以减轻炎症,维持肠道的健康,从而再一次印证了饲粮中添加PLP对肉鸡的ADG和F/G等生长性能指标有改善作用。
4 结论① 饲粮中添加400~600 g/t PLP时可以促进肉鸡生长,提高饲料效率。
② 饲粮中添加600 g/t PLP时肉鸡的屠宰率、全净膛率和半净膛率显著提高。
③ 饲粮中添加600 g/t PLP时提高了肉鸡十二指肠淀粉酶、脂肪酶和胰蛋白酶活性。
④ 饲粮中添加600 g/t PLP可以改善肉鸡盲肠微生物组成,提高盲肠微生物α多样性。
⑤ 对肉鸡生长性能指标进行二次曲线拟合,得出PLP在肉鸡饲粮中的适宜添加量为455~490 g/t。
| [1] |
张宏福, 夏冰, 陈亮, 等. 灭活乳酸菌研究与应用前沿进展[J]. 饲料工业, 2021, 42(15): 1-8. ZHANG H F, XIA B, CHEN L, et al. Frontier advances on research and application of inactivated lactic bacteria[J]. Feed Industry, 2021, 42(15): 1-8 (in Chinese). |
| [2] |
孔祥丽, 吴昕雨, 许晓曦. 植物乳杆菌代谢产物抑菌机制与应用研究进展[J]. 食品安全质量检测学报, 2021, 12(8): 3131-3140. KONG X L, WU X Y, XU X X. Research progress on metabolites and bacteriostasis mechanism of Lactobacillus plantarum[J]. Journal of Food Safety & Quality, 2021, 12(8): 3131-3140 (in Chinese). DOI:10.19812/j.cnki.jfsq11-5956/ts.2021.08.024 |
| [3] |
SALMINEN S, COLLADO M C, ENDO A, et al. The international scientific association of probiotics and prebiotics (ISAPP) consensus statement on the definition and scope of postbiotics[J]. Nature Reviews Gastroenterology&Hepatology, 2021, 18(9): 649-667. |
| [4] |
KALAVATHY R, ABDULLAH N, JALALUDIN S, et al. Effect of Lactobacillus cultures and oxytetracycline on the growth performance and serum lipids of chickens[J]. International Journal of Poultry Science, 2008, 7(4): 385-389. DOI:10.3923/ijps.2008.385.389 |
| [5] |
易先国. 热灭活植物乳杆菌对肉鸡生长性能、肠道形态及免疫相关基因表达的影响[J]. 中国饲料, 2020(18): 34-38. YI X G. Effects of thermally inactivated plant Lactobacillus on growth performance, intestinal morphology and immune-related gene expression in broilers[J]. China Feed, 2020(18): 34-38 (in Chinese). |
| [6] |
赵巍, 孙喆, 王欣, 等. 灭活植物乳杆菌培养物对肉仔鸡生长性能、盲肠菌群及血清生化指标的影响[J]. 中国兽医学报, 2016, 36(8): 1440-1445. ZHAO W, SUN Z, WANG X, et al. Effect of inactivated Lactobacillus cultures on growth performance, cecal microflora and serum biochemical indexes of broilers[J]. Chinese Journal of Veterinary Science, 2016, 36(8): 1440-1445 (in Chinese). |
| [7] |
赵庆华, 张冲, 路广金, 等. 植物乳杆菌LP-37对AA肉鸡生长及免疫性能的影响[J]. 山东畜牧兽医, 2022, 43(5): 7-11, 14. ZHAO Q H, ZHANG C, LU G J, et al. Effects of Lactobacillus plantarum LP-37 on the growth and immune performance of AA broilers[J]. Shandong Journal of Animal Science and Veterinary Medicine, 2022, 43(5): 7-11, 14 (in Chinese). |
| [8] |
张辉华, 毕英佐, 曹永长, 等. 热灭活乳酸杆菌制剂对竹丝肉鸡生长性能的影响[J]. 黑龙江畜牧兽医, 2005(8): 36-37. ZHANG H H, BI Y Z, CAO Y C, et al. Effects of heat-killed Lactobacillus preparations on growth performance of bamboo silk broilers[J]. Heilongjiang Animal Science and Veterinary Medicine, 2005(8): 36-37 (in Chinese). |
| [9] |
黄金华, 李泰佑, 王士长, 等. 复合益生菌制剂对肉鸡生长性能、屠宰性能和肌肉品质的影响[J]. 畜牧与饲料科学, 2014, 35(5): 30-33. HUANG J H, LI T Y, WANG S C, et al. Effects of complex-probiotic-preparation on growth performance, slaughter performance and meat quality of broiler[J]. Animal Husbandry and Feed Science, 2014, 35(5): 30-33 (in Chinese). |
| [10] |
王志祥, 乔家运, 王自恒, 等. 乳酸杆菌对断奶仔猪生长性能、养分表观消化率和消化酶活性的影响[J]. 西北农林科技大学学报(自然科学版), 2006, 34(4): 23-27. WANG Z X, QIAO J Y, WANG Z H, et al. Effect of Lactobacillus on growth performance, nutrient digestibility and digestive enzyme activities of weaned piglets[J]. Journal of Northwest A & F University (Natural Science Edition), 2006, 34(4): 23-27 (in Chinese). |
| [11] |
王恒月. 日粮中添加乳杆菌属培养物对肉鸡生长性能、小肠消化酶以及肠道与粪便中细菌酶活性的影响[J]. 饲料研究, 2019, 42(2): 31-34. WANG H Y. Effect of Lactobacillus added to diet on growth performance, intestinal digestive enzymes and bacterial enzyme activities in intestinal and feces of broilers[J]. Feed Research, 2019, 42(2): 31-34 (in Chinese). |
| [12] |
JIN L Z, HO Y W, ABDULLAH N, et al. Growth performance, intestinal microbial populations, and serum cholesterol of broilers fed diets containing Lactobacillus cultures[J]. Poultry Science, 1998, 77(9): 1259-1265. |
| [13] |
陈佳. 产CLA乳酸菌培养物对肉仔鸡生长性能及其小肠发育与菌群的影响[D]. 硕士学位论文. 合肥: 安徽农业大学, 2008. CHEN J. Effect of Lactobacillus cultures producing conjugated linoleic acid in based diet on development of small intestine, intestinal microflora and growth performance in broiler[D]. Master's Thesis. Hefei: Anhui Agricultural University, 2008. (in Chinese) |
| [14] |
朱广素, 王刚, 王园园, 等. 植物乳杆菌通过调节肠道短链脂肪酸水平缓解代谢综合征[J]. 食品科学, 2019, 40(13): 102-109. ZHU G S, WANG G, WANG Y Y, et al. Lactobacillus plantarum alleviates metabolic syndrome by modulating intestinal short-chain fatty acid levels[J]. Food Science, 2019, 40(13): 102-109 (in Chinese). |
| [15] |
黄强, 文超良, 孙从佼, 等. 鸡肠道微生物组成及其影响因素[J]. 中国家禽, 2021, 43(8): 96-105. HUANG Q, WEN CH L, SUN C J, et al. Composition of chicken intestinal microorganisms and its influencing factors[J]. China Poultry, 2021, 43(8): 96-105 (in Chinese). |
| [16] |
AHIR V B, KORINGA P G, BHATT V D, et al. Metagenomic analysis of poultry gut microbes[J]. Indian Journal of Poultry Science, 2010, 45(2): 111-114. |
| [17] |
OAKLEY B B, LILLEHOJ H S, KOGUT M H, et al. The chicken gastrointestinal microbiome[J]. FEMS Microbiology Letters, 2014, 360(2): 100-112. |
| [18] |
PANDIT R J, HINSU A T, PATEL N V, et al. Microbial diversity and community composition of caecal microbiota in commercial and indigenous Indian chickens determined using 16S rDNA amplicon sequencing[J]. Microbiome, 2018, 6(1): 115. |
| [19] |
AWAD W A, MANN E, DZIECIOL M, et al. Age-related differences in the luminal and mucosa-associated gut microbiome of broiler chickens and shifts associated with Campylobacter jejuni infection[J]. Frontiers in Cellular and Infection Microbiology, 2016, 6: 154. |
| [20] |
MANCABELLI L, FERRARIO C, MILANI C, et al. Insights into the biodiversity of the gut microbiota of broiler chickens[J]. Environmental Microbiology, 2016, 18(12): 4727-4738. |
| [21] |
MOHD SHAUFI M A, SIEO C C, CHONG C W, et al. Deciphering chicken gut microbial dynamics based on high-throughput 16S rRNA metagenomics analyses[J]. Gut Pathogens, 2015, 7: 4. |
| [22] |
LI B, ZHANG X X, GUO F, et al. Characterization of tetracycline resistant bacterial community in saline activated sludge using batch stress incubation with high-throughput sequencing analysis[J]. Water Research, 2013, 47(13): 4207-4216. |




