我国农业农村部要求自2020年7月1日起,饲粮中禁止使用除中草药外的促生长类药物饲料添加剂。在“禁抗”的大背景下,寻找绿色、安全和高效的抗生素替代品成为研究热点。丁酸钠是一种有机酸盐,无污染、无有害残留,能够刺激肠上皮细胞增殖和分化,并增强肠道屏障功能[1],具有维持肠道完整性、改善肠道形态以及提高免疫力和抗病力的作用[2]。黄芪素为黄芪提取物,其有益成分为黄芪多糖和黄芪甲苷等,具有多种生物活性,可提高巨噬细胞活性,具有抗衰老、抗氧化、抗病毒、抗菌和抗癌等功效[3],且作为饲料添加剂使用时具有增强动物机体免疫力、提高成活率以及促进动物生长发育等功能[4]。益生菌是一类有活性的微生物,与使用抗生素不同,适度使用益生菌可使动物的非特异性免疫力增强,饲料利用率提高,动物的健康水平和生长性能得以改善,并减少环境污染[5]。目前,丁酸钠、黄芪素和复合益生菌分别作为单一的添加剂在肉仔鸡饲粮中的应用研究报道较多,但对联合添加及不同添加量、添加形式等协同作用的相关研究相对匮乏,很难在生产实践中提出具体的方案。鉴于此,本试验选用1日龄宁都黄鸡母鸡为试验对象,研究笼养条件下在基础饲粮中联合添加丁酸钠、黄芪素和复合益生菌作为抗生素替代品,评价其对宁都黄鸡生长性能、血清免疫和抗氧化功能以及肠道健康的影响,为丁酸钠、黄芪素和复合益生菌在宁都黄鸡生产中的联合应用提供参考依据。
1 材料与方法 1.1 试验材料1日龄宁都黄鸡雏鸡购自宁都县麒麟禽业有限公司;金霉素(纯度98%)购自江西某兽药有限公司;丁酸钠、黄芪素和复合益生菌均为市售商品,其中丁酸钠由江西某农牧发展有限公司提供,黄芪素由湖北某生物科技有限公司提供,复合益生菌由宜春某生物科技有限公司提供。丁酸钠为丁酸钠纯粉(含量≥99%);黄芪素为黄芪提取物,有效成分为黄芪多糖,含量≥60%;复合益生菌主要为乳酸片球菌、枯草芽孢杆菌和产朊假丝酵母菌,总有效活菌数>6×109 CFU/g。
1.2 试验设计和饲粮试验选取1日龄健康、体重相近的宁都黄鸡母鸡648只,随机分成6个组,每组6个重复,每个重复18只。Ⅰ组为对照组,饲喂基础饲粮;Ⅱ组为抗生素组,饲喂在基础饲粮中添加150 mg/kg金霉素的饲粮;Ⅲ组为丁酸钠和黄芪素复合组,饲喂在基础饲粮中添加500 mg/kg丁酸钠和500 mg/kg黄芪素的饲粮;Ⅳ组为丁酸钠和复合益生菌复合组,饲喂在基础饲粮中添加500 mg/kg丁酸钠和200 mg/kg复合益生菌的饲粮;Ⅴ组为黄芪素和复合益生菌复合组,饲喂在基础饲粮中添加500 mg/kg黄芪素和200 mg/kg复合益生菌的饲粮;Ⅵ组为丁酸钠、黄芪素和复合益生菌复合组,饲喂在基础饲粮中添加500 mg/kg丁酸钠、500 mg/kg黄芪素和200 mg/kg复合益生菌的饲粮。试验期56 d。基础饲粮参照我国《鸡饲养标准》(NY/T 33—2004)[6]配制,其组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of basal diets (air-dry basis) |
试验于2021年10月至2021年12月在江西省农业科学院畜牧兽医研究所试验基地进行,试验前28 d在层叠式育雏笼内完成,试验后28 d转入育成舍在3层重叠式育成笼内进行。所有试验鸡的饲养环境一致,免疫、卫生消毒等程序按照标准养殖制度进行。
1.4 测定指标及方法 1.4.1 生长性能指标试验第56天08:00,以重复为单位对试验鸡进行空腹称重,试验期间记录耗料量,计算各组平均日增重(ADG)、平均日采食量(ADFI)和料重比(F/G)。
1.4.2 血清免疫和抗氧化指标试验第56天,鸡只禁食12 h,每个重复随机选取2只健康且接近平均体重的宁都黄鸡,翅静脉采集5 mL血样,3 000 r/min离心15 min制备血清,于-20 ℃保存待测。
血清免疫指标:血清免疫球蛋白A(IgA)、免疫球蛋白G(IgG)、免疫球蛋白M(IgM)、干扰素-γ(IFN-γ)、肿瘤坏死因子-α(TNF-α)、白细胞介素-2(IL-2)和白细胞介素-4(IL-4)含量采用酶联免疫吸附试验(ELISA)试剂盒进行测定,试剂盒购自北京华英生物技术研究所,测定仪器为DR-200BS酶标分析仪(无锡华卫德朗仪器有限公司)。
血清抗氧化指标:血清谷胱甘肽过氧化物酶(GSH-Px)和超氧化物歧化酶(SOD)活性、总抗氧化能力(T-AOC)和丙二醛(MDA)含量采用比色法进行测定,测定试剂盒购自北京华英生物技术研究所,所用仪器为BS-420全自动生化分析仪(深圳迈瑞生物医疗电子股份有限公司)。
1.4.3 肠道组织形态学指标试验结束时,每重复随机选取2只宁都黄鸡屠宰,剖开腹部,分离出十二指肠、空肠和回肠,迅速截取各肠段中段约2 cm,用生理盐水把肠道内容物冲洗干净,再放到4%甲醛溶液中固定,经冲水、梯度酒精脱水、二甲苯透明和石蜡包埋等处理后,以5 μm的厚度切片,并进行常规苏木素-伊红(HE)染色。采用光学显微镜(Eclipse Ci,Nikon)观察绒毛形态,使用Image-Pro plus 6.0软件测量绒毛高度(VH)和隐窝深度(CD),并计算绒毛高度/隐窝深度(V/C)值。
1.4.4 盲肠微生物区系试验结束时,每重复随机选取2只宁都黄鸡屠宰,剖开腹部,分离出盲肠,用灭菌线将盲肠结扎,确保肠道内容物充足,剪下结扎的盲肠段,立即将内容物转入2 mL冻存管,置于-80 ℃冰箱保存。样品送北京诺禾致源科技股份有限公司进行16S rDNA测序,基于Illumina NovaSeq测序平台对V3~V4高变区进行双末端测序,以分析盲肠菌群丰富度和多样性。
1.5 数据处理和统计分析试验数据采用Excel 2007进行初步整理后,采用SPSS 19.0统计软件进行单因素方差分析(one-way ANOVA),并采用Duncan氏法进行多重比较,P < 0.05表示差异显著,0.05 < P < 0.10表示差异有显著趋势,结果以平均值和均值标准误(SEM)表示。
2 结果 2.1 复合添加剂对宁都黄鸡生长性能的影响由表 2可知,各组宁都黄鸡初始体重差异不显著(P>0.05)。与Ⅰ组相比,Ⅳ组、Ⅴ组和Ⅵ组宁都黄鸡56日龄体重和ADG显著提高(P < 0.05),Ⅲ组、Ⅳ组、Ⅴ组和Ⅵ组F/G显著降低(P < 0.05),各组ADFI之间无显著差异(P>0.05)。此外,与Ⅱ组相比,Ⅵ组宁都黄鸡F/G显著降低(P < 0.05)。
|
|
表 2 复合添加剂对宁都黄鸡生长性能的影响 Table 2 Effects of compound additives on growth performance of Ningdu yellow chickens |
由表 3可知,与Ⅰ组相比,Ⅲ组、Ⅳ组、Ⅴ组和Ⅵ组宁都黄鸡血清IgG、IgA、IgM、和IL-4含量均显著提高(P < 0.05),血清IL-2、TNF-α和IFN-γ含量均显著降低(P < 0.05)。与Ⅱ组相比,Ⅳ组、Ⅴ组和Ⅵ组宁都黄鸡血清IgG、IgA和IL-4含量均显著提高(P < 0.05);Ⅲ组、Ⅳ组、Ⅴ组和Ⅵ组血清IgM含量均显著提高(P < 0.05),血清IL-2、TNF-α及IFN-γ含量均显著降低(P < 0.05)。
|
|
表 3 复合添加剂对宁都黄鸡血清免疫指标的影响 Table 3 Effects of compound additives on serum immune indices of Ningdu yellow chickens |
由表 4可知,与Ⅰ组和Ⅱ组相比,Ⅲ组、Ⅳ组、Ⅴ组和Ⅵ组宁都黄鸡血清GSH-Px、SOD活性和T-AOC显著提高(P < 0.05),Ⅳ组、Ⅴ组和Ⅵ组血清MDA含量显著降低(P < 0.05)。
|
|
表 4 复合添加剂对宁都黄鸡血清抗氧化指标的影响 Table 4 Effects of compound additives on serum antioxidant indices of Ningdu yellow chickens |
由表 5可知,各组宁都黄鸡十二指肠VH和CD之间均无显著差异(P>0.05);Ⅲ组和Ⅳ组十二指肠V/C值显著高于Ⅰ组(P < 0.05),与Ⅱ组无显著差异(P>0.05)。各组宁都黄鸡空肠VH之间无显著差异(P>0.05);Ⅳ组和Ⅴ组空肠CD显著低于Ⅰ组(P < 0.05),与Ⅱ组无显著差异(P>0.05);Ⅲ组、Ⅳ组和Ⅴ组空肠V/C值显著高于Ⅰ组(P < 0.05),与Ⅱ组无显著差异(P>0.05)。各组宁都黄鸡回肠VH、CD和V/C值之间均无显著差异(P>0.05)。
|
|
表 5 复合添加剂对宁都黄鸡肠道组织形态的影响 Table 5 Effects of compound additives on intestinal morphology of Ningdu yellow chickens |
由表 6可知,各组有效序列数较高,均在68 000以上,且各组覆盖度均在0.998以上,说明测序结果已经基本覆盖样本的物种多样性。与Ⅱ组相比,Ⅲ组和Ⅵ组Shannon指数显著提高(P < 0.05),Simpson指数有提高的趋势(P=0.054);各组操作分类单元(OTU)数、Chao1指数和Ace指数之间均无显著差异(P>0.05)。
|
|
表 6 复合添加剂对宁都黄鸡盲肠微生物alpha多样性的影响 Table 6 Effects of compound additives on cecal microbial alpha diversity of Ningdu yellow chickens |
由图 1和表 7可知,各组样品中厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidota)都为其主要的菌门,其中厚壁菌门相对丰度为44.53%~66.53%,并以Ⅴ组最高,且Ⅲ组和Ⅴ组厚壁菌门相对丰度显著高于Ⅱ组(P < 0.05);拟杆菌门相对丰度为22.39%~39.06%,并以Ⅱ组最高,且Ⅲ组和Ⅴ组拟杆菌门相对丰度显著低于Ⅱ组(P < 0.05)。各组其他菌门相对丰度之间均无显著差异(P>0.05),但分布变异较大。脱硫杆菌门(Desulfobacterota)相对丰度以Ⅱ组和Ⅵ组较高;Ⅰ组变形菌门(Proteobacteria)相对丰度最高为3.33%,其他组变形菌门相对丰度变化不大均在3.00%以下;酸杆菌门(Acidobacteriota)相对丰度以Ⅱ组和Ⅳ组较高;蓝藻菌门(Cyanobacteria)相对丰度以Ⅱ组最高;放线菌门(Actinobacteria)、黏细菌门(Myxococcota)和疣微菌门(Verrucomicrobiota)相对丰度以Ⅰ组最高。
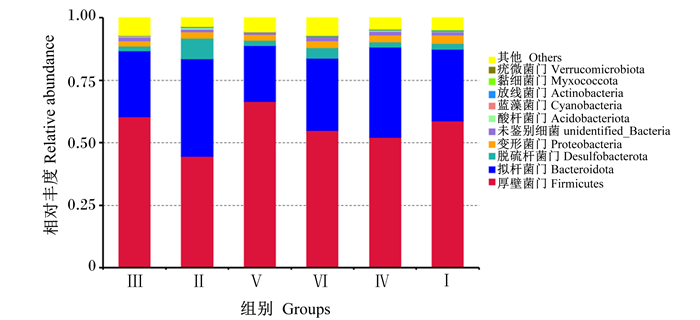
|
图 1 宁都黄鸡盲肠菌群在门水平上的分布 Fig. 1 Distribution of cecal microflora of Ningdu yellow chickens at phylum level |
|
|
表 7 宁都黄鸡盲肠菌群在门水平上的相对丰度 Table 7 Relative abundances of cecal microflora of Ningdu yellow chickens at phylum level |
由图 2和表 8可知,在属水平上,各组均以拟杆菌属(Bacteroides)的相对丰度最高,占21.02%~37.47%。其中,Ⅳ组拟杆菌属相对丰度与Ⅱ组无显著差异(P>0.05),Ⅲ组、Ⅴ组和Ⅵ组拟杆菌属相对丰度显著低于Ⅱ组(P < 0.05)。各组其他菌属的相对丰度均无显著差异(P>0.05),但分布差异较大。罗姆布茨菌属(Romboutsia)、苏黎世杆菌属(Turicibacter)和CHKCI001相对丰度以Ⅴ组最高;嗜胆菌属(Bilophila)相对丰度以Ⅱ组最高;粪杆菌属(Faecalibacterium)、乳杆菌属(Lactobacilus)和发酵乳杆菌属(Limosilactobacillus)相对丰度以Ⅱ组最低。
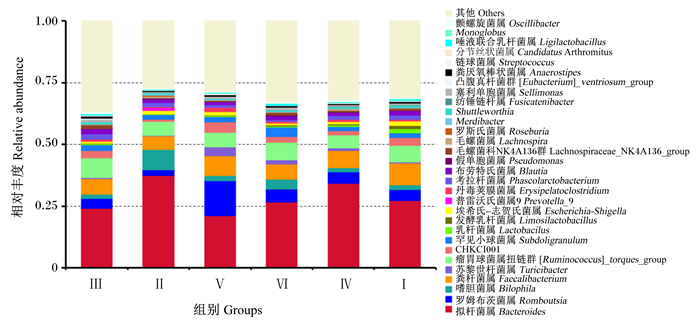
|
图 2 宁都黄鸡盲肠菌群在属水平上的分布 Fig. 2 Distribution of cecal microflora of Ningdu yellow chickens at genus level |
|
|
表 8 宁都黄鸡盲肠菌群在属水平上的相对丰度 Table 8 Relative abundances of cecal microflora of Ningdu yellow chickens at genus level |
生长性能是反映肉鸡生长最直接的指标,提高生长性能是增加经济效益的关键[7]。已有研究表明,饲粮单独添加丁酸钠、黄芪素和复合益生菌均能够提高家禽的生长性能[8-10]。王永芬等[11]研究发现,黄芪多糖和益生菌联合添加比例适当时对提高肉仔鸡的生长性能具有较好的协同作用,益生菌可促进黄芪多糖的吸收和利用,黄芪多糖中的生物碱、甙类和挥发油等活性物质对益生菌又具有促菌作用。范秋丽等[12]研究发现,丁酸钠和益生菌联合使用对1~63日龄黄羽肉鸡后期的ADG提升效果显著高于抗生素组。本试验结果表明,饲粮联合添加丁酸钠、黄芪素和复合益生菌能够显著提高宁都黄鸡末重和ADG,并显著降低F/G,对提高宁都黄鸡的生长性能有显著影响。这一试验结果证明了饲粮联合添加丁酸钠、黄芪素和复合益生菌对宁都黄鸡的促生长作用。这可能与丁酸钠、黄芪素和复合益生菌都能够促进消化酶的分泌,从而提高饲料转化率有关。丁酸钠可通过刺激胆囊收缩素的释放来促进胰腺分泌胰液和胰肽酶E,提高胰肽酶E的活性[13];且丁酸钠水解后的丁酸能够修复受损肠道组织,促进鸡小肠黏膜发育以及胃肠道细胞增殖成熟和消化液的分泌,提高饲料转化率。而黄芪素中的有益成分黄芪多糖是一种天然活性物质[14],可通过促进免疫器官发育和增强T细胞、B细胞和自然杀伤细胞等免疫细胞功能来提高动物免疫调节能力,改善肠道健康,提高动物生长性能。复合益生菌进入胃肠道后迅速增殖,产生多种抑菌代谢产物如过氧化氢和乳酸等,能够抑制病原菌繁殖,调节胃肠菌群,使动物肠道pH下降,促进胃肠吸收,提高饲料的消化率[15]。丁酸钠、黄芪素和复合益生菌都具有提高肠道消化吸收的能力。通过本试验研究发现,丁酸钠、黄芪素和复合益生菌联合添加同时也具有较好的协同作用,提高了1~56日龄宁都黄鸡的生长性能。
3.2 复合添加剂对宁都黄鸡血清免疫功能的影响IgA、IgG、IgM这3种免疫球蛋白是介导体液免疫的主要抗体,也是衡量免疫功能的重要指标[16]。Fang等[17]报道,饲粮中添加丁酸钠(1 g/kg)可以显著提高断奶仔猪血清IgG和IgA含量,降低腹泻率,增强机体免疫功能。Zhang等[18]研究发现,复合益生菌(由嗜酸乳杆菌、枯草芽孢杆菌和丁酸梭菌组成)可以显著提高肉仔鸡血清IgA和IgM含量。本试验结果显示,饲粮联合添加丁酸钠、黄芪素和复合益生菌可以提高宁都黄鸡血清免疫球蛋白含量。其中,复合益生菌分别与丁酸钠和黄芪素联合使用的血清IgM含量显著高于丁酸钠与黄芪素联合使用,且三者联合使用的血清IgA、IgG和IgM含量显著高于其他组合,达到了替代抗生素的效果,能够有效提高宁都黄鸡血清免疫功能。分析原因可能是丁酸钠和黄芪素中的主要成份黄芪多糖都有促进免疫器官发育,提高小肠黏膜抗体分泌型免疫球蛋白A(sIgA)的分泌,增强免疫球蛋白含量的作用,而益生菌本身是非特异性免疫调节因子,可以有效调节机体的免疫系统,促进免疫球蛋白的合成[19];也可能是复合益生菌分别与丁酸钠和黄芪素的协同作用导致其代谢产物,在肠道具有抗原识别部位的淋巴组织集合发挥免疫佐剂作用,活化肠黏膜内的相关淋巴组织,使sIgA分泌增强,而sIgA能预防肠道蛋白酶的分解,形成黏膜上的抗体,从而刺激机体免疫系统,使更多的淋巴细胞分化成浆细胞产生抗体[11]。
细胞因子是炎症反应的重要介质和调节剂。各种促炎性细胞因子(IL-2、IFN-γ和TNF-α等)与抗炎性细胞因子[白细胞介素-4(IL-4)、白细胞介素-5(IL-5)和白细胞介素-10(IL-10)等]之间的协同作用是调节机体炎症发展的关键。本研究中,饲粮联合添加丁酸钠、黄芪素和益生菌可以显著降低宁都黄鸡血清IL-2、IFN-γ和TNF-α含量,并显著提高血清IL-4含量,这一试验结果表明丁酸钠、黄芪素和益生菌联合添加能显著抑制机体炎性因子(IL-2、IFN-γ和TNF-α)的产生,减缓炎症反应,保障宁都黄鸡的健康生长,发挥积极的抗炎作用。各试验组合均能在一定程度上促进机体免疫系统生长发育,使肉仔鸡始终保持良好的免疫状态,而在调节细胞免疫及抗炎症作用方面要以益生菌与丁酸钠、黄芪素的互作效应较优,分析原因可能是益生菌或片段被吞噬细胞和树突状细胞吞噬后,诱导产生TNF-α、IFN-γ等细胞因子,增强肠道黏膜上皮细胞的兴奋;同时还刺激肥大细胞产生IL-4来增强细胞因子网络,调节细胞免疫应答[20]。本试验中,益生菌对胃肠道免疫系统的刺激强度要优于黄芪素和丁酸钠,其中三者联用抗炎效果更为明显,可能与三者之间在细胞免疫、细胞因子调节等方面存在显著的互作协同效应,目前联合使用的研究较少,具体机制需要开展进一步深入研究。
3.3 复合添加剂对宁都黄鸡血清抗氧化功能的影响动物机体的抗氧化反应是对外界异物入侵发出的积极反应,通过提高抗氧化相关酶含量或者活力来清除异物氧化损伤产生的自由基,也间接提高机体免疫水平[21]。刘明生等[22]研究发现,在蛋鸡饲粮中添加0.1%黄芪多糖和0.1%的益生菌,提高了血清SOD、GSP-Px活性和T-AOC,降低了血清MDA含量,增强了机体的抗氧化能力和抗病力。本研究中,复合益生菌分别与丁酸钠和黄芪素组合及三者联用对宁都黄鸡血清MDA含量的降低效果显著低于对照组和抗生素组及丁酸钠与黄芪素联合使用组,且三者联用组血清MDA含量显著低于复合益生菌与丁酸钠和黄芪素联合使用组;复合益生菌与丁酸钠和黄芪素联用组及三者联用试验组血清SOD、GSH-Px活性和T-AOC显著高于对照组和抗生素组,且三者联用组血清SOD、GSH-Px活性和T-AOC显著高于丁酸钠、黄芪素和复合益生菌联合使用组。这可能与益生菌作为一种抗原物质,能够刺激胃肠道免疫系统的发育,增强机体对抗原物质的刺激,促进机体特异性体液的免疫应答[23];而黄芪多糖本身也具有抗原的特性,能够促进免疫细胞的增殖,激发相应的免疫反应[24];丁酸钠也具有促进机体抗氧化酶相关基因的表达,增强机体对自由基的清除能力,改善机体的抗氧化功能等特性[25]。这三者的协同作用机理可能通过刺激机体免疫系统,提高SOD、GSH-Px活性和T-AOC等,增强机体对多种活性氧(ROS)的清除,有效抑制脂质过氧化产物MDA的产生,因此对宁都黄鸡发挥良好的抗氧化功能起了关键作用。本试验结果同时也表明,饲粮中联合添加丁酸钠、黄芪素和复合益生菌可以有效调节机体免疫系统,促进机体分泌免疫球蛋白,提高抗氧化酶SOD、GSH-Px活性和T-AOC,减少炎症相关因子IL-2、IFN-γ和TNF-α的释放量,可见宁都黄鸡在免疫抗体水平、抗氧化和抗炎功能上存在密切的交互关系。
3.4 复合添加剂对宁都黄鸡肠道组织形态的影响肠道上皮结构是营养物质被消化和吸收的基础,肠道的形态变化可以揭示肠道的健康状况,评估肠道营养效果[26],同时它的VH、CD及V/C值是反映肠道结构完整性的重要指标[27]。王继凤等[28]在肉仔鸡饲粮中添加0.05%~0.10%的丁酸钠,能显著提高其小肠VH和V/C值。Shan等[29]在雏鸡饲粮中添加一定量的黄芪多糖,发现雏鸡的小肠V/C值显著提高。田浪等[30]研究发现,复合益生菌在添加量为300 g/t时,可显著提高50日龄黄羽肉鸡十二指肠VH和V/C值。本试验结果表明,饲粮联合添加丁酸钠、黄芪素和复合益生菌可以显著降低空肠隐窝深度,并显著提高空肠和十二指肠V/C值。这一试验结果证明,丁酸钠、黄芪素和复合益生菌联合添加对宁都黄鸡空肠和十二指肠的肠道形态有改善作用,但对回肠各项指标没有显著影响,原因可能是由于在添加粉状丁酸钠、黄芪素和复合益生菌时,在消化道前段吸收较多,随着肠段的后移,肠绒毛逐渐变短萎缩,肠绒毛表面积减小导致复合添加剂被肠绒毛细胞吸收减少。向仕权等[31]和刘锐钢等[32]报道,丁酸钠能提高肠道上皮细胞中闭合蛋白-1(occludin-1)、封闭蛋白-1(claudin-1)以及三叶因子3(TFF3)基因的表达,促使细胞紧密连接,促进肠道受损黏膜的修护,从而改善肠道黏膜形态。黄玉章[33]研究发现,黄芪多糖能够增加肠道黏液细胞和上皮淋巴细胞数量,保护肠黏膜上皮,从而改善肠道绒毛形态。谢文惠[34]研究发现,复合益生菌还能改善肠道黏液分泌,增强肠道上皮细胞的紧密连接,调节肠道上皮细胞增殖与分化,修复受损肠道,降低CD,改善肠道黏膜形态。以上研究结果说明,丁酸钠、黄芪多糖和复合益生菌都具有促进肠道发育的能力,增强肠道吸收,维持肠道黏膜的完整性。联系本试验1~56日龄宁都黄鸡的生长性能结果,进一步表明丁酸钠、黄芪素和复合益生菌联合添加在一定程度上改善了宁都黄鸡的肠道形态发育,从而促进了宁都黄鸡的健康生长。
3.5 复合添加剂对宁都黄鸡盲肠微生物区系的影响肠道微生态系统是影响动物消化吸收能力的重要因素,肠道菌群平衡有助于提高动物的消化吸收能力,保障动物健康[35]。盲肠是肠道细菌的主要集中部位,具有最高的细菌多样性[36]。在alpha多样性分析中发现,丁酸钠、黄芪素和复合益生菌联合添加在饲粮中都能够对盲肠微生物的多样性有一定的改善作用,且丁酸钠、黄芪素组合和三者联合添加的Shannon指数显著高于抗生素组,有较高的群落多样性。鸡的盲肠微生物在门水平上,厚壁菌门和拟杆菌门构成了大多数微生物群落,能够抵抗外来细菌的定殖,在能量的产生和代谢中起着重要作用[37],这与本研究结果一致。本试验结果表明,厚壁菌门和拟杆菌门是宁都黄鸡肠道内相对丰度比例较高的菌群,相对丰度占80%以上,为绝对优势菌群,与前人研究结果[38]一致。大部分研究都表明,丁酸钠和益生菌等可以改善肠道微生物组成[39-40],但是当动物处于非健康状态时,肠道菌群急剧改变会扰乱肠道菌群,导致肠道功能失调,增加肠道外疾病发生几率[41]。本研究中,复合添加剂能够提高厚壁菌门相对丰度,一定程度降低肠道变形菌门相对丰度。厚壁菌门发酵能力较强,可以促进机体脂肪的沉积,能够发酵产生短链脂肪酸,维持机体肠道健康[42]。变形菌门为革兰氏阴性菌,其中包括很多病原菌,如大肠杆菌、沙门氏菌等,易引起消化不良[43]。因此,本试验结果提示,复合添加剂能够通过促进宁都黄鸡肠道有益菌的增殖,抑制有害菌或杀灭病原菌来调节肠道微生物环境,缓解肠道菌群失衡。不过,在属水平上没有达到显著水平,这可能与肉鸡品种、饲养环境和添加剂量有关,但本研究复合添加剂能够在一定程度上提高瘤胃球菌属和罕见小球菌属相对丰度。有研究发现,瘤胃球菌具有抗炎性的功能,能起到降低和改善肠道炎症的作用[44],罕见小球菌属通过发酵反应产生丁酸、乳酸等,维持肠道黏膜屏障、缓解肠道炎症,调节肠道环境[45],这也说明复合添加剂能起到改善宁都黄鸡肠道微生态平衡,维持肠道微生物稳态,促进肠道健康的作用。
4 结论① 丁酸钠、黄芪素和复合益生菌联合添加可以提高宁都黄鸡生长性能。
② 丁酸钠、黄芪素和复合益生菌联合添加可以提高宁都黄鸡血清免疫和抗氧化功能,降低炎症反应,效果优于抗生素组,有替代抗生素的潜质。
③ 丁酸钠、黄芪素和复合益生菌联合添加可以改善宁都黄鸡小肠肠道形态结构,维持肠道微生物稳态,促进肠道健康。
| [1] |
ELNESR S S, ALAGAWANY M, ELWAN H, et al. Effect of sodium butyrate on intestinal health of poultry-a review[J]. Annals of Animal Science, 2020, 20(1): 29-41. DOI:10.2478/aoas-2019-0077 |
| [2] |
李祥, 何金环, 潘春梅, 等. 丁酸钠对肉鸡肠道形态与消化吸收功能影响的研究进展[J]. 中国畜牧兽医, 2021, 48(5): 1603-1612. LI X, HE J H, PAN C M, et al. Research progress on effect of sodium butyrate on intestinal morphology, digestion and absorption function of broilers[J]. China Animal Husbandry & Veterinary Medicine, 2021, 48(5): 1603-1612 (in Chinese). DOI:10.16431/j.cnki.1671-7236.2021.05.011 |
| [3] |
ZHENG Y J, REN W Y, ZHANG L N, et al. A review of the pharmacological action of Astragalus polysaccharide[J]. Front Pharmacol, 2020, 11: 349. DOI:10.3389/fphar.2020.00349 |
| [4] |
WANG K L, ZHANG H R, HAN Q J, et al. Effects of Astragalus and ginseng polysaccharides on growth performance, immune function and intestinal barrier in weaned piglets challenged with lipopolysaccharide[J]. Journal of Animal Physiology and Animal Nutrition, 2020, 104(4): 1096-1105. DOI:10.1111/jpn.13244 |
| [5] |
SARANGI N R, BABU L K, KUMAR A, et al. Effect of dietary supplementation of prebiotic, probiotic, and synbiotic on growth performance and carcass characteristics of broiler chickens[J]. Veterinary World, 2016, 9(3): 313-319. DOI:10.14202/vetworld.2016.313-319 |
| [6] |
中华人民共和国农业部. 鸡饲养标准: NY/T 33—2004[S]. 北京: 中国农业出版社, 2004. Ministry of Agriculture of the PRC. Feeding standard of chicken: NY/T 33—2004[S]. Beijing: China agricultural Press, 2004. (in Chinese) |
| [7] |
杨季, 王思博, 鲁茗源, 等. 橙皮苷对肉仔鸡生长性能、肌肉品质及肠道形态结构的影响[J]. 动物营养学报, 2021, 33(1): 297-307. YANG J, WANG S B, LU M Y, et al. Effects of hesperidin on growth performance, muscle quality and intestinal morphology of broilers[J]. Chinese Journal of Animal Nutrition, 2021, 33(1): 297-307 (in Chinese). DOI:10.3969/j.issn.1006-267x.2021.01.030 |
| [8] |
SIKANDAR A, ZANEB H, YOUNUS M, et al. Effect of sodium butyrate on performance, immune status, microarchitecture of small intestinal mucosa and lymphoid organs in broiler chickens[J]. Asian Australasian Journal of Anima Sciences, 2017, 30(5): 690-699. DOI:10.5713/ajas.16.0824 |
| [9] |
WU S J. Effect of dietary Astragalus membranaceus polysaccharide on the growth performance and immunity of juvenile broilers[J]. Poultry Science, 2018, 97(10): 3489-3493. DOI:10.3382/ps/pey220 |
| [10] |
AGUSTONO B, LOKAPIRNASARI W P, YUNITA M N, et al. Efficacy of dietary supplementary probiotics as substitutes for antibiotic growth promoters during the starter period on growth performances, carcass traits, and immune organs of male layer chicken[J]. Veterinary World, 2022, 15(2): 324-330. |
| [11] |
王永芬, 乔宏兴, 席磊, 等. 益生菌-黄芪复合生物制剂的制备及其对肉仔鸡的影响[J]. 中国农业大学学报, 2011, 16(1): 54-59. WANG Y F, QIAO H X, XI L, et al. Preparation of probiotics-astragalus complex biological reagent and its effect on broilers[J]. Journal of China Agricultural University, 2011, 16(1): 54-59 (in Chinese). |
| [12] |
范秋丽, 蒋守群, 苟钟勇, 等. 枯草芽孢杆菌, 低聚壳聚糖和丁酸钠对黄羽肉鸡生长性能, 免疫功能和肉品质的影响[J]. 中国畜牧兽医, 2020, 47(4): 1080-1091. FAN Q L, JIANG S Q, GOU Z Y, et al. Effects of Bacillus subtilis, oligoemeric chitosan and sodium butyrate on growth performance, immune function and meat quality in yellow-feathered chickens[J]. China Animal Husbandry & Veterinary Medicine, 2020, 47(4): 1080-1091. |
| [13] |
ARAUJO G, TERRÉ M, MEREU A, et al. Effects of supplementing a milk replacer with sodium butyrate or tributyrin on performance and metabolism of Holstein calves[J]. Animal Production Science, 2016, 56(11): 1834-1841. DOI:10.1071/AN14930 |
| [14] |
JIN M L, ZHAO K, HUANG Q S, et al. Structural features and biological activities of the polysaccharides from Astragalus membranaceus[J]. International Journal of Biological Macromolecules, 2014, 64: 257-266. DOI:10.1016/j.ijbiomac.2013.12.002 |
| [15] |
简宗辉, 孙帅, 豆腾飞, 等. 益生菌在养鸡生产中应用的研究进展[J]. 畜牧与兽医, 2021, 53(11): 129-134. JIAN Z H, SUN S, DOU T F, et al. Advances in the application of probiotics in chicken production[J]. Animal Husbandry & Veterinary Medicine, 2021, 53(11): 129-134 (in Chinese). |
| [16] |
FATHI M M, EBEID T A, AL-HOMIDAN I, et al. Influence of probiotic supplementation on immune response in broilers raised under hot climate[J]. British Poultry Science, 2017, 58(5): 512-516. DOI:10.1080/00071668.2017.1332405 |
| [17] |
FANG C L, SUN H, WU J, et al. Effects of sodium butyrate on growth performance, haematological and immunological characteristics of weanling piglets[J]. Journal of Animal Physiology and Animal Nutrition, 2014, 98(4): 680-685. DOI:10.1111/jpn.12122 |
| [18] |
ZHANG Z F, KIM I H. Effects of multistrain probiotics on growth performance, apparent ileal nutrient digestibility, blood characteristics, cecal microbial shedding, and excreta odor contents in broilers[J]. Poultry Science, 2014, 93(2): 364-370. DOI:10.3382/ps.2013-03314 |
| [19] |
KOENEN M E, KRAMER J, VAN DER HULST R, et al. Immunomodulation by probiotic lactobacilli in layer- and meat-type chickens[J]. British Poultry Science, 2004, 45(3): 355-366. DOI:10.1080/00071660410001730851 |
| [20] |
吴宇薇, 杨海明, 张泉. 饲粮添加益生菌对肉鸡免疫机能的影响[J]. 中国家禽, 2019, 41(12): 43-46. WU Y W, YANG H M, ZHANG Q. Effect of dietary probiotics on immune function of broilers[J]. China Poultry, 2019, 41(12): 43-46 (in Chinese). |
| [21] |
游斌杰, 翟少钦, 朱买勋. 中药复方提取物对IBDV感染SPF鸡抗氧化和抗炎能力的影响[J]. 湖南农业大学学报(自然科学版), 2021, 47(4): 462-466. YOU B J, ZHAI S Q, ZHU M X. Effect of traditional Chinese medicine extract on anti-oxidant and anti-inflammatory ability of SPF chicks infected IBDV[J]. Journal of Hunan Agricultural University (Natural Sciences), 2021, 47(4): 462-466 (in Chinese). DOI:10.13331/j.cnki.jhau.2021.04.015 |
| [22] |
刘明生, 蒋春茂, 甘辉群, 等. 黄芪多糖和微生态制剂对蛋鸡生产性能和免疫机能的影响[J]. 江苏农业科学, 2018, 46(14): 154-156. LIU M S, JIANG C M, GAN H Q, et al. Effects of Astragalus polysaccharides and probiotics on production performance and immune function of chickens[J]. Jiangsu Agricultural Sciences, 2018, 46(14): 154-156 (in Chinese). |
| [23] |
NAYEBPOR M, FARHOMAND P, HASHEMI A. Effects of different levels of direct fed microbial (Primalac) on growth performance and humoral immune response in broiler chickens[J]. Journal of Animal and Veterinary Advances, 2007, 6(11): 1308-1313. |
| [24] |
全雪容, 唐佳希, 田凤云, 等. 黄芪多糖的生理功能及其在畜禽生产中的应用研究进展[J]. 中国畜牧杂志, 2021, 57(12): 31-36. QUAN X R, TANG J X, TIAN F Y, et al. Physiological function of Astragalus polysaccharide and its application in livestock and poultry production[J]. Chinese Journal of Animal Science, 2021, 57(12): 31-36 (in Chinese). |
| [25] |
王敏, 班博, 邓攀, 等. 丁酸钠的生物学功能及其在畜禽生产中的应用[J]. 经济动物学报, 2020, 24(4): 234-241. WANG M, BAN B, DENG P, et al. Biological function of sodium butyrate and its application in livestock and poultry production[J]. Journal of Economic Animal, 2020, 24(4): 234-241 (in Chinese). |
| [26] |
CSERNUS B, CZEGLÉDI L. Physiological, antimicrobial, intestine morphological, and immunological effects of fructooligosaccharides in pigs[J]. Archives Animal Breeding, 2020, 63(2): 325-335. |
| [27] |
CHAMORRO S, ROMERO C, BRENES A, et al. Impact of a sustained consumption of grape extract on digestion, gut microbial metabolism and intestinal barrier in broiler chickens[J]. Food & Function, 2019, 10(3): 1444-1454. |
| [28] |
王继凤, 李芙燕, 陈耀星, 等. 3种饲料添加剂对肉鸡小肠形态结构的影响[J]. 畜牧兽医学报, 2008, 39(8): 1111-1115. WANG J F, LI F Y, CHEN Y X, et al. Effects of three feed additives on mucosal structure in small intestine of broiler[J]. ACTA VETERINARIA ET ZOOTECHNICA SINICA, 2008, 39(8): 1111-1115 (in Chinese). |
| [29] |
SHAN C L, SUN B D, DALLOUL R A, et al. Effect of the oral administration of Astragalus polysaccharides on jejunum mucosal immunity in chickens vaccinated against Newcastle disease[J]. Microbial Pathogenesis, 2019, 135: 103621. |
| [30] |
田浪, 何彦侠, 侯月娥, 等. 复合益生菌制剂对黄羽肉鸡生产性能、抗氧化指标及免疫功能的影响[J]. 中国兽医学报, 2017, 37(8): 1540-1544, 1582. TIAN L, HE Y X, HOU Y E, et al. Effects of dietary mixed probiotics on the growth performance, antioxidant activity and immune function in yellow-feathered broilers[J]. Chinese Journal of Veterinary Science, 2017, 37(8): 1540-1544, 1582 (in Chinese). |
| [31] |
向仕权, 谭小玲, 冯岚, 等. 丁酸钠抑制缺氧致人脐静脉内皮细胞通透性增加及机制[J]. 第三军医大学学报, 2016, 38(14): 1609-1614. XIANG S Q, TAN X L, FENG L, et al. Butyrate suppresses hypoxia-induced hyperpermeability in human umbelical vein endothelial cells[J]. Journal of third military medical university, 2016, 38(14): 1609-1614 (in Chinese). |
| [32] |
刘锐钢, 肖英平, 陈安国. 丁酸盐的生物学功能和机制及其在动物生产中的应用[J]. 动物营养学报, 2013, 25(6): 1180-1188. LIU R G, XIAO Y P, CHEN A G. Biological functions and mechanism of butyrate and its application in animal production[J]. Chinese Journal of Animal Nutrition, 2013, 25(6): 1180-1188 (in Chinese). |
| [33] |
黄玉章. 黄芪多糖对奥尼罗非鱼生长性能和免疫功能的影响[D]. 硕士学位论文. 福州: 福建农林大学, 2009. HUANG Y Z. Effect of Astragalus polysaccharide on the growth performance and immune function of Oreochromis-nilotecus[D]. Master's Thesis. Fuzhou: Fujian Agriculture and Forestry University, 2009. (in Chinese) |
| [34] |
谢文惠. 复合益生菌制剂对肉鸡生长、免疫功能及肠道菌群的影响[D]. 硕士学位论文. 大庆: 黑龙江八一农垦大学, 2018. XIE W H. Effects of compound probiotics on growth, immunity indices and intestinal flora in broilers[D]. Master's Thesis. Daqing: Heilongjiang Bayi Agricultural University, 2018. (in Chinese) |
| [35] |
LEE K W, EVERTS H, KAPPERT H J, et al. Effects of dietary essential oil components on growth performance, digestive enzymes and lipid metabolism in female broiler chickens[J]. British Poultry Science, 2003, 44(3): 450-457. |
| [36] |
OLADOKUN S, KOEHLER A, MACISAAC J, et al. Bacillus subtilis delivery route: effect on growth performance, intestinal morphology, cecal short-chain fatty acid concentration, and cecal microbiota in broiler chickens[J]. Poultry Science, 2021, 100(3): 100809. |
| [37] |
PANDIT R J, HINSU A T, PATEL N V, et al. Microbial diversity and community composition of caecal microbiota in commercial and indigenous Indian chickens determined using 16s rDNA amplicon sequencing[J]. Microbiome, 2018, 6(1): 115. |
| [38] |
SINGH K M, SHAH T, DESHPANDE S, et al. High through put 16S rRNA gene-based pyrosequencing analysis of the fecal microbiota of high FCR and low FCR broiler growers[J]. Molecular Biology Reports, 2012, 39(12): 10595-10602. |
| [39] |
YANG X J, YIN F G, YANG Y H, et al. Dietary butyrate glycerides modulate intestinal microbiota composition and serum metabolites in broilers[J]. Scientific Reports, 2018, 8(1): 4940. |
| [40] |
张利环, 贾浩, 张若男, 等. 复合益生菌对肉鸡肠道微生物区系的影响[J]. 中国畜牧兽医, 2022, 49(2): 488-500. ZHANG L H, JIA H, ZHANG R N, et al. Effects of compound probiotics on the intestinal microflora of broilers[J]. China Animal Husbandry & Veterinary Medicine, 2022, 49(2): 488-500 (in Chinese). |
| [41] |
CHU H, KHOSRAVI A, KUSUMAWARDHANI I P, et al. Gene-microbiota interactions contribute to the pathogenesis of inflammatory bowel disease[J]. Science, 2016, 352(6289): 1116-1120. |
| [42] |
ZHANG J C, GUO Z, XUE Z S, et al. A phylo-functional core of gut microbiota in healthy young Chinese cohorts across lifestyles, geography and ethnicities[J]. The ISME Journal, 2015, 9(9): 1979-1990. |
| [43] |
陈瑜, 刘婉薇, 李良芳, 等. 功能性消化不良患者唾液菌群的研究[J]. 重庆医学, 2017, 46(13): 1789-1791, 1796. CHEN Y, LIU W W, LI L F, et al. Analysis on saliva microbiome in patients with functionaldyspepsia[J]. Chongqing Medicine, 2017, 46(13): 1789-1791, 1796 (in Chinese). |
| [44] |
HUWS S A, KIM E J, LEE M R F, et al. As yet uncultured bacteria phylogenetically classified as Prevotella, Lachnospiraceae incertae sedis and unclassified Bacteroidales, Clostridiales and Ruminococcaceae may play a predominant role in ruminal biohydrogenation[J]. Environmental Microbiology, 2011, 13(6): 1500-1512. |
| [45] |
VINOLO M A R, RODRIGUES H G, NACHBAR R T, et al. Regulation of inflammation by short chain fatty acids[J]. Nutrients, 2011, 3(10): 858-876. |




