2. 河南省畜牧总站, 郑州 450008
2. Henan Provincial Animal Husbandry General Station, Zhengzhou 450008, China
益生菌、酶制剂等具有促进反刍动物瘤胃微生态系统发育、提高瘤胃消化能力和肠道营养物质吸收、恢复胃肠道微生物群落、抑制病原菌定植以及增强黏膜免疫力的作用,从而能够提高反刍动物生长性能,维持瘤胃内环境的稳定[1]。米曲霉是曲霉属真菌中的一种丝状真菌,具有产生蛋白酶、淀粉酶和纤维素酶等复合酶类的作用,其代谢产物可以刺激纤维素分解菌的生长,提高饲粮中纤维的消化率,改善瘤胃发酵功能[2]。产朊假丝酵母不仅具有氨基酸组成平衡、蛋白质含量高的特点,而且其细胞壁中含有的β-葡聚糖、葡甘露聚糖和甘露糖蛋白具有抑制细胞DNA损伤、抗氧化、抗突变和抗毒活性的作用[3-4]。纤维素酶主要是由细菌和真菌发酵产生的一种高活性的微生态制剂,可以降解植物性饲粮中粗纤维、植酸等难降解的物质,提高饲粮利用率,提高反刍动物生长性能[5-6]。Zerby等[7]研究表明,在绵羊饲粮中添加1 g/d的米曲霉培养物可有效提高绵羊的平均日增重(ADG)。丁洪涛等[8]研究发现,添加产朊假丝酵母可以提高奶牛瘤胃氨态氮(NH3-N)和总挥发性脂肪酸含量,改善瘤胃发酵。肖杰等[9]在育肥湖羊饲粮中添加0.1%的纤维素酶显著提高了湖羊ADG,降低了料重比(F/G),改善了育肥湖羊生长性能。姜碧薇等[10]研究表明,纤维素酶与复合益生菌(主要成分为酵母菌、枯草芽孢杆菌和乳酸菌)混合处理稻草和苜蓿干草可显著提高滩羊ADG,降低F/G,改善瘤胃细菌多样性。由此可见,米曲霉、产朊假丝酵母及纤维素酶具有提高动物生长性能、促进瘤胃发酵、改善瘤胃细菌丰富度及多样性的作用,但三者复合对反刍动物的研究相对较少。因此,本研究用菌酶复合制剂饲喂育肥湖羊,探究对其生长性能、瘤胃发酵参数和细菌菌群的影响,并筛选出适宜的添加水平,为菌酶复合制剂在育肥湖羊生产的应用提供数据支撑。
1 材料与方法 1.1 试验材料试验所用菌酶复合制剂由河南某生物制品有限公司提供,由米曲霉(孢子数5×109个/g)、产朊假丝酵母(活菌数5×109 CFU/g)及纤维素酶(15 000 FPU/g DM)组成。
1.2 试验设计选择156只60日龄、体重在17 kg左右且健康状况良好的雄性育肥湖羊,随机分为4个组,每组3个重复,每个重复13只羊。对照组(A组)饲喂基础饲粮(全价颗粒饲粮),试验组饲喂在基础饲粮的基础上分别添加0.1%(B组)、0.2%(C组)和0.3%(D组)菌酶复合制剂的饲粮。菌酶复合制剂在每次饲喂时按照质量比混于基础饲粮中进行饲喂。
1.3 试验饲粮及饲养管理饲养试验于2020年9月至2020年11月在河南省漯河市某养殖场进行,预试期7 d,正试期60 d。每天于06:00和16:00进行饲喂,自由采食,自由饮水,其他饲养管理按养殖场规定执行。基础饲粮按照我国农业行业标准NY/T 816—2004《肉羊饲养标准》和场区生产实践配制,其组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
正试期第1天、第30天及第60天早晨对每只试验羊空腹称重,计算每只羊第1~30天、第31~60天及第1~60天的ADG。以重复为单位每天记录喂料量及剩料量,计算第1~30天、第31~60天及第1~60天的平均日采食量(ADFI)。根据ADG及ADFI计算F/G。
1.4.2 养分表观消化率测定正试期结束前3 d,每组随机选择3只试验羊进行消化试验,采用全收粪法且每只羊单栏饲喂,于每日06:00和16:00饲喂后采集全部粪样并称重,连续采集3 d,同时记录采食量。按照每天采集的鲜粪重的10%加入质量分数为10%的稀硫酸固氮,混匀,最后1 d采集结束后将采集的所有粪样以重复为单位混匀,按总重的5%取样,于65 ℃条件下烘干后置于室温回潮24 h,粉碎过40目筛,装于自封袋中备用;同时采集饲粮样品。饲粮和粪样中干物质(DM)、有机物(OM)、粗蛋白质(CP)、粗脂肪(EE)、钙(Ca)、磷(P)含量分别采用GB/T 6435—1986、GB/T 6434—2006、GB/T 6432—2018(凯氏定氮法)、GB/T 6433—2006、GB/T 6436—2002和GB/T 6437—2018方法测定,中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)含量测定参照Van Soest等[11]的方法。养分表观消化率计算公式如下:
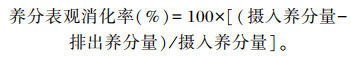
|
试验结束当天,每个重复随机挑选2只羊,使用瘤胃液采集管空腹采集瘤胃液,采集的第1管先弃掉,继续采集并于4层纱布过滤后分别装于50 mL离心管及5 mL冻存管中。50 mL离心管置于冰盒中保存,回到实验室后转移至-20 ℃冰箱保存,用于瘤胃pH、NH3-N及挥发性脂肪酸(VFA)含量的测定;5 mL冻存管置于液氮中保存,回到实验室后转移至-80 ℃冰箱保存,用于瘤胃细菌菌群的测定。其中,NH3-N含量采用苯酚-次氯酸钠比色法[12]测定;瘤胃VFA含量采用离子色谱法测定[13]。
1.4.4 瘤胃细菌菌群测序瘤胃细菌菌群测序由上海派森诺生物科技股份有限公司完成,采用16S rRNA进行测序,扩增区域为V3~V4区,引物对为338F(5′-ACTCCTACGGGAGGCAGCA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′),扩增片段长度为480 bp。首先按照基因组DNA提取试剂盒提取样品总DNA,采用Illumina NovaSeq测序平台根据序列质量进行初步筛查;对问题样本进行重测、补测。通过质量初筛的原始序列按照index和barcode信息,进行文库和样本划分,并去除barcode序列。之后按照DADA2分析流程进行序列去噪得到操作分类单元(OTU)代表序列,使用QIIME2软件进行alpha多样性分析、物种分类学注释及物种组成分析。
1.5 数据统计及分析试验数据使用Excel 2016进行整理,采用SPSS 26.0软件对所测数据进行单因素方差分析(one-way ANOVA)和Duncan氏法多重比较,A组和D组瘤胃细菌菌群差异采用t检验,结果用“平均值±标准差”表示,P < 0.05表示差异显著。
2 结果与分析 2.1 菌酶复合制剂对育肥湖羊生长性能的影响由表 2可知,与A组相比,D组育肥湖羊第60天体重显著提高(P < 0.05);且D组第31~60天及第1~60天ADG显著提高了14.89%和11.13%(P < 0.05),F/G显著降低了12.54%和9.51%(P < 0.05)。B组和C组育肥湖羊第60天体重及整个试验期的ADG和F/G与A组相比均无显著差异(P>0.05)。各组育肥湖羊各阶段ADFI之间均无显著差异(P>0.05)。
|
|
表 2 菌酶复合制剂对育肥湖羊生长性能的影响 Table 2 Effects of probiotics and enzyme compound preparation on growth performance of fattening Hu sheep (n=13) |
由表 3可知,与A组相比,B组、C组和D组ADF表观消化率显著提高(P < 0.05),分别提高了15.08%、14.95%和9.73%,且各试验组间差异不显著(P>0.05)。与A组相比,B组、C组和D组NDF表观消化率分别提高了5.16%(P < 0.05)、4.76%(P < 0.05)和1.43%(P>0.05)。各组其他养分表观消化率之间均无显著差异(P>0.05)。
|
|
表 3 菌酶复合制剂对育肥湖羊养分表观消化率的影响 Table 3 Effects of probiotics and enzyme compound preparation on nutrient apparent digestibility of fattening Hu sheep (n=3) |
由表 4可知,D组育肥湖羊瘤胃pH显著低于A组、B组和C组(P < 0.05),且A组、B组和C组3组之间瘤胃pH差异不显著(P>0.05)。与A组相比,B组、C组和D组瘤胃NH3-N含量分别显著提高了54.72%、76.38%和66.13%(P < 0.05)。VFA含量方面,与A组相比,B组、C组和D组瘤胃总挥发性脂肪酸、丙酸和异丁酸含量显著降低(P < 0.05);B组和D组瘤胃丁酸含量显著降低(P < 0.05)。
|
|
表 4 菌酶复合制剂对育肥湖羊瘤胃发酵参数的影响 Table 4 Effects of probiotics and enzyme compound preparation on rumen fermentation parameters of fattening Hu sheep (n=6) |
与A组相比,D组育肥湖羊生长性能显著提高,因此,随机选择A组和D组4个重复的瘤胃液样品进行16S rRNA测序分析。
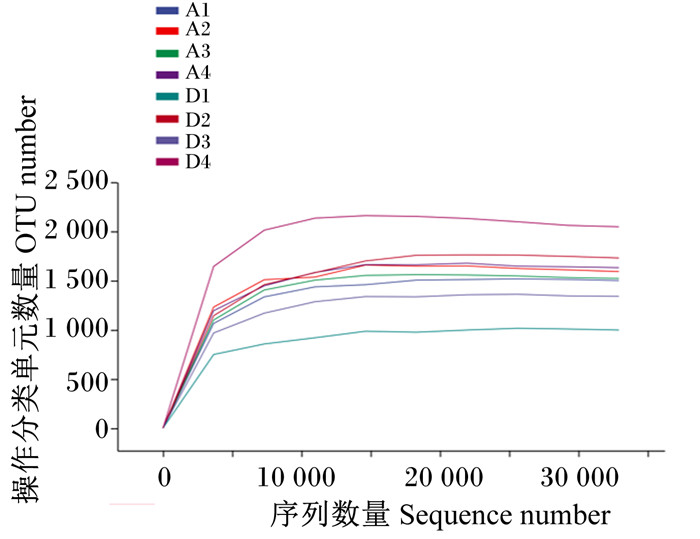
2.4.1 育肥湖羊瘤胃细菌菌群alpha多样性分析通过对A组和D组的8个瘤胃液样品进行测序共获得683 155条序列,经质量过滤、去噪后共获得594 522条有效序列,每个样品至少产生67 798条有效序列,平均产生74 315条有效序列。由图 1可知,随着测序深度的增加,稀释曲线末端均趋于平缓,表明测序结果已足够反映当前样本的多样性,继续增加测序深度已无法检测到新的OTU。
|
A1、A2、A3和A4分别为A组的4个样品;D1、D2、D3和D4分别为D组的4个样品。 A1, A2, A3 and A4 were 4 samples in group A, respectively; D1, D2, D3 and D4 were 4 samples in group D, respectively. 图 1 育肥湖羊瘤胃细菌菌群稀释曲线 Fig. 1 Rumen bacterial community rarefaction curves of fattening Hu sheep |
通过对A组和D组瘤胃细菌菌群进行alpha多样性分析(表 5)可知,2组之间反映物种丰富度的Chao1指数、OTU数量以及反映物种多样性的Shannon指数、Simpson指数均差异不显著(P>0.05),这表明饲粮添加0.3%菌酶复合制剂对育肥湖羊瘤胃细菌菌群丰富度和多样性均无显著影响;且2组的覆盖度都达到了99%以上,这说明样本中未被检测出的物种所占的比例较低。
|
|
表 5 育肥湖羊瘤胃细菌菌群alpha多样性分析 Table 5 Alpha diversity analysis of rumen bacterial community of fattening Hu sheep (n=4) |
由表 6可知,A组和D组育肥湖羊瘤胃细菌菌群在门水平前10种菌门中的优势菌门为厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)。与A组相比,D组拟杆菌门和TM7的相对丰度显著降低(P < 0.05),分别降低了18.57%和39.29%;D组放线菌门(Actinobacteria)和蓝藻菌门(Cyanobacteria)的相对丰度显著提高(P < 0.05);2组其他菌门的相对丰度之间差异均不显著(P>0.05)。
|
|
表 6 育肥湖羊瘤胃细菌菌群在门水平上的组成 Table 6 Composition of rumen bacterial community of fattening Hu sheep at phylum level (n=4) |
由表 7可知,在属水平前10种菌属中,普雷沃氏菌属(Prevotella)和瘤胃球菌属(Ruminococcus)为瘤胃中的优势菌属。与A组相比,D组欧陆森氏菌属(Olsenella)的相对丰度显著提高(P < 0.05),YRC22的相对丰度显著降低(P < 0.05),其他菌属的相对丰度差异均不显著(P>0.05)。
|
|
表 7 育肥湖羊瘤胃细菌菌群在属水平上的组成 Table 7 Composition of rumen bacterial community of fattening Hu sheep at genus level (n=4) |
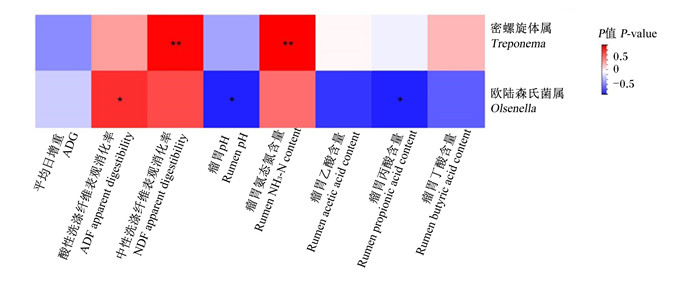
为了进一步探究瘤胃细菌菌群对育肥湖羊生长性能和瘤胃发酵参数的影响,将属水平前10种的细菌与育肥湖羊ADG、NDF和ADF表观消化率以及瘤胃pH、NH3-N、乙酸、丙酸和丁酸含量进行相关性分析,由相关性热图(图 2)可知,在属水平前10种菌群中,仅有密螺旋体属(Treponema)和欧陆森氏菌属相对丰度与这些因素具有显著相关性,其中密螺旋体属相对丰度与NDF表观消化率和瘤胃NH3-N含量呈极显著正相关(P < 0.01);欧陆森氏菌属相对丰度与ADF表观消化率呈显著正相关(P < 0.05),与瘤胃pH和丙酸含量呈显著负相关(P < 0.05)。
|
“*”表示P < 0.05,“* *”表示P < 0.01。 "*" indicated P < 0.05, and "* *" indicated P < 0.01. 图 2 育肥湖羊瘤胃细菌菌群相关性热图(属水平) Fig. 2 Heatmap of rumen bacterial community correlation of fattening Hu sheep (genus level) |
益生菌及酶制剂等饲料添加剂具有调控动物胃肠道微生物群落的作用,从而能够减少致病菌的增殖,提高动物生长性能[14]。Kritas等[15]研究发现,饲粮添加益生菌制剂可以显著提高羔羊体重。邱玉朗等[16]研究发现,用复合益生菌饲喂小尾寒羊可以显著提高其ADG,降低F/G。本试验在饲粮中添加米曲霉、产朊假丝酵母及纤维素酶复合的菌酶制剂饲喂育肥湖羊,结果表明菌酶复合制剂可以提高育肥湖羊生长性能,其中0.3%菌酶复合制剂添加组在试验后期和整个试验期的ADG显著提高,F/G显著降低,这表明复合益生菌和纤维素酶复合制剂对动物的促生长作用需要有一定的过程,长期添加菌酶复合制剂对提高湖羊的ADG和饲料利用率具有显著的效果。本试验中,饲粮添加0.3%菌酶复合制剂对湖羊的促生长效果最优,但是否随着菌酶复合制剂添加水平的提高会有更优的效果,有待进一步研究;不过,考虑到实际生产成本等因素,0.3%菌酶复合制剂为可接受的最优添加水平。菌酶复合制剂提高了湖羊ADG,降低了F/G,这也与其提高饲粮中纤维的表观消化率结果相一致。本试验中,饲粮添加菌酶复合制剂对育肥湖羊ADFI并无影响,这与Hernández等[17]和李忠玲等[18]的研究结果一致,但也有研究表明使用菌酶制剂可以提高羔羊采食量[19]。这可能是由于益生菌及酶制剂种类不同,造成的试验结果也不一致。
3.2 菌酶复合制剂对育肥湖羊养分表观消化率的影响反刍动物饲粮中大部分可消化的营养物质都在瘤胃内被消化,并且瘤胃具有消化纤维素、半纤维素等结构性碳水化合物的能力[20]。米曲霉、产朊假丝酵母及其代谢产物具有促进纤维素分解菌生长、提高纤维素酶活性以及提高饲粮中纤维消化率的作用[21]。王红梅等[22]研究发现,饲粮中添加复合酶制剂可以显著提高肉羊NDF和ADF的消化率。曾辉等[23]研究发现,使用酶制剂与乳酸菌复合发酵玉米秸秆,显著提高了玉米秸秆中NDF和ADF的降解率。本试验结果表明,饲粮添加不同水平的菌酶复合制剂均可以提高饲粮中ADF和NDF的表观消化率,这可能是由于添加的菌酶复合制剂提高了湖羊瘤胃内纤维素分解菌及纤维素酶的活性[24];同时,NDF和ADF表观消化率的提高也促进了湖羊生长性能的提高。
3.3 菌酶复合制剂对育肥湖羊瘤胃发酵参数的影响瘤胃pH稳定是瘤胃内环境稳定的基础,也是瘤胃正常发挥作用的保证[25]。NH3-N是瘤胃蛋白质代谢的中间产物,是瘤胃微生物蛋白合成的主要成分之一,为瘤胃微生物的生长提供氮源[26]。VFA是瘤胃降解饲粮中碳水化合物的产物,为反刍动物的生长发育提供能量[27]。苏丽萍等[28]研究表明,饲粮添加复合酶制剂可以显著降低青海育肥藏系羔羊瘤胃pH,显著提高NH3-N含量。牛建康[29]研究发现,饲喂活性干酵母可以提高泌乳牛瘤胃中VFA的含量。本试验结果表明,D组瘤胃pH显著降低,但各组瘤胃pH测定值总体偏高,这可能一方面与基础饲粮中添加小苏打有关,另一方面与饲喂颗粒饲粮等因素有关,具体原因有待进一步研究。本试验中,与A组相比,B组、C组和D组瘤胃NH3-N含量显著升高,这可能是由于添加菌酶复合制剂促进了瘤胃中蛋白质的降解,从而显著提高了瘤胃NH3-N的含量。本试验结果表明,与A组相比,B组、C组和D组瘤胃中总挥发性脂肪酸、丙酸、丁酸及异丁酸的含量降低,这可能是由于菌酶复合制剂改变了与瘤胃VFA相关微生物的丰度,从而影响了瘤胃内VFA的含量。
3.4 菌酶复合制剂对育肥湖羊瘤胃细菌菌群的影响反刍动物瘤胃是一个复杂的动态微生态系统,由大量不同的微生物组成,具有高度的微生物多样性,且各种微生物处于平衡状态,维持瘤胃内环境的稳定[30]。厚壁菌门和拟杆菌门是反刍动物瘤胃门水平上的优势菌群,占整个瘤胃细菌的比例较大[31],这与本试验研究结果一致。研究表明,拟杆菌门与厚壁菌门比值降低,有利于营养物质吸收以及脂肪沉积[32],本试验中,D组拟杆菌门相对丰度显著低于A组,使D组拟杆菌门与厚壁菌门比值降低,这与D组生长性能提高相对应。放线菌门是瘤胃中一类重要的革兰氏阳性菌,是瘤胃微生物生命中的常规成员[33]。研究发现,放线菌门占瘤胃细菌总数的3%左右[34],本试验中D组放线菌门相对丰度显著高于A组,但其值在正常范围内,而A组放线菌门相对丰度值较低,可能是由于A组拟杆菌门相对丰度较高,抑制了放线菌门的生长。钟港等[35]研究由复合益生菌发酵菌糠替代白酒糟对育肥牛瘤胃微生物群落的影响,结果表明,饲喂发酵菌糠可以显著降低TM7的相对丰度。本试验中,D组TM7相对丰度显著低于A组,但其在瘤胃中的作用尚不清楚。研究发现,蓝藻菌门中具有硝酸盐还原菌,可以将硝酸盐以同化或异化的方式还原为氨[36]。本试验中,D组蓝藻菌门相对丰度显著高于A组,可能是由于菌酶复合制剂促进了瘤胃内可利用硝酸盐的微生物生长,同时也与D组瘤胃NH3-N含量显著提高相对应。
本试验中,育肥湖羊瘤胃细菌菌群属水平上占比最大的2种菌属为普雷沃氏菌属和瘤胃球菌属,分别属于拟杆菌门和厚壁菌门。同时,A组和D组普雷沃氏菌属和瘤胃球菌属相对丰度差异均不显著,这说明饲粮添加菌酶复合制剂不会影响育肥湖羊瘤胃中优势菌属的相对丰度。欧陆森氏菌属属于放线菌门,研究表明,小鼠在摄入低聚糖后,肠道菌群中欧陆森氏菌属和放线菌门的相对丰度显著提高,并提出欧陆森氏菌属具有利用低聚糖的观点[37]。Mager等[38]将欧陆森氏菌属与免疫检查点抑制剂一起植入无菌小鼠体内,结果发现欧陆森氏菌属在小鼠癌症模型中可以显著增强免疫治疗的效力。本试验中,与A组相比,D组欧陆森氏菌属相对丰度显著提高,说明饲粮添加菌酶复合制剂可以提高瘤胃对饲粮中低聚糖的分解利用,同时提高动物机体的免疫能力;同时,D组欧陆森氏菌属相对丰度的提高也是导致门水平放线菌门相对丰度高于A组的主要原因。研究发现,YRC22相对丰度与瘤胃中乙酸含量呈正相关,但其在瘤胃中的生理功能还有待探究[39]。本试验结果表明,D组YRC22相对丰度显著低于A组,与D组瘤胃乙酸含量低于A组对应。
此外,本试验通过研究瘤胃细菌与环境因子之间相互影响的关系发现,密螺旋体属相对丰度与NDF表观消化率和瘤胃NH3-N含量呈极显著正相关,密螺旋体属属于厚壁菌门,能够降解粗饲粮中含有的半纤维素,且能够帮助纤维分解菌参与纤维素的降解[40]。本试验中,D组瘤胃中密螺旋体属相对丰度在数值上大于A组,与D组NDF和ADF表观消化率以及瘤胃NH3-N含量的提高相对应。本试验中,欧陆森氏菌属相对丰度与ADF表观消化率呈显著正相关,与瘤胃pH和丙酸含量呈显著负相关;与A组相比,D组欧陆森氏菌属相对丰度显著提高,这与D组育肥湖羊ADF表观消化率的提高以及瘤胃pH和丙酸含量的降低相对应。
4 结论在育肥湖羊饲粮中添加0.3%的菌酶复合制剂可以:
① 提高育肥湖羊ADG,降低F/G,提高饲粮ADF表观消化率;
② 降低瘤胃拟杆菌门与厚壁菌门比值,有利于能量利用;同时,提高瘤胃欧陆森氏菌属相对丰度,其与ADF表观消化率呈显著正相关,有助于提高育肥湖羊对饲粮中纤维的消化率。
| [1] |
UYENO Y, SHIGEMORI S G U, SHIMOSATO T. Effect of probiotics/prebiotics on cattle health and productivity[J]. Microbes and Environments, 2015, 30(2): 126-132. DOI:10.1264/jsme2.ME14176 |
| [2] |
肖君. 米曲霉培养物对绵羊瘤胃发酵和菌群多样性的影响[D]. 硕士学位论文. 长春: 吉林农业大学, 2015. XIAO J. Effects of Aspergillus oryzae culture on rumen fermentation and microbial diversity[D]. Master's Thesis. Changchun: Jilin Agricultural University, 2015. (in Chinese) |
| [3] |
MIADOKOVÁ E, SVIDOVÁ S, VLCKOVÁ V, et al. Diverse biomodulatory effects of glucomannan from Candida utilis[J]. Toxicology in Vitro, 2006, 20(5): 649-657. DOI:10.1016/j.tiv.2005.12.001 |
| [4] |
VLČKOVÁ V, DÚHOVÁ V, SVIDOVÁ S, et al. Antigenotoxic potential of glucomannan on four model test systems[J]. Cell Biology and Toxicology, 2004, 20(6): 325-332. DOI:10.1007/s10565-004-0089-7 |
| [5] |
吴爽, 周玉香, 贾柔, 等. 纤维素酶处理荞麦秸秆对其纤维结构和滩羊肉品质的影响[J]. 草业学报, 2021, 30(1): 170-180. WU S, ZHOU Y X, JIA R, et al. Effects of cellulase treatment of buckwheat straw on fiber structure and meat quality of Tan sheep[J]. Acta Prataculturae Sinica, 2021, 30(1): 170-180 (in Chinese). |
| [6] |
张对红. 米曲霉培养物对湖羊生产性能和瘤胃功能的影响[D]. 硕士学位论文. 兰州: 兰州大学, 2021. ZHANG D H. Effects of Aspergillus oryzae culture on the performance and rumen function of Hu sheep[D]. Master's Thesis. Lanzhou: Lanzhou University, 2021. (in Chinese) |
| [7] |
ZERBY H N, BARD J L, LOERCH S C, et al. Effects of diet and Aspergillus oryzae extract or Saccharomyces cervisiae on growth and carcass characteristics of lambs and steers fed to meet requirements of natural markets[J]. Journal of Animal Science, 2011, 89(7): 2257-2264. DOI:10.2527/jas.2010-3308 |
| [8] |
丁洪涛, 刘星, 夏冬华, 等. 产朊假丝酵母对奶牛体外瘤胃发酵参数及日粮营养物质消化率的影响[J]. 中国畜牧杂志, 2012, 48(9): 56-59. DING H T, LIU X, XIA D H, et al. Effects of Candida utilis on simulated rumen fermentation parameters and dietary nutrient digestibility of dairy cows[J]. Chinese Journal of Animal Science, 2012, 48(9): 56-59 (in Chinese). DOI:10.3969/j.issn.0258-7033.2012.09.014 |
| [9] |
肖杰, 孙攀峰, 李鹏伟, 等. 饲粮中添加单宁和纤维素酶对育肥湖羊生长性能、营养物质消化率及肠道形态的影响[J]. 中国饲料, 2020(8): 33-36. XIAO J, SUN P F, LI P W, et al. Effects of tannins and cellulase on growth performance, nutrients digestibility and intestinal morphology of Hu sheep[J]. China Feed, 2020(8): 33-36 (in Chinese). DOI:10.15906/j.cnki.cn11-2975/s.20200809 |
| [10] |
姜碧薇, 周玉香, 王甜, 等. 酶菌混合处理稻草和苜蓿干草对滩羊生长性能、血清生化指标、瘤胃细菌多样性及KEGG通路的影响[J]. 动物营养学报, 2021, 33(3): 1482-1492. JIANG B W, ZHOU Y X, WANG T, et al. Effects of straw and alfalfa hay treated by enzyme and bacteria on growth performance, serum biochemical indexes, rumen bacterial diversity and KEGG pathway of Tan sheep[J]. Chinese Journal of Animal Nutrition, 2021, 33(3): 1482-1492 (in Chinese). DOI:10.3969/j.issn.1006-267x.2021.03.030 |
| [11] |
VAN SOEST P J, ROBERTSON J B, LEWIS B A. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition[J]. Journal of Dairy Science, 1991, 74(10): 3583-3597. DOI:10.3168/jds.S0022-0302(91)78551-2 |
| [12] |
BRODERICK G A, KANG J H. Automated simultaneous determination of ammonia and total amino acids in ruminal fluid and in vitro media[J]. Journal of Dairy Science, 1980, 63(1): 64-75. DOI:10.3168/jds.S0022-0302(80)82888-8 |
| [13] |
牟豪杰, 孟庆翔, 任丽萍, 等. 离子色谱法同时测定牛瘤胃液中乳酸和挥发性脂肪酸含量[J]. 理化检验(化学分册), 2009, 45(1): 52-54. MOU H J, MENG Q X, REN L P, et al. Simultaneous determination of lactic acid and volatile fatty acids in ox rumen juice by ion chromatography[J]. Physical Testing and Chemical Analysis Part B: Chemical Analysis, 2009, 45(1): 52-54 (in Chinese). DOI:10.3321/j.issn:1001-4020.2009.01.019 |
| [14] |
ANGELAKIS E. Weight gain by gut microbiota manipulation in productive animals[J]. Microbial Pathogenesis, 2017, 106: 162-170. DOI:10.1016/j.micpath.2016.11.002 |
| [15] |
KRITAS S K, GOVARIS A, CHRISTODOULOPOULOS G, et al. Effect of Bacillus licheniformis and Bacillus subtilis supplementation of ewe's feed on sheep milk production and young lamb mortality[J]. Journal of Veterinary Medicine A, 2006, 53(4): 170-173. DOI:10.1111/j.1439-0442.2006.00815.x |
| [16] |
邱玉朗, 李林, 纪传来, 等. 秸秆玉米浆混合发酵对肉羊生长及血液指标的影响[J]. 饲料研究, 2019, 42(1): 12-14. QIU Y L, LI L, JI C L, et al. Effects of straw corn slurry mixed fermentation on growth and blood indexes of mutton sheep[J]. Feed Research, 2019, 42(1): 12-14 (in Chinese). DOI:10.13557/j.cnki.issn1002-2813.2019.01.004 |
| [17] |
HERNÁNDEZ R, GONZÁLEZ S S, PINOS-RODRÍGUEZ J M, et al. Effect of a yeast culture on nitrogen balance and digestion in lambs fed early and mature orchard grass[J]. Journal of Applied Animal Research, 2009, 35(1): 53-56. DOI:10.1080/09712119.2009.9706984 |
| [18] |
李忠玲, 杜忍让, 武和平, 等. 复合酶制剂对陕北绒山羊增重效果的研究[J]. 畜牧兽医杂志, 2014, 33(6): 4-7. LI Z L, DU R R, WU H P, et al. Study on gaining effect of compound enzyme preparation in Shanbei white-cashmere goat[J]. Journal of Animal Science and Veterinary Medicine, 2014, 33(6): 4-7 (in Chinese). DOI:10.3969/j.issn.1004-6704.2014.06.002 |
| [19] |
拉加. 多酶益生素处理青稞秸秆饲喂育肥羊增重效果试验[J]. 山东畜牧兽医, 2018, 39(3): 7-8. LA J. Effect of multi enzyme probiotics on weight gain of fattening sheep fed with highland barley straw[J]. Shandong Journal of Animal Science and Veterinary Medicine, 2018, 39(3): 7-8 (in Chinese). DOI:10.3969/j.issn.1007-1733.2018.03.005 |
| [20] |
肖怡. 三种益生菌对肉羊甲烷排放、物质代谢和瘤胃发酵的影响[D]. 硕士学位论文. 阿拉尔: 塔里木大学, 2016. XIAO Y. Effects of three probiotics on methane emission, nutrient metabolism and rumen fermentation in mutton sheep[D]. Master's Thesis. Alar: Tarim University, 2016. (in Chinese) |
| [21] |
NEWBOLD C J, MCINTOSH F M, WALLACE R J. Changes in the microbial population of a rumen-simulating fermenter in response to yeast culture[J]. Canadian Journal of Animal Science, 1998, 78(2): 241-244. DOI:10.4141/A97-086 |
| [22] |
王红梅, 屠焰, 司丙文, 等. 不同配伍酶制剂处理玉米秸秆对肉用绵羊生长性能和营养物质消化率的影响[J]. 中国农业科学, 2016, 49(24): 4806-4813. WANG H M, TU Y, SI B W, et al. Effects of corn straw treated with different compatibility enzymes on growth performance and nutrient digestibility of mutton sheep[J]. Scientia Agricultura Sinica, 2016, 49(24): 4806-4813 (in Chinese). DOI:10.3864/j.issn.0578-1752.2016.24.012 |
| [23] |
曾辉, 邱玉朗, 李林, 等. 酶制剂和乳酸菌对秸秆微贮饲料质量及瘤胃降解率的影响[J]. 中国畜牧杂志, 2018, 54(11): 84-88. ZENG H, QIU Y L, LI L, et al. Effect of enzyme preparation and Lactobacillus on the quality and rumen degradation rate of corn stalks microbial feeds[J]. Chinese Journal of Animal Science, 2018, 54(11): 84-88 (in Chinese). |
| [24] |
WANG Y, MCALLISTER T A, RODE L M, et al. Effects of an exogenous enzyme preparation on microbial protein synthesis, enzyme activity and attachment to feed in the rumen simulation technique (Rusitec)[J]. The British Journal of Nutrition, 2001, 85(3): 325-332. |
| [25] |
李孟伟, 彭丽娟, 彭开屏, 等. 抑制不同种类瘤胃微生物活性对水牛瘤胃发酵和脂肪酸代谢的影响[J]. 中国畜牧兽医, 2020, 47(9): 2767-2778. LI M W, PENG L J, PENG K B, et al. Effects of inhibition of different rumen microbial activity on rumen fermentation and fatty acid metabolism in buffaloes[J]. China Animal Husbandry & Veterinary Medicine, 2020, 47(9): 2767-2778 (in Chinese). |
| [26] |
WALLACE R J, ARTHAUD L, NEWBOLD C J. Influence of Yucca shidigera extract on ruminal ammonia concentrations and ruminal microorganisms[J]. Applied and Environmental Microbiology, 1994, 60(6): 1762-1767. DOI:10.1128/aem.60.6.1762-1767.1994 |
| [27] |
MATTHEWS C, CRISPIE F, LEWIS E, et al. The rumen microbiome: a crucial consideration when optimising milk and meat production and nitrogen utilisation efficiency[J]. Gut Microbes, 2019, 10(2): 115-132. DOI:10.1080/19490976.2018.1505176 |
| [28] |
苏丽萍, 何长芳, 马双青, 等. 添加复合纤维素酶对青海育肥藏系羔羊瘤胃发酵的影响研究[J]. 青海畜牧兽医杂志, 2014, 44(4): 22-24. SU L P, HE C F, MA S Q, et al. Effect of adding compound cellulase enzyme on rumen fermentation of fattening lamb[J]. Chinese Qighai Journal of Animal and Veterinary Sciences, 2014, 44(4): 22-24 (in Chinese). |
| [29] |
牛建康. 活性干酵母对泌乳牛生产性能、瘤胃发酵及甲烷排放的影响[D]. 硕士学位论文. 保定: 河北农业大学, 2019. NIU J K. Effects of active dry yeasts on performance, rumen fermentation and methane production of lactating dairy cows[D]. Master's Thesis. Baoding: Agricultural University of Hebei, 2019. (in Chinese) |
| [30] |
COLLADO M C, ISOLAURI E, SALMINEN S, et al. The impact of probiotic on gut health[J]. Current Drug Metabolism, 2009, 10(1): 68-78. DOI:10.2174/138920009787048437 |
| [31] |
LEE J E, LEE S, SUNG J, et al. Analysis of human and animal fecal microbiota for microbial source tracking[J]. The ISME Journal, 2011, 5: 362-365. |
| [32] |
CHANG J, WANG T, WANG P, et al. Compound probiotics alleviating aflatoxin B1 and zearalenone toxic effects on broiler production performance and gut microbiota[J]. Ecotoxicology and Environmental Safety, 2020, 194: 110420. |
| [33] |
SUL'ÁK M, SIKOROVÁ L, JANKUVOVÁ J, et al. Variability of actinobacteria, a minor component of rumen microflora[J]. Folia Microbiologica, 2012, 57(4): 351-353. |
| [34] |
PANDYA P R, SINGH K M, PARNERKAR S, et al. Bacterial diversity in the rumen of Indian Surti buffalo (Bubalus bubalis), assessed by 16S rDNA analysis[J]. Journal of Applied Genetics, 2010, 51(3): 395-402. |
| [35] |
钟港, 陈东, 田科雄, 等. 发酵菌糠替代白酒糟对育肥牛瘤胃发酵参数、微生物菌群结构和功能的影响[J]. 动物营养学报, 2022, 34(1): 381-394. ZHONG G, CHEN D, TIAN K X, et al. Effects of replacing distiller's grains with fermented spent mushroom substrate on rumen fermentation parameters, microbial community structure and function of fattening cattle[J]. Chinese Journal of Animal Nutrition, 2022, 34(1): 381-394 (in Chinese). |
| [36] |
ZHAO L P, MENG Q X, REN L P, et al. Effects of nitrate addition on rumen fermentation, bacterial biodiversity and abundance[J]. Asian-Australasian Journal of Animal Sciences, 2015, 28(10): 1433-1441. |
| [37] |
毛丙永. 功能性低聚糖对肠道细菌的影响及机制[D]. 博士学位论文. 无锡: 江南大学, 2015. MAO B Y. Effects of functional oligosaccharides on the gut bacteria and the mechanism[D]. Ph. D. Thesis. Wuxi: Jiangnan University, 2015. (in Chinese) |
| [38] |
MAGER L F, BURKHARD R, PETT N, et al. Microbiome-derived inosine modulates response to checkpoint inhibitor immunotherapy[J]. Science, 2020, 369(6510): 1481-1489. |
| [39] |
GAOWA N R, PANKE-BUISSE K, WANG S X, et al. Brisket disease is associated with lower volatile fatty acid production and altered rumen microbiome in Holstein heifers[J]. Animals, 2020, 10(9): 1712. |
| [40] |
李希, 毛杨毅, 罗惠娣, 等. 饲粮纤维水平对育肥羔羊瘤胃微生物组成及多样性的影响[J]. 中国畜牧兽医, 2021, 48(4): 1251-1263. LI X, MAO Y Y, LUO H D, et al. Effects of dietary crude fiber level on rumen microbial composition and diversity of fattening lambs[J]. China Animal Husbandry & Veterinary Medicine, 2021, 48(4): 1251-1263 (in Chinese). |




