核黄素(riboflavin,RF)是反刍动物本身和瘤胃微生物所需的必需营养因子,以黄素单核苷酸(FMN)和黄素腺嘌呤二核苷酸(FAD)的形式参与生物体能量、碳水化合物、蛋白质和脂肪代谢过程中的氧化还原反应,并参与叶酸、钴铵素和吡哆醇的活化与代谢[1-2]。早期体外研究发现,瘤胃液中添加RF提高了纤维物质的降解率,增加了黄色瘤胃球菌、白色瘤胃球菌和总原虫数量[3-4]。最近的研究发现,在精粗比为50 ∶ 50的饲粮中添加RF改善了公牛平均日增重和饲料效率,提高了养分表观消化率,增加了瘤胃总挥发性脂肪酸(TVFA)浓度以及总细菌、总真菌和总原虫数量[5]。目前已有研究表明,由饲粮提供的和瘤胃微生物合成的RF不能满足公牛瘤胃微生物生长的需求[5]。目前,外源添加RF对绵羊瘤胃发酵和微生物生长调控的研究还未见报道。本试验采用体外发酵产气法,研究不同添加水平RF对绵羊瘤胃发酵参数、酶活性和菌群数量的影响,以期明确外源补充RF对绵羊瘤胃发酵的调控机制,旨在为RF应用于肉羊生产提供理论依据。
1 材料与方法 1.1 试验材料RF购于北京某生物科技有限公司,纯度>98%。
1.2 试验动物和饲养管理瘤胃液供体动物选用3只3周岁、体重(50.0±1.5) kg且安装有瘤胃瘘管的杜泊×小尾寒羊杂交F1代公绵羊。基础饲粮依据NRC(2007)[6]配制,精粗比50 ∶ 50,其组成及营养水平见表 1。试验羊自由采食和饮水,每天饲喂2次(07:00、19:00)。预试期为10 d。
|
|
表 1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
根据文献中RF在奶公牛饲粮中适宜添加水平(53 mg/kg)[5],本试验设置5个添加水平。采用单因子试验设计,各组分别在基础饲粮中添加0(对照)、15、30、45、60和75 mg/kg RF作为发酵底物,每组6个平行,同时设置6个空白。
1.4 体外发酵试验试验依据Menke等[7]体外产气技术并结合尼龙袋技术进行。试验羊饲喂基础饲粮第11天晨饲前,通过瘘管从瘤胃的不同部位采集3只羊的瘤胃液,4层纱布迅速过滤后以1 ∶ 2的比例与人工唾液混合,保持39 ℃恒温、旋涡状态,并持续通入CO2。发酵底物经烘干粉碎至粒径为1.0 mm,准确称取0.200 0 g装入4.0 cm×1.5 cm尼龙袋中(孔径38~40 μm),放入发酵管(100 mL,Haberle公司,德国),同时准备6个空白(发酵管中加空尼龙袋)。发酵管39 ℃预热后加入30 mL培养液,排尽气体,记录初始值后置于39 ℃人工瘤胃培养箱(DHP-9162,上海一恒科学仪器有限公司)中振荡培养。体外发酵试验重复2批。
1.5 样品采集与分析 1.5.1 产气量和甲烷产量记录各发酵管0、2、4、6、8、12、16、20、24、30、36和48 h的产气量,采集发酵气体,用气相色谱仪(Agilent 7890B,美国)测定发酵48 h内产生气体中的甲烷(CH4)产量[8]。
1.5.2 瘤胃发酵参数采集发酵48 h的发酵液样品,立即用pH计(PHS-3C,上海雷军科技有限公司)测定pH;采用气相色谱仪并参考Wang等[9]的方法测定发酵液挥发性脂肪酸(VFA)浓度;参照白齐昌等[10]的方法测定发酵液氨态氮(NH3-N)浓度;采用考马斯亮蓝指示剂法测定发酵液微生物蛋白质(MCP)浓度[10]。
1.5.3 瘤胃酶活性按照Agarwal等[11]的方法测定发酵液羧甲基纤维素酶、纤维二糖酶、果胶酶、α-淀粉酶和蛋白酶活性。酶活性单位定义为39 ℃条件下30 min内每毫升瘤胃液释放的还原糖量[12]。
1.5.4 瘤胃菌群数量应用珠磨-十六烷基三甲基溴化铵(CTAB)法提取发酵液微生物总DNA,使用核酸蛋白测定仪测定DNA浓度,并用TE buffer将DNA浓度稀释至100 ng/mL。利用实时荧光定量PCR测定瘤胃菌群数量,将通过文献查找并设计好的瘤胃10种菌群的引物对样本菌群16S/18S rDNA的目的片段进行普通PCR扩增。瘤胃菌群基因引物序列如表 2所示,由上海生工生物工程有限公司合成。PCR反应体系和反应条件见参考文献[12]。
|
|
表 2 瘤胃菌群基因引物序列 Table 2 Primer sequences of rumen microflora gene |
产气量计算公式如下:

|
采用Ørskov等[13]提出的动态发酵模型计算产气参数,计算公式如下:
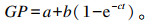
|
式中:GP为t时间点累计产气量(mL);a、b分别为快速和慢速发酵部分产气量(mL);c为产气速率(%/h);a+b为潜在产气量(mL)。a、b、c值根据非线性最小二乘法求得。
1.6 数据处理与统计分析试验数据采用SPSS 22.0统计软件进行单因素方差分析(one-way ANOVA),差异显著时用Duncan氏法进行多重比较,结果以平均值和均值标准误(SEM)表示,P < 0.05表示差异显著。
2 结果 2.1 RF对体外发酵产气参数和甲烷产量的影响由表 3可知,48 h累积产气量、慢速发酵部分产气量和潜在产气量随着RF添加水平的增加呈二次项升高(P < 0.05)。48 h累积产气量、慢速发酵部分产气量和潜在产气量均以30 mg/kg RF组最高,显著高于其他各组(P < 0.05);对照组、15、45和60 mg/kg RF组次之,显著高于75 mg/kg RF组(P < 0.05);75 mg/kg RF组最低,显著低于其他各组(P < 0.05)。各组之间快速发酵部分产气量、产气速率和甲烷产量差异不显著(P>0.05)。
|
|
表 3 RF对体外发酵产气参数和甲烷产量的影响 Table 3 Effects of RF on gas production parameters and CH4 yield in vitro fermentation |
由表 4可知,pH随着RF添加水平的增加呈二次项降低(P < 0.05),对照组pH显著高于其他各组(P < 0.05)。TVFA、乙酸、丙酸、丁酸、戊酸和异戊酸浓度随着RF添加水平的增加呈二次项升高(P < 0.05);30和45 mg/kg RF组TVFA浓度显著高于对照组和75 mg/kg RF组(P < 0.05),15 mg/kg RF组TVFA浓度显著高于75 mg/kg RF组(P < 0.05);75 mg/kg RF组乙酸浓度显著低于其他各组(P < 0.05);30和45 mg/kg RF组丙酸和异戊酸浓度显著高于对照组和75 mg/kg RF组(P < 0.05);对照组丁酸浓度显著低于15、30、45和60 mg/kg RF组(P < 0.05);30和45 mg/kg RF组戊酸浓度显著高于对照组和75 mg/kg RF组(P < 0.05),15和60 mg/kg RF组戊酸浓度显著高于对照组(P < 0.05)。乙酸/丙酸随着RF添加水平的增加呈线性降低(P < 0.05),60和75 mg/kg RF组乙酸/丙酸显著低于对照组以及15、30和45 mg/kg RF组(P < 0.05)。氨态氮浓度随着RF添加水平的增加呈线性升高(P < 0.05),45、60和75 mg/kg RF组氨态氮浓度显著高于对照组(P<0.05)。各组之间异丁酸和MCP浓度无显著差异(P>0.05)。
|
|
表 4 RF对体外发酵瘤胃发酵参数的影响 Table 4 Effects of RF on rumen fermentation parameters in vitro fermentation |
由表 5可知,各组之间羧甲基纤维素酶、果胶酶和纤维二糖酶活性无显著差异(P>0.05)。木聚糖酶活性随着RF添加水平的增加呈线性降低(P < 0.05),75 mg/kg RF组木聚糖酶活性显著低于对照组以及15、30和45 mg/kg RF组(P < 0.05)。α-淀粉酶和蛋白酶活性随着RF添加水平的增加呈二次项升高(P < 0.05);30 mg/kg RF组α-淀粉酶活性显著高于对照组以及60和75 mg/kg RF组(P < 0.05),与15和45 mg/kg RF组差异不显著(P>0.05),且15、45、60和75 mg/kg RF组α-淀粉酶活性高于对照组(P < 0.05);45 mg/kg RF组蛋白酶活性显著高于对照组以及15、60和75 mg/kg RF组(P < 0.05),与30 mg/kg RF组差异不显著(P>0.05)。
|
|
表 5 RF对体外发酵瘤胃酶活性的影响 Table 5 Effects of RF on rumen enzyme activities in vitro fermentation |
由表 6可知,总细菌、总真菌、总原虫、黄色瘤胃球菌、白色瘤胃球菌、溶纤维丁酸弧菌、产琥珀酸丝状杆菌、栖瘤胃普雷沃氏菌和嗜淀粉瘤胃杆菌数量均随着RF添加水平的增加呈二次项升高(P < 0.05)。30 mg/kg RF组总细菌、总真菌、黄色瘤胃球菌和产琥珀酸丝状杆菌数量显著高于对照组以及60和75 mg/kg RF组(P < 0.05),与15和45 mg/kg RF组差异不显著(P>0.05);30 mg/kg RF组白色瘤胃球菌、栖瘤胃普雷沃氏菌和总原虫数量显著高于对照组以及15、60和75 mg/kg RF组(P < 0.05),与45 mg/kg RF组差异不显著(P>0.05);30 mg/kg RF组溶纤维丁酸弧菌数量显著高于对照组和75 mg/kg RF组(P < 0.05),与15、45和60 mg/kg RF组差异不显著(P>0.05);30和45 mg/kg RF组嗜淀粉瘤胃杆菌数量显著高于对照组以及15、60和75 mg/kg RF组(P < 0.05)。各组之间总产甲烷菌数量无显著差异(P>0.05)。
|
|
表 6 RF对体外发酵瘤胃菌群数量的影响 Table 6 Effects of RF on rumen microflora numbers in vitro fermentation |
产气量能反映瘤胃微生物对底物营养物质的发酵程度[14],与营养物质瘤胃降解率呈正相关[7]。发酵48 h累积产气量、慢速发酵部分产气量和潜在产气量的提高与TVFA浓度提高的结果相一致,归因于总细菌、总真菌和总原虫数量的提高,表明补充RF可以促进瘤胃微生物的生长,从而进一步提高饲料的营养物质在瘤胃中的降解。Wu等[5]研究发现,公牛饲粮中添加RF提高了干物质和有机物瘤胃降解率。甲烷生成量主要受饲粮组成、瘤胃发酵类型和微生物区系等因素的影响[15]。本试验中,添加RF对产总产甲烷菌数量无显著影响,这应该是造成甲烷产量无显著变化的原因。但是,添加RF后,甲烷产量和总产甲烷菌数量的变化结果与瘤胃总原虫数量增加的结果不一致。瘤胃原虫能为甲烷菌的生长提供栖息场所,且原虫发酵碳水化合物过程中产生的氢是甲烷菌产生甲烷的底物,甲烷作为甲烷菌的能源物质,能促进甲烷菌的生长[16]。本试验中,添加RF提高了丙酸产量,碳水化合物发酵生成丙酸的过程消耗氢[16],因此总原虫数量的增加没有提高甲烷产量。另外,RF对瘤胃内氧化还原反应有调控作用,RF以FAD和FMA的形式参与氢的传递和电子的转移[1]。
瘤胃pH与TVFA浓度呈负相关,是反映瘤胃内环境的重要指标,pH小于6.2将抑制纤维的降解和微生物的代谢[17]。添加RF降低了瘤胃液pH,归因于添加RF后TVFA浓度的提高,但pH在6.45~6.48,对瘤胃菌群的生长发育和饲料营养物质的降解不会产生负面影响。瘤胃TVFA浓度的增加与总细菌、总真菌和总原虫数量增加促进瘤胃发酵有关。本试验结果表明,瘤胃微生物所需的RF需要外源补充,与Wu等[5]的试验结果相一致。在瘤胃微生物氧化还原反应代谢过程中,FAD将碳水化合物发酵过程中产生的氢离子传递给NAD,生成NADH[18]。前人研究发现,白色瘤胃球菌的生长和纤维的降解需要外源补充RF,且添加RF可以促进瘤胃原虫的生长[3-4]。瘤胃中的乙酸和丙酸分别来源于微生物对饲料中纤维物质和营养性碳水化合物的降解[19]。添加RF提高了瘤胃乙酸浓度,与总真菌、总原虫及主要纤维分解菌(黄色瘤胃球菌、白色瘤胃球菌、产琥珀酸丝状杆菌和溶纤维丁酸弧菌)数量提高的结果相一致,表明RF促进了饲粮中纤维物质在瘤胃的降解。Wu等[5]试验发现,公牛饲粮中添加RF提高了中性洗涤纤维瘤胃降解率。纤维分解细菌、厌氧真菌和原虫通过分泌外纤维分解酶将饲料中的纤维物质降解为乙酸,其中真菌产生的纤维酶活性最高,菌丝能穿透植物的细胞壁;而原虫数量最多,大概占到微生物总量的50%,能够降解约33%的纤维[20-21]。添加RF提高了瘤胃丙酸浓度,归因于嗜淀粉瘤胃杆菌、溶纤维丁酸弧菌和栖瘤胃普雷沃氏菌数量的增加以及α-淀粉酶活性的升高。这3种菌是瘤胃中主要的淀粉分解菌,通过分泌α-淀粉酶将饲粮中淀粉降解为丙酸[20-21]。添加RF高了瘤胃乙酸和丙酸浓度,但是降低了乙酸/丙酸,表明瘤胃发酵类型转变,产生了更多的丙酸。Wu等[5]研究发现,添加RF后公牛瘤胃发酵类型向乙酸发酵型转变。试验结果的不同可能与试验方法(体外和体内)的不同有关,因为体内试验存在瘤胃壁对VFA的吸收,而且瘤胃壁对丙酸的吸收速率大于乙酸[16]。瘤胃中戊酸、异丁酸和异戊酸主要由支链氨基酸在瘤胃中被微生物降解产生,同时也是大多数纤维分解菌生长发育的必需营养因子[12]。添加RF后,戊酸和异戊酸浓度的增加与蛋白酶活性升高和主要蛋白分解菌(溶纤维丁酸弧菌、栖瘤胃普雷沃氏菌和嗜淀粉链球菌)数量的增加有关,同时也是纤维分解菌数量增加的原因之一。前期研究发现,饲粮中添加异戊酸提高了肉牛瘤胃纤维分解菌数量[22]。
瘤胃氨态氮是饲粮中蛋白质的降解情况与MCP合成情况的综合反映,氨态氮是合成MCP的重要原料[16]。本试验中,氨态氮浓度随着RF添加水平的增加而增加,但各组之间MCP浓度没有显著差异,一定程度说明了添加RF提高了饲粮中蛋白质在瘤胃内的消化率,这与发酵液中蛋白酶活性的增加同时蛋白质分解菌数量的增加一致,表明添加RF可促进瘤胃某些蛋白质分解菌的生长,提高蛋白质分解酶活性。另外,氨态氮浓度的提高与原虫数量的增加有关,原虫吞噬细菌获得氮源的过程中,将细菌蛋白质降解为氨,并释放到瘤胃液中[16]。一定程度上可防止细菌过快发酵碳水化合物生成乳酸以及pH的大幅降低;同时原虫的脱氨基作用可释放大量氨产生降解氮,供其他微生物利用合成MCP[23]。此外,本试验中,75 mg/kg RF组48 h累积产气量以及TVFA、乙酸浓度等显著降低,说明RF超过一定添加水平时会对瘤胃发酵产生负面影响,其原因可能是由于RF的细菌合成和降解之间存在平衡,过多的RF不能被利用,被瘤胃细菌降解产生羟乙基黄素(HEF)和甲酰甲基黄素(FMF)等代谢物[24],这些代谢物可能对瘤胃菌群及酶活性产生一定的抑制作用,但其具体作用及影响机制还有待研究。
4 结论添加RF可以促进绵羊体外发酵,提高48 h产气量及TVFA、乙酸和丙酸浓度,增加总细菌、总真菌和总原虫数量。在本试验条件下,RF添加水平为30 mg/kg时体外发酵效果较好。
| [1] |
POWERS H J. Riboflavin (vitamin B-2) and health[J]. The American Journal of Clinical Nutrition, 2003, 77(6): 1352-1360. DOI:10.1093/ajcn/77.6.1352 |
| [2] |
赵芸君, 桑断疾, 蒋亚军, 等. 反刍动物核黄素营养研究进展[J]. 中国畜牧兽医, 2010, 37(10): 5-10. ZHAO Y J, SANG D J, JIANG Y J, et al. Advances in riboflavin nutrition for ruminant[J]. China Animal Husbandry & Veterinary Medicine, 2010, 37(10): 5-10 (in Chinese). |
| [3] |
HUNGATE R E. The rumen and its microbes[M]. New York: Academic Press, 1966.
|
| [4] |
BRYANT M P, ROBINSON I M. Some nutritional requirements of the genus ruminococcus[J]. Applied Microbiology, 1961, 9(2): 91-95. DOI:10.1128/am.9.2.91-95.1961 |
| [5] |
WU H M, ZHANG J, WANG C, et al. Effects of riboflavin supplementation on performance, nutrient digestion, rumen microbiota composition and activities of Holstein bulls[J]. British Journal of Nutrition, 2021, 126(9): 1288-1295. DOI:10.1017/S0007114520005243 |
| [6] |
N RC. Nutrient requirements of small ruminants: sheep, goats, cervids, and new world camelids[M]. Washington, D.C.: The National Academies Press, 2007.
|
| [7] |
MENKE H K, RAAB L, SALEWSKI A, et al. The estimation of the digestibility and metabolizable energy content of ruminant feedingstuffs from the gas production when they are incubated with rumen liquor in vitro[J]. The Journal of Agricultural Science, 1979, 93(1): 217-222. DOI:10.1017/S0021859600086305 |
| [8] |
WU H, MENG Q X, YU Z T. Evaluation of ferric oxide and ferric citrate for their effects on fermentation, production of sulfide and methane, and abundance of select microbial populations using in vitro rumen cultures[J]. Bioresource Technology, 2016, 211: 603-609. DOI:10.1016/j.biortech.2016.03.126 |
| [9] |
WANG C, LIU Q, GUO G, et al. Effects of rumen-protected folic acid on ruminal fermentation, microbial enzyme activity, cellulolytic bacteria and urinary excretion of purine derivatives in growing beef steers[J]. Animal Feed Science and Technology, 2016, 221(Part A): 185-194. |
| [10] |
白齐昌, 郝小燕, 项斌伟, 等. 沙棘黄酮对绵羊体外产气量、瘤胃发酵参数和微生物菌群的影响[J]. 动物营养学报, 2020, 32(3): 1405-1414. BAI Q C, HAO X Y, XIANG B W, et al. Effects of sea buckthorn flavone on gas production, rumen fermentation parameters and microflora population of sheep in vitro[J]. Chinese Journal of Animal Nutrition, 2020, 32(3): 1405-1414 (in Chinese). |
| [11] |
AGARWAL N, KAMRA D N, CHAUDHARY L C, et al. Microbial status and rumen enzyme profile of crossbred calves fed on different microbial feed additives[J]. Letters in Applied Microbiology, 2002, 34(5): 329-336. DOI:10.1046/j.1472-765X.2002.01092.x |
| [12] |
刘永嘉, 王聪, 刘强, 等. 日粮补充异丁酸对犊牛生长性能、瘤胃发酵和纤维分解菌菌群的影响[J]. 草业学报, 2019, 28(7): 151-158. LIU Y J, WANG C, LIU Q, et al. Effects of isobutyrate supplementation on growth performance, ruminal fermentation and cellulolytic bacterial abundance in calves[J]. Acta Prataculturae Sinica, 2019, 28(7): 151-158 (in Chinese). |
| [13] |
ØRSKOV E R, MCDONALD I. The estimation of protein degradability in the rumen from incubation measurements weighted according to rate of passage[J]. The Journal of Agricultural Science, 1979, 92(2): 499-503. DOI:10.1017/S0021859600063048 |
| [14] |
张静, 尚昕堃, 陈雷, 等. 叶酸浓度对肉牛瘤胃体外发酵和养分消化率的影响[J]. 山西农业大学学报(自然科学版), 2021, 41(1): 75-80. ZHANG J, SHANG X K, CHEN L, et al. Effects of folic acid concentration on in vitro fermentation and nutrient digestibility of beef cattle rumen[J]. Journal of Shanxi Agricultural University(Natural Science Edition), 2021, 41(1): 75-80 (in Chinese). |
| [15] |
郑玮才, 郝小燕, 张宏祥, 等. 饲粮添加酿酒酵母和地衣芽孢杆菌对绵羊生长性能与瘤胃发酵的影响[J]. 中国农业科学, 2020, 53(16): 3385-3393. ZHENG W C, HAO X Y, ZHANG H X, et al. Effects of Saccharomyces cerevisiae and Bacillus licheniformis on growth performance and rumen fermentation in sheep[J]. Scientia Agricultura Sinica, 2020, 53(16): 3385-3393 (in Chinese). DOI:10.3864/j.issn.0578-1752.2020.16.015 |
| [16] |
冯仰廉. 反刍动物营养学[M]. 北京: 科学出版社, 2004. FENG Y L. Ruminant nutrition[M]. Beijing: Science Press, 2004 (in Chinese). |
| [17] |
牟春堂, 郝小燕, 刘笑梅, 等. 葡多酚对绵羊瘤胃体外发酵参数及微生物区系的影响[J]. 动物营养学报, 2020, 32(1): 302-309. MU C T, HAO X Y, LIU X M, et al. Effects of grape polyphenols on in vitro rumen fermentation parameters and microflora of sheep[J]. Chinese Journal of Animal Nutrition, 2020, 32(1): 302-309 (in Chinese). |
| [18] |
SEPÚLVEDA CISTERNAS I, SALAZAR J C, GARCÍA-ANGULO V A. Overview on the bacterial iron-riboflavin metabolic axis[J]. Frontiers in Microbiology, 2018, 9: 1478. |
| [19] |
FLINT H J. The rumen microbial ecosystem-some recent developments[J]. Trends in Microbiology, 1997, 5(12): 483-488. |
| [20] |
SCHWEIKERT M, FUJISHIMA M, GÖRTZ H D. Symbiotic associations between ciliates and prokaryotes[M]//ROSENBERG E, DELONG E F, LORY S, et al. The Prokaryotes. Berlin: Springer, 2013: 427-463.
|
| [21] |
AKIN D E, BORNEMAN W S. Role of rumen fungi in fiber degradation[J]. Journal of Dairy Science, 1990, 73(10): 3023-3032. |
| [22] |
LIU Q, WANG C, PEI C X, et al. Effects of isovalerate supplementation on microbial status and rumen enzyme profile in steers fed on corn stover based diet[J]. Livestock Science, 2014, 161: 60-68. |
| [23] |
WILLIAMS A G. Rumen holotrich ciliate protozoa[J]. Microbiological Reviews, 1986, 50(1): 25-49. |
| [24] |
WEST D W, OWEN E C. Degradation of riboflavin by alimentary bacteria of the ruminant and man: production of 7, 8-dimethyl-10-carboxymethylisoalloxazine[J]. British Journal of Nutrition, 1973, 29(1): 33-41. |




