2. 西南大学动物科学技术学院, 重庆 402460;
3. 广西扬翔股份有限公司, 贵港 537100
2. College of Animal Science and Technology, Southwest University, Chongqing 402460, China;
3. Guangxi Yangxiang Co., Ltd., Guigang 537100, China
粗饲料是反刍动物饲粮最重要的组成成分,提高粗饲料的利用率对提高反刍动物生产性能、降低饲料成本具有重要意义。粗饲料在瘤胃被降解的首要条件是与微生物或酶进行接触,反刍动物瘤胃粗饲料主要依靠瘤胃固相微生物降解。瘤胃微生物可在底物表面形成微生物膜,因此,底物表面的微生物酶与瘤胃液中的酶相比活性更高且不易被瘤胃液稀释。研究表明,植物细胞壁结构性多糖降解酶在瘤胃内容物3部分(瘤胃液相降解酶∶固相易被洗下降解酶∶固相不易被洗下降解酶)中的比活力为1.0 ∶ 2.0 ∶ 4.6[1]。这意味着在固相食糜表面不易洗下的酶越多,则饲料纤维的降解率越高。瘤胃微生物对饲粮降解利用不仅与饲粮化学组成(即营养成分)有关,而且与饲粮颗粒的物理化学特性有关,如单位质量饲粮颗粒的表面积[即比表面积(specific surface area,SSA)]越大,意味着可供微生物附着的可降解位点也越多。高巍[2]研究发现,纤维降解菌的黏附数量和木聚糖酶活性随饲粮表面积增加而增加。刘勇等[3]研究发现,提高稻草中性洗涤纤维比表面积可有效提高稻草纤维物质消失率。Weimer等[4]认为,纤维素降解速率随纤维素比表面积增加而升高。减小粗饲料颗粒会增加其比表面积,从而增加纤维分解菌及酶的作用面积,促进纤维物质的降解[5]。但底物比表面积增加或减少后,黏附在底物表面的微生物种类与组成会发生什么变化目前并不清楚。因此,本研究旨在探索玉米秸秆比表面积变化对其营养物质降解和瘤胃微生物在玉米秸秆表面黏附特性的影响,初步揭示底物比表面积影响底物降解特性的机理。
1 材料与方法 1.1 试验材料试验所选材料为秋收去除玉米籽实后的秸秆。玉米秸秆带回实验室后切成2~4 cm长,65 ℃烘干后粉碎并测定其营养物质含量,以干物质(DM)为基础,玉米秸秆粗蛋白质(CP)含量为6.29%,中性洗涤纤维(NDF)含量为67.5%,酸性洗涤纤维(ADF)含量为41.4%。粉碎后的玉米秸秆过60目筛,分别取60目上和60目下的玉米秸秆采用比表面仪(Quadrasorb SI,美国康塔仪器公司)测定其比表面积,60目上和60目下的玉米秸秆比表面积分别为0.664和1.135 m2/g。
1.2 尼龙袋试验与样品采集选用3头成年去势、体况良好并装有永久性瘤胃瘘管的浏阳黑山羊[体重(20.00±2.20) kg]作为试验动物。试验动物基础饲粮由玉米秸秆和精料补充料组成,精粗比为40 ∶ 60,每天饲喂精料200 g,粗料300 g,自由饮水。
分别准确称取3 g(精确到0.000 1 g)2种比表面积的玉米秸秆,装入尼龙袋中(孔径35 μm,规格6 cm×12 cm),每头羊每个时间点作2个平行。将尼龙袋绑在塑料管上,一次性将全部尼龙袋投入瘤胃中,分别于0、6、12、24、36、48、72 h取出尼龙袋,用清水冲掉表面的瘤胃食糜,再用洗衣机洗涤8 min;将冲洗干净的尼龙袋于65 ℃烘干48 h,取出称重,装入样品袋常温保存,用以测定营养物质瘤胃降解率。以相同的试验材料与瘘管羊再开展1次尼龙袋试验,分别于0、1、4、8、12、24、48 h取出尼龙袋,用以采集瘤胃固相紧密黏附微生物样品。参照Chen等[6]的方法收集瘤胃固相食糜。尼龙袋取出后迅速置于装有4 ℃生理盐水并灭菌的500 mL三角瓶中。摇床振荡2 min,转数200 r/min,倒出浑浊的生理盐水,再加入4 ℃生理盐水,继续振荡,直至加入的生理盐水振荡后仍然清澈为止。取出尼龙袋,并去除多余液体,切记不要用力搓揉。打开尼龙袋,用灭菌称量勺将剩余食糜转移至50 mL无菌无酶离心管中,液氮速冻,-80 ℃保存。参照王加启[7]的方法洗脱瘤胃固相微生物。取2 g固相食糜,加入20 mL 15%的吐温80,0 ℃振荡2.5 h,取出后静置5 min,取上清2 mL用于分析瘤胃固相紧密黏附微生物数量。
1.3 样品测定 1.3.1 常规营养物质含量的测定按照张丽英[8]的方法测定DM、CP含量;按Hall等[9]方法使用Fi-bretherm FT12全自动纤维仪(Gerhardt Analytical Systems,德国)测定NDF和ADF含量。
1.3.2 瘤胃微生物荧光定量分析参照Yu等[10]的方法提取DNA,引物序列如表 1所示。参照焦金真等[15]的方法进行质粒构建与标准曲线制作,之后进行荧光定量分析。反应体系:SYBR Green Ⅰ荧光染料预混试剂5 μL,ROX 0.2 μL,上、下游引物(10 μmol/L)各0.2 μL,质粒DNA模板或样品DNA模板1 μL(DNA模板浓度稀释到10 ng/L左右),牛血清白蛋白0.05 μL和灭菌双蒸去离子水3.35 μL。反应条件:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火和延伸30 s并采集荧光信号,共40个循环。按仪器操作说明选择熔解曲线分析,60 ℃升至95 ℃ 15 s,60 ℃ 15 s,95 ℃ 15 s,自动采集荧光。
|
|
表 1 实时荧光定量PCR引物序列 Table 1 Primer sequences for RT-qPCR |
16S rDNA扩增选择区域为V3~V4区,使用通用引物,并在通用引物的5’端加上适合MiSeq PE300测序的index序列和接头序列,完成特异性融合引物的设计。正向引物(5′—3′):CTACGGGNGGCWGCAG(F)和反向引物(5′—3′):GACTACHVGGGTWTCTAAT(R)。以稀释后的基因组DNA为模板,使用诺唯赞的Taq DNA Polymerase进行PCR,确保扩增的准确性和高效性。利用Fragment Analyzer进行PCR产物文库质检。文库质检合格后,根据每个样品的数据量要求进行相应比例的混合。使用QIAquick胶回收试剂盒(QIAGEN,美国),对混合后文库进行切胶纯化(切胶范围:500~750 bp)。利用Fragment Analyzer和Applied Biosystems QuantStudio 6实时荧光定量PCR仪器进行文库质检及定量。使用Illumina MiSeq PE300进行上机测序。
去除测序结果reads中N碱基比例大于10%的序列和低质量序列,用Flash1.2.11[16]进行reads拼接,采用Qime 1.9.1进行tags质控过滤,再与Glod database(r20110519)数据库对比(UCHIME algorithm)去嵌合体处理,根据barcode确定对应样品,去除barcode和引物序列。利用Mothurv 1.39.1软件去冗余处理(https://www.mothur.org/),计算tags丰度。按照相似度大于97%用Uparse(usearch v9.2.645)[17]将序列聚类为操作分类单元(operational taxonomic unit, OTU),使用RDP方法将该代表序列与已知物种的16S数据进行比对,从而对每个OTU进行物种归类。
1.4 数据计算根据尼龙袋试验测定的营养物质含量结果,玉米秸秆各营养物质在瘤胃内不同时间点的降解率(P)计算公式如下:

|
采用Orskov方程进行拟合:
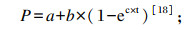
|
各营养物质有效降解率(effective degradability,ED)计算公式如下:
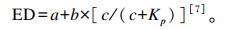
|
式中:a为当t=0时的截距,为快速降解部分(%);b为慢速降解部分(%);c为慢速降解部分的降解速率常数(%/h);t为瘤胃发酵时间(h);Kp为瘤胃食糜的外流速度,在本研究中取值为Kp=0.036%/h。
1.5 统计分析采用NLREG(V5.4)软件计算玉米秸秆营养物质降解参数,采用SPSS 19.0一般线性模型进行统计分析。对于尼龙袋降解动力学参数数据,统计模型中比表面积为固定效应,动物为随机因子。对于微生物数据,统计模型中包括比表面积、发酵时间以及二者的交互作用,其中发酵时间作为重复测量因素,结果以平均值和均值标准误(SEM)表示,P < 0.05表示差异显著,P < 0.01表示差异极显著。
2 结果与分析 2.1 玉米秸秆瘤胃降解模型参数由表 2可知,2种比表面玉米积秸秆间DM和NDF的慢速降解部分及降解速率常数,以及CP的降解动力学各参数均无显著差异(P>0.05)。比表面积高的玉米秸秆DM和NDF的快速降解部分比低比表面积玉米秸秆极显著提高(P < 0.01),提高玉米秸秆比表面积时,DM和NDF的有效降解率极显著提高(P < 0.01)。
|
|
表 2 比表面积对玉米秸秆营养物质瘤胃降解模型参数的影响 Table 2 Effects of specific surface area on parameters of nutrient rumen degradation model of corn straw |
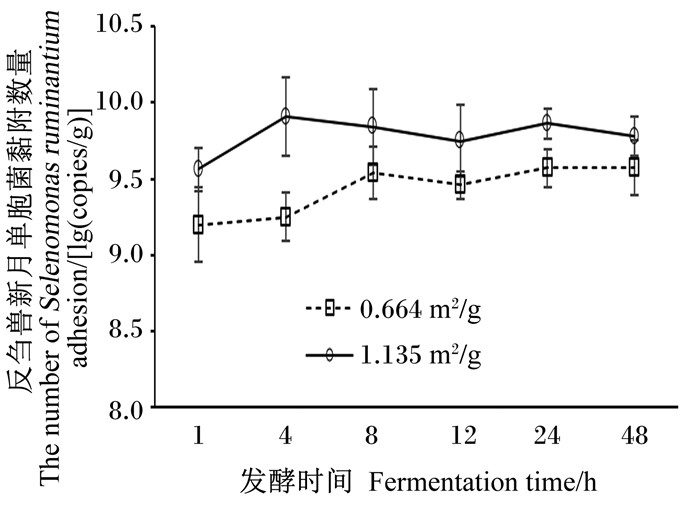
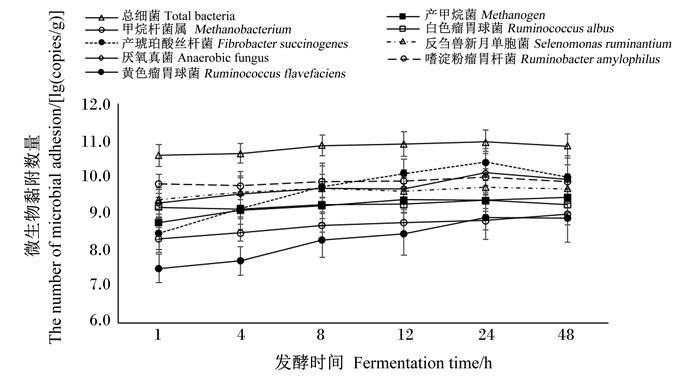
由表 3可知,2种比表面积玉米秸秆间表面黏附的总细菌、产甲烷菌、厌氧真菌及黄色瘤胃球菌的黏附数量无显著差异(P>0.05)。增加玉米秸秆比表面积极显著提高白色瘤胃球菌、反刍兽新月单胞菌及嗜淀粉瘤胃杆菌的黏附数量(P < 0.01),但显著降低产琥珀酸丝杆菌的黏附数量(P < 0.05);玉米秸秆比表面积和发酵时间对反刍兽新月单胞菌的黏附数量有极显著交互作用(P < 0.01)。由图 1可知,发酵8 h之前,反刍兽新月单胞菌在比表面积较小的玉米秸秆表面的黏附数量一直处于增加状态,而在比表面积较高的玉米秸秆表面的黏附数量在发酵4 h时达到最高,然后开始降低;发酵时间对微生物黏附数量均有极显著影响(P < 0.01)。由图 2可知,发酵48 h内,总细菌、产甲烷菌、厌氧真菌、白色瘤胃球菌、黄色瘤胃球菌、产琥珀酸丝杆菌及嗜淀粉瘤胃杆菌在玉米秸秆表面黏附数量都随发酵时间的延长而增加,在24 h时黏附细菌数量达到最高。
|
|
表 3 玉米秸秆比表面积对微生物黏附数量的影响 Table 3 Effects of specific surface area of corn straw on the number of microbial adhesion |
|
图 1 玉米秸秆比表面积及发酵时间对反刍兽新月单胞菌黏附数量的影响 Fig. 1 Effects of specific surface area of corn straw and fermentation time on the number of Selenomonas ruminantium adhesion |
|
图 2 发酵时间对微生物黏附数量的影响 Fig. 2 Effects of fermentation time on the number of microbial adhesion |
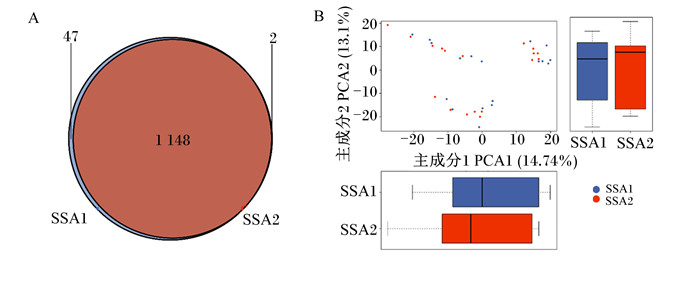
由图 3可知,比表面积较低(SSA1)的玉米秸秆与和比表面积较高(SSA2)的玉米秸秆共有OTU数1 148个,较低比表面积玉米秸秆1 195个,较高比表面积玉米秸秆1 150个(图 3-A)。主成分分析(PCA)发现,较低比表面积玉米秸秆与较高比表面积玉米秸秆间表面黏附的瘤胃细菌数量无明显差异(图 3-B)。
|
SSA1:比表面积为0.664 m2/g;SSA2:比表面积为1.135 m2/g。 SSA1: specific surface area was 0.664 m2/g; SSA2: specific surface area was1.135 m2/g. 图 3 不同比表面积玉米秸秆表面黏附细菌OTU韦恩图(A)及基于OTU丰度的主成分分析图(B) Fig. 3 Venn diagram of OTU (A)and PCA (B) based on OTU abundance of microbial adhesion to surface of corn straw with different specific surface areas |
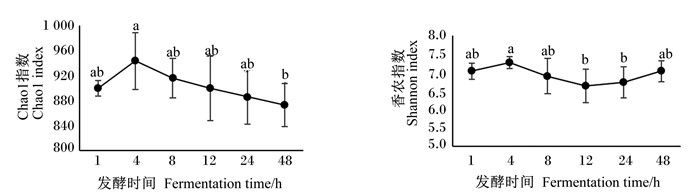
由表 4可知,提高玉米秸秆比表面积显著降低玉米秸秆表面微生物的Chao1指数(P < 0.05),但对香农指数和辛普森指数无显著影响(P>0.05);发酵时间对Chao1指数和香农指数有显著影响(P < 0.05)。由图 4可知,发酵48 h内,Chao1指数在发酵4 h时达到最高,随后开始下降。随发酵时间延长,香农指数在发酵4 h达到最高,随后下降,并在12 h达到最低,随后又开始上升。
|
|
表 4 玉米秸秆比表面积对微生物alpha多样性的影响 Table 4 Effects of specific surface area on microbial alpha diversity of corn straw |
|
不同字母表示差异显著(P < 0.05)。 Different letters mean significant difference (P < 0.05)。 图 4 不同发酵时间对微生物Chao1指数和香农指数的影响 Fig. 4 Effects of different fermentation time on Chao1 index and Shannon index of microorganisms |
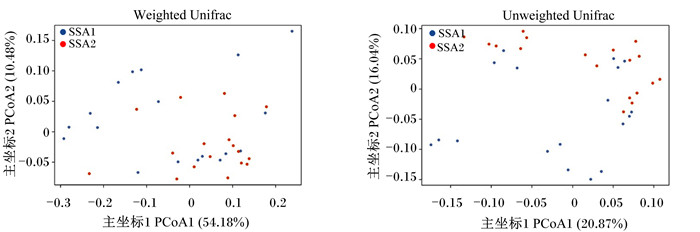
由图 5可知,对于玉米秸秆表面黏附微生物的β多样性,主坐标分析(PCoA)结果表明,2种比表面积间无明显差异。
|
图 5 玉米秸秆不同比表面积底物表面细菌菌群主坐标分析 Fig. 5 PCoA of bacterial flora on surface of substrates with different specific surface areas of corn straw |
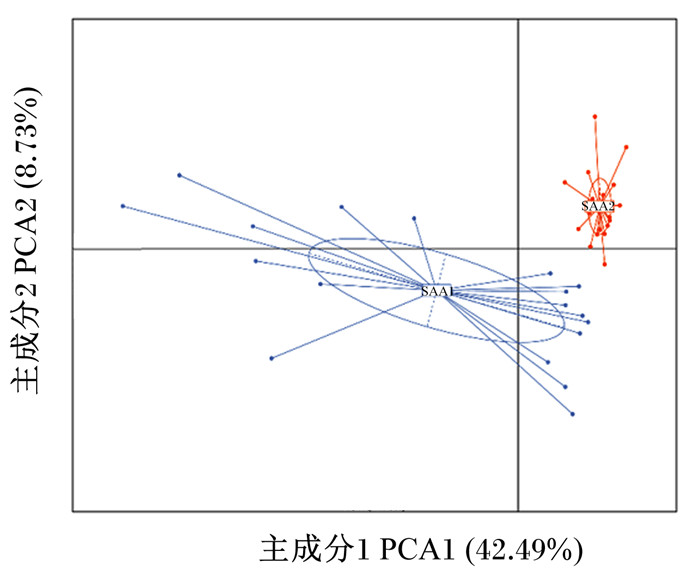
由图 6可知,微生物属水平PCA表明,2种比表面积玉米秸秆属水平微生物组成存在明显差异。
|
图 6 不同比表面积秸秆表面属水平微生物主成分分析 Fig. 6 PCA of genus-level microorganisms on surface of corn straw with different specific surface areas |
由表 5可知,提高玉米秸秆比表面积可显著或极显著提高解琥珀酸弧菌属(P < 0.01)、链球菌属(P < 0.05)相对丰度,显著或极显著降低纤维杆菌属(P < 0.01)、密螺旋体属(P < 0.01)、产乙酸糖发酵菌属(P < 0.05)和瘤胃杆菌属(P < 0.01)的相对丰度。发酵时间对依赖杆菌属(P < 0.01)、解琥珀酸弧菌属(P < 0.01)、瘤胃杆菌属(P < 0.05)、普雷沃氏菌属(P < 0.05)、密螺旋体属(P < 0.01)、瘤胃球菌属(P < 0.01)、产乙酸糖发酵菌属(P < 0.01)以及其他菌属(P < 0.01)的相对丰度有显著或极显著影响。玉米秸秆比表面积及发酵时间对普雷沃氏菌属、解琥珀酸弧菌属、密螺旋体属、产乙酸糖发酵菌属及其他菌属的相对丰度有显著的互作影响(P < 0.05)。
|
|
表 5 玉米秸秆比表面积对属水平微生物相对丰度的影响 Table 5 Effects of specific surface area of corn straw on relative abundance of genus-level microorganisms |
粗饲料在反刍动物咀嚼和反刍过程中进行物理破碎,同时食糜在瘤胃中经微生物发酵以提高其消化率。研究表明,在以狗牙根为唯一干草源时,其瘤胃上层中42%左右的饲粮颗粒大小在0.125~1.000 mm,10%左右的饲粮颗粒大小在0.125 mm以下,颗粒大小在1.000~4.000 mm的占24%左右[19]。基于此,本研究将饲粮颗粒分别设为60目以上(>0.25 mm)和60目以下(< 0.25 mm)。底物颗粒越小,其比表面积越大,同时其表面吸附能力越强,黏附位点与酶解位点越多,越有利于瘤胃微生物对营养物质的降解[3]。刘勇等[3]研究发现,提高稻草NDF的比表面积可有效提高稻草纤维物质的降解率。Weimer等[4]认为,纤维素降解速率随比表面积增加而增加。
本研究发现,增加玉米秸秆的比表面积可以提高玉米秸秆DM、NDF、CP的瘤胃降解率。微生物对底物的降解,其本质还是微生物酶的降解。高巍[2]研究发现,增加植物饲料比表面积,可提高纤维降解菌的黏附数量与木聚糖酶的活性。Miron等[5]认为,降低饲粮颗粒大小,可增加其比表面积,饲粮颗粒表面供纤维分解菌及酶作用的有效面积也越大,有利于微生物对营养物质的降解。当瘤胃中降解细胞壁的微生物达到一定数量时,饲粮的消化过程就主要受饲粮颗粒表面可供微生物定植和侵袭面积的限制[20]。由此可见,增加玉米秸秆比表面积对其瘤胃降解性能的促进作用,可能与微生物的黏附和酶解位点增加有关。本研究发现,增加玉米秸秆的比表面积可增加白色瘤胃球菌、反刍兽新月单胞菌、嗜淀粉瘤胃杆菌的黏附数量。Miron等[5]认为,粗饲料颗粒越小,其比表面积就越大,粗饲料颗粒表面供纤维分解菌及酶作用的有效面积也越大,进而更有利于纤维物质的降解。白色瘤胃球菌、反刍兽新月单胞菌、嗜淀粉瘤胃杆菌等细菌是瘤胃降解粗饲料的主要细菌,其黏附数量的增加是提高粗饲料营养物质瘤胃降解率的重要原因。玉米秸秆表面黏附微生物的数量与种类随时间的变化规律是其黏附、增殖、竞争营养与空间的综合表现[1]。本研究发现,瘤胃总细菌、产甲烷菌、厌氧真菌、白色瘤胃球菌、黄色瘤胃球菌、产琥珀酸丝杆菌及嗜淀粉瘤胃杆菌在玉米秸秆表面黏附数量都随发酵时间的延长而增加,在24 h时黏附细菌数量达到最高。吴小燕等[21]以安装永久瘤胃瘘管的宣汉黄牛为试验动物,研究瘤胃微生物对不同类型底物的黏附规律,结果发现,瘤胃微生物在不同原料表面的黏附数量与黏附速度差异较大。这可能与不同底物表面的黏附位点类型、数量以及降解速度不同有关。研究表明,在相同粉碎粒度下,不同种秸秆或牧草其比表面积存在显著差异[22-23],说明其供微生物黏附的位点数量也存在差异。瘤胃细菌的多样性和丰度是影响瘤胃功能的关键因素。本研究发现,比表面积和发酵时间对普雷沃氏菌属、解琥珀酸弧菌属、密螺旋体属、产乙酸糖发酵菌属相对丰度存在相互作用。增加底物比表面积实质是增加微生物黏附位点和降解位点,随着发酵时间的延长,不同比表面积玉米秸秆的降解速度、功能微生物在其表面的黏附时间和增殖速度不同[1],故不同微生物的相对丰度不同。
4 结论提高玉米秸秆比表面积不影响玉米秸秆表面黏附细菌的种类和总细菌数量,但会增加白色瘤胃球菌、产琥珀酸丝杆菌、反刍兽新月单胞菌、嗜淀粉瘤胃杆菌等瘤胃功能微生物的黏附数量,改变普雷沃氏菌属、解琥珀酸弧菌属、密螺旋体属、产乙酸糖发酵菌属、纤维杆菌属、瘤胃杆菌属的相对丰度,改善DM、NDF和CP的瘤胃降解率。
| [1] |
冯仰廉. 反刍动物营养学[M]. 北京: 科学出版社, 2004. FENG Y L. Ruminant nutrition[M]. Beijing: Science Press, 2004 (in Chinese). |
| [2] |
高巍. 瘤胃微生物对植物细胞壁降解的相对贡献及其附着与降解的关系研究[D]. 博士学位论文. 北京: 中国农业大学, 2004. GAO W. Relative contributions of rumen microorganisms to degradation of plant cell walls and the relationship between their adhesion and degradation[D]. Ph. D. Thesis. Beijing: China Agricultural University, 2004. (in Chinese) |
| [3] |
刘勇, 冉涛, 谭支良, 等. 表面张力和比表面积对纤维体外发酵特性的影响[J]. 畜牧兽医学报, 2013, 44(6): 901-910. LIU Y, RAN T, TAN Z L, et al. Effects of surface tension and specific surface areas on in vitro fermentation of fiber[J]. Acta Veterinaria et Zootechnica Sinica, 2013, 44(6): 901-910 (in Chinese). |
| [4] |
WEIMER P J, LOPEZ-GUISA J M, FRENCH A D, et al. Effect of cellulose fine structure on kinetics of its digestion by mixed ruminal microorganisms in vitro[J]. Applied and Environmental Microbiology, 1990, 56(8): 2421-2429. DOI:10.1128/aem.56.8.2421-2429.1990 |
| [5] |
MIRON J, BEN-GHEDALIA D, MORRISON M. Invited review: adhesion mechanisms of rumen cellulolytic bacteria[J]. Journal of Dairy Science, 2001, 84(6): 1294-1309. DOI:10.3168/jds.S0022-0302(01)70159-2 |
| [6] |
CHEN X L, WANG J K, WU Y M, et al. Effects of chemical treatments of rice straw on rumen fermentation characteristics, fibrolytic enzyme activities and populations of liquid- and solid-associated ruminal microbes in vitro[J]. Animal Feed Science and Technology, 2008, 141(1/2): 1-14. |
| [7] |
王加启. 反刍动物营养学研究方法[M]. 北京: 现代教育出版社, 2011. WANG J Q. Methods in ruminant nutrition research[M]. Beijing: Modern education press, 2011 (in Chinese). |
| [8] |
张丽英. 饲料分析及饲料质量检测技术[M]. 3版. 北京: 中国农业大学出版社, 2007. ZHANG L Y. Feed analysis and feed quality detection technology[M]. 3rd ed. Beijing: China Agricultural University Press, 2007 (in Chinese). |
| [9] |
HALL M B, PELL A N, CHASE L E. Characteristics of neutral detergent-soluble fiber fermentation by mixed ruminal microbes[J]. Animal Feed Science and Technology, 1998, 70(1/2): 23-39. |
| [10] |
YU Z T, MORRISON M. Improved extraction of PCR-quality community DNA from digesta and fecal samples[J]. BioTechniques, 2004, 36(5): 808-812. DOI:10.2144/04365ST04 |
| [11] |
DENMAN S E, MCSWEENEY C S. Development of a real-time PCR assay for monitoring anaerobic fungal and cellulolytic bacterial populations within the rumen[J]. FEMS Microbiology Ecology, 2006, 58: 572-582. DOI:10.1111/j.1574-6941.2006.00190.x |
| [12] |
CHRISTOPHERSE C T. Grain and artificial stimulation of the rumen change the abundance and diversity of methanogens and their association with ciliates[D]. Ph. D. Thesis. Perth WA: The University of Western Australia, 2007.
|
| [13] |
KOIKE S, KOBAYASHI Y. Development and use of competitive PCR Assays for the rumen cellulolytic bacteria: Fibrobacter Succinogenes, Ruminococcus albus and Ruminococcus flavefaciens[J]. FEMS Microbiology Letters, 2001, 204(2): 361-366. DOI:10.1111/j.1574-6968.2001.tb10911.x |
| [14] |
CHEN J Q, STEVENSON D M, WEIMER P J. Albusin B, a bacteriocin from the ruminal bacterium Ruminococcus albus 7 that inhibits growth of Ruminococcus flavefaciens[J]. Applied and Environmental Microbiology, 2004, 70(5): 3167-3170. DOI:10.1128/AEM.70.5.3167-3170.2004 |
| [15] |
焦金真, 王芃芃, 汤少勋, 等. 浏阳黑山羊胃肠道不同部位重要功能微生物的数量分布特征研究[J]. 畜牧兽医学报, 2013, 44(10): 1590-1599. JIAO J Z, WANG P P, TANG S X, et al. Quantity and distribution characteristics of functional microorganisms in gastrointestinal tract of Liuyang black goats[J]. Acta Veterinaria et Zootechnica Sinica, 2013, 44(10): 1590-1599 (in Chinese). DOI:10.11843/j.issn.0366-6964.2013.10.012 |
| [16] |
MAGOČ T, SALZBERG S L. FLASH: fast length adjustment of short reads to improve genome assemblies[J]. Bioinformatics, 2011, 27(21): 2957-2963. DOI:10.1093/bioinformatics/btr507 |
| [17] |
EDGAR R C, HAAS B J, CLEMENTE J C, et al. UCHIME improves sensitivity and speed of chimera detection[J]. Bioinformatics, 2011, 27(16): 2194-2200. DOI:10.1093/bioinformatics/btr381 |
| [18] |
ØRSKOV E R, MCDONALD I. The estimation of protein degradability in the rumen from incubation measurements weighted according to rate of passage[J]. Journal of Agricultural Science, 1979, 92(2): 499-503. DOI:10.1017/S0021859600063048 |
| [19] |
LUGINBUHL J M, POND K R, BURNS J C. Changes in ruminal and fecal particle weight distribution of steers fed coastal bermudagrass hay at four levels[J]. Journal of Animal Science, 1990, 68(9): 2864-2873. DOI:10.2527/1990.6892864x |
| [20] |
DEHORITY B A, TIRABASSO P A. Effect of ruminal cellulolytic bacterial concentrations on in situ digestion of forage cellulose[J]. Journal of Animal Science, 1998, 76(11): 2905-2911. DOI:10.2527/1998.76112905x |
| [21] |
吴小燕. 不同来源饲料对宣汉黄牛瘤胃固相粘附微生物数量及细菌区系的影响[D]. 硕士学位论文. 雅安: 四川农业大学, 2014. WU X Y. Effect of different source feedstuffs on the quantities of rumen microbe and bacterial community adhensive to solid fractions in Xuan-han yellow cattle[D]. Master's Thesis. Ya'an: Sichuan Agricultural University, 2014. (in Chinese) |
| [22] |
党坦, 刘志刚, 蒋红梅, 等. 粗饲料来源和颗粒大小及其纤维成分的表面特性研究[J]. 饲料广角, 2013(23): 38-41. DANG T, LIU Z G, JIANG H M, et al. Surface properties of forages and their fiber at different particle sizes[J]. Feed China, 2013(23): 38-41 (in Chinese). DOI:10.3969/j.issn.1002-8358.2013.23.013 |
| [23] |
WEIMER P J. Redundancy, resilience, and host specificity of the ruminal microbiota: implications for engineering improved ruminal fermentations[J]. Frontiers in Microbiology, 2015, 6: 296. |




