2. 黑龙江省农垦科学院畜牧兽医研究所, 哈尔滨 150038
2. Institute of Animal Husbandry and Veterinary of Heilongjiang Academy of Land Reclamation Science, Harbin 150038, China
乳腺炎是奶牛养殖过程中发病率较高的一种疾病,是造成养殖场经济损失的主要疾病之一。奶牛乳腺发生炎症后不但会造成乳腺组织的损坏减少当期产奶量,还会因使用抗生素治疗而增加原料奶的安全风险。尽管乳腺炎的发生可以由代谢、生理变化和创伤等引起,但是但目前普遍认为更常见的原因或主要原因是由致病性微生物造成的。有几种类型的微生物与乳腺炎的发生有关,主要包括细菌、真菌和酵母菌。大肠杆菌是导致奶牛乳腺炎最常见的革兰氏阴性菌病原体[1]。脂多糖(lipopolysaccharide,LPS)是革兰氏阴性菌外膜的主要成分,被认为是激发先天性免疫反应的强烈刺激因素[2]。在乳腺组织受到病原微生物感染后,乳腺组织的免疫系统被激活以消除病原体,而多种先天性免疫因子及促炎症因子参与其中并发挥重要作用。肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)和白细胞介素-6(interleukin-6, IL-6)作为促炎症因子可以刺激中性粒细胞的杀菌活性,并增加局部炎症反应[3]。当乳腺上皮细胞受到LPS的刺激后,可以大量产生TNF-α和IL-6[4-5]。白细胞介素-8(interleukin-8, IL-8)可以介导中性粒细胞募集到感染部位,并诱导中性粒细胞的杀菌作用[6]。乳铁蛋白(lactoferrin, LF)是一种由上皮细胞、巨噬细胞和中性粒细胞产生的抗菌肽,它可以抑制细菌在体内的生长并阻止细菌逃脱机体免疫系统对它们的清除[7]。而LPS的刺激可以增加乳腺上皮细胞中IL-8和LF的合成[7-8]。尽管越来越多的研究揭示了免疫因子和促炎症因子在乳腺感染过程中的变化和作用,但奶牛机体的代谢状态,比如血糖浓度,对这个过程的影响却往往被忽略。众所周知,围产期奶牛经常处于能量负平衡状态,尤其是在产后初期由于大量泌乳的需要而使得奶牛体内的葡萄糖大部分被用于乳糖合成和能量供给,致使血糖浓度处于较低水平。而产后初期也正是奶牛免疫力较低和多种传染性疾病的高发时期,其中也包括乳腺炎。一些研究表明,能量负平衡造成了奶牛的免疫抑制[9],减少了免疫细胞的数量,降低了杀灭病原菌的能力和免疫系统的敏感性[10]。有研究证实葡萄糖浓度的变化对肿瘤细胞胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)、转化生长因子-β1(transforming growth factor-beta 1, TGF-β1)的分泌和IL-6 mRNA的表达产生影响[11-13]。此外,葡萄糖也对早孕绒毛细胞滋养细胞IL-6和TNF-α的表达以及单核细胞IL-6的表达具有显著影响[14-15]。然而,葡萄糖对乳腺上皮细胞炎症相关基因表达的影响少有研究和报道。而对这方面的研究将有助于揭示能量负平衡对乳腺免疫功能的影响,对深入理解乳腺炎发病机制、降低奶牛乳腺感染风险和提高乳腺抗菌能力等方面具有理论研究和应用价值。因此,本试验将对葡萄糖对LPS刺激下的奶牛乳腺上皮细胞炎症相关基因表达的影响进行研究,以期为了解不同能量水平对乳腺上皮细胞免疫反应能力的影响提供依据。
1 材料与方法 1.1 试验动物试验中使用的乳腺组织采自哈尔滨市周边屠宰场宰杀的泌乳期奶牛。挑选现场宰杀奶牛的健康乳腺,取出乳腺中间部位的组织立即放入含有抗生素的生理盐水中,2 h内带回实验室进行处理。
1.2 主要仪器与试剂CO2细胞培养箱购自Thermo Forma公司;倒置显微镜、激光扫描共聚焦显微镜、正置荧光显微镜均购自Leica公司;PCR仪购自Eppendoff公司。
试验所使用的主要试剂及来源见表 1。
|
|
表 1 主要试剂与来源 Table 1 Main reagents and sources |
奶牛乳腺上皮细胞分离与纯化方法详见本团队以往的研究报道[16], 简要操作过程如下:取出新鲜的乳腺组织→剔除多余组织→氟康唑注射液清洗3次→含有双抗的D-Hank’s溶液清洗4次→剪碎成组织碎块→D-Hank’s溶液清洗3次→胶原酶溶液中37 ℃消化2~3 h直至组织块溶解→滤网过滤→收集滤液离心→弃上清液,加入DMEM/F12培养液吹打混匀后离心→重复前一步骤→第3次离心后弃去上清液→加入含有10胎牛血清(FBS)的DMEM/F12培养液,轻轻吹打混匀→将细胞悬液转移入培养皿,调整细胞密度→37 ℃、5% CO2条件下培养至80%铺满→利用细胞差异性贴壁技术对乳腺上皮细胞进行纯化操作。
1.4 乳腺上皮细胞的鉴定纯化后乳腺上皮细胞的鉴定详见本团队前期的文献[9]报道,简要操作步骤如下:细胞爬片培养→固定→清洗→TBST封闭→角蛋白18抗体孵育过夜→TBST清洗→二抗孵育→TBST清洗→溴化乙锭(PI)避光孵育→TBST清洗→抗荧光淬灭封片剂→共聚焦显微镜观察。
1.5 试验设计纯化后的乳腺上皮细胞在无糖的DMEM培养体系中培养1 h后弃掉培养液,根据试验设计将细胞按照如下方式进行处理:1)为了研究不同浓度葡萄糖对乳腺上皮细胞炎症相关基因表达的影响,将细胞分别用含有0.18、0.50、0.90和4.50 mg/mL葡萄糖的完全培养液[16]继续培养24 h;2)为了研究LPS对乳腺上皮细胞炎症相关基因表达的影响,将细胞分为2组——对照组和LPS组,对照组细胞分别用含有0.18、0.50、0.90和4.50 mg/mL葡萄糖的完全培养液继续培养24 h,LPS组细胞分别用含有0.18、0.50、0.90和4.50 mg/mL葡萄糖并同时添加1 μg/mL LPS的完全培养液继续培养24 h;3)为了研究不同浓度葡萄糖对LPS刺激乳腺上皮细胞炎症相关基因表达的影响,将细胞分别用含有0.18、0.50、0.90和4.50 mg/mL葡萄糖并同时添加1 μg/mL LPS的完全培养液继续培养24 h。培养结束后收取细胞提取RNA,对相关基因mRNA的相对表达量进行检测。
1.6 目的基因mRNA相对表达量的检测利用GenBank查询牛TNF-α、IL-6、LF、TGF-β1、IL-8、诱导型一氧化氮合成酶(induced nitric oxide synthase, iNOS)和β-肌动蛋白(β-actin)基因,利用Primer Premier 5.0软件设计和评价引物(表 2),利用BLAST分析引物的专一性。
|
|
表 2 引物信息 Table 2 Primer information |
按照Trizol试剂说明书提取总RNA后进行反转录,采用20 μL体系,见表 3。反应条件为37 ℃ 15 min,85 ℃ 5 s。
|
|
表 3 反转录反应体系 Table 3 Reverse transcription reaction system |
利用实时荧光定量PCR检测TNF-α、IL-6、LF、TGF-β1、IL-8和iNOS mRNA在不同处理细胞中的相对表达量。采用20 μL反应体系(表 4),95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火31 s,40个循环。每个样品重复3次,以β-actin为内参基因对目的基因表达量进行校正。因在各葡萄糖浓度的试验处理中未设置空白对照,故采用2-△△Ct计算公式进行各个基因mRNA相对表达量的计算。
|
|
表 4 实时荧光定量PCR反应体系 Table 4 Real time fluorescence quantitative PCR reaction system |
采用SPSS 23.0软件的独立样本t检验法对目的基因的mRNA相对表达量倍数变化进行差异显著性分析,采用单因素方差分析(one-way ANOVA)的Duncan氏多重比较法对目的基因的mRNA相对表达量进行差异显著性分析,P < 0.05表示差异显著,P < 0.01表示差异极显著。
2 结果与分析 2.1 奶牛乳腺上皮细胞的培养与鉴定在奶牛乳腺组织进行酶消化处理后将组织液进行培养,得到的是乳腺上皮细胞和成纤维细胞组成的混合培养体系。为了对细胞进一步纯化,本试验根据乳腺上皮细胞和成纤维细胞对胰蛋白酶敏感性的差异,对混合培养体系中的乳腺上皮细胞进行纯化。纯化后得到的乳腺上皮细胞体外培养形态呈现出典型的鹅卵石状贴壁生长状态。为了鉴定所得到的细胞是否为乳腺上皮细胞,本试验采用细胞免疫荧光染色法对纯化后的细胞进行标志性蛋白角蛋白18检测。结果(图 1)显示,培养体系中绝大部分细胞呈现绿色荧光,即角蛋白18表达阳性,说明本试验体系得到了高纯度的乳腺上皮细胞。
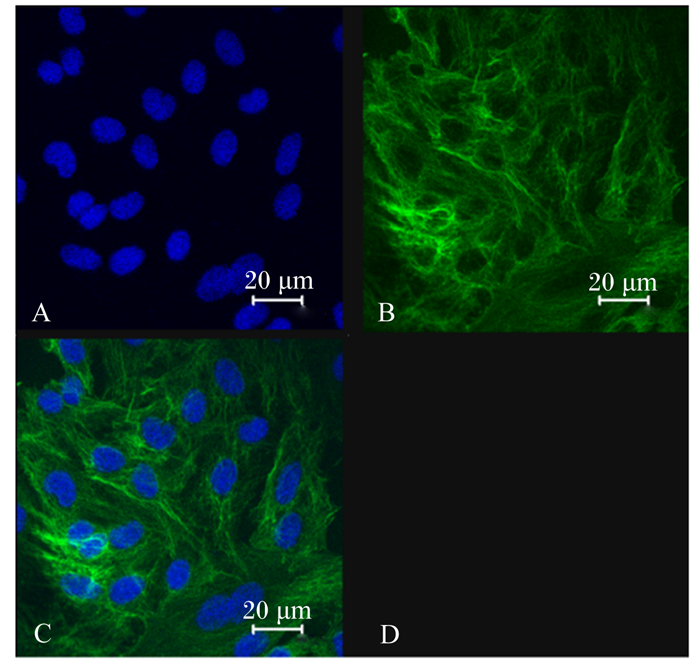
|
A:蓝色为细胞核;B:绿色为角蛋白18荧光;C:细胞核与角蛋白18荧光合成图;D:背景。 A: blue is nucleus; B: green is cytokeratin 18 fluorescence; C: merged of nucleus and cytokeratin 18 fluorescence; D: background. 图 1 乳腺上皮细胞的鉴定 Fig. 1 Identification of mammary epithelial cells |
为了研究葡萄糖对乳腺上皮细胞中IL-8、iNOS、TNF-α、LF、TGF-β1和IL-6基因表达的影响,本试验对培养在不同葡萄糖浓度(0.18、0.50、0.90和4.50 g/L)条件下的乳腺上皮细胞中上述基因的mRNA相对表达量进行了分析。结果显示,不同葡萄糖浓度并未对IL-8、iNOS和LF的mRNA相对表达量产生显著影响(P>0.05)(图 2-A、图 2-B、图 2-C);IL-6的mRNA相对表达量在前2个较低葡萄糖浓度(0.18和0.50 g/L)之间和后2个较高葡萄糖浓度(0.90和4.50 g/L)之间均未出现显著差异(P>0.05),但2个较低葡萄糖浓度条件下IL-6的mRNA相对表达量均显著高于2个较高葡萄糖浓度条件下(P < 0.05)(图 2-D)。类似这种低浓度葡萄糖提高基因表达的情况也出现在了TGF-β1和TNF-α基因的表达中。TGF-β1基因在前2个较低葡萄糖浓度(0.18和0.50 g/L)条件下的mRNA相对表达量均显著高于高葡萄糖浓度(4.50 g/L)条件下(P < 0.05),而葡萄糖浓度为0.90 g/L TGF-β1的mRNA相对表达量与其他葡萄糖浓度间均无显著差异(P>0.05)(图 2-E)。对于TNF-α基因(图 2-F),其mRNA相对表达量随着葡萄糖浓度的降低出现了波动变化,葡萄糖浓度为0.18 g/L时虽然与0.90 g/L时差异不显著(P>0.05),但却比0.50和4.50 g/L时显著升高(P < 0.05),而0.50、0.90、4.50 g/L之间差异均不显著(P>0.05)。
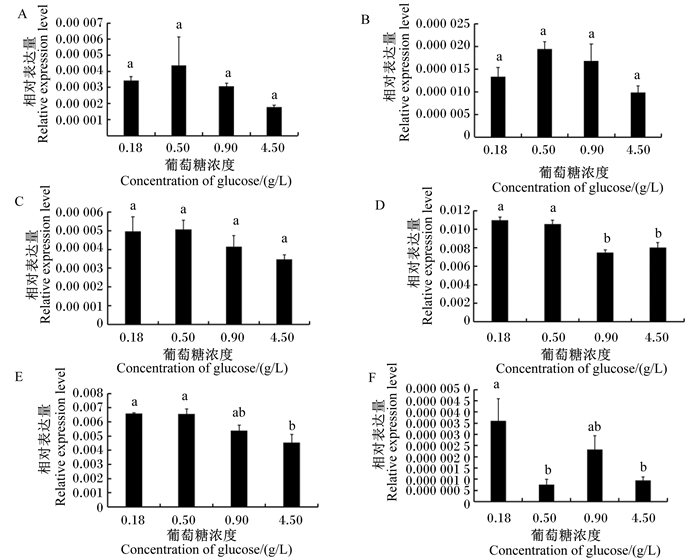
|
A~F分别为IL-8、iNOS、LF、IL-6、TGF-β1、TNF-α的mRNA相对表达量。 A to F were mRNA relative expression levels of IL-8, iNOS, LF, IL-6, TGF-β1 and TNF-α, respectively. 数据柱标注不同小写字母表示组间差异显著(P < 0.05),无字母或相同字母表示组间差异不显著(P>0.05)。图 4同。 Data columns with different small letters indicate significant difference between groups (P < 0.05), while without letter or with the same letter indicate no significant difference between groups (P < 0.05). The same as Fig. 4. 图 2 不同葡萄糖浓度下乳腺上皮细胞中IL-8、iNOS、TNF-α、LF、TGF-β1和IL-6的mRNA相对表达量 Fig. 2 mRNA relative expression levels of IL-8, iNOS, TNF-α, LF, TGF-β1 and IL-6 in mammary epithelial cells under different glucose concentrations |
为了分析LPS对乳腺上皮细胞中IL-8、iNOS、TNF-α、LF、TGF-β1和IL-6基因表达的影响,将对照组(0 μg/mL LPS)中各基因的mRNA相对表达量作为1,计算出LPS组(1 μg/mL LPS)中各基因mRNA相对表达量相对于各自对照组的倍数。结果显示,添加LPS极显著下调了TGF-β1基因在0.90和4.50 g/L葡萄糖浓度下的mRNA相对表达量(P < 0.01),而其在0.18和0.50 g/L葡萄糖浓度下的mRNA相对表达量与对照组相比虽然有所下降但是差异不显著(P>0.05)(图 3-A)。与此相比,添加LPS刺激了其余5个基因的表达,其中IL-6、TNF-α和IL-8的mRNA相对表达量在各个葡萄糖浓度下被LPS刺激后都表现出极显著上调(P < 0.01)(图 3-A、图 3-B、图 3-C);LF和iNOS的mRNA相对表达量仅在0.18和0.50 g/L葡萄糖浓度下出现极显著上调(P < 0.01),后者在4.50 g/L葡萄糖浓度下出现显著上调(P < 0.05),而LPS对二者在其他葡萄糖浓度下的mRNA相对表达量无显著影响(P>0.05)(图 2-A)。从以上结果可以发现LPS对上述基因的表达具有显著的刺激作用,而这个刺激作用的效果在一定程度上受到了葡萄糖浓度变化的影响,因此有必要进一步分析葡萄糖浓度在LPS刺激这些基因表达过程中的影响。
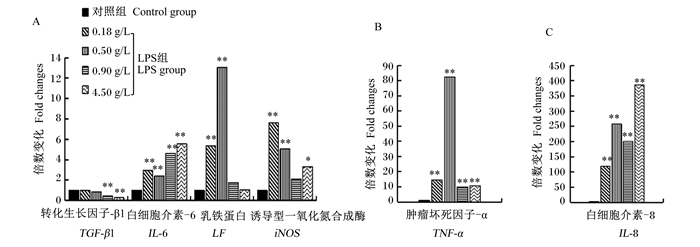
|
数据柱无标记表示与对照组差异不显著(P>0.05),标记“*”和“* *”分别表示与对照组差异显著(P < 0.05)和极显著(P < 0.01)。 Data columns without marker represents no significant difference (P>0.05) compared with control group, while with "*" and "* *" represent significant (P < 0.05) and extremely significant difference (P < 0.01) compared with control group, respectively. 图 3 LPS刺激下乳腺上皮细胞中IL-8、iNOS、TNF-α、LF、TGF-β1和IL-6的mRNA相对表达量 Fig. 3 mRNA relative expression levels of IL-8, iNOS, TNF-α, LF, TGF-β1 and IL-6 in mammary epithelial cells stimulated by LPS |
如图 4所示,在LPS(1 μg/mL)刺激下,乳腺上皮细胞中各基因的mRNA相对表达量均随着培养液中葡萄糖浓度的改变而发生了显著的变化。葡萄糖浓度的升高对经LPS刺激后IL-8和IL-6基因的表达具有提升的作用。对于IL-8基因(图 4-A),在葡萄糖浓度为0.18 g/L时mRNA相对表达量最低,在葡萄糖浓度为0.50 g/L时与0.18 g/L时相比有所提升但差异不显著(P>0.05),而在葡萄糖增浓度加至0.90 g/L时与0.18 g/L时相比显著提高(P < 0.05),但没有显著高于0.50 g/L时(P>0.05);当葡萄糖浓度提升至最高浓度4.50 g/L时,IL-8的mRNA相对表达量被进一步提高,显著高于0.18和0.50 g/L时(P < 0.05),但与0.90 g/L时差异不显著(P>0.05)。对于IL-6基因(图 4-D),其经LPS刺激后的mRNA相对表达量虽然在葡萄糖浓度从0.18 g/L提高到0.50 g/L时出现了显著下降(P < 0.05)的现象,但随着葡萄糖浓度继续增加至0.90和4.50 g/L时,其mRNA相对表达量呈现逐渐升高趋势,且后3个浓度之间差异显著(P < 0.05)。
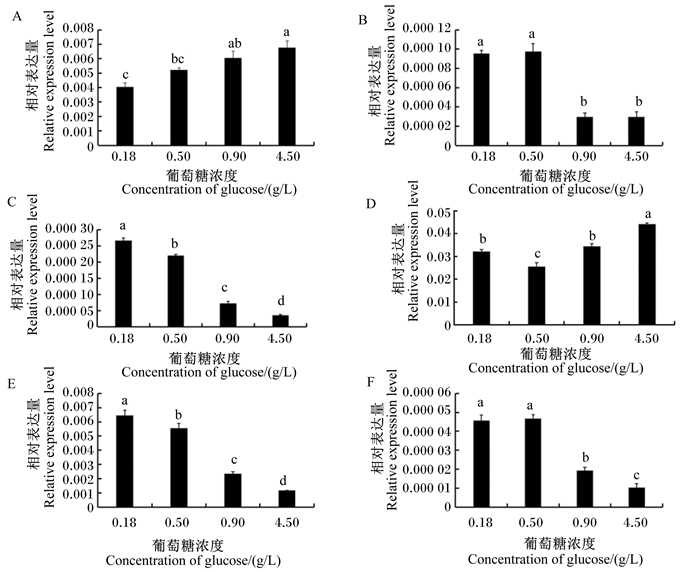
|
A~F分别为IL-8、iNOS、LF、IL-6、TGF-β1、TNF-α的mRNA相对表达量。 A to F were mRNA relative expression levels of IL-8, iNOS, LF, IL-6, TGF-β1 and TNF-α, respectively. 图 4 不同葡萄糖浓度下LPS刺激的乳腺上皮细胞中IL-8、iNOS、TNF-α、LF、TGF-β1和IL-6的mRNA相对表达量 Fig. 4 mRNA relative expression levels of IL-8, iNOS, TNF-α, LF, TGF-β1 and IL-6 in mammary epithelial cells stimulated by LPS in different glucose concentrations |
对于经LPS刺激后的iNOS、TNF-α、LF和TGF-β1基因而言,它们的表达出现了与IL-8和IL-6基因相反的变化趋势,即葡萄糖浓度的升高促使这些基因的表达下降。LF和TGF-β1的mRNA相对表达量随着葡萄糖浓度的增加而逐渐下降,并且每个浓度之间均存在显著差异(P < 0.05)(图 4-C和图 4-E)。iNOS的mRNA相对表达量虽然在前2个较低葡萄糖浓度之间差异不显著(P>0.05),但当葡萄糖浓度增加至0.90和4.50 g/L时其mRNA相对表达量均出现了显著降低(P < 0.05),而后2个较高葡萄糖浓度之间的差异不显著(P>0.05)(图 4-B)。TNF-α的mRNA相对表达量变化与iNOS相似,唯一不同的是TNF-α的mRNA相对表达量在最高浓度4.50 g/L时显著低于0.90 g/L时(P < 0.05)(图 4-F)。
3 讨论乳腺炎作为奶牛养殖过程中投入成本最高和最为流行的疾病,一直受到奶牛生产管理和科研人员的高度重视。在乳腺感染的初始阶段很多先天性免疫因子和细胞因子参与其中,对快速清除病原菌和启动免疫反应发挥了不可替代的作用。在奶牛的多个生理阶段当中,产犊后的泌乳初期是乳腺炎的高发时期,此时期的奶牛经常处于能量负平衡状态。血液中葡萄糖浓度的下降既是造成能量负平衡的原因之一,又是该时期主要的生理现象,其对泌乳初期奶牛乳腺免疫反应能力的影响及其与乳腺炎发病的关系值得研究和关注。目前已知有几种类型的微生物与乳腺炎发生有关,主要包括细菌、真菌和酵母菌。大肠杆菌是导致奶牛乳腺感染最常见的革兰氏阴性菌[1]。LPS是革兰氏阴性菌外膜的主要成分,被认为是激发先天性免疫反应的强烈刺激因素[2]。鉴于此,本文探究了不同浓度葡萄糖对LPS模拟的炎症模型中乳腺上皮细胞炎症相关基因表达的影响。
3.1 低葡萄糖浓度对乳腺上皮细胞募集中性粒细胞能力的影响有研究表明,当机体受到微生物感染时,感染部位的巨噬细胞分泌的IL-8介导中性粒细胞募集,并诱导中性粒细胞氧化爆发以消除炎症刺激并提高对细菌的清除率。当IL-8接触中性粒细胞后,使中性粒细胞形态改变并游走至反应部位并释放大量可引发局部炎症反应活性产物,以发挥杀菌的作用[6, 17]。本试验结果显示,在未受LPS刺激时,葡萄糖并未对IL-8基因的表达产生显著影响,与柴斌[18]在大鼠的肾小球系膜细胞中的试验结果相似。本研究结果还显示,当受到LPS刺激时,葡萄糖浓度的降低会减弱LPS对该基因表达的刺激作用。该研究结果表明,当奶牛处于能量负平衡期间,此时若受到细菌感染,乳腺中IL-8基因的表达将受到不利影响,可能会减弱其对中性粒细胞的募集作用。
研究表明LPS能诱导中性粒细胞产生IL-6,而IL-6是炎症起始过程中的重要细胞介质,能募集到更多的中性粒细胞,并可触发嗜中性粒细胞的杀菌作用[19]。鲍运平等[20]的研究结果显示,使用氨基葡萄糖治疗后的关节炎患者的关节液中IL-6的表达量出现了降低现象。本研究发现,IL-6基因在低葡萄糖浓度条件下有较高的表达,而经过LPS处理后在低葡萄糖浓度条件下该基因的表达出现下调趋势。由此可见,能量负平衡期间的低血糖环境不利于机体产生更多的IL-6以应对病原菌的入侵。
3.2 低葡萄糖浓度对乳腺上皮细胞免疫抑制作用的影响TNF-α被认为是一种细胞因子,主要由淋巴细胞和巨噬细胞等产生[21]。TNF-α具有多种免疫功能,除了抗菌活性和抗炎作用之外,还可以调节一些生理功能,如发热、能量代谢等活动[21]。诸多因素如细胞因子和LPS等诱导TNF-α产生后,与其他细胞因子[如白细胞介素-2(IL-2)]相结合介导免疫炎症反应,如乳房炎[22]。孙光野等[9]的研究结果也同样显示,在处于能量负平衡的奶牛血液中TNF-α的水平高于健康奶牛,并且高水平的TNF-α被认为是能量负平衡期间免疫抑制的指标之一。本研究结果显示,在未受LPS刺激时,低葡萄糖浓度时TNF-α的mRNA相对表达量高于其他浓度时;在受到LPS刺激后,TNF-α的mRNA相对表达量在各个葡萄糖浓度下均被显著升高,尤其以低葡萄糖浓度下升高的最为明显。由此可见,TNF-α的适当增加有助于淋巴细胞向感染部位聚集,实现对病原微生物的清除[9],然而在能量负平衡情况下受到病原菌感染所引起的TNF-α急剧增加可能会引发免疫抑制作用,从而降低奶牛免疫细胞的功能,增加炎症发生的几率。
转化生长因子-β(transforming growth factor-beta, TGF-β)超家族负责调节细胞生长分化,参与炎症、免疫等生理或病理过程,具有广泛的生物学活性。TGF-β超家族的成员TGF-β1是一种免疫抑制剂,在免疫反应中主要功能为阻碍T、B淋巴细胞的增殖[23]。研究发现, TGF-β1在体内也可作为炎性因子参与炎症的发生过程[24]。本研究结果显示,葡萄糖浓度降低能促进TGF-β1基因的表达,低浓度葡萄糖可以加剧LPS对奶牛乳腺上皮细胞中TGF-β1基因表达的促进作用。由此可以推测,当奶牛处于能量负平衡时,由于血糖浓度较低,有助于TGF-β1表达量的升高,容易造成机体免疫抑制,可能会增加患乳腺炎的风险。
3.3 低葡萄糖浓度对乳腺上皮细胞抗菌能力的影响iNOS在正常生理条件下几乎不表达,但在许多细胞培养研究和动物炎症模型中,其可以由LPS刺激而被快速短暂地诱导[25-27]。核因子-κB(nuclear factor-kappa B,NF-κB)是介导细胞信号传递的重要转录因子,参与炎症反应、免疫反应等多种生理过程[28]。iNOS与NF-κB特异性结合后,能产生大量一氧化氮(NO)。生理性的NO可以使NF-κB水平上升,发挥抗凋亡的作用。而高水平致病性的NO可抑制NF-κB的抗凋亡活性,损伤细胞功能。大量的NO入血后,会损伤血红蛋白对氧的运输、能量代谢等能力,促进炎症反应。在本研究中,未受LPS刺激的乳腺上皮细胞表现为葡萄糖浓度的改变不会显著影响iNOS基因在细胞内的表达。在LPS刺激下,低葡萄糖浓度条件下iNOS基因呈现较高的表达水平。由此可以推测,当奶牛处于能量负平衡状态时,适量的生理性的NO对奶牛有保护作用,但发生炎症后,iNOS的高表达产生了过量致病性的NO,这会对奶牛乳腺上皮细胞和乳腺组织造成不利影响。
LF是一种由上皮细胞、巨噬细胞和中性粒细胞产生的抗菌肽,LF受体与LPS结合可以发挥免疫调节作用。LF通过与游离铁离子结合,从而阻止利用这些离子作为代谢辅助因子的细菌生长[29],同时,LF能抑制多种细菌入侵宿主,以避免致病菌通过侵入细胞内逃避宿主免疫系统对它们的清除[7]。本研究结果表明,在未加入LPS的对照组中,葡萄糖浓度的变化不会影响LF的表达。但在加入LPS后,低葡萄糖浓度能增强LPS对LF基因表达的刺激作用。这可能说明,当奶牛血糖浓度降低时,奶牛乳腺上皮细胞在受到细菌感染时可以大量合成LF参与免疫反应,以清除病原微生物。
综上所述,当处于低葡萄糖浓度条件时,乳腺上皮细胞的抗菌和抗炎能力受到不利影响。此时如果受到感染,iNOS的高表达使细胞产生大量的NO对自身造成一定损害;TGF-β1和TNF-α的高表达促进了免疫抑制作用,降低了乳腺的免疫反应能力;而IL-8和IL-6表达水平的下降,降低了对中性粒细胞的募集作用,减弱了乳腺对病原体的清除能力;尽管LF的表达量有所提高,但很难改变低葡萄糖浓度对乳腺整体免疫功能的负面影响。
4 结论在乳腺上皮细胞发生感染时,尽管低浓度葡萄糖通过促进LF基因的表达保护乳腺组织,但是低浓度葡萄糖仍然通过降低IL-8和IL-6基因的表达减弱二者对中性粒细胞的募集作用,同时通过提高TNF-α、TGF-β1和iNOS基因的表达加重免疫抑制和细胞损伤,对乳腺的免疫功能造成不利影响。因此,奶牛能量负平衡期间的低葡萄糖浓度可能是造成乳腺炎发病率升高的重要原因之一。
| [1] |
SULABH S, BHUSHAN B, PANIGRAHI M, et al. Differential response of immune-related genes to peptidoglycan and lipoteichoic acid challenge in vitro[J]. Veterinary World, 2016, 9(9): 983-988. DOI:10.14202/vetworld.2016.983-988 |
| [2] |
ALEXANDER C, RIETSCHEL E T. Bacterial lipopolysaccharides and innate immunity[J]. Journal of Endotoxin Research, 2001, 7(3): 167-202. |
| [3] |
BANNERMAN D D, PAAPE M J, LEE J W, et al. Escherichia coli and Staphylococcus aureus elicit differential innate immune responses following intramammary infection[J]. Clinical and Diagnostic Laboratory Immunology, 2004, 11(3): 463-472. |
| [4] |
SHUSTER D E, KEHRLI M E, J r, STEVENS M G. Cytokine production during endotoxin-induced mastitis in lactating dairy cows[J]. American Journal of Veterinary Research, 1993, 54(1): 80-85. |
| [5] |
SCHMITZ S, PFAFFL M W, MEYER H H D, et al. Short-term changes of mRNA expression of various inflammatory factors and milk proteins in mammary tissue during LPS-induced mastitis[J]. Domestic Animal Endocrinology, 2004, 26(2): 111-126. DOI:10.1016/j.domaniend.2003.09.003 |
| [6] |
FISHER R C, BELLAMKONDA K, ALEX MOLINA L, et al. Disrupting inflammation-associated CXCL8-CXCR1 signaling inhibits tumorigenicity initiated by sporadic- and colitis-colon cancer stem cells[J]. Neoplasia, 2019, 21(3): 269-281. DOI:10.1016/j.neo.2018.12.007 |
| [7] |
LONGHI C, CONTE M P, SEGANTI L, et al. Influence of lactoferrin on the entry process of Escherichia coli HB101 (pRI203) in HeLa cells[J]. Medical Microbiology and Immunology, 1993, 182(1): 25-35. |
| [8] |
BOUDJELLAB N, CHAN-TANG H S, LI X, et al. Interleukin 8 response by bovine mammary epithelial cells to lipopolysaccharide stimulation[J]. American Journal of Veterinary Research, 1998, 59(12): 1563-1567. |
| [9] |
孙光野, 夏成, 徐闯, 等. 围生期奶牛能量负平衡与免疫抑制的关系[J]. 黑龙江畜牧兽医, 2019(6): 36-40. SUN G Y, XIA C, XU C, et al. The relationship between negative energy balance and immunosuppression in perinatal dairy cow[J]. Heilongjiang Animal Science and Veterinary Medicine, 2019(6): 36-40 (in Chinese). DOI:10.13881/j.cnki.hljxmsy.2018.03.0147 |
| [10] |
管若溦, 刘建新. 围生期奶牛易感疾病的原因及常见病患的早期监测[J]. 浙江大学学报(农业与生命科学版), 2019, 45(5): 519-525. GUAN R W, LIU J X. Causes of susceptibility to diseases and early monitoring of common diseases in perinatal dairy cows[J]. Journal of Zhejiang University (Agriculture & Life Sciences), 2019, 45(5): 519-525 (in Chinese). |
| [11] |
张素敏, 王彤, 刘海东, 等. 不同浓度的葡萄糖对SW480肿瘤细胞分泌IGF-1、TGF-β1的影响[J]. 现代中西医结合杂志, 2014, 23(6): 577-579. ZHANG S M, WANG T, LIU H D, et al. Effect of different concentrations of glucose on secretions of IGF-1 and TGF-β1 in SW480 tumor cells[J]. Modern Journal of Integrated Traditional Chinese and Western Medicine, 2014, 23(6): 577-579 (in Chinese). DOI:10.3969/j.issn.1008-8849.2014.06.004 |
| [12] |
代博曼, 张素敏. 葡萄糖和胰岛素对SW480肿瘤细胞分泌IGF-1、TGF-β-1的影响[J]. 世界最新医学信息文摘, 2016, 16(4): 31-32. DAI B M, ZHANG S M. Effects of glucose and insulin on the secretion of IGF-1 and TGF-β-1 in SW480 tumor cells[J]. World Latest Medicine Information, 2016, 16(4): 31-32 (in Chinese). |
| [13] |
孙凤娥, 刘玉霞, 许郑林, 等. 葡萄糖和胰岛素对4T1肿瘤细胞IL-6 mRNA表达的影响[J]. 河北医药, 2011, 33(14): 2094-2096. SUN F E, LIU Y X, XU Z L, et al. Effect of glucose and insulin on the expression of IL-6 mRNA in 4T1 cells[J]. Hebei Medical Journal, 2011, 33(14): 2094-2096 (in Chinese). |
| [14] |
黄俊花, 李栋, 刘媛. 高浓度D-葡萄糖对早孕绒毛细胞滋养细胞TNF-α、IL-6表达的影响[J]. 山东医药, 2011, 51(18): 78-79. HUANG J H, LI D, LIU Y. Effect of high concentration of d-glucose on the expression of TNF-α and IL-6 in trophoblast cells of early pregnancy[J]. Shandong Medical Journal, 2011, 51(18): 78-79 (in Chinese). DOI:10.3969/j.issn.1002-266X.2011.18.048 |
| [15] |
宋华静, 杨利波, 亓文波. 葡萄糖浓度波动对单核细胞表达白介素6的影响[J]. 山东大学学报(医学版), 2009, 47(8): 18-20. SONG H J, YANG L B, QI W B. Effect of glucose fluctuation on IL-6 produced by monocytes[J]. Journal of Shandong University (Health Sciences), 2009, 47(8): 18-20 (in Chinese). |
| [16] |
张金友, 黄鹤, 李伟, 等. 低水平葡萄糖对奶牛乳腺上皮细胞促炎症因子表达的影响[J]. 中国畜牧兽医, 2019, 46(5): 1525-1531. ZHANG J Y, HUANG H, LI W, et al. Effect of low level glucose on proinflammatory cytokines expression in bovine mammary epithelial cells[J]. China Animal Husbandry & Veterinary Medicine, 2019, 46(5): 1525-1531 (in Chinese). |
| [17] |
WANG Y, LIU J L, JIANG Q Y, et al. Human adipose-derived mesenchymal stem cell-secreted CXCL1 and CXCL8 facilitate breast tumor growth by promoting angiogenesis[J]. Stem Cells, 2017, 35(9): 2060-2070. DOI:10.1002/stem.2643 |
| [18] |
柴斌. LPS和高浓度葡萄糖对大鼠肾小球系膜细胞分泌NO、IL-6和IL-8的影响的研究[D]. 硕士学位论文. 天津: 天津医科大学, 2000. CHAI B. The effect of LPS and high concertration of glucose on the production of NO, IL-6 & IL-8 in rat glomerular mesangial cells[D]. Master's Thesis. Tianjin: Tianjin Medical University, 2000. (in Chinese) |
| [19] |
宋传旺, 刘佳佳. 中性粒细胞产生IL-6的研究概述[J]. 泸州医学院学报, 2002, 25(6): 535-538. SONG C W, LIU J J. A summary of the research on the production of IL-6 by neutrophil[J]. Journal of Luzhou Medical College, 2002, 25(6): 535-538 (in Chinese). |
| [20] |
鲍运平, 易洋, 彭礼林, 等. 氨基葡萄糖对膝骨关节炎IL-6、VEGF、SOD、MDA影响的临床研究[J]. 中外医学研究, 2013, 11(19): 12-14. BAO Y P, YI Y, PENG L L, et al. Clinical research about the effect of glucosamine on the lever of IL-6, VEGF, SOD and MDA in the patients with knee osteoarthritis[J]. Chinese and Foreign Medical Research, 2013, 11(19): 12-14 (in Chinese). |
| [21] |
YOSHIOKA M, ITO T, MIYAZAKI S, et al. The release of tumor necrosis factor-alpha, interleukin-1, interleukin-6 and prostaglandin E2 in bovine Kupffer cells stimulated with bacterial lipopolysaccharide[J]. Veterinary Immunology and Immunopathology, 1998, 66(3/4): 301-307. |
| [22] |
KUSHIBIKI S. Tumor necrosis factor-α-induced inflammatory responses in cattle[J]. Animal Science Journal, 2011, 82(4): 504-511. |
| [23] |
李俊峰, 魏枫. TGF-β1与自身免疫性甲状腺疾病[J]. 包头医学院学报, 2009, 25(6): 104-105. LI J F, WEI F. TGF-β1 and autoimmune thyroid disease[J]. Journal of Baotou Medical College, 2009, 25(6): 104-105 (in Chinese). |
| [24] |
李瑜, 王凤龙, 丁旭娜, 等. TGF-β1对奶牛乳腺上皮细胞增殖与凋亡的影响[J]. 动物医学进展, 2012, 33(9): 53-57. LI Y, WANG F L, DING X N, et al. TGF-β1 effect on proliferation and apoptosis of bovine mammary epithelial cells[J]. Progress in Veterinary Medicine, 2012, 33(9): 53-57 (in Chinese). |
| [25] |
SURH Y J, CHUN K S, CHA H H, et al. Molecular mechanisms underlying chemopreventive activities of anti-inflammatory phytochemicals: down-regulation of COX-2 and iNOS through suppression of NF-kappa B activation[J]. Mutation Research, 2001, 480/481: 243-268. |
| [26] |
TAKAHASHI M, MUTOH M, KAWAMORI T, et al. Altered expression of beta-catenin, inducible nitric oxide synthase and cyclooxygenase-2 in azoxymethane-induced rat colon carcinogenesis[J]. Carcinogenesis, 2000, 21(7): 1319-1327. |
| [27] |
VANE J R, MITCHELL J A, APPLETON I, et al. Inducible isoforms of cyclooxygenase and nitric-oxide synthase in inflammation[J]. Proceedings of the National Academy of Sciences of the United States of America, 1994, 91(6): 2046-2050. |
| [28] |
史丙科, 李守林. NF-κB/iNOS-NO信号转导通路的临床研究进展[J]. 医学理论与实践, 2020, 33(24): 4081-4083. SHI B K, LI S L. Clinical research progress of NF-κB/iNOS-NO signal transduction pathway[J]. The Journal of Medical Theory and Practice, 2020, 33(24): 4081-4083 (in Chinese). |
| [29] |
ROSA L, CUTONE A, LEPANTO M S, et al. Lactoferrin: a natural glycoprotein involved in iron and inflammatory homeostasis[J]. International Journal of Molecular Sciences, 2017, 18(9): 1985. |



