奶牛生产中,为提高产奶量,一般会在饲粮中添加高精料,但长时间饲喂高精料会诱发奶牛亚急性酸中毒(subacute ruminal acidosis,SARA)和一些营养代谢性疾病,如瘤胃炎、蹄叶炎、间歇性腹泻等,并导致产奶量下降[1-3],给奶牛养殖业造成巨大的经济损失。其原因主要是饲喂高精料产生大量的有机酸,导致瘤胃pH急剧下降和微生物解体并释放大量脂多糖(lipopolysaccharides,LPS)、组胺和细菌抗原肽物质,引起奶牛系统性炎症反应[4]。目前,SARA主要有3种学说,包括短链脂肪酸(short chain fatty acids,SCFAs)、乳酸和内毒素中毒学说,其中比较接受的是SCFAs中毒学说[5]。
SCFAs是瘤胃内微生物发酵饲粮中碳水化合物产生的含有2~6个碳原子的脂肪酸,主要包括乙酸、丙酸和丁酸,约占总挥发性脂肪酸(volatile fatty acids,VFA)的95%[6]。SCFAs能够被瘤胃上皮组织通过简单扩散或相关的SCFAs转运蛋白吸收进入血液[7-8]。之前的研究表明,SCFAs能调节瘤胃上皮的炎症反应[9]。研究显示,浓度为5~40 mmol/L的SCFAs能够促进奶牛瘤胃上皮细胞(bovine rumen epithelial cells,BRECs)中促炎症因子白细胞介素-1β(IL-1β)和肿瘤坏死因子-α(TNF-α)的表达以及趋化因子CC趋化因子20(CCL20)、CXC趋化因子2(CXCL2)、CXC趋化因子3(CXCL3)和CXC趋化因子8(CXCL8)的表达[10]。然而,目前并未见在SARA条件下SCFAs浓度对BRECs炎症反应和瘤胃上皮屏障影响的研究。泌乳中期奶牛饲喂正常饲粮时,奶牛瘤胃液中SCFAs浓度在80 mmol/L左右。SARA条件下,奶牛瘤胃液中SCFAs浓度一般在100 mmol/L[11]。奶牛在SARA条件下能引起瘤胃上皮炎症反应和破坏瘤胃上皮的屏障功能。因此,我们假设高浓度的SCFAs能促进瘤胃上皮的促炎症反应和破坏瘤胃上皮屏障功能。
SCFAs刺激乳腺上皮细胞(bovine mammary epithelial cells, BMECs)能够显著加强p38促分裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信号通路的激活,而添加200 ng/mL的百日咳毒素与BMECs孵育之后,结合和抑制了细胞的Gi/o家族蛋白,这个结果暗示SCFAs刺激BMECs的炎症反应受到了Gi/o家族蛋白的调控[12]。之前的研究已经报道,G-蛋白偶联受体41(G protein-coupled receptor 41,GPR41)介导SCFAs调控BRECs炎症反应[9]。SCFAs通过激活小鼠结肠上皮细胞的GPR41和G-蛋白偶联受体43(G protein-coupled receptor 43,GPR43)来积极响应免疫应答并激活p38和磷酸化细胞外信号调节激酶1/2(pERK1/2)MAPK信号通路,从而介导保护性免疫反应[13]。随着SCFAs浓度(5~40 mmol/L)逐渐升高,GPR41表达量也逐渐增加[10],然而,SARA条件下SCFAs浓度对GPR41表达的影响仍未知。之前的研究中,GPR41和GPR43作为SCFAs的受体已经被证明[14],并且GPR41已经被证明能够在BRECs中表达[15],但未检测到GPR43在BRECs表达[9]。SARA条件下产生高浓度的SCFAs对BRECs免疫反应、紧密连接蛋白和GPR41表达的相关研究还未见报道。因此,本试验目的是研究不同浓度SCFAs对BRECs免疫反应、紧密连接蛋白和GPR41表达的影响,旨在理解GPR41在BRECs炎症反应调控中的作用,这可为理解瘤胃上皮炎症反应的潜在机制带来新的思路。
1 材料与方法 1.1 试验材料DMEM/F12培养基、胎牛血清、非必需氨基酸(non-essential amino acids,NEAA)磷酸盐缓冲液(PBS)和胰蛋白酶为美国Gibco公司产品;乙酸、丙酸、丁酸、青霉素、链霉素和乙二胺四乙酸(EDTA)为美国Sigma公司产品;荧光定量96孔板和8连管为美国Bio-Rad公司产品;PrimeScriptTM RT Master Mix和SYBR® Premix Ex TaqTM Ⅱ为宝生物工程(大连)有限公司产品;总RNA提取试剂盒为天根生化科技(北京)有限公司产品。
1.2 试验方法 1.2.1 BRECs培养BRECs来自于扬州大学动物培养物保存与应用研究所(Institute of Animal Culture Collection and Application,Yangzhou University,IACCA)。用DMEM/F12完全培养基培养BRECs,待细胞密度达到培养瓶70%生长面积,用0.05%胰蛋白酶-0.02% EDTA消化细胞,放置于37 ℃细胞培养箱温育3 min,培养瓶中的细胞开始发亮并从瓶底脱落,拍打培养瓶数次。如果还有部分BRECs未从培养瓶底部脱落,再放置于37 ℃细胞培养箱温育2 min,用力拍打培养瓶数次,直至细胞全部脱落。用5 mL含10% FBS的DMEM/F12完全培养基终止消化,传至3个25 cm2培养瓶中继续培养,细胞密度再次达到培养瓶80%生长面积,这一过程需要3 d。
1.2.2 试验设计试验设4个试验组,在培养基中分别添加20、50、100和150 mmol/L SCFAs培养BRECs 24 h。培养24 h之后,细胞被收集提取总RNA。每组设3个重复。20 mmol/L SCFAs由12 mmol/L乙酸、5 mmol/L丙酸和3 mmol/L丁酸组成。50 mmol/L SCFAs由30 mmol/L乙酸、12.5 mmol/L丙酸和7.5 mmol/L丁酸组成。100 mmol/L SCFAs由60 mmol/L乙酸、25 mmol/L丙酸和15 mmol/L丁酸组成。150 mmol/L SCFAs由90 mmol/L乙酸、37.5 mmol/L丙酸和22.5 mmol/L丁酸组成。
1.2.3 反转录cDNA按照TaKaRa反转录试剂盒将总RNA逆转录为cDNA,试验于冰上操作,反转录体系由500 ng总RNA、2 μL 5×PrimeScript RT Master Mix和无RNA酶水组成,总体积为10 μL。反应条件:37 ℃ 15 min和85 ℃ 5 s。
1.2.4 荧光定量PCRPCR反应体系:SYBR® Premix Ex TaqTM Ⅱ Kit 10 μL、上游和下游引物(10 μmol/L)各1 μL、cDNA模板100 ng和灭菌蒸馏水,总体积20 μL。反应条件:95 ℃预变性30 s;95 ℃ 5 s,60 ℃ 30 s,40个循环,每个样品3个重复且使用甘油醛-3-磷酸脱氢酶(GAPDH)作为内参基因。PCR产物通过2%琼脂糖凝胶电泳分离,随后在凝胶成像仪中观察PCR产物。荧光定量PCR引物在表 1中列出。
|
|
表 1 荧光定量PCR引物 Table 1 Primers for RT-qPCR |
试验数据结果用“平均值±标准差”表示。运用SPSS 16.0统计软件中的单因素方差分析(one-way ANOVA)模块进行单因素方差分析,显著性检验应用LSD法进行。P < 0.10表示为差异有显著趋势,P < 0.05表示差异显著。相关性使用GraphPad Prism 6软件进行分析。相关系数用r表示,r>0为正相关,r < 0为负相关;|r|越接近1,相关性越强,|r|越接近0,相关性越弱。
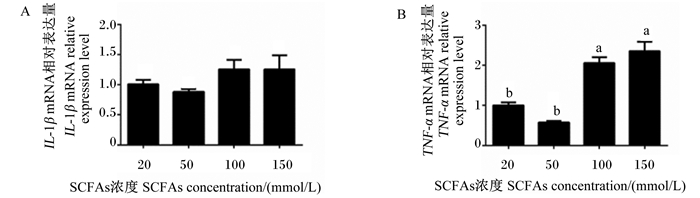
2 结果与分析 2.1 不同浓度SCFAs对促炎症因子表达的影响由图 1可知,与添加20和50 mmol/L SCFAs时相比,添加100和150 mmol/L SCFAs时促炎症因子IL-1β的mRNA相对表达量并未发现显著改变(P>0.05),但TNF-α的mRNA相对表达量被显著提高(P < 0.05)。
|
数据柱标注不同小写字母表示差异显著(P<0.05),相同字母或无字母表示差异不显著(P>0.05)。下图同。 Data columns with different letters mean significant difference (P < 0.05), while with the same or no letter mean no significant difference (P>0.05). The same as below. 图 1 不同浓度SCFAs对促炎症因子表达的影响 Fig. 1 Effects of different concentrations of SCFAs on expression of pro-inflammatory factors |
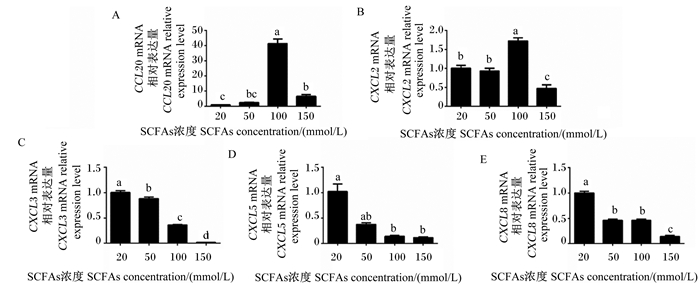
由图 2-A和图 2-B可知,与添加20和50 mmol/L SCFAs时相比,添加100 mmol/L SCFAs时CCL20和CXCL2的mRNA相对表达量被显著上调(P < 0.05),然而,添加150 mmol/L SCFAs时CCL20和CXCL2的mRNA相对表达量与添加100 mmol/L SCFAs时相比被显著下调(P < 0.05)。由图 2-C、图 2-D和图 2-E可知,随着SCFAs浓度的增加,CXCL3、CXCL5和CXCL8的mRNA相对表达量逐渐下调;更为重要的是,添加150 mmol/L SCFAs时,CXCL3、CXCL5和CXCL8的mRNA相对表达量最低。
|
图 2 不同浓度SCFAs对趋化因子表达的影响 Fig. 2 Effects of different concentrations of SCFAs on expression of chemokines |
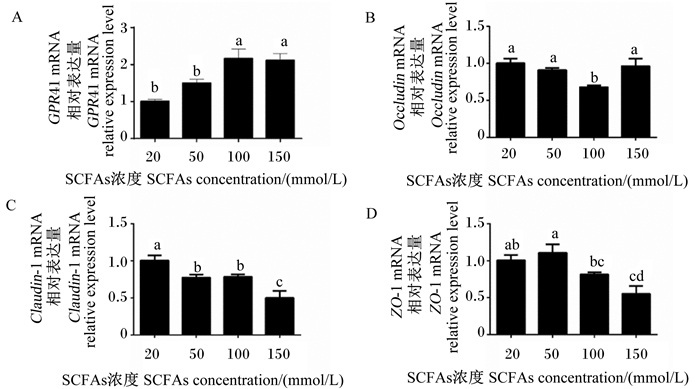
由图 3-A可知,随着SCFAs浓度从20 mmol/L上升至100 mmol/L,GPR41的mRNA相对表达量被逐渐上调。SCFAs浓度为100 mmol/L时,GPR41的mRNA相对表达量显著高于SCFAs浓度为20和50 mmol/L时(P < 0.05);然而,SCFAs浓度为150 mmol/L时,GPR41的mRNA相对表达量与SCFAs浓度为100 mmol/L时相比并没有发生显著改变(P>0.05)。SCFAs浓度为150 mmol/L时,紧密连接蛋白闭合蛋白-1(Claudin-1)和闭锁小带蛋白-1(ZO-1)的mRNA相对表达量最低(图 3-C和图 3-D),且显著低于SCFAs浓度为20和50 mmol/L时(P < 0.05)。
|
图 3 不同浓度SCFAs对GPR41和紧密连接蛋白表达的影响 Fig. 3 Effects of different concentrations of SCFAs on expression of GPR41 and tight junction proteins |
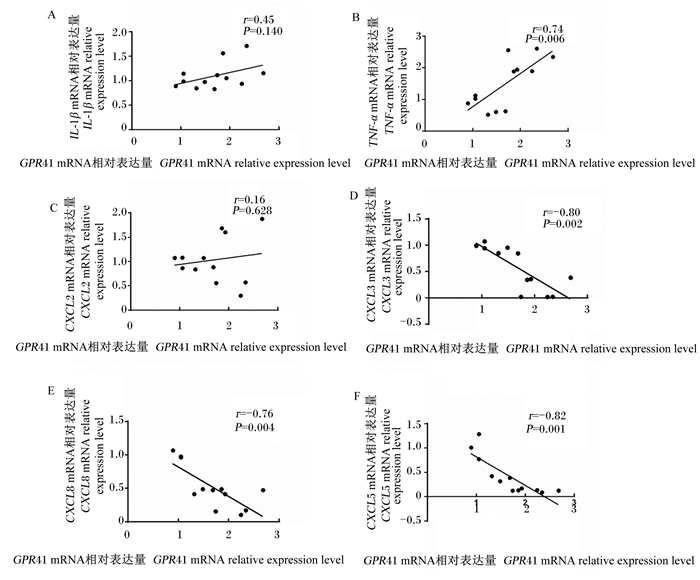
由图 4可知,GPR41的mRNA相对表达量与促炎症因子TNF-α的mRNA相对表达量呈显著正相关(P < 0.05)。然而,GPR41的mRNA相对表达量与趋化因子CXCL3、CXCL5和CXCL8的mRNA相对表达量呈显著负相关(P < 0.05)。
|
图 4 BRECs中GPR41 mRNA相对表达量与免疫细胞因子mRNA相对表达量之间的相关性 Fig. 4 Correlations between mRNA expression levels of GPR41 and immune cytokines in BRECs |
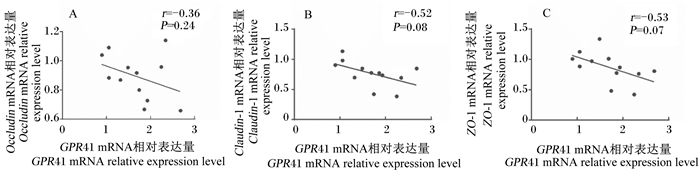
由图 5可知,GPR41的mRNA相对表达量与紧密连接蛋白Claudin-1和ZO-1的mRNA相对表达量呈负相关趋势(0.05≤P < 0.10)。
|
图 5 BRECs中GPR41 mRNA相对表达量与紧密连接蛋白mRNA相对表达量之间的相关性 Fig. 5 Correlations between mRNA expression levels of GPR41 and tight junction proteins in BRECs |
长期饲喂高精料饲粮会诱发奶牛SARA营养代谢病,导致瘤胃内有机酸大量累积和瘤胃pH急剧下降,瘤胃含大量H+,从而改变瘤胃内环境的酸碱平衡,打破瘤胃菌群结构平衡,影响瘤胃微生物区系多样性并诱发微生物解体释放大量细菌抗原肽和LPS等促炎症因子,破坏瘤胃上皮的免疫屏障功能,引起奶牛瘤胃上皮炎症反应以及机体的系统性炎症反应[16]。奶牛SARA条件下,瘤胃内产生的有机酸大部分是SCFAs,因此,SCFAs是诱发奶牛瘤胃上皮促炎症反应的重要因素。SARA条件下,奶牛瘤胃液中SCFAs浓度一般在100 mmol/L,有时甚至更高[11]。本试验结果证明,100和150 mmol/L的SCFAs能诱导BRECs的促炎症反应,抑制趋化因子表达和瘤胃宿主的免疫应答,减少紧密连接蛋白的表达,破坏瘤胃上皮的屏障功能。
在现代奶牛生产中,为提高产奶量,通常使用高精料饲粮,然而长时间饲喂高精料会诱发瘤胃SARA。目前,SARA主要有3种学说,包括SCFAs、乳酸和内毒素中毒学说。目前研究较多的是SCFAs中毒学说。研究显示,长时间饲喂高精料产生大量有机酸,诱发瘤胃上皮促炎症反应,增加瘤胃上皮的通透性[17]。此外,SARA条件下产生更多的SCFAs,激活MAPK和核因子-κB(NF-κB)信号通路,进而促进瘤胃上皮促炎症因子IL-1β、IL-6和TNF-α表达[11]。随着SCFAs浓度的增加,能够激活BRECs中促炎症因子TNF-α表达,尤其是SCFAs浓度达到150 mmol/L时,BRECs中促炎症因子TNF-α的mRNA相对表达量最高。上述结果表明,高浓度SCFAs能诱导瘤胃上皮的促炎症反应。之前的研究也显示,低浓度的SCFAs显著上调大部分CCL型和CXCL型趋化因子的表达,加强瘤胃上皮免疫应答反应[9]。趋化因子的主要作用是趋化免疫细胞如巨噬细胞和中性粒细胞到达组织受感染的部位进行免疫应答和促进杀伤细胞进行加工和处理抗原[18]。值得注意的是,添加150 mmol/L SCFAs孵育BRECs时,CXCL3、CXCL5和CXCL8的mRNA相对表达量最低,这表明高浓度SCFAs减少BRECs中趋化因子的表达,抑制瘤胃上皮的免疫应答。因为趋化因子表达量的增加能够进一步促进免疫细胞趋化至瘤胃免疫层来加工处理抗原肽。
奶牛瘤胃上皮含有许多屏障层特性,包括角质层、颗粒层、棘层和基底层,这4层相互作用和交叉联系,在宿主和瘤胃微生物之间建立屏障保护,维持瘤胃稳态。紧密连接蛋白位于瘤胃上皮的中间层,对于瘤胃上皮细胞的分化、调控上皮屏障的间隙和阻止内毒素移位至血液至关重要[19-20]。紧密连接蛋白主要由闭合蛋白(Claudins)、Occludin和ZO-1组成,它们与细胞骨架的稳定性密切相关[21]。高精料饲粮饲喂条件下抑制Claudins、Occludin和ZO-1的表达,并引起瘤胃上皮促炎症因子TNF-α的表达,因此,瘤胃上皮紧密连接蛋白的稳定与瘤胃上皮免疫屏障对奶牛健康具有至关重要的作用[22]。本试验结果显示,SCFAs浓度为150 mmol/L时,紧密连接蛋白Claudin-1和ZO-1的mRNA相对表达量显著低于SCFAs浓度为20和50 mmol/L时且此时表达量最低,结果证明,高浓度的SCFAs能破坏BRECs的免疫屏障功能。SCFAs浓度由20 mmol/L增加至100 mmol/L,BRECs中GPR41的表达被激活。但是,SCFAs浓度由100 mmol/L增加至150 mmol/L时,BRECs中GPR41的mRNA相对表达量并没有被改变。此外,通过相关性分析发现,GPR41的mRNA相对表达量与促炎症因子TNF-α的mRNA相对表达量呈显著正相关;然而,GPR41的mRNA相对表达量与趋化因子CXCL3、CXCL5和CXCL8的mRNA相对表达量呈显著负相关;同时,GPR41的mRNA相对表达量与紧密连接蛋白Claudin-1和ZO-1的mRNA相对表达量呈负相关趋势。以上结果表明,SCFAs通过GPR41负调控BRECs的中趋化因子和紧密连接蛋白的表达。
4 结论100和150 mmol/L的SCFAs能诱导BRECs的促炎症反应,抑制趋化因子表达和免疫反应,减少紧密连接蛋白的表达,破坏瘤胃上皮的免疫屏障功能。
| [1] |
NORDLUND K V, GARRETT E F. Rumenocentesis: a technique for collecting rumen fluid for the diagnosis of subacute rumen acidosis in dairy herds[J]. The Bovine Practitioner, 1994, 28: 109-112. |
| [2] |
DUFFIELD T, PLAIZIER J C, FAIRFIELD A, et al. Comparison of techniques for measurement of rumen pH in lactating dairy cows[J]. Journal of Dairy Science, 2004, 87(1): 59-66. DOI:10.3168/jds.S0022-0302(04)73142-2 |
| [3] |
KRAUSE K M, OETZEL G R. Understanding and preventing subacute ruminal acidosis in dairy herds: a review[J]. Animal Feed Science and Technology, 2006, 126(3/4): 215-236. |
| [4] |
MAO S Y, ZHANG R Y, WANG D S, et al. Impact of subacute ruminal acidosis (SARA) adaptation on rumen microbiota in dairy cattle using pyrosequencing[J]. Anaerobe, 2013, 24: 12-19. DOI:10.1016/j.anaerobe.2013.08.003 |
| [5] |
CALSAMIGLIA S, BLANCH M, FERRET A, et al. Is subacute ruminal acidosis a pH related problem?Causes and tools for its control[J]. Animal Feed Science and Technology, 2012, 172(1/2): 42-50. |
| [6] |
BERGMAN E N. Energy contributions of volatile fatty acids from the gastrointestinal tract in various species[J]. Physiological Reviews, 1990, 70(2): 567-590. DOI:10.1152/physrev.1990.70.2.567 |
| [7] |
ASCHENBACH J R, PENNER G B, STUMPFF F, et al. Ruminant nutrition symposium: role of fermentation acid absorption in the regulation of ruminal pH[J]. Journal of Animal Science, 2011, 89(4): 1092-1107. DOI:10.2527/jas.2010-3301 |
| [8] |
LEONHARD-MAREK S, STUMPFF F, MARTENS H. Transport of cations and anions across forestomach epithelia: conclusions from in vitro studies[J]. Animal, 2010, 4(7): 1037-1056. DOI:10.1017/S1751731110000261 |
| [9] |
詹康. SCFAs通过GPR41调控奶牛瘤胃上皮细胞炎症反应的研究[D]. 博士学位论文. 扬州: 扬州大学, 2018. ZHAN K. SCFAs regulate the inflammatory response of bovine rumen epithelial cells by GPR41[D]. Ph. D. Thesis. Yangzhou: Yangzhou University, 2018. (in Chinese) |
| [10] |
严康, 冯宝宝, 詹康, 等. 短链脂肪酸对奶牛瘤胃上皮细胞的炎性细胞因子和G-蛋白偶联受体41表达的影响[J]. 动物营养学报, 2019, 31(3): 1259-1265. YAN K, FENG B B, ZHAN K, et al. Effects of short chain fatty acids on expression of inflammatory factors and G-protein coupled receptor 41 in bovine rumen epithelial cells[J]. Chinese Journal of Animal Nutrition, 2019, 31(3): 1259-1265 (in Chinese). |
| [11] |
ZHAO C X, LIU G W, LI X B, et al. Inflammatory mechanism of rumenitis in dairy cows with subacute ruminal acidosis[J]. BMC Veterinary Research, 2018, 14(1): 135. DOI:10.1186/s12917-018-1463-7 |
| [12] |
YONEZAWA T, HAGA S, KOBAYASHI Y, et al. Short-chain fatty acid signaling pathways in bovine mammary epithelial cells[J]. Regulatory Peptides, 2009, 153(1/3): 30-36. |
| [13] |
KIM M H, KANG S G, PARK J H, et al. Short-chain fatty acids activate GPR41 and GPR43 on intestinal epithelial cells to promote inflammatory responses in mice[J]. Gastroenterology, 2013, 145(2): 396-406. DOI:10.1053/j.gastro.2013.04.056 |
| [14] |
BROWN A J, GOLDSWORTHY S M, BARNES A A, et al. The orphan G protein-coupled receptors GPR41 and GPR43 are activated by propionate and other short chain carboxylic acids[J]. Journal of Biological Chemistry, 2003, 278(13): 11312-11319. |
| [15] |
姜茂成, 詹康, 贡笑笑, 等. 不同pH和SCFAs对奶牛瘤胃上皮细胞SCFAs转运蛋白和GPR41表达的影响[J]. 中国农业大学学报, 2018, 23(10): 63-70. JIANG M C, ZHAN K, GONG X X, et al. Effects of different pH and SCFAs on the expressions of SCFAs transport proteins and GPR41 in the rumen epithelial cells of dairy cow[J]. Journal of China Agricultural University, 2018, 23(10): 63-70 (in Chinese). |
| [16] |
姜茂成, 詹康, 严康, 等. 奶牛瘤胃上皮细胞分离培养与鉴定[J]. 中国农业大学学报, 2018, 23(1): 80-86. JIANG M C, ZHAN K, YAN K, et al. Culture and identification of the bovine rumen epithelial cell line[J]. Journal of China Agricultural University, 2018, 23(1): 80-86 (in Chinese). |
| [17] |
魏子维, 邓铭, 孙宝丽, 等. 高精料饲粮对反刍动物胃肠道健康的影响及调控措施[J]. 动物营养学报, 2021, 33(3): 1277-1285. WEI Z W, DENG M, SUN B L, et al. Effects of high concentrate diet on gastrointestinal health of ruminants and its regulation measures[J]. Chinese Journal of Animal Nutrition, 2021, 33(3): 1277-1285 (in Chinese). |
| [18] |
SINA C, GAVRILOVA O, FÖRSTER M, et al. G protein-coupled receptor 43 is essential for neutrophil recruitment during intestinal inflammation[J]. Journal of Immunology, 2009, 183(11): 7514-7522. |
| [19] |
GRAHAM C, SIMMONS N L. Functional organization of the bovine rumen epithelium[J]. American Journal of Physiology: Regulatory, Integrative and Comparative Physiology, 2005, 288(1): R173-R181. |
| [20] |
PENNER G B, STEELE M A, ASCHENBACH J R, et al. Ruminant nutrition symposium: molecular adaptation of ruminal epithelia to highly fermentable diets[J]. Journal of Animal Science, 2011, 89(4): 1108-1119. |
| [21] |
FANNING A S, ANDERSON J M. PDZ domains and the formation of protein networks at the plasma membrane[J]. Current Topics in Microbiology and Immunology, 1998, 228: 209-233. |
| [22] |
LIU J H, XU T T, LIU Y J, et al. A high-grain diet causes massive disruption of ruminal epithelial tight junctions in goats[J]. American Journal of Physiology: Regulatory, Integrative and Comparative Physiology, 2013, 305(3): R232-R241. |




