肉鹅是我国重要的经济水禽。据国家水禽产业体系2020年底统计,我国肉鹅年出栏量近6亿只,占全世界养鹅总量的90%。长期以来,使用抗生素是促进肉鹅生长、维持肠道健康及避免炎症反应的最有效手段之一[1]。但随着饲料禁抗、养殖减抗等政策的逐步落实[2],肉鹅养殖业因“替抗”储备技术不足,导致疫病防控难度增加、生长性能下降等,严重制约产业发展,亟待开发有效的“替抗”养殖新技术。
酿酒酵母培养物(yeast culture, YC)是利用特定发酵工艺,将酿酒酵母(Saccharomyces cerevisiae)细胞经过充分厌氧发酵得到的发酵产品,主要由酵母细胞代谢产物、发酵后的营养物质及灭活酵母细胞所构成[3]。YC的有效成分为酵母细胞壁多糖(α-D-甘露聚糖、几丁质、β-D-葡聚糖、甘露寡糖等),消化酶(植酸酶等),可消化小肽,B族维生素(维生素B1、维生素B2、维生素B5、维生素B6等),有机酸,未知生长因子等[4]。农业部2013年将YC、酿酒酵母提取物和酿酒酵母细胞壁从《饲料添加剂品种目录》转入《饲料原料目录》,可见其在畜禽养殖过程中具有较高的安全性和有效性。研究发现,酿酒酵母产品在抑制肠道病原菌增殖[5]、提高饲料原料消化利用率、减少肠道温室气体排放[6]等方面具有明显效果。梁秀丽等[7]对比了基础饲粮(对照)、抗生素饲粮、酵母培养物对肉鸡生长及抗病性能的影响,发现酵母培养物组肉鸡平均日增重、平均日采食量较对照组均有提高,料重比降低,且发病率和死淘率降低,应用效果良好。熊子标[8]发现,饲粮添加2%酵母培养物可提高四川白鹅生长性能、抗氧化能力、机体免疫力和对营养物质的利用率,改善肉品质嫩度、促进消化器官生长和肠道发育。
研究发现,核转录因子-κB(nuclear factor-κB,NF-κB)信号通路是后生元制剂调节细胞免疫反应的主要途径之一[9]。酵母细胞壁多糖等多种后生元类物质可被多个细胞表面受体家族,如Toll样受体家族(Toll like reporters, TLRs),直接或间接识别,并通过调节NF-κB抑制蛋白(NF-κB inhibitor of kappa B, IκB)磷酸化影响下游炎症因子表达[10]。YC被认为是当前最安全有效的后生元制剂之一,但当前针对YC的研究大都集中在养殖应用效果评价,其肠道功能保护、免疫反应调节的机制鲜有报道。为此,本试验在建立原代鹅肠上皮细胞培养体系的基础上,分析探讨YC对内毒素(LPS)诱导的鹅肠上皮细胞损伤的保护作用,为深入研究YC的肠上皮调节功能提供支持。
1 材料与方法 1.1 YC溶液配制本试验所用YC为浅橙色粗粉(干物质≥94.0%),含24.0%粗蛋白质、3.2%粗脂肪、11.0%粗纤维、6.4%粗灰分。该产品使用酿啤酒用谷物及甜菜粕作为发酵底物,灭活啤酒酵母含量约占40%。参照魏方[11]的方法配制YC溶液:称取0.6 g YC粗粉放入30 mL磷酸盐缓冲液(PBS)中,涡旋将其充分混合并在摇床上室温温浴1 h,使大部分粉末溶解, 然后1 000×g离心10 min除去剩余固体,收集上清液,得到20 g/L YC溶液备用。
1.2 鹅肠上皮细胞培养体系建立 1.2.1 鹅肠上皮细胞分离取25~26胚龄鹅蛋(购自安徽天之骄鹅业有限公司),75%酒精喷洒外壳,晾干后,取出完整小肠,置于37 ℃含1%青链霉素(V900929,Sigma,美国)的PBS中,随后小心剥离肠系膜,冲洗肠腔内容物,将小肠组织剪成 < 1 mm3碎块,使用含1%青链霉素的PBS反复漂洗3~5次,至上清液澄清,170×g离心4 min,弃上清,制成组织沉淀。制备含300 U/mL胶原酶Ⅺ(C7657,Sigma,美国)和0.1 mg/mL中性蛋白酶Ⅰ(D4818,Sigma,美国)的37 ℃混合酶溶液,加入组织沉淀中,混匀,37 ℃消化30~40 min后,170×g离心10 min弃上清,即获得鹅肠上皮细胞沉淀。
1.2.2 鹅肠上皮细胞纯化根据上皮细胞较成纤维细胞贴壁慢的特点,选用“相差贴壁法”使2类细胞分离以达到纯化目的。首先,将分离得到的细胞沉淀,然后用含有1%青链霉素、5%胎牛血清(10099-141,Gibco,美国)、10 ng/mL表皮生长因子(EGF,E4127,Sigma,美国)的DMEM/F12培养基(L310KJ,上海源培生物科技股份有限公司)吹匀,随后将悬液接种至第1个培养瓶中,置于37 ℃、5% CO2培养箱培养90 min。随后,轻轻吸取全部培养液(含未贴壁上皮细胞),接种到第2个用鼠尾胶原蛋白(C8062,Solarbio,北京)包被过的培养瓶中,置于37 ℃、5% CO2培养箱继续培养24 h后,更换新鲜细胞培养液,即获得纯化的鹅肠上皮细胞。
1.2.3 鹅肠上皮细胞形态学观察与鉴定微绒毛是肠上皮细胞特有的形态结构,可被用于肠上皮细胞鉴定。本试验中,使用细胞刮刀将纯化后贴壁生长的单层肠上皮细胞轻轻刮下,置于2.5%戊二醛溶液,4 ℃固定,过夜。用0.1 mol/L的二甲砷酸钠缓冲液清洗3次,后固定用1%锇酸固定2 h,再用缓冲液漂洗20 min,后经脱水、置换、浸透、包埋聚合,形成包埋块。再对包埋块进行修块、半薄切片定位,保证样品表面积小于0.2 mm×0.2 mm。用超薄切片机将包埋块切成50 nm的超薄切片,将超薄切片捞在有支持膜的载网上。醋酸铀染液室温染色30 min,蒸馏水清洗,柠檬酸铅室温染色8 min,清洗,晾干,观察、拍片、记录。试验委托武汉谷歌生物科技有限公司进行透射电镜观察。此外,试验通过对细胞核进行苏木素染色观察肠上皮细胞形态。具体操作如下:将纯化后的细胞接种在6孔板内的细胞爬片(801008,Nest,无锡)上,37 ℃、5% CO2培养箱培养24 h后,洗去培养基,95%乙醇固定20 min,PBS洗涤2次,苏木素染液(G1080,Solarbio,北京)染核2~3 min,自来水洗涤,光学显微镜镜下观察,拍片,记录。
1.3 建立LPS诱导肠上皮细胞炎性损伤模型利用LPS处理鹅肠上皮细胞,建立肠上皮细胞炎性损伤模型。具体操作如下:首先,台盼蓝染色后,使用自动细胞计数仪(IC1000,Countstar,上海)完成计数;接着,按照每孔0.5×104~1.0×104个细胞将对数生长期细胞接种于培养板,置于37 ℃、5% CO2培养箱中培养;最后,待细胞生长至80%时,弃去细胞培养上清液,加入配制的含有终浓度分别为0(对照组)、0.1、0.5、1.0、5.0、10.0、50.0和100.0 μg/mL的LPS培养液,每组6个平行。37 ℃培养24 h后,加入10 μL的CCK8试剂(K1018,APE×BIO,美国),将培养板置于培养箱内孵育2~4 h,用酶标仪测定在450 nm处的吸光度,测定细胞活性。
采用实时荧光定量PCR(RT-qPCR)测定白细胞介素-1β(interleukin-1β,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和白细胞介素-8(interleukin-8,IL-8)、Toll样受体2A(TLR2A)、Toll样受体4(TLR4)、髓样分化因子88(myeloid differentiation factor 88,MyD88)、NF-κB基因相对表达量。具体操作如下:使用终浓度分别为0(对照)、0.5、1.0、5.0和10.0 μg/mL的LPS培养液处理细胞后,按照TRIZOL试剂盒(R401,Vazyme,南京)操作提取细胞总RNA,反转录成cDNA后,进行RT-qPCR反应。引物由南京金斯瑞生物科技有限公司合成,序列见表 1。RT-qPCR 20 μL体系如下:qPCR Master Mix(2×)10 μL,上、下游引物(10 μmol/L)各0.4 μL,模板cDNA 2 μL;无菌双蒸水7.2 μL。反应条件:95 ℃ 30 s,95 ℃ 10 s,60 ℃ 30 s,40个循环;95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s。试验以β-肌动蛋白(β-actin)为内参基因,用2-ΔΔCt法计算各目的基因相对表达量。
|
|
表 1 实时荧光定量PCR引物序列 Table 1 Primer sequences for RT-qPCR |
试验分组设置为:对照组、LPS组和LPS+低浓度YC(100 mg/L)组(LYC组)、LPS+中浓度YC(300 mg/L)组(MYC组)和LPS+高浓度YC(500 mg/L)组(HYC组)。其中,对照组用DMEM/F12培养基培养肠上皮细胞24 h;LPS组用含有1 μg/mL LPS的DMEM/F12培养基培养24 h;LPS+低、中、高浓度YC组先分别用YC浓度为100、300和500 mg/L的DMEM/F12培养基,在37 ℃孵育细胞3 h后,弃去培养基,再加入终浓度为1 μg/mL LPS的DMEM/F12培养基培养24 h。各组细胞处理后,按照1.3方法测定细胞活性。同时,提取各组肠上皮细胞的总RNA,按照1.3方法测定IL-1β、IL-8、TNF-α及NF-κB基因相对表达量。
1.5 YC预处理对LPS诱导的鹅肠上皮细胞氧化损伤的影响按1.3所述方法进行细胞计数,并将鹅肠上皮细胞以每孔1×105个细胞接种于12孔板内的细胞爬片(801008,Nest,无锡)上,药物处理后,利用荧光探针2′, 7′-二氯荧光黄双乙酸盐(DCFH-DA)进行活性氧(ROS)含量检测(S0033,上海碧云天生物技术有限公司),荧光显微镜观察。同时,将鹅肠上皮细胞以每孔2×105个细胞接种于6孔板中,药物处理后,用0.05%胰蛋白酶(2530062,Gibco,美国)消化细胞,收集细胞悬浮液,170×g离心10 min,弃上清后加入PBS配制细胞悬液,细胞破碎仪破碎细胞,测定超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性及丙二醛(MDA)、一氧化氮(NO)含量。采用WST-1法测定SOD活性,TBA法测定MDA含量,钼酸铵法测定CAT活性,微板法测定NO含量,具体测定方法参照南京建成生物工程研究所提供的说明书。
1.6 统计与分析使用GraphPad Prism 7.0软件分析试验数据并作图,基于单因素方差分析(one-way ANOVA)评估比较平均值,采用Tukey法进行组间多重比较,数据以“平均值±标准差”表示。P < 0.05为差异显著。
2 结果与分析 2.1 原代鹅肠上皮细胞培养体系建立本试验成功建立鹅肠上皮细胞体外培养方法,用混合酶消化法分离得到鹅肠上皮细胞(图 1-A)。用相差贴壁法分离纯化肠上皮细胞(图 1-B),细胞核染色后观察结果(图 1-C、图 1-D)显示,上皮细胞自隐窝细胞团长出,细胞呈卵圆形或多角形,单层贴壁生长,边缘清晰紧密相连。此外,试验选用投射电镜观察纯化后细胞标志性的微绒毛结构(图 1-E),说明获得的细胞为肠上皮细胞,可用于后续试验。
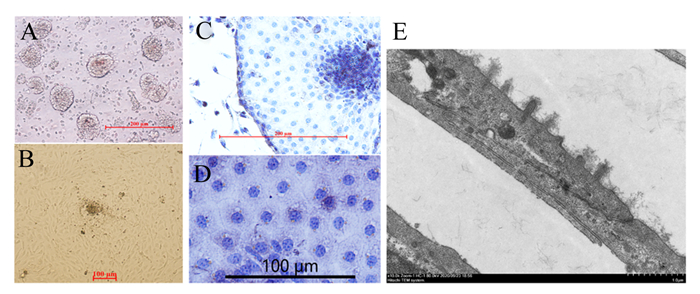
|
A:消化后的肠隐窝细胞团;B:培养24 h的肠上皮细胞;C和D:苏木素染核观察肠上皮细胞形态;E:投射电镜观察肠上皮细胞微绒毛结构。 A: intestinal crypts cell mass after digestion; B: intestinal epithelial cells after cultured 24 h; C and D: the morphology of intestinal epithelial cells with nuclear staining with hematoxylin; E: the microvilli structure of intestinal epithelial cells observed by transmission electron microscope. 图 1 鹅肠上皮细胞培养体系建立 Fig. 1 Establishment of culture system of goose intestinal epithelial cells |
本试验通过分析细胞活性改变及炎症反应发生,建立LPS诱导的鹅肠上皮细胞炎性损伤模型。由图 2可知,不同浓度的LPS处理对鹅肠上皮细胞活性无显著影响(P>0.05)。由图 3可知,在细胞促炎因子表达方面,与对照组相比,1.0 μg/mL LPS处理显著上调肠上皮细胞TNF-α、IL-1β和IL-8基因相对表达量(P < 0.05);在NF-κB炎症信号通路相关基因表达方面,与对照组相比,1.0 μg/mL LPS处理显著或极显著上调肠上皮细胞TLR2A(P < 0.01)、TLR4(P < 0.01)、MyD88(P < 0.05)和NF-κB(P < 0.01)基因相对表达量。因此,后续试验选用终浓度为1.0 μg/mL LPS处理鹅肠上皮细胞,建立炎性损伤模型。
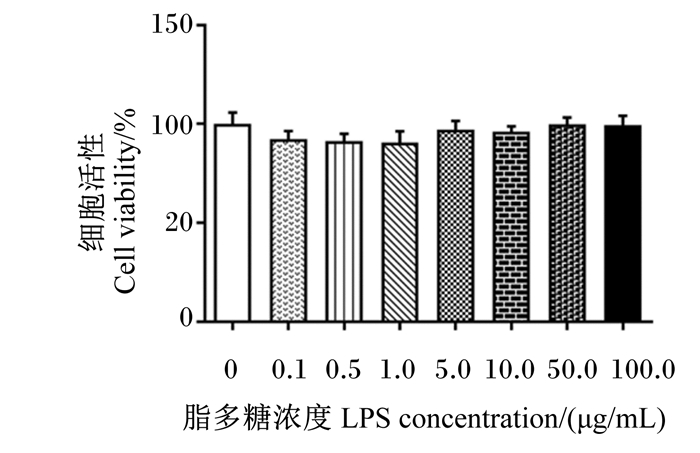
|
数据柱标注不同小写字母表示差异显著(P < 0.05),不同大写字母表示差异极显著(P < 0.01),无字母或相同字母表示差异不显著(P>0.05)。下图同。 Value columns with different small letters mean significant difference (P < 0.05), and with different capital letters mean significant difference (P < 0.01), while with no letter or the same letters mean no significant difference (P > 0.05). The same as below. 图 2 LPS浓度对鹅肠上皮细胞活性的影响 Fig. 2 Effects of LPS concentrations on viability of goose intestinal epithelial cells |
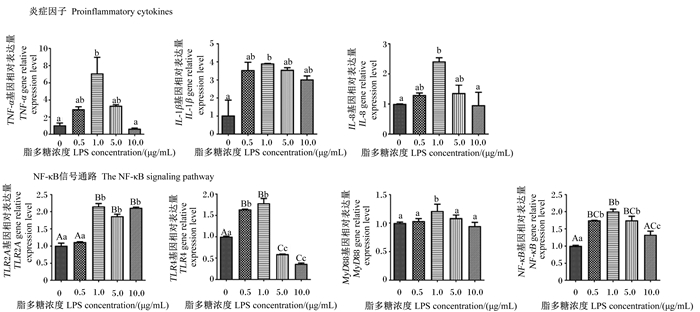
|
TLR2A: Toll样受体2A Toll-like receptor 2A; TLR4: Toll样受体4 Toll-like receptor 4; MyD88: 髓样分化因子88 myeloid differentia 88; NF-κB: 核转录因子-κB nuclear factor-κB; IL-1β: 白细胞介素-1β interleukin-1β; TNF-α: 肿瘤坏死因子-α tumor necrosis factor-α; IL-8:白细胞介素-8 interleukin-8。图 6同the same as Fig. 6。 图 3 LPS浓度对鹅肠上皮细胞促炎因子和NF-κB信号通路基因表达的影响 Fig. 3 Effects of LPS concentration on expressions of proinflammatory factors and NF-κB signaling pathway genes in goose intestinal epithelial cells |
试验使用浓度为0(对照)、100、200、300、400和500 mg/L的YC溶液处理鹅肠上皮细胞,评价YC对鹅肠上皮细胞活性的影响。由图 4可知,与对照组相比,当YC浓度为300 mg/L时,细胞活性显著升高(P < 0.05)。后续试验选取100 mg/L作为YC的低浓度处理,300 mg/L作为YC的中浓度处理,500 mg/L作为YC的高浓度处理。
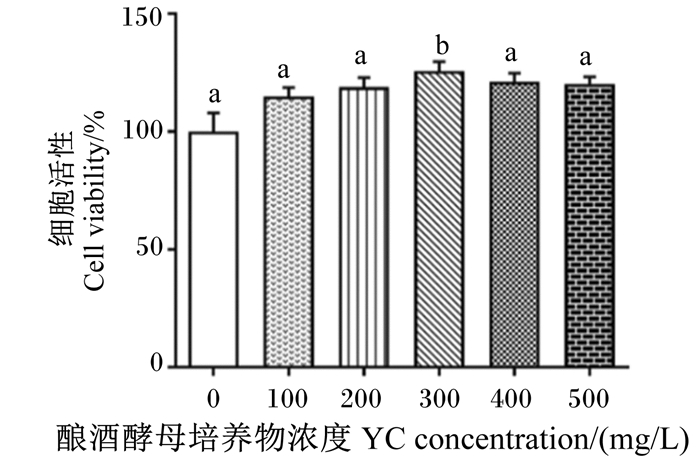
|
图 4 YC浓度对鹅肠上皮细胞细胞活性的影响 Fig. 4 Effects of YC concentration on viability of goose intestinal epithelial cells |
由图 5-A可知,在鹅肠上皮细胞中,与对照组相比,LPS增加细胞ROS产生;而YC可发挥减少肠上皮细胞氧化应激的功能,与LPS组相比,不同浓度YC预处理不同程度地减少细胞ROS生成。通过测定氧化应激相关指标发现(图 5-B),在鹅肠上皮细胞中,与对照组相比,LPS显著降低细胞SOD和CAT活性(P < 0.05),显著提高MDA和NO含量(P < 0.05)。与LPS组相比,LYC组对细胞氧化应激指标无显著影响(P>0.05);MYC组显著提高细胞SOD活性(P < 0.05),显著降低MDA和NO含量(P < 0.05);HYC组显著降低了细胞NO含量(P < 0.05)。
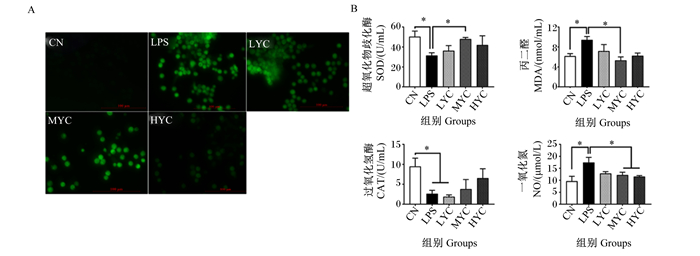
|
A:肠上皮细胞ROS生成;B:抗氧化相关指标。*: P < 0.05。 A: ROS synthesis of goose intestinal epithelial cells; B: antioxidant related indicators. *: P < 0.05. 图 5 YC预处理对LPS诱导的鹅肠上皮细胞氧化损伤的影响 Fig. 5 Effects of YC pretreatment on oxidative damage induced by LPS in goose intestinal epithelial cells |
由图 6可知,在细胞促炎因子表达方面,与对照组相比,LPS组极显著上调肠上皮细胞TNF-α和IL-1β基因相对表达量(P < 0.01),但MYC组TNF-α基因相对表达量显著下调(P < 0.05),HYC组IL-1β基因相对表达量显著下调(P < 0.05)。在NF-κB信号通路基因表达方面,与对照组相比,LPS组显著或极显著上调肠上皮细胞TLR2A(P < 0.01)、TLR4(P < 0.05)、MyD88(P < 0.01)和NF-κB(P < 0.01)基因相对表达量;与对照组相比,LYC组对LPS诱导的肠上皮细胞炎症反应无显著影响(P>0.05),MYC组细胞TLR2A(P < 0.01)和TLR4(P < 0.05)基因相对表达量显著或极显著下调,HYC组TLR2A(P < 0.01)、TLR4(P < 0.05)和NF-κB(P < 0.01)基因相对表达量显著或极显著下调。
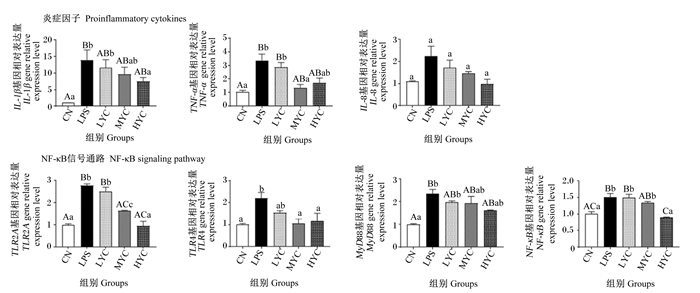
|
图 6 YC预处理对LPS诱导的鹅肠上皮细胞炎性因子及NF-κB信号通路基因表达的影响 Fig. 6 Effects of YC pretreatment on expressions of proinflammatory factors and NF-κB signaling pathway genes in goose intestinal epithelial cells |
肠上皮细胞是机体更新速度最快的一类细胞,其结构和功能完整性对动物健康具有重要作用。体外培养肠上皮细胞可进一步了解和模拟肠道生物学功能。目前,国内外关于分离、培养鹅肠上皮细胞的研究很少。李融[12]利用组织块种植法得到的鹅肠上皮细胞生长状况良好,细胞活性较强,经过纯化,得到了纯度较高的鹅肠上皮细胞。付晶等[13]通过酶消化法成功分离并培养原代鹅肠上皮细胞,可获得大量的健全肠绒毛隐窝单位。以上2种方法相比,组织块培养法得到的上皮细胞纯度更高,但酶消化法可以得到更多、更健全的隐窝单位。考虑到肠道炎症反应、免疫激活、应激等发生与隐窝功能密切相关,利用肠隐窝单位培养单层肠样结构具有肠上皮的关键特性,更有助于解析肠上皮整体功能的改变[14]。因此,本试验联合使用浓度为300 U/mL的胶原酶(Ⅺ型)和0.1 mg/mL的中性蛋白酶(Ⅰ型)消化收获大量健全肠隐窝单位,并培养成单层上皮细胞结构用于后续试验。
本研究通过LPS建立体外鹅小肠炎性损伤模型。作为病原相关分子模式(PAMPs)的代表物质,LPS可导致免疫激活和组织损伤,是建立肠上皮细胞炎性损伤模型的重要工具[15]。聚集的LPS于胞外形成LPS-LBP-sCD14三联复合物,继而作用于膜上TLRs并激活胞内MyD88/NF-κB信号级联反应[16-17]。TLR2/4可招募活化胞浆内的接头蛋白MyD88,活化的MyD88通过磷酸化级联反应使IκB磷酸化而降解,抑制解除后的NF-κB转位入核,启动靶基因(IL-1β、TNF-α等)转录,导致炎症发生与扩大[16-17]。在本试验中,LPS处理并没有导致鹅原代肠上皮细胞凋亡,但1 μg/mL LPS处理可诱导产生炎症反应,激活NF-κB信号通路,上调IL-1β、TNF-α等炎性因子基因表达,这与很多研究的结果[18]相一致。
YC的有效成分主要是酿酒酵母细胞的胞外代谢产物,饲喂YC对哺乳期犊牛[19]、断奶仔猪[20]、蛋鸡[21]等的生长性能、肠道健康和机体免疫均有促进作用,特别是可以增强机体非特异性免疫力,降低非洁净环境下的动物死亡率[21]。研究表明,YC中的酵母多糖通过与TLRs、补体受体3等细胞受体结合,启动机体免疫应答,具有免疫调节功能[22]。比如,可溶性β-葡聚糖可通过补体受体3激活抗体介导的补体系统降低炎性反应,改善宿主的防御机制[23]。本试验中,使用YC预处理LPS诱导的肠上皮细胞后,基于NF-κB通路传导的细胞炎症反应受到抑制,炎性因子基因表达下调。值得注意的是,YC对肠道免疫的调控是复杂的,存在维持调节免疫平衡的功能。一方面,酵母培养物中的甘露聚糖和β-葡聚糖可激活机体免疫系统,引发免疫应答,并以单核细胞、巨噬细胞和嗜中性粒细胞为主要靶细胞[24];另一方面,YC中丰富的生长因子、小肽、寡糖、维生素等物质可为细胞正常生长提供营养、维持上皮完整性、缓解炎性损伤、调节细胞因子表达等,达到保护肠上皮功能的作用[25]。由此发现,YC对肠上皮的保护是系统性的、多种途径并存的,并且YC对不同类型细胞的作用机制存在差异。
YC还可发挥抗氧化功能,缓解应激状态下细胞产生的氧化损伤。据报道,酵母多糖可提高机体SOD和GSH-Px活性,降低MDA含量,提高清除或抑制氧自由基的能力,避免细胞氧化损伤[26]。ROS是体内最关键的活性氧自由基之一;而NO对自由基损伤作用起放大效应,也是引起氧化应激损伤的主要自由基。SOD、GSH-Px、CAT等组成的抗氧化系统可通过消除肠道上皮细胞内的ROS来降低炎症因子和信号因子基因表达,对肠道上皮细胞起到保护作用[27]。其中,SOD活性可间接反映机体清除自由基能力,可将超氧自由基转化为过氧化氢,使细胞免受氧化应激损伤;MDA含量可反映机体脂质过氧化物的生成速率和强度,也反映出机体组织氧化损伤的程度;CAT与SOD共同组成生物体内活性氧防御系统,在清除超氧自由基、过氧化氢和过氧化物及阻止或减少羟基自由基形成等方面发挥重要作用[28]。已有研究证实,肉鸡饲粮中添加酵母细胞壁可提高21和42日龄空肠SOD活性和42日龄空肠GSH-Px活性[29]。本试验发现,LPS显著提高了鹅肠上皮细胞ROS生成,SOD活性下降,MDA含量升高,细胞出现明显氧化损伤;而使用YC预处理后,鹅肠上皮细胞ROS生成减少,SOD活性上调,MDA和NO含量降低,表明YC对LPS诱导的肠上皮细胞氧化损伤存在保护作用,可帮助细胞有效清除活性氧类物质,这可能是因为YC中还有的酵母多糖能直接作用于自由基(如羟基自由基),通过促进自由基进一步氧化为过氧自由基,而分解成对机体无害的产物,达到抗氧化作用[30]。
4 结论试验结果表明,YC不仅可通过调节鹅肠上皮免疫平衡,维持LPS诱导下的细胞正常功能,还可提高清除或抑制氧自由基的能力,缓解肠上皮细胞的炎性损伤和氧化应激。
| [1] |
范雪. 丁酸梭菌和枯草芽孢杆菌对扬州鹅生理与生产性能的影响[D]. 硕士学位论文. 扬州: 扬州大学, 2021. FAN X. Effects of Clostridium butyricum and Bacillus subtilis on physiology and production performance of Yangzhou geese[D]. Master's Thesis. Yangzhou: Yangzhou University, 2021. (in Chinese) |
| [2] |
F DA. Veterinary feed directive[J]. Federal Register, 2015, 80: 31707-31735. |
| [3] |
罗强, 李宁, 郑梓, 等. 酿酒酵母培养物对哺乳母猪繁殖性能的影响[J]. 家畜生态学报, 2021, 42(12): 67-72. LUO Q, LI N, ZHENG Z, et al. Effect of yeast culture on reproductive performance of lactating sows[J]. Acta Ecologae Animalis Domastici, 2021, 42(12): 67-72 (in Chinese). DOI:10.3969/j.issn.1673-1182.2021.12.011 |
| [4] |
ELGHANDOUR M M Y, TAN Z L, ABU HAFSA S H, et al. Saccharomyces cerevisiae as a probiotic feed additive to non and pseudo-ruminant feeding: a review[J]. Journal of Applied Microbiology, 2020, 128(3): 658-674. DOI:10.1111/jam.14416 |
| [5] |
VAN DEN ABBEELE P, DUYSBURGH C, RAKEBRANDT M, et al. Dried yeast cell walls high in beta-glucan and mannan-oligosaccharides positively affect microbial composition and activity in the canine gastrointestinal tract in vitro[J]. Journal of Animal Science, 2020, 98(6): skaa173. DOI:10.1093/jas/skaa173 |
| [6] |
孙红梅, 曹连宾, 郝力壮, 等. 酵母培养物对牦牛瘤胃发酵及甲烷产量的影响[J]. 江苏农业科学, 2015, 43(3): 177-182. SUN H M, CAO L B, HAO L Z, et al. Effects of yeast culture on rumen fermentation and methane production in yaks[J]. Jiangsu Agricultural Sciences, 2015, 43(3): 177-182 (in Chinese). DOI:10.15889/j.issn.1002-1302.2015.03.057 |
| [7] |
梁秀丽, 朱春霞, 潘韵. 酵母培养物在肉鸡生产中的应用试验研究[J]. 中国饲料, 2018(11): 59-61. LIANG X L, ZHU C X, PAN Y, et al. Study on the application of yeast culture in the broiler production[J]. Chinese Feed, 2018(11): 59-61. DOI:10.15906/j.cnki.cn11-2975/s.20181111 |
| [8] |
熊子标. 酵母培养物对四川白鹅生产性能、消化生理和机体免疫的影响[D]. 硕士学位论文. 重庆: 西南大学, 2020. XIONG Z B. Effect of yeast culture on production performance, digestive physiology and immunity of Sichuan white goose[D]. Master's Thesis. Chongqing: Southwest University, 2020. (in Chinese) |
| [9] |
TANIGUCHI K, KARIN M. NF-κB, inflammation, immunity and cancer: coming of age[J]. Nature Reviews Immunology, 2018, 18(5): 309-324. DOI:10.1038/nri.2017.142 |
| [10] |
JASTRZAB R, GRACZYK D, SIEDLECKI P. Molecular and cellular mechanisms influenced by postbiotics[J]. International Journal of Molecular Sciences, 2021, 22(24): 13475. DOI:10.3390/ijms222413475 |
| [11] |
魏方. 酿酒酵母培养物和提取物诱导绵羊瘤胃上皮细胞β-防御素-1表达及信号通路的研究[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2020. WEI F. Study on β-defensin-1 expression and signaling pathways induced by S. cerevisiae cultures and extracts in ovine ruminal epithelial cells[D]. Master's Thesis. Hohhot: Inner Mongolia Agricultural University, 2020. (in Chinese) |
| [12] |
李融. pcDNA3.0-SV40T重组质粒的构建及其在鹅小肠上皮细胞中的表达[D]. 硕士学位论文. 扬州: 扬州大学, 2009. LI R. Construction of recombinant plasmid pcDNA3.0-SV40T and expression in goose intestinal epithelial cells[D]. Master's Thesis. Yangzhou: Yangzhou University, 2009. (in Chinese) |
| [13] |
付晶, 林桐, 陈艾玲, 等. 茶多酚对过氧化氢诱导鹅小肠上皮细胞氧化损伤的保护作用[J]. 东北农业大学学报, 2020, 51(4): 61-69. FU J, LIN T, CHEN A L, et al. Protective effect of tea polyphenols on H2O2-induced oxidative stress in intestinal epithelial cells of goose embryo[J]. Journal of Northeast Agricultural University, 2020, 51(4): 61-69 (in Chinese). DOI:10.3969/j.issn.1005-9369.2020.04.008 |
| [14] |
THORNE C A, CHEN I W, SANMAN L E, et al. Enteroid monolayers reveal an autonomous WNT and BMP circuit controlling intestinal epithelial growth and organization[J]. Developmental Cell, 2018, 44(5): 624-633. DOI:10.1016/j.devcel.2018.01.024 |
| [15] |
TANG J, XU L Q, ZENG Y W, et al. Effect of gut microbiota on LPS-induced acute lung injury by regulating the TLR4/NF-kB signaling pathway[J]. International Immunopharmacology, 2021, 91: 107272. DOI:10.1016/j.intimp.2020.107272 |
| [16] |
DESAI J, STEIGER S, ANDERS H J. Molecular pathophysiology of gout[J]. Trends in Molecular Medicine, 2017, 23(8): 756-768. DOI:10.1016/j.molmed.2017.06.005 |
| [17] |
LONG D L, LIU M, LI H Y, et al. Dysbacteriosis induces abnormal neurogenesis via LPS in a pathway requiring NF-κB/IL-6[J]. Pharmacological Research, 2021, 167: 105543. DOI:10.1016/j.phrs.2021.105543 |
| [18] |
BIAN Y F, DONG Y Y, SUN J J, et al. Protective effect of kaempferol on LPS-induced inflammation and barrier dysfunction in a coculture model of intestinal epithelial cells and intestinal microvascular endothelial cells[J]. Journal of Agricultural and Food Chemistry, 2020, 68(1): 160-167. DOI:10.1021/acs.jafc.9b06294 |
| [19] |
徐晓锋, 金亚东, 张力莉, 等. 酵母培养物添加方式对哺乳期犊牛生长性能、粪便菌群及血清免疫指标的影响[J]. 中国饲料, 2018(1): 37-43. XU X F, JIN Y D, ZHANG L L, et al. Effects of different supplementation of yeast culture on growth performance, fecal microorganism and serum immune indexes of calves[J]. China Feed, 2018(1): 37-43 (in Chinese). |
| [20] |
刘明, 谭利伟, 杨凤娟, 等. 啤酒酵母提取物替代血浆蛋白粉对断奶仔猪生产性能、腹泻发生率和肠道形态的影响[J]. 中国畜牧杂志, 2017, 53(2): 116-121. LIU M, TAN L W, YANG F J, et al. Effects of replacement of dietary spray dried plasma protein with beer yeast extract on growth performance, diarrhea incidence and intestinal morphology of weaned piglets[J]. Chinese Journal of Animal Science, 2017, 53(2): 116-121 (in Chinese). |
| [21] |
王传龙, 乔鹏飞, 张善媚, 等. 富锗酵母菌培养物对蛋鸡抗氧化性能及血清生化免疫指标的影响[J]. 中国家禽, 2017, 39(21): 24-27. WANG C L, QIAO P F, ZHANG S M, et al. Effect of yeast germanium culture on antioxidant properties of eggs and serum biochemical immune indexes[J]. China Poultry, 2017, 39(21): 24-27 (in Chinese). |
| [22] |
SABER A, ALIPOUR B, FAGHFOORI Z, et al. Cellular and molecular effects of yeast probiotics on cancer[J]. Critical Reviews in Microbiology, 2017, 43(1): 96-115. |
| [23] |
STIER H, EBBESKOTTE V, GRUENWALD J. Immune-modulatory effects of dietary yeast beta-1, 3/1, 6-D-glucan[J]. Nutrition Journal, 2014, 13: 38. |
| [24] |
李振慧, 吴桂萍, 刘龙, 等. 酵母多糖对产蛋后期蛋鸡生产性能、免疫功能、血清生化指标和抗氧化能力的影响[J]. 动物营养学报, 2022, 34(4): 2413-2424. LI Z H, WU G P, LIU L, et al. Effects of yeast polysaccharide on performance, immune function, serum biochemical indices and antioxidant capacity of laying hens during late laying period[J]. Chinese Journal of Animal Nutrition, 2022, 34(4): 2413-2424 (in Chinese). |
| [25] |
VAN DER PEET-SCHWERING C M C, JANSMAN A J M, SMIDT H, et al. Effects of yeast culture on performance, gut integrity, and blood cell composition of weanling pigs[J]. Journal of Animal Science, 2007, 85(11): 3099-3109. |
| [26] |
李颍. 葡萄酒泥酵母水溶性多糖制备工艺优化及其体外抗氧化活性研究[D]. 硕士学位论文. 兰州: 甘肃农业大学, 2015. LI Y. Optimization of water soluble polysaccharide preparation fromwine yeast and its antioxidant activities in vitro[D]. Master's Thesis. Lanzhou: Gansu Agricultural University, 2015. (in Chinese) |
| [27] |
杨思博. 过氧化氢酶对热应激肉鸡抗氧化及肠道功能的影响[D]. 硕士学位论文. 沈阳: 沈阳农业大学, 2020. YANG S B. Effect of catalase on antioxidation and intestinal function of heat-stressed broilers[D]. Master's Thesis. Shenyang: Shenyang Agricultural University, 2020. (in Chinese) |
| [28] |
SHI C, CHEN X R, LIU Z J, et al. Oleuropein protects L-02 cells against H2O2-induced oxidative stress by increasing SOD1, GPx1 and CAT expression[J]. Biomedicine & Pharmacotherapy, 2017, 85: 740-748. |
| [29] |
WANG T, CHENG K, YU C Y, et al. Effects of a yeast-derived product on growth performance, antioxidant capacity, and immune function of broilers[J]. Poultry Science, 2021, 100(9): 101343. |
| [30] |
YU D H, BAO Y M, WEI C L, et al. Studies of chemical constituents and their antioxidant activities from Astragalus mongholicus Bunge[J]. Biomedical and Environmental Sciences, 2005, 18(5): 297-301. |




