2. 抗性基因工程与寒地生物多样性保护黑龙江省重点实验室, 齐齐哈尔 161006
2. Key Laboratory of Resistant Genetic Engineering and Cold Biodiversity Conservation of Heilongjiang Province, Qiqihar 161006, China
适当运动有助于身体健康[1],但急性力竭运动使机体细胞处于缺氧状态,导致细胞膜通透性增加,位于线粒体内膜上的呼吸链受到抑制,从而ATP生成减少,分解增加,生成大量活性氧(reactive oxygen species, ROS),使机体产生氧化应激(oxidative stress, OS)反应[2]。肝脏含有丰富的线粒体,因此是ROS攻击的主要器官[3]。正常状态下,机体内的ROS的生成和清除处在一个动态平衡状态,当机体产生ROS时,细胞内部清除ROS的酶促系统和非酶促系统将发挥作用,例如,谷胱甘肽(glutathione,GSH)等可以中和氧自由基,减少自由基对机体的损伤[4]。
清除ROS的酶促系统主要包括超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)和谷胱甘肽还原酶(glutathione reductase,GR)等。GSH-Px是机体内一种重要的催化分解过氧化氢的酶,可以起到保护细胞膜结构和功能完整的作用[5]。GR是一种将氧化型谷胱甘肽(glutathione oxidized,GSSG)还原成GSH的酶。GSH是参与体内氧化应激反应的重要还原剂,由γ-谷氨酸、半胱氨酸和甘氨酸组成,以巯基还原(GSH)和二硫键氧化(GSSG)形式存在[6]。其中GSH是主要形式,具有清除自由基、解毒、促进铁质吸收等多种重要生理功能[7]。GSH含量的多少是衡量机体抗氧化能力的重要因素[8]。此外,谷氨酰半胱氨酸连接酶(glutamate-cysteine ligase,GCL)是GSH合成限速酶,由谷氨酸-半胱氨酸连接酶催化亚基(glutamate-cysteine ligase catalytic subunit, GCLC)和谷氨酸-半胱氨酸连接酶调节亚基(glutamate-cysteine ligase modifier subunit, GCLM)组成,其表达受核转录因子E2相关因子2(nuclear factor E2 related factor 2,Nrf2)的调控[9]。Nrf2是氧化应激感受器,可以与抗氧化反应元件(ARE)特异性结合,调节编码抗氧化蛋白,当GCLC表达降低时,会导致GSH的合成减少,进而导致对ROS清除能力的下降,引起氧化损伤。机体受到氧化损伤后,会自动修复受到的损伤,而在修复过程中,GCLC与GCLM的表达都会升高,进而GSH的表达也会升高[10]。
当急性力竭运动产生的ROS超出机体的清除能力时,就会对机体特别是肝脏造成损伤。目前治疗急性肝脏损伤的药物有人参皂苷、蒲葵子、熊去胆碱胶囊[11]、雷公藤甲素[12]、糖皮质激素、中药复方861合剂等[13]。但这些药物原材料稀有,且副作用大,因此寻找来源广泛且治疗效果好的药物成为肝脏损伤研究的关键。
紫云英苷(astragalin, AG)是从百蕊草或杜仲等中草药中提取的黄酮类化合物,化学名称是山奈酚-3-O-葡萄糖苷,相对分子质量为448.38。其常温下呈黄色针晶状,熔点218~220 ℃,沸点823.2 ℃(760 mmHg),不溶于水,溶于甲醇、乙醇等有机溶剂[14]。研究表明,紫云英苷具有抗炎、抗氧化、抗过敏性皮炎、提高机体免疫力等作用[15]。但紫云英苷对小鼠肝脏氧化损伤的修复作用效果如何尚不清楚。本试验以C57BL/6J雄性小鼠为研究对象,通过急性力竭运动制备小鼠肝脏损伤模型,分别灌胃0.1 mL 50、100 mg/kg的紫云英苷后检测小鼠肝脏组织氧自由基的清除能力、GSH含量及其相关酶的活性,同时检测Nrf2基因以及Nrf2/ARE信号通路相关基因GCLC、GCLM的表达变化,初步探索紫云英苷对力竭运动后小鼠的肝脏损伤的修复能力,为肝脏损伤治疗及紫云英苷的开发应用提供新思路。
1 材料与方法 1.1 试验材料试验动物:48只8周龄无特定病原体(SPF)级雄性C57BL/6J小鼠,购自长春亿斯实验动物技术有限责任公司。试验开始前,动物适应环境1周。对动物的使用与饲养严格遵守国家实验动物福利伦理的相关规定以及齐齐哈尔大学实验动物管理与使用条例。
试药试剂:紫云英苷(纯度为98%)购自源叶生物科技有限公司,二甲基亚砜(DMSO)、RIPA裂解液购自上海碧云天生物技术有限公司,GSH、GSH-Px、GR检测试剂盒购自南京建成生物工程研究所,BCA蛋白质测定试剂盒和Trizol试剂购自美国赛默飞世尔科技有限公司,cDNA反转录试剂盒购自上海东洋纺生物科技有限公司,荧光定量PCR试剂盒购自宝生物工程(大连)有限公司,Nrf2、GCLC、GCLM和β-肌动蛋白(β-actin)一抗购自武汉三鹰生物技术有限公司,二抗购自LI-COR公司。
试验仪器:Spark10M多功能酶标仪(Tecan, 瑞士)、Z32HK高速台式冷冻离心机(Hermle, 德国)、Thermo Electron(-80 ℃)超低温冰箱(Thermo, 美国)、实时荧光定量PCR仪(Eppendorf, 德国)、NanoDropND-2000C微量紫外分光光度计(Thermo, 美国)、电子分析天平(北京赛多利斯仪器系统有限公司)。
1.2 试验方法将48只8周龄雄性C57BL/6J小鼠在实验室饲养1周,基础饲粮喂养,正常饮水,室温环境生存,在试验开始前进行游泳测试。小鼠分组及急性力竭运动处理参照祝锴烨等[26]的报道:将小鼠随机分为4组,分别为DMSO组、力竭运动组、50 mg/kg BW紫云英苷组、100 mg/kg BW紫云英苷组,每组3个重复,每个重复4只。除DMSO组外,其余3组小鼠进行一次性游泳4 h。2个紫云英苷组在力竭运动后分别灌胃0.1 mL由DMSO溶解的50和100 mg/kg BW紫云英苷,力竭运动组在力竭运动后灌胃等量生理盐水,DMSO组灌胃等量生理盐水配制的0.1% DMSO。灌胃1 h后将小鼠断颈处死后冰上解剖取肝脏,预冷生理盐水洗去肝脏表面血液,滤纸吸干,液氮速冻后保存在-80 ℃直至分析。
1.3 检测指标 1.3.1 小鼠肝脏中抗氧化指标的测定根据试剂盒操作步骤对肝脏组织进行相应处理,检测肝脏中羟自由基(·OH)和超氧阴离子(O2-)清除能力以及GSH含量、GSH-Px和GR活性。
1.3.2 小鼠肝脏中抗氧化相关基因表达的检测从-80 ℃冰箱取出肝脏组织,剪取一定量肝脏组织于液氮中研磨成粉末,加入1 mL Trizol试剂提取总RNA,用NanoDropND-2000C微量紫外分光光度计进行定量分析。取1 μg RNA样品,按照ReverTra Ace qPCR RT Master Mix with gDNA Remover反转录试剂盒说明书进行反转录,获得cDNA。以各组cDNA为模板,β-actin基因为内参,进行实时荧光定量PCR(qRT-PCR)。反应体系为10 μL:TB Green Premix Ex TaqⅡ 5 μL,cDNA 1.5 μL,上、下游引物各0.5 μL,ddH2O 2.5 μL。反应条件:95 ℃预变性30 s,95 ℃ 1 min,60 ℃ 30 s,40个循环,得到Nrf2、GCLC、GCLM、β-actin mRNA的Ct值,用2-△△Ct法计算各目的基因mRNA的相对表达量。所需引物均由上海生物工程有限公司合成,引物序列见表 1。
|
|
表 1 实时荧光定量PCR引物序列 Table 1 Primer sequences for qRT-PCR |
从-80 ℃冰箱肝脏组织,剪取一定量肝脏组织于液氮中研磨成粉末,加入1 mL RIPA裂解液,按照RIPA裂解液(强)说明书提取蛋白质,利用BAC法测定蛋白质浓度后,取10 μg进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)。然后采用湿转法将凝胶中的目的蛋白电转印到聚偏氟乙烯(PVDF)膜上。用封闭液(含5%脱脂奶粉)孵育1 h后,加入用TBST按照1 ∶ 2 000稀释的Nrf2、GCLC、GCLM和β-actin一抗4 ℃孵育过夜;0.2% TBS-Tween洗膜3次,15 min/次;二抗室温避光孵育1 h;0.2% TBS-Tween洗膜3次,每次15 min;Odyssey红外荧光扫仪检测条带,并进行灰度扫描,用ImageJ进行灰度分析。
1.4 统计分析所有数据采用SPSS 22.0软件进行t检验或方差分析,计量资料数据以平均值±标准差(mean±SD)表示,以P<0.05表示差异显著,以P<0.01表示差异极显著。数据通过GraphPad Prism 5.0软件进行作图。
2 结果与分析 2.1 紫云英苷对小鼠肝脏中·OH和O2-清除能力的影响紫云英苷对小鼠肝脏中·OH和O2-清除能力的影响见表 2。与DMSO组相比,力竭运动组小鼠肝脏中·OH和O2-清除能力分别降低54%(P < 0.01)和43%(P < 0.01);与力竭运动组相比,灌胃浓度为50和100 mg/kg的紫云英苷均能增强力竭运动后小鼠肝脏中·OH和O2-清除能力,分别使·OH清除能力提高1.45(P < 0.05)和1.25倍(P < 0.01),O2-清除能力提高1.78(P < 0.01)和1.95倍(P < 0.01)。
|
|
表 2 紫云英苷对小鼠肝脏中·OH和O2-清除能力的影响 Table 2 Effects of astragalin on hepatic ·OH and O2- scavenging capacity of mice |
紫云英苷对小鼠肝脏中GSH含量的影响见表 3。与DMSO组相比,力竭运动组小鼠肝脏中GSH含量降低27%(P < 0.05);与力竭运动组相比,灌胃浓度为50和100 mg/kg BW的紫云英苷均可提高力竭运动后小鼠肝脏中GSH含量,分别使GSH含量提高1.36(P < 0.05)和2.21倍(P < 0.01)。上述结果表明紫云英苷可显著改善由力竭运动造成的小鼠肝脏中GSH含量的降低。
|
|
表 3 紫云英苷对小鼠肝脏中GSH含量的影响 Table 3 Effects of astragalin on hepatic GSH content of mice |
紫云英苷对小鼠肝脏中GSH-Px和GR活性的影响见表 4。与DMSO组相比,力竭运动组的小鼠肝脏中GSH-Px和GR活性分别降低32%(P < 0.01)和37%(P < 0.05);与力竭运动组相比,灌胃浓度为50和100 mg/kg BW的紫云英苷均可提高小鼠肝脏中GSH-Px和GR活性,分别使GSH-Px活性提高1.54(P < 0.01)和1.99倍(P < 0.01),GR活性提高1.42(P < 0.01)和1.62倍(P < 0.01)。
|
|
表 4 紫云英苷对小鼠肝脏GSH-Px和GR活性的影响 Table 4 Effects of astragalin on hepatic GSH-Px and GR activities of mice |
qRT-PCR结果(图 1-A)显示,与DMSO组相比,力竭运动组小鼠肝脏中Nrf2和GCLM的mRNA相对表达量显著降低(P < 0.05),GCLC的mRNA相对表达量没有显著变化(P>0.05);与力竭运动组相比,灌胃浓度为50和100 mg/kg BW的紫云英苷均可使小鼠肝脏中Nrf2、GCLC、GCLM的mRNA相对表达量显著或极显著升高(P < 0.05或P < 0.01)(图 1-A)。
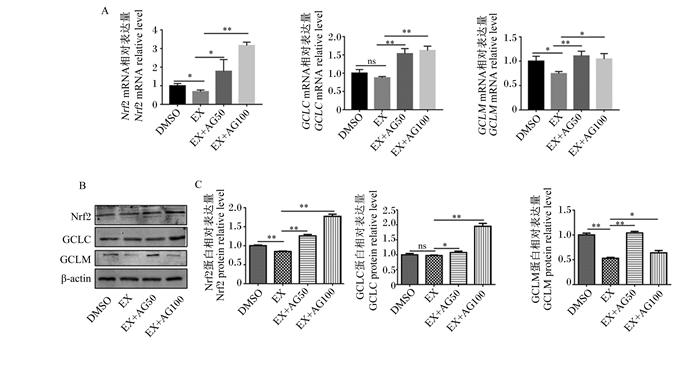
|
GCLC:谷氨酸-半胱氨酸连接酶催化亚基glutamate-cysteine ligase catalytic subunit;GCLM:谷氨酸-半胱氨酸连接酶调节亚基glutamate-cysteine ligase modifier subunit;Nrf2:受核转录因子E2相关因子2 nuclear factor E2 related factor 2;β-actin:β-肌动蛋白;DMSO:DMSO组DMSO group;EX:力竭运动组exhaustive exercise group;EX+AG50:50 mg/kg BW紫云英苷组50 mg/kg BW astragalin group;EX+AG100:100 mg/kg BW紫云英苷组100 mg/kg BW astragalin group。 数据柱标注“ns”表示没有显著差异(P>0.05),标注“*”表示差异显著(P<0.05),标注“* *”表示差异极显著(P<0.01)。 Data columns with "ns" indicated no significant difference (P > 0.05), with "*" indicated significant difference (P < 0.05), and with "* *" indicated extremely significant difference (P < 0.01). 图 1 紫云英苷对小鼠肝脏中Nrf2、GCLC、GCLM基因和蛋白表达的影响 Fig. 1 Effects of astragalin on expression of hepatic Nrf2, GCLC and GCLM genes and proteins of mice |
Western blot结果(图 1-B、图 1-C)显示,力竭运动组小鼠肝脏中Nrf2和GCLM的蛋白相对表达量极显著降低(P < 0.01),GCLC的蛋白相对表达量没有显著变化(P>0.05);与力竭运动组相比,灌胃浓度为50和100 mg/kg BW的紫云英苷可使小鼠肝脏中Nrf2、GCLC、GCLM的蛋白相对表达量显著或极显著升高(P < 0.05或P < 0.01)。
3 讨论研究发现,健康机体内自由基的形成和清除维持在一定的动态平衡范围内[16],当进行剧烈运动时机体会产生大量自由基[17],而机体清除自由基的能力有限,当大量的自由基不能及时从体内清除时,就会导致机体产生氧化应激损伤。肝脏作为机体重要的解毒器官,大量的自由基会破坏肝脏组织细胞膜,使肝细胞发生氧化应激反应,产生更多的自由基,造成恶性循环,从而造成肝脏损伤[18]。祝锴烨等[19]的研究发现,急性力竭运动(一次性游泳4 h)会导致小鼠肝脏组织的抗氧化能力下降和氧化损伤。本试验结果也证实力竭运动组的小鼠肝脏对·OH和O2-的清除能力比DMSO组小鼠降低,表明力竭运动已对小鼠肝脏造成损伤,肝脏损伤模型制备成功。
研究表明机体中主要存在2类抗氧化系统,一类是酶抗氧化系统,包括SOD、GSH-Px以及过氧化氢酶(CAT)等;另一类是非酶类抗氧化系统,包括维生素D、维生素E、GSH、褪黑素、α-硫辛酸、类胡萝卜素以及微量元素铜、锌、硒等[20-22]。GSH-Px是机体内存在的一种重要的过氧化物分解酶,可以催化GSH转化成GSSG,使有毒的过氧化物转化为无毒的羟基化合物,同时促进过氧化氢的分解[23]。GSH是机体中重要的抗氧化剂与自由基清除剂,普遍存在于植物、微生物和所有哺乳动物细胞内,GSH可以作为GSH-Px催化反应的底物,还原过氧化氢和过氧化物,使机体内的氧自由基维持在一个较低的水平,以免对机体造成损伤[24]。本试验结果表明,力竭运动组小鼠肝脏中GSH含量比DMSO组小鼠显著降低,同时力竭运动组小鼠肝脏中GSH-Px与GR活性相比DMSO组的小鼠也显著或极显著下降,说明一次性游泳4 h的力竭运动小鼠肝脏组织消耗了大量的GSH,产生了大量的ROS。
研究表明,植物源黄酮类化学物具有抗氧化作用[25]。小鼠灌胃苜蓿总黄酮后其肝脏和肾脏组织中的SOD活性升高而MDA含量显著降低,进而发挥清除ROS的功能[26]。紫云英苷作为一种黄酮类化合物,可以起到抗炎、抗菌、抗过敏、抗氧化等作用,它可以有效清除ROS,与过氧自由基作用来终止多不饱和脂肪酸自氧化过程中的自由基链反应[27]。有研究报道,与plubocatechine A、雷杜辛、表儿茶素、槲皮素相比,在相同剂量下紫云英苷的抗氧化活性是最高的[28]。祝锴烨等[19]研究发现,灌胃50或100 mg/kg BW的紫云英苷均不会对小鼠肝脏造成损伤。本试验结果表明,与力竭运动组小鼠相比,力竭运动后灌胃50或100 mg/kg BW紫云英苷的小鼠肝脏中GSH含量显著或极显著提高,GSH-Px与GR活性极显著升高,同时对·OH和O2-的清除能力也显著或极显著增强。这一结果表明紫云英苷对小鼠的肝脏损伤有一定的修复作用。
研究发现,当机体发生氧化应激时,会导致蛋白激酶发生磷酸化,进而影响Nrf2与Keap1解耦连并转于细胞核内,启动ARE调控的抗氧化酶基因的转录与表达,从而调控Nrf2下游基因GCL表达[29]。GCL是GSH合成限速酶,由2个亚基GCLC和GCLM组成[9]。当发生氧化应激后GCLC和GCLM表达量会降低,进而影响GSH、GSH-Px表达,最终影响对·OH和O2-的清除能力[30]。本试验结果表明,急性力竭运动导致肝脏组织发生氧化应激损伤时,与DMSO组相比,力竭运动组小鼠肝脏中Nrf2、GCLM的mRNA和蛋白相对表达量显著或极显著下降,GCLC的mRNA和蛋白相对表达量略有降低;灌胃50或100 mg/kg BW紫云英苷组的小鼠肝脏中Nrf2、GCLC、GCLM的mRNA和蛋白相对表达量与力竭运动组小鼠相比显著或极显著升高。
综合本试验结果可知,紫云英苷可通过上调Nrf2基因表达进而调节其下游的GCLC、GCLM基因表达,最终提高小鼠肝脏中GSH含量,增强小鼠肝脏的抗氧化能力,并在一定程度上修复力竭运动导致的小鼠肝脏损伤。
4 结论综上所述,适量的紫云英苷可通过上调Nrf2以及其调控的下游因子GCLC和GCLM基因的表达在一定程度上修复力竭运动导致的小鼠肝脏损伤。
| [1] |
CHOW L S, GERSZTEN R E, TAYLOR J M, et al. Exerkines in health, resilience and disease[J]. Nature Reviews Endocrinology, 2022, 18(5): 273-289. DOI:10.1038/s41574-022-00641-2 |
| [2] |
ZOROV D B, JUHASZOVA M, SOLLOTT S J. Mitochondrial reactive oxygen species (ROS) and ROS-induced ROS release[J]. Physiological Reviews, 2014, 94(3): 909-950. DOI:10.1152/physrev.00026.2013 |
| [3] |
ZHOU J S, LI A, LI X J, et al. Dysregulated mitochondrial Ca2+ and ROS signaling in skeletal muscle of ALS mouse model[J]. Archives of Biochemistry and Biophysics, 2019, 663: 249-258. DOI:10.1016/j.abb.2019.01.024 |
| [4] |
毛丽娟, 许豪文. 运动对大鼠肝脏GSH、GSSG含量及GSH/GSSG的影响[J]. 体育与科学, 2004, 25(1): 60-63, 34. MAO L J, XU H W. Exercise effects on the content of GSH, GSSG and GSH/GSSG ratio in liver[J]. Journal of Sports & Science, 2004, 25(1): 60-63, 34 (in Chinese). DOI:10.3969/j.issn.1004-4590.2004.01.018 |
| [5] |
何亮伟, 耿婷, 李艳静, 等. 谷胱甘肽反应性代谢物引起药物性肝损伤的机制研究进展[J]. 中国药房, 2017, 28(7): 990-994. HE L W, GENG T, LI Y J, et al. Progress in mechanism of drug-induced liver injury induced by glutathione reactive metabolites[J]. China Pharmacy, 2017, 28(7): 990-994 (in Chinese). |
| [6] |
王月明, 于振海, 熊艳蕾, 等. 力竭运动诱导的大鼠红细胞氧化应激对谷胱甘肽合成的影响及其机制探讨[J]. 中国细胞生物学学报, 2018, 40(2): 223-230. WANG Y M, YU Z H, XIONG Y L, et al. Effects of exhaustive exercise induced oxidative stress on glutathione synthesis in rat erythrocytes and its mechanism[J]. Chinese Journal of Cell Biology, 2018, 40(2): 223-230 (in Chinese). |
| [7] |
孙菲菲, 韩明子, 金世柱, 等. 不同剂量还原型谷胱甘肽对大鼠急性肝损伤的修复作用[J]. 胃肠病学和肝病学杂志, 2009, 18(11): 1037-1039. SUN F F, HAN M Z, JIN S Z, et al. Repair role of reduced glutathione of different dose on acute liver injury of mice[J]. Chinese Journal of Gastroenterology and Hepatology, 2009, 18(11): 1037-1039 (in Chinese). DOI:10.3969/j.issn.1006-5709.2009.11.018 |
| [8] |
侯潇男. 高压电烧伤大鼠血清GSSG、GR的变化及乌司他丁的干预作用[D]. 硕士学位论文. 石家庄: 河北医科大学, 2017. HOU X N. The change of GSSG, GR in the plasma which were received high-voltage electrical burn and the intervention effect of ulinastatin[D]. Master's Thesis. Shijiazhuang: Hebei Medical University, 2017. (in Chinese) |
| [9] |
钟海, 吴维权, 唐飞, 等. NRF2信号通路在三氯乙烯致HepG2细胞氧化应激中的作用[J]. 中国职业医学, 2020, 47(6): 660-665. ZHONG H, WU W Q, TANG F, et al. Role of NRF2 signaling pathway in trichloroethylene-induced oxidative stress in HepG2 cells[J]. China Occupational Medicine, 2020, 47(6): 660-665 (in Chinese). |
| [10] |
胡跃强, 唐农, 王启芝, 等. 实验性脑缺血损伤大鼠Nrf2/ARE信号通路相关基因NQO1、GCLC和GCLM表达的变化[J]. 中风与神经疾病杂志, 2019, 36(10): 873-876. HU Y Q, TANG N, WANG Q Z, et al. The expression changes of Nrf2/ARE signaling pathway related genes NQO1, GCLC and GCLM in rats with experimental cerebral ischemia reperfusion injury[J]. Journal of Apoplexy and Nervous Diseases, 2019, 36(10): 873-876 (in Chinese). |
| [11] |
冯书芳. 熊去氧胆酸胶囊治疗抗肿瘤药所致急性药物性肝损伤的疗效观察[J]. 中国校医, 2021, 35(8): 621-622. FENG S F. Observation on the therapeutic effect of ursodeoxycholic acid capsule on acute drug-induced liver injury caused by antineoplastic drugs[J]. Chinese Journal of School Doctor, 2021, 35(8): 621-622 (in Chinese). |
| [12] |
卫博文, 蒋杨雨, 曹丹, 等. 雷公藤甲素对Con A诱导小鼠急性肝损伤的保护作用及机制[J]. 现代生物医学进展, 2021, 21(14): 2607-2611. WEI B W, JIANG Y Y, CAO D, et al. Protective effect and mechanisms of triptolide on acute liver injury induced by Concanavalin A in mice[J]. Progress in Modern Biomedicine, 2021, 21(14): 2607-2611 (in Chinese). |
| [13] |
王睿, 高秉红, 李平. 药物对肝损伤的影响和干预研究概况[J]. 甘肃医药, 2021, 40(4): 294-296. WANG R, GAO B H, LI P. Research status of drug effect and intervention on hepatic injury[J]. Gansu Medical Journal, 2021, 40(4): 294-296 (in Chinese). |
| [14] |
聂龙, 彭磊, 李钰芳, 等. 紫云英苷生物活性及其机制的研究进展[J]. 热带农业科学, 2020, 40(6): 64-70. NIE L, PENG L, LI Y F, et al. Research advances in the biological activities and mechanism of astragalin[J]. Chinese Journal of Tropical Agriculture, 2020, 40(6): 64-70 (in Chinese). |
| [15] |
TAN W, YU K Q, LIU Y Y, et al. Anti-fatigue activity of polysaccharides extract from Radix Rehmanniae Preparata[J]. International Journal of Biological Macromolecules, 2012, 50(1): 59-62. DOI:10.1016/j.ijbiomac.2011.09.019 |
| [16] |
吕磊, 李瑶, 王永园, 等. 运动预适应减轻一次性运动力竭大鼠心肌凋亡及其机制研究[J]. 东南国防医药, 2021, 23(3): 225-229. LYU L, LI Y, WANG Y Y, et al. Exercise preconditioning alleviates myocardial apoptosis and its mechanism in rats after exhaustive exercise[J]. Military Medical Journal of Southeast China, 2021, 23(3): 225-229 (in Chinese). |
| [17] |
龙泳君, 廖艳萍, 孙麟. 一次力竭运动对雌性大鼠琥珀酸脱氢酶的影响[J]. 当代畜禽养殖业, 2021(4): 29-31. LONG Y J, LIAO Y P, SUN L. Effect of an exhaustive exercise on succinate dehydrogenase in female rats[J]. Modern Livestock and Poultry Breeding Industry, 2021(4): 29-31 (in Chinese). |
| [18] |
XU J S, LI Y. Effects of salidroside on exhaustive exercise induced oxidative stress in rats[J]. Molecular Medicine Reports, 2012, 6(5): 1195-1198. |
| [19] |
祝锴烨, 吴秋雪, 罗海静, 等. 紫云英苷对急性力竭运动小鼠肝脏组织中miR-155表达的影响[J]. 动物营养学报, 2021, 33(12): 7062-7069. ZHU K Y, WU Q X, LUO H J, et al. Effects of astragalin on expression of miR-155 in liver tissue of mice after acute exhaustive exercise[J]. Chinese Journal of Animal Nutrition, 2021, 33(12): 7062-7069 (in Chinese). |
| [20] |
KE C Y, YANG F L, WU W T, et al. Vitamin D3 reduces tissue damage and oxidative stress caused by exhaustive exercise[J]. International Journal of Medical Sciences, 2016, 13(2): 147-153. |
| [21] |
吴严冰. 白藜芦醇对力竭运动小鼠肝损伤的保护作用[J]. 世界华人消化杂志, 2015, 23(19): 3117-3122. WU Y B. Resveratrol protects the liver of exhaustively exercised mice[J]. World Chinese Journal of Digestology, 2015, 23(19): 3117-3122 (in Chinese). |
| [22] |
方俊, 卢向阳, 蒋红梅, 等. 猪血多肽成分及其清除活性氧的能力观察[J]. 中国临床康复, 2006, 10(17): 122-124. FANG J, LU X Y, JIANG H M, et al. Ingredient of polypeptide of swine blood and its capacity to scavenge active oxygen[J]. Chinese Journal of Clinical Rehabilitation, 2006, 10(17): 122-124 (in Chinese). |
| [23] |
宋玉果, 王涤新. 谷胱甘肽作为脂质过氧化损伤指标的研究[J]. 中华预防医学杂志, 1999, 33(5): 317-319. SONG Y G, WANG D X. Study on glutathione as an index of lipid peroxidation damage[J]. Chinese Journal of Preventive Medicine, 1999, 33(5): 317-319 (in Chinese). |
| [24] |
HUANG C C, HUANG W C, YANG S C, et al. Ganoderma tsugae hepatoprotection against exhaustive exercise-induced liver injury in rats[J]. Molecules, 2013, 18(2): 1741-1754. |
| [25] |
曹志超, 顾翔, 苏佩清. 黄酮类化合物抗氧化及其作用机制的研究进展[J]. 实用临床医药杂志, 2009, 13(13): 110-112. CAO Z C, GU X, SU P Q, et al. Research advances on antioxidative functions and mechanism of flavonoids[J]. Journal of Clinical Medicine in Practice, 2009, 13(13): 110-112 (in Chinese). |
| [26] |
李宝兰, 张咏梅, 卢小康, 等. 苜蓿总黄酮对小鼠脂类代谢及氧自由基的影响[J]. 草业科学, 2009, 26(8): 93-96. LI B L, ZHANG Y M, LU X K, et al. Impact of total flavone of alfalfa on the lipid metabolism and oxygen-derived free radicals in mice[J]. Pratacultural Science, 2009, 26(8): 93-96 (in Chinese). |
| [27] |
李丰阳. 紫云英苷抗LPS诱发的小鼠乳腺炎作用及机制研究[D]. 硕士学位论文. 长春: 吉林大学, 2014. LI F Y. The anti-inflammatory effects and mechanisms of astragalin on LPS-induced mouse mastitis[D]. Master's Thesis. Changchun: Jilin University, 2014. (in Chinese) |
| [28] |
耿佳琳, 焦玉苗, 焉炳飞, 等. 罗布麻中5种黄酮化合物抗氧化活性DFT研究[J]. 当代化工, 2015, 44(12): 2763-2765. GENG J L, JIAO Y M, YAN B F, et al. Density functional theory study on antioxidation activity of five flavones from Apocynum venetum[J]. Contemporary Chemical Industry, 2015, 44(12): 2763-2765 (in Chinese). |
| [29] |
邰宵辉, 张玲芳, 张旭霞, 等. Nrf2/ARE信号通路及其在肿瘤发生发展中作用的研究进展[J]. 现代肿瘤医学, 2021, 29(17): 3113-3116. TAI X H, ZHANG L F, ZHANG X X, et al. Progress of Nrf2/ARE signaling pathway and tumor genesis and development[J]. Journal of Modern Oncology, 2021, 29(17): 3113-3116 (in Chinese). |
| [30] |
原亮. 二氢杨梅素通过调节Nrf2信号通路缓解LPS诱导的鸡肝损伤[D]. 硕士学位论文. 哈尔滨: 东北农业大学, 2021. YUAN L. Dihydromyricetin attenuates LPS-induced chicken hepatic injury by regulating Nrf2 signal pathway[D]. Master's Thesis. Harbin: Northeast Agricultural University, 2021. (in Chinese) |




