短链有机酸主要包括乳酸和挥发性脂肪酸(volatile fatty acids,VFA)等,广泛存在于反刍动物前胃以及其他草食动物和包括人在内的杂食动物的后肠道内,主要由消化道微生物通过利用碳水化合物进行混合酸发酵而产生。其中,VFA是分子中包含1~7个碳原子的直链或支链脂肪酸的统称,主要包括甲酸、乙酸、丙酸、丁酸、异丁酸、戊酸和异戊酸等。据报道,这些短链有机酸能够分别为反刍动物、人或其他杂食动物和草食动物提供约70%、10%和20%~30%的能量需要[1]。在这些短链有机酸中,乙酸、丙酸和丁酸是微生物发酵碳水化合物的主要产物,约占正常生理状态下肠道内容物中短链有机酸的95%,也是宿主尤其是反刍动物可利用代谢能的主要形式[1]。戊酸主要由乙酸和丙酸缩合而成,而支链VFA如异丁酸、异戊酸和2-甲基丁酸,则主要由蛋白降解菌利用支链氨基酸通过脱氨基作用而产生,它们在肠道短链有机酸中的占比通常不超过5%[1]。甲酸虽然也是肠道微生物混合酸发酵的主要产物之一,但它是产甲烷菌的主要发酵底物,常以中间产物的形式参与肠道甲烷生成作用[2]。乳酸主要由乳酸菌进行混合酸发酵产生,其在正常的肠道内环境中浓度通常并不高,但在适宜乳酸菌生长的低pH的肠道内环境中,其浓度会迅速累积,严重时可导致反刍动物瘤胃急性酸中毒[3]。此外,短链有机酸尤其是VFA还会影响上皮细胞生长、宿主血液流速以及肠道正常的分泌和吸收功能,甚至可能间接影响胆固醇合成以及胰岛素和胰高血糖素的分泌[1]。因此,快速、简便、准确地同时测定肠道内容物中短链有机酸浓度,对研究动物对营养物质的消化、吸收和代谢过程,以及肠道甲烷生成作用乃至代谢性疾病均具有重要意义。
目前,肠道内容物中短链有机酸浓度的检测方法主要有高效液相色谱法[4-6]、离子色谱法[7-8]、气相色谱法[9-11]、毛细管电泳法[12]、核磁共振波谱法[13-14]、气相色谱-质谱联用法[15]等。传统的蒸馏滴定法由于选择性差、检测效率低,目前已很少使用[12];也有研究者使用拉曼光谱检测VFA,但该方法目前能够测定的VFA种类十分有限[16]。气相色谱法灵敏度和分辨率高、重现性好,是目前最为常用的VFA定量方法;但直接气相色谱法仅能测定乙酸等挥发性较强的酸,对于甲酸和乳酸则很难直接检测,需要进行衍生化处理,而衍生化处理则会导致误差来源增加,结果重现性变差,且所用的衍生化试剂还会对环境造成污染[12]。离子色谱法灵敏度高、重现性好,且能同时测定乳酸和多种VFA,但离子色谱仪依赖性较强,价格相对较为昂贵,普适性较差。毛细管电泳法前处理简单、检测效率高、灵敏度好、检出限也可满足实际需要,但其对试剂纯度的要求非常高,且电解质的选择相对较为复杂[12]。核磁共振波谱法无需对样品进行复杂的前处理,方法灵活且无偏向性,但其灵敏度较低,动态范围有限,且仪器维护和运行成本更为高昂,普适性更差[13-14]。液相色谱灵敏度高、线性范围较宽、重现性好,能够分析70%以上的有机物,且正常条件下色谱柱可长时间重复利用,样品前处理也较为简单[14]。然而,传统的液相色谱对乳酸和部分VFA的分离度较差,且目前尚没有全面地同时分析肠道内容物中乳酸、甲酸和常见的VFA的研究报道。
以聚合树脂(如聚苯乙烯-二乙烯基苯)为填料的色谱柱可基于配体交换反应来保留和有效地分离含有醇羟基或羧基的碳水化合物,如糖、醇和有机酸等。该类色谱柱对仪器要求简单,可在标准的高效液相色谱(high performance liquid chromatography,HPLC)系统中运行,且流动相仅使用纯水或稀酸即可。因此,本研究拟利用配体交换柱基于高效液相色谱仪建立一种同时测定肠道内容物中乳酸和甲酸等8种动物消化道常见有机酸浓度的外标分析方法,并使用瘤胃液为样品对所建方法进行检验,以期为研究营养物质在动物肠道中的消化吸收以及肠道甲烷生成乃至代谢性疾病提供技术支撑。
1 材料与方法 1.1 仪器与设备安捷伦高效液相色谱仪(Agilent 1260 Infinity Ⅱ,安捷伦科技有限公司,德国),配备G7129A型自动进样器和柱温箱模块、G7111A型四元梯度泵和在线脱气机模块、Hi-Plex H配体交换色谱柱(300 mm×7.7 mm,8 μm)、G7114A型可变波长检测器、OpenLAB CDS ChemStation型色谱工作站。ELGA LabWater超纯水制备仪(PURELAB Ultra Genetic,威立雅水处理技术有限公司,英国)。高速冷冻离心机(AXTGL20M,盐城市安信实验仪器有限公司,中国)。奥豪斯电子天平(OHAUS AR1140,奥豪斯公司,美国)。
1.2 试剂与肠道内容物样品甲酸(99%)、乙酸(99.8%)、丙酸(99.5%)、异丁酸(99.5%)、丁酸(99.5%)、异戊酸(99.0%)和戊酸(99.5%)对照品均为优级纯,购自上海麦克林生化科技有限公司;BePure乳酸标准品(纯度90.2%)购自北京曼哈格生物科技有限公司;偏磷酸购自金克隆(北京)生物技术有限公司;浓硫酸购自成都市科隆化学品有限公司。肠道内容物样品选用瘤胃液,于晨饲后3 h采集自装有永久性瘤胃瘘管的晋南牛(体重约350 kg),冰水浴后5 400 r/min转速下4 ℃低温离心10 min,取上清液使用液氮冷冻,-80 ℃冰箱保存备用。
1.3 色谱条件的考察与筛选使用电子天平和移液枪通过减重法准确称取0.042 2 g甲酸、0.534 0 g乙酸、0.607 7 g丙酸、0.058 5 g异丁酸、0.237 0 g丁酸、0.058 8 g异戊酸、0.073 1 g戊酸和0.070 2 g乳酸标准品,转移至盛有0.005 mmol/L硫酸溶液的100 mL容量瓶中,定容,配制成乳酸、甲酸、乙酸、丙酸、异丁酸、丁酸、异戊酸和戊酸浓度分别为7.029 4、9.076 3、88.748 0、81.622 8、6.606 2、26.763 7、5.699 8和7.121 8 mmol/L的混合标准品溶液A。随后,以混标液A(混标液A)为检测对象,分别考察流动相浓度、柱温和流速对混合标准品中各有机酸组分分离效率和检测灵敏度的影响。其中硫酸流动相的浓度分别选用0.005和0.010 mol/L;柱温设置55、60和65 ℃ 3个梯度;流速分别选用0.5、0.6和0.7 mL/min。
1.4 系统适用性试验由于肠道内容物中蛋白质等大分子化合物浓度较高,为防止这些物质阻塞色谱系统,通常需要进行预处理。因此依据本课题组多年来的经验和前人相关研究,本方法按照生物样品预处理流程,使用25%的偏磷酸溶液进行预处理,具体操作方法为:将混标液A以体积比5 ∶ 1的比例同25%偏磷酸溶液混合,冷冻24 h,解冻后在4 ℃下12 000 r/min低温离心10 min,取上清液使用0.22 μm滤膜过滤后上机检测。此外,本试验同时以未作预处理的混标液A为对照,以考察预处理方案是否对待测有机酸组分产生干扰。上机检测采用经步骤1.3优化后的色谱条件,即流动相选用0.005 mol/L硫酸溶液、进样量20 μL、柱温60 ℃、流速0.7 mL/min。随后连续进样6针,以考察色谱系统的重现性。
1.5 线性、定量限和检测限准确移取不同体积的混标液A,使用0.005 mol/L硫酸溶液逐级进行梯度浓度稀释,配制成不同浓度的混标液用于线性测试,色谱条件同1.4。此外,为了评价添加偏磷酸对待测有机酸线性是否有影响,对于不同浓度的线性测试混标液,本研究同时按照1.4所述方法进行预处理作为试剂对照。
同时,为了确定各待测有机酸的定量限和检测线,将混标液A进行梯度浓度稀释,至每种有机酸色谱峰的信噪比分别达到10±2和3±1,分别作为各待测有机酸组分的定量限和检测限。随后,以峰面积为横坐标,以各待测有机酸的摩尔浓度为纵坐标,以各待测有机酸在混标液A及处于定量限时混标稀释液中的浓度和峰面积分别为上、下限进行线性拟合,获得各有机酸线性回归方程及相应的决定系数。
1.6 混标液中有机酸的稳定性和方法的精密度混标液中各有机酸的稳定性通过在室温状态下同一混标液在不同存放时间点测定的各有机酸组分保留时间的标准差和峰面积的相对标准偏差进行评价。试验选用1.4中混标液A的50%浓度线性测试液,经25%的偏磷酸预处理后,分别于0、6、12、18、24、48和72 h进样测定,预处理方法和色谱条件同1.4。
方法的精密度采用重复性试验进行评价。以1.2中所采晋南牛瘤胃液为供试品,取3 mL解冻后的瘤胃液样品6份,分别添加0.6 mL(体积比5 ∶ 1)25%偏磷酸溶液,充分混匀后冷冻24 h。解冻后在4 ℃下12 000 r/min低温离心10 min,上清液经0.22 μm滤膜过滤后作为重复性试验待测溶液,采用与1.4相同的色谱条件上机检测,通过保留时间的标准差和峰面积的相对标准偏差来衡量方法的精密度。
1.7 方法的准确度评价方法的准确度采用加标回收率试验来评价。以1.2中所采晋南牛瘤胃液为供试品,首先通过1.5所得各待测有机酸的峰面积和1.4所得标准曲线计算瘤胃液中各有机酸浓度,然后利用减量法精确称取适量各有机酸标准品,分别配制成约为瘤胃液各有机酸浓度的60%、100%和140%的混标液B、C和D。随后,将瘤胃液样品分别与混标液B、C和D等体积混合配制成加标样液,按照1.5中重复性试验所述方法进行预处理后上机检测,色谱条件同1.4。最后按照下式计算各有机酸的加标回收率:

|
对比不同色谱条件下混标液中各有机酸组分的色谱图(图 1)结果显示,流动相浓度和柱温对各有机酸的出峰时间、峰面积和分离度均无显著影响,流速的增加虽然使得分离度有所降低,但各色谱条件下所有待测有机酸的分离度均高于1.7,分离效果良好且无拖尾现象,均可满足检测要求。此外,随着流速的增加,各有机酸的保留时间逐渐减少,末位戊酸峰的出峰时间由0.5 mL/min流速时的33.550 min减少至0.7 mL/min流速时的28.656 min,后者的分离效率更高,分析时间更少。值得一提的是,流速也对峰面积有一定的影响,且流速增加会使柱压升高,而Hi-Plex配体交换柱是低背压柱,为了避免压力过高导致色谱柱损伤,应尽量避免通过继续增加流速的办法来提高检测效率。综合考虑分离度、分离效率、流动相浓度和柱压等各方面的因素,本研究确定优化后的色谱条件为:流动相0.005 mol/L硫酸溶液、流速0.7 mL/min和柱温60 ℃。
|
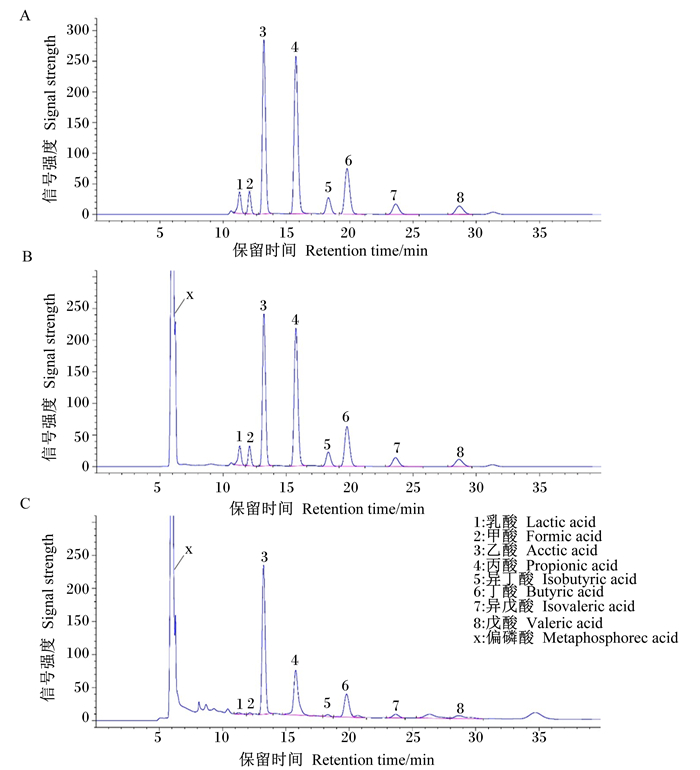
图 1 未经偏磷酸预处理(A)和经偏磷酸预处理(B)的混标液A及瘤胃液样品(C)的色谱图 Fig. 1 Chromatograms of standard mix A pretreated without (A) or with (B) metaphosphoric acid and rumen fluid sample (C) |
图 1展示了未经偏磷酸预处理的混标液(图 1-A)、经偏磷酸预处理的混标液(图 1-B)和瘤胃液样品(图 1-C)的色谱图。对比图 1-A和图 1-B可以看出,未经偏磷酸预处理的混标液和经偏磷酸预处理的混标液中8种待测有机酸的出峰时间、分离度和峰形均保持一致,相应的峰面积在数值上也均无明显差异,表明偏磷酸预处理对各待测有机酸组分无干扰;各相邻待测有机酸色谱峰之间的分离度均大于1.7,满足分析要求;6次连续进样间各有机酸的保留时间的标准差均低于0.050 min,峰面积的相对标准偏差均小于1%,复现性良好。另外,由待测瘤胃液样品的色谱图(图 1-C)可知,各待测有机酸组分的色谱峰与相邻物质色谱峰之间的分离情况良好,足以满足分析要求。上述结果表明,所建外标定量方法系统适用性良好。
2.3 线性、定量限和检测限根据外标法所得各待测有机酸的浓度(Y,mmol/L)和峰面积(X)的拟合曲线的线性方程和决定系数,以及各有机酸的线性范围、定量限和检测限见表 1。由表 1可知,乳酸、甲酸、乙酸、丙酸、异丁酸、丁酸、异戊酸和戊酸浓度的线性范围分别为0.043 9~7.029 4 mmol/L、0.022 7~9.076 3 mmol/L、0.554 7~88.748 0 mmol/L、0.510 1~81.622 8 mmol/L、0.041 3~6.606 2 mmol/L、0.167 3~26.763 7 mmol/L、0.035 6~5.699 8 mmol/L和0.044 5~7.121 8 mmol/L,且线性范围下限即为其定量限。同时,无论是否进行偏磷酸预处理,8种有机酸线性方程的决定系数均不低于0.999 9,表明各待测有机酸在线性范围内,峰面积和浓度间的线性关系良好。此外,无论进行偏磷酸预处理与否,同一种有机酸所得线性方程的斜率和截距在数量级上没有显著差异,表明是否进行偏磷酸预处理对标准曲线没有显著影响。乳酸、甲酸、乙酸、丙酸、异丁酸、丁酸、异戊酸和戊酸浓度的检测限分别为0.015 4、0.007 9、0.194 1、0.178 6、0.005 8、0.058 5、0.012 5和0.017 8 mmol/L,分别相当于供试瘤胃液样品中各目标有机酸浓度的2.399 8%、1.140 8%、0.234 4%、0.624 8%、0.768 6%、0.385 5%、0.618 8%和0.433 1%;另外,各有机酸浓度的检测限约为其定量限的1/3左右,基本符合二者之间稀释倍数及信噪比的关系,表明即使在检测限范围内,其线性效应可能也是存在的。
|
|
表 1 各待测有机酸的线性参数、定量限和检测限 Table 1 Linear parameters, LOQ and LOD of each targeted organic acid |
由表 2可知,混标液中各目标有机酸在72 h内7次测定的峰面积相对标准偏差(relative standard deviation, RSD)值均小于3.30%,保留时间的标准差均不大于0.056 min,表明8种有机酸于室温条件下3 d内是稳定的,足以满足分析需要;此外,除了乳酸的RSD值为3.26%外,其余7种有机酸的RSD值均低于1.00%,表明乳酸的方法稳定性略低于其余7种有机酸。
|
|
表 2 混标液中各目标有机酸的稳定性和方法的精密度 Table 2 Stability of targeted organic acids in standard mix and precision of method |
6份瘤胃液平行样品中各待测有机酸保留时间的标准差均不大于0.014 min,同时峰面积的RSD值均小于3.20%,表明本方法的精密度良好。
2.5 方法的准确度加标回收率试验结果(表 3)显示,乳酸、甲酸、乙酸、丙酸、异丁酸、丁酸、异戊酸和戊酸的加标回收率范围分别为82.79%~94.47%、80.56%~102.69%、100.85%~101.57%、104.23%~110.94%、94.23%~97.80%、84.48%~92.37%、95.20%~99.66%和97.45%~111.50%。除少数低浓度的甲酸和乳酸外,低、中、高3种浓度的加标样液所测得的各有机酸的加标回收率均处于90%~110%内,表明本方法的准确度良好。
|
|
表 3 瘤胃液中各待测有机酸的加标回收率 Table 3 Spike recovery rate of targeted organic acids in rumen fluid |
包括乳酸和挥发性脂肪酸在内的多种短链有机酸是动物胃肠道中微生物发酵的重要代谢产物,同时也对宿主能量和养分供应乃至生理过程均具有重要影响。因此,快速、简便、准确且尽可能多地同时测定肠道食糜中各种有机酸的浓度,对于研究动物肠道营养具有重要意义,尤其是对于进化出专门供微生物栖息和共生的肠室的草食动物如牛、羊等反刍家畜而言。本研究建立了一种基于配体交换柱的液相色谱外标定量方法,方法使用0.005 mol/L的硫酸溶液为流动相,辅以最常用的紫外检测器,可同时检测肠道内容物中的乳酸和7种VFA浓度。与气相色谱基础的方法[11-12, 15]相比,本方法不需衍生化处理便可直接测定甲酸和乳酸,也无需配备载气或昂贵的质谱检测器,对环境压力小,且可避免由于二次检测导致的工作量的累加;与目前报道的离子色谱[7]、核磁共振[14]、拉曼光谱[16]和毛细管电泳法[12]等相比,本方法所需的仪器设备配置低,且可同时测定的有机酸的种类更多;与目前已报道的液相色谱法[4, 17-18]相比,本方法更为简单,分离度更好,且可同时测定更多类型的有机酸,对肠道内容物样品的适用性更好。
先前的报道显示,具有前肠发酵功能的草食动物前胃中VFA的浓度通常在60~150 mmol/L,而具有后肠发酵能力的动物后肠道中VFA的浓度在30~120 mmol/L,且各VFA的组成模式没有本质上的差异[1]。本研究中所用瘤胃液中目标有机酸的总浓度为137.653 9 mmol/L,其中乳酸、甲酸、乙酸、丙酸、异丁酸、丁酸、异戊酸和戊酸浓度分别占总量的0.48%、0.52%、61.51%、21.10%、0.56%、11.28%、1.50%和3.05%,其浓度分别为本研究所建方法中各有机酸的定量限的15、31、149、56、18、91、57和92倍,同时分别为各有机酸线性范围最高浓度的1/11、1/13、1/1.1、1/3、1/9、1/2、1/3和1/2。若按相同的有机酸组成模式扩大或缩小的话,本研究所得各有机酸的线性范围完全足以满足各种类型肠道内容物中有机酸浓度检测的需要。值得一提的是,与定量限是由试验测得而与所用检测方法客观共存的情况不同,本研究中线性范围上限是根据前期经验所设,理论上是可以扩展的,对于某些极端状况如瘤胃酸中毒导致乳酸浓度超过线性范围上限的情况,读者可自行增加混标液中相应酸的浓度以拓展其线性范围,但需在使用前验证其线性,此外也可对待测液进行稀释后再上机检测。
通常认为,甲酸和乙酸等短链脂肪酸仅在酸性形式下具有挥发性,而处于阴离子状态时是不具有挥发性的[1]。然而,本研究中稳定性试验的结果显示,即使在室温条件下,同一混标液中的8种目标有机酸在72 h内、7个时间点的峰面积RSD值均低于5%的标准,且除乳酸外的其余7种VFA的峰面积RSD值甚至全部低于1%,表明即使是以酸性形式存在的有机酸,在室温下也可以相对稳定地保存3 d时间,足以满足绝大多数检测的需求,这可能与本方法使用顶空式密闭进样小瓶进行保存有关。需要注意的是,室温下72 h检测时,乳酸的峰面积在偏磷酸预处理和未预处理的混标液中分别较0 h增加了9%和4%,而这个数值在48 h则仅为4%和2%,因此建议制备好的上机待测样液室温存放时间不超过2 d,如有可能在上机前尽量低温保存。
动物肠道内容物作为生物基材料,不可避免地会含有较多的蛋白质、微生物和脂质等生物大分子物质,这些物质需要在上机检测前进行预处理加以去除,以免阻塞和损伤色谱柱。根据前人的研究成果[9, 15]和本课题组多年来的经验[19],本研究选用25%偏磷酸溶液以体积比5 ∶ 1的比例进行预处理以除去生物大分子物质。为了评价偏磷酸预处理是否会对目标有机酸的检测造成影响,本研究在稳定性和线性试验中设置了空白对照,并在瘤胃样液重复性和回收率试验中直接使用25%偏磷酸溶液进行预处理,结果表明无论是否进行偏磷酸预处理,各有机酸的保留时间、分离度、线性和稳定性均无显著差异,且方法的精密度和准确度良好。这些结果表明使用偏磷酸对样品进行预处理不会对待测有机酸的稳定性和线性及方法的精密度和准确度造成负面影响,这与许丽卫等[15]最近的研究结果相似。
综上所述,本研究基于配体交换柱建立了一种利用外标法同时检测动物肠道内容物中乳酸和甲酸等8种短链有机酸浓度的液相色谱方法。方法使用25%偏磷酸溶液对样品进行预处理后,以0.005 mol/L的硫酸溶液为流动相,在0.7 mL/min的流速下使用紫外检测器于210 nm波长条件下进行检测。所得各有机酸的方法检测限均不高于所用瘤胃样液中相应酸浓度的2.40%;所得各有机酸标准曲线方程的决定系数均不低于0.999 9,线性关系良好,且线性范围足以满足常见肠道内容物中目标有机酸的常规检测需要;混标液中各有机酸组分的峰面积在72 h内的RSD值均小于3.30%,稳定性良好,但建议上机待测样液的室温保存时间不超过48 h。所用瘤胃液样品的方法重复性试验中各有机酸峰面积RSD值均不超过3.20%,回收率试验中各有机酸绝大多数的加标回收率均处于90%~110%,方法的精密度和准确度良好。
4 结论本试验建立了一种同时检测肠道内容物中乳酸等8种短链有机酸浓度的液相色谱外标定量方法,该方法仪器配置要求低,前处理和流动相简单,系统适应性、线性和稳定性良好,方法的精密度和准确度高,足以满足肠道内容物样品中目标有机酸的检测需要,可为研究营养物质在动物肠道中的消化吸收以及肠道甲烷生成乃至代谢性疾病等方面提供技术支撑。另外,该法亦可用于其他生物基样品如沼气液和青贮发酵浸提液中短链有机酸的定量分析。
| [1] |
BERGMAN E N. Energy contributions of volatile fatty acids from the gastrointestinal tract in various species[J]. Physiological Reviews, 1990, 70(2): 567-590. DOI:10.1152/physrev.1990.70.2.567 |
| [2] |
MCALLISTER T A, MEALE S J, VALLE E, et al. Ruminant nutrition symposium: use of genomics and transcriptomics to identify strategies to lower ruminal methanogenesis[J]. Journal of Animal Science, 2015, 93(4): 1431-1449. DOI:10.2527/jas.2014-8329 |
| [3] |
HUMER E, PETRI R M, ASCHENBACH J R, et al. Invited review: practical feeding management recommendations to mitigate the risk of subacute ruminal acidosis in dairy cattle[J]. Journal of Dairy Science, 2018, 101(2): 872-888. DOI:10.3168/jds.2017-13191 |
| [4] |
苏利红, 曹雨莉, 李飞, 等. 高效液相色谱测定山羊瘤胃液挥发性脂肪酸条件优化的研究[J]. 动物医学进展, 2013, 34(8): 61-65. SU L H, CAO Y L, LI F, et al. Optimizing condition of high performance liquid chromatography for detecting volatile fatty acids in goat rumen fluid[J]. Progress in Veterinary Medicine, 2013, 34(8): 61-65 (in Chinese). DOI:10.3969/j.issn.1007-5038.2013.08.012 |
| [5] |
PEU P, BÉLINE F, MARTINEZ J. Volatile fatty acids analysis from pig slurry using high-performance liquid chromatography[J]. International Journal of Environmental Analytical Chemistry, 2004, 84(13): 1017-1022. DOI:10.1080/03067310412331303217 |
| [6] |
IBÁÑEZ A B, BAUER S. Analytical method for the determination of organic acids in dilute acid pretreated biomass hydrolysate by liquid chromatography-time-of-flight mass spectrometry[J]. Biotechnology for Biofuels, 2014, 7(1): 145. DOI:10.1186/s13068-014-0145-3 |
| [7] |
牟豪杰, 孟庆翔, 任丽萍, 等. 离子色谱法同时测定牛瘤胃液中乳酸和挥发性脂肪酸含量[J]. 理化检验(化学分册), 2009, 45(1): 52-54. MOU H J, MENG Q X, REN L P, et al. Simultaneous determination of lactic acid and volatil fatty acids in ox rumen juice by ion chromatography[J]. Physical Testing and Chemical Analysis(Chemical Analysis), 2009, 45(1): 52-54 (in Chinese). DOI:10.3321/j.issn:1001-4020.2009.01.019 |
| [8] |
贾鹏禹, 孙蕊, 李井春, 等. 离子排斥色谱法测定瘤胃液中乳酸和挥发性脂肪酸的含量[J]. 黑龙江畜牧兽医, 2017(3): 43-46. JIA P Y, SUN R, LI J C, et al. Determination of the contents of lactic acid and volatile fatty acids in rumen liquid using ion exclusion chromatography[J]. Heilongjiang Animal Science and Veterinary Medicine, 2017(3): 43-46 (in Chinese). |
| [9] |
ERWIN E S, MARCO G J, EMERY E M. Volatile fatty acid analyses of blood and rumen fluid by gas chromatography[J]. Journal of Dairy Science, 1961, 44(9): 1768-1771. DOI:10.3168/jds.S0022-0302(61)89956-6 |
| [10] |
丁学智, 龙瑞军, 淡瑞芳, 等. 瘤胃发酵液挥发性脂肪酸的气相色谱分析方法[J]. 甘肃农业大学学报, 2006, 41(2): 24-26. DING X Z, LONG R J, DAN R F, et al. A determination method based on gas chromatography for analysis of volatile fatty acids in rumen fluid[J]. Journal of Gansu Agricultural University, 2006, 41(2): 24-26 (in Chinese). DOI:10.3969/j.issn.1003-4315.2006.02.006 |
| [11] |
王俊红, 高歌, 张圆圆, 等. 顶空-气相色谱法测定反刍动物瘤胃液中挥发性脂肪酸含量[J]. 浙江大学学报(农业与生命科学版), 2021, 47(5): 667-672. WANG J H, GAO G, ZHANG Y Y, et al. Determination of the volatile fatty acid contents in rumen fluid of ruminants by headspace-gas chromatograph method[J]. Journal of Zhejiang University (Agriculture & Life Sciences), 2021, 47(5): 667-672 (in Chinese). |
| [12] |
FILÍPEK J, DVOŘÁK R. Determination of the volatile fatty acid content in the rumen liquid: comparison of gas chromatography and capillary isotachophoresi[J]. Acta Veterinaria Brno, 2009, 78(4): 627-633. DOI:10.2754/avb200978040627 |
| [13] |
ATTAELMANNAN M A, DAHL A A, REID R S. Analysis of volatile fatty acids in rumen fluid by proton NMR spectroscopy[J]. Canadian Science Publishing, 1999, 79(3): 401-404. |
| [14] |
WANG M Y, WANG H Y, ZHENG H R, et al. Comparison of HPLC and NMR for quantification of the main volatile fatty acids in rumen digesta[J]. Scientific Reports, 2021, 11(1): 24337. DOI:10.1038/s41598-021-03553-9 |
| [15] |
许丽卫, 耿梅梅, 陈闻, 等. 气相色谱-质谱联用法测定瘤胃液中的甲酸和其他6种挥发性脂肪酸[J]. 动物营养学报, 2021, 33(2): 1145-1152. XU L W, GENG M M, CHEN W, et al. Determination of formic acid and other six volatile fatty acids in rumen fluid by gas chromatography-mass spectrometry method[J]. Chinese Journal of Animal Nutrition, 2021, 33(2): 1145-1152 (in Chinese). DOI:10.3969/j.issn.1006-267x.2021.02.055 |
| [16] |
UDÉN P, SJAUNJA L O. Estimating volatile fatty acid concentrations in rumen samples by Fourier transform mid-IR transmission spectroscopy[J]. Animal Feed Science and Technology, 2009, 152(1/2): 123-132. |
| [17] |
DE BAERE S, EECKHAUT V, STEPPE M, et al. Development of a HPLC-UV method for the quantitative determination of four short-chain fatty acids and lactic acid produced by intestinal bacteria during in vitro fermentation[J]. Journal of Pharmaceutical and Biomedical Analysis, 2013, 80: 107-115. DOI:10.1016/j.jpba.2013.02.032 |
| [18] |
YU C X, WANG Y, CAO H, et al. Simultaneous determination of 13 organic acids in liquid culture media of edible fungi using high-performance liquid chromatography[J]. BioMed Research International, 2020, 2020: 2817979. |
| [19] |
ZHANG Y W, ZHAO X W, CHEN W B, et al. Effects of adding various silage additives to whole corn crops at ensiling on performance, rumen fermentation, and serum physiological characteristics of growing-finishing cattle[J]. Animals: an Open Access Journal from MDPI, 2019, 9(9): 695. |




