2. 新疆泰昆集团昌吉饲料有限责任公司, 昌吉 831199
2. Xinjiang Taikun Group Changji Feed Limited Liability Company, Changji 831199, China
纤维是反刍动物的主要能量来源[1],是构成细胞壁的主要成分。由于其复杂的结合形式,限制了胞内营养物质的降解,导致营养物质大量排泄和细胞壁部分不完全利用,在理想饲喂条件下,其降解率仍不超过65%。因此,为降解细胞壁释放胞内营养物质,提高饲料利用率,研究人员提出过许多方法,如添加不同的化学物质(氢氧化钠、尿素等)、粉碎揉碎原料、进行生物处理等,但结果都不能达到需求。吴爽[2]研究表明,在饲粮中添加外源纤维复合酶可有效提高反刍动物的采食量和饲料转化率,且添加外源纤维复合酶可提高底物可发酵部分,改善瘤胃发酵;另有研究表明添加外源纤维复合酶可降低肠道食糜黏度,提高纤维消化率[3],释放出可支持有益于微生物区系的低聚糖,同时抑制致病菌增殖[4]。因此,添加外源复合非淀粉多糖酶制剂(来自具有高纤维素和半纤维素活性的真菌、细菌)是提高动物能量利用率和生产性能的有效途径之一。将其以液体或颗粒形式与饲粮、干草、青贮、精料等饲料混合,可破解细胞壁,从而释放更多营养物质,提高饲料的消化率[5]。本试验通过体外发酵法研究外源非淀粉多糖酶的最适配比及对体外发酵的综合影响效果,探讨外源复合非淀粉多糖酶的营养调控作用,为外源酶制剂在生产中的应用提供理论指导。
1 材料与方法 1.1 试验材料及供体动物试验所用非淀粉多糖酶制剂均由山东某酶制剂有限公司提供。4种酶制剂纤维素酶、木聚糖酶、β-葡聚糖酶、甘露聚糖酶的菌种来源为里氏木霉,标识酶活分别为300 000、300 000、50 000和50 000 U/g。其他试剂除特殊说明外,均为分析纯,水均为符合GB/T 6682-2008中规定的二级水。
在石河子大学动物试验站选取6只60日龄的羊作为瘤胃液供体羊。基础饲粮根据NRC(2004)日增重100 g肉羊的营养需要量配制,其组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
酶活测定采用3,5-二硝基水杨酸(DNS)法,分光光度计(精科721G,上海)540 nm处测量吸光度值。纤维素酶、木聚糖酶、β-葡聚糖酶、甘露聚糖酶活性测定所用底物分别为羧甲基纤维素钠、小麦粉木聚糖(可溶性)和小麦粉木聚糖(不可溶性)、葡聚糖、甘露聚糖。
本试验中酶活定义为:在39 ℃、pH 6.5条件下,每分钟从1 mg/mL溶液中释放1 μmoL还原糖所需酶量,即定义为1个酶活单位(U)。
1.2.2 单酶最适添加量的体外筛选采用单因素完全随机试验设计,将4种酶按照在饲粮中的添加量分别设定7个水平(0、50、125、250、750、1 000、2 000 U/g,干物质基础),每个水平设3个重复,添加到饲粮中,模拟瘤胃体外消化试验,培养12 h,并记录12 h累积产气量(GP)及干物质降解率(DMD)。
1.2.3 复合酶酶谱的体外筛选根据单酶最适添加量的体外筛选试验结果,将纤维素酶、木聚糖酶、β-葡聚糖酶、甘露聚糖酶再设计3个梯度。按照三元正交表中L9(34)设计9组复合酶配比,进行体外瘤胃消化试验。记录不同时间段(2、6、8、12、24、36、48 h)的GP及发酵48 h后pH、DMD。采用正交试验极差分析方法,求出体外酶解反应中pH、平均GP和DMD提高率3个指标下4种酶的主次顺序,并得出最佳配比。
|
|
表 2 试验因素与水平 Table 2 Test factors and levels |
|
|
表 3 正交设计试验方案 Table 3 Orthogonal design experiment scheme |
根据复合酶酶谱的体外筛选试验结果,确定4种酶最佳配比为纤维素酶∶木聚糖酶∶β-葡聚糖酶为∶甘露聚糖酶=1 000∶250∶500∶50(U/g,干物质基础)。再设定2组,分别为对照组(基础饲粮)和试验组(基础饲粮+复合酶)。每组设置24个玻璃注射器。培养至2、4、6、8、12、24、48 h,随机取3个注射器快速读取活塞所处刻度值并测定pH,用冰水终止反应,抽取发酵液用低温离心机(4 ℃,5 400 r/min,10 min)离心,取上清液-20 ℃条件下保存,用来测定总挥发性脂肪酸(TVFA)、乙酸(acetic acid)、丙酸(propionic acid)、丁酸(butyric acid)的浓度、氨态氮(NH3-N)、微生物蛋白(MCP)的含量,并计算乙丙比(A/P);将玻璃注射器内的滤袋取出,冲洗干净后,105 ℃烘干,称重,用来测定发酵后DMD。
1.3 体外发酵及样品采集晨饲前采集瘤胃内容物,装于提前预温并充满CO2的保温瓶中,用4层纱布过滤在预热39 ℃的容器中并持续通CO2 5 min。整个操作于39 ℃水浴中进行。按照试验设计,在饲粮中加入相应的酶,混合均匀。根据Menke等[6]的方法将瘤胃液与人工培养液以1∶2的体积混合制成人工瘤胃液,每个注射器中加入200 mg饲粮和30 mL人工瘤胃液后,迅速放入39 ℃恒温振荡水浴箱中。
1.4 测定指标及测定方法发酵液用pH计(力辰科技笔式酸度计pH-10,上海)测定;NH3-N浓度使用比色法测定[7];MCP浓度采用试剂盒(北京全式金生物技术公司)使用全波长酶标仪(Multiskan GO,美国)测定,测定方法按照试剂盒说明书进行;挥发性脂肪酸(VFA)浓度采用液相色谱仪(Agilent 1100,美国)测定[8]。发酵残渣在105 ℃烘箱中烘12 h至恒重后测定干物质含量。

|
利用Excel 2019进行数据整理后,采用SPSS 19.0软件对单酶添加量进行单因素方差分析,复合酶酶谱的体外筛选试验进行正交极差分析,外源复合非淀粉多糖酶体外发酵试验采用一般线性模型进行方差分析,试验结果以平均值和均值标准误(SEM)表示。采用Duncan氏法进行多重比较。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析 2.1 模拟瘤胃条件下单酶活性测定结果模拟瘤胃(39 ℃,pH 6.5)条件下测得的纤维素酶、木聚糖酶(底物为可溶性)、木聚糖酶(底物为不可溶性)、β-葡聚糖酶、甘露聚糖酶的活性分别为18 000、76 000、100 000、61 000、30 000 U/mL。
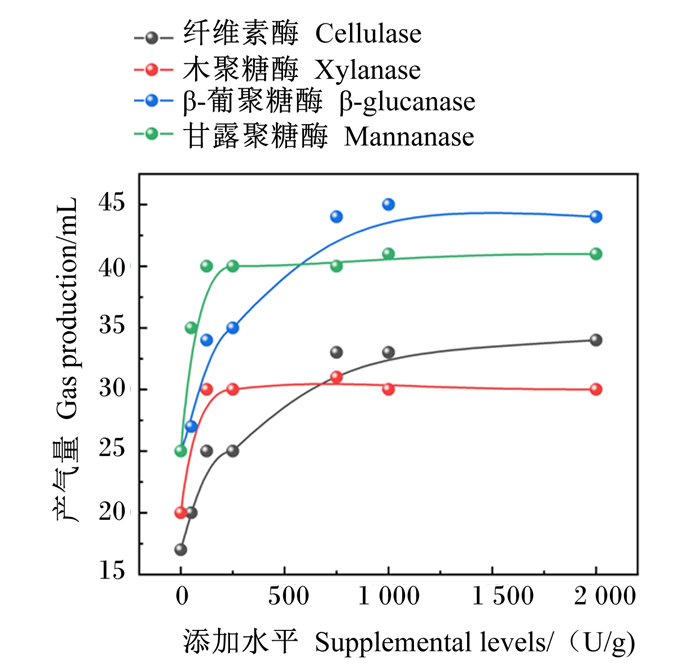
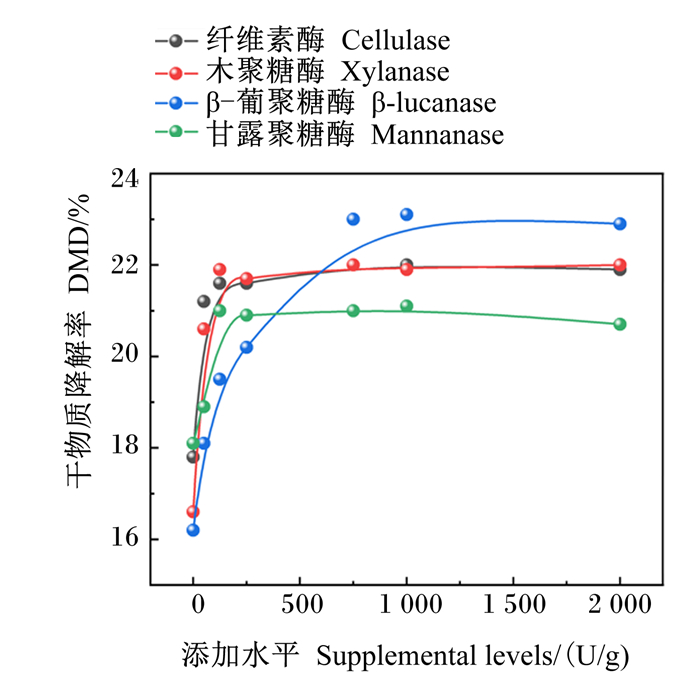
2.2 单酶最适添加量的体外筛选4种单酶不同添加量对GP和DMD的影响分别见图 1、图 2。由图可知,GP和DMD均随纤维素酶、木聚糖酶、β-葡聚糖酶、甘露聚糖酶添加量的增加呈现先增加后趋于平稳的趋势。根据表 6中差异显著性分析结果判断出单酶最适添加量。
|
图 1 4种单酶不同添加量对体外GP的影响 Fig. 1 Effects of different supplemental levels of 4 kinds of single enzymes on GP in vitro |
|
图 2 4种单酶不同添加量对体外DMD的影响 Fig. 2 Effects of different supplemental levels of 4 kinds of single enzymes on DMD in vitro |
|
|
表 6 4种单酶体外消化对GP和DMD的影响 Table 6 Effects of in vitro enzymatic digestion of 4 kinds of single enzymes on GP and DMD |
根据图 1、图 2和表 6得出,纤维素酶、木聚糖酶、β-葡聚糖酶、甘露聚糖酶体外发酵GP最优的添加量分别为750、125、750、125 U/g;对DMD最优的添加量分别为125、125、750、125 U/g。综合GP和DMD 2个指标,确定饲粮在体外发酵时各单酶的最佳添加量为纤维素酶750 U/g、木聚糖酶125 U/g、葡聚糖酶750 U/g、甘露聚糖酶125 U/g。
2.3 外源复合非淀粉多糖酶酶谱的体外筛选不同配比的非淀粉多糖酶对瘤胃体外发酵的pH、GP和DMD的影响如表 7所示。采用正交试验极差法得出,4种单酶对pH的影响主次顺序依次为纤维素酶、β-葡聚糖酶、甘露聚糖酶、木聚糖酶,最佳组合配比为A3B1C1D3;4种单酶对GP的影响主次顺序依次为纤维素酶、木聚糖酶、β-葡聚糖酶、甘露聚糖酶,最佳组合配比为A3B3C1D2;4种单酶对DMD的影响主次顺序依次为木聚糖酶、纤维素酶、甘露聚糖酶、β-葡聚糖酶,最佳组合配比为A3B3C1D3;
|
|
表 7 外源复合非淀粉多糖酶酶谱筛选结果 Table 7 Screening results of zymogram of exogenous complex non-starch polysaccharidases |
根据pH、GP和DMD这3项指标的极差分析的试验结果,最终以编号为9的组合A3B3C1D1[纤维素酶∶木聚糖酶∶β-葡聚糖酶∶甘露聚糖酶=1 000∶250∶500∶50(U/g,干物质基础)]为最优配比。
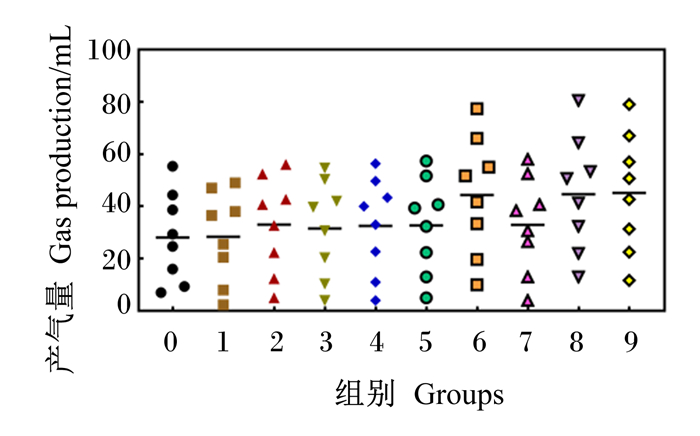
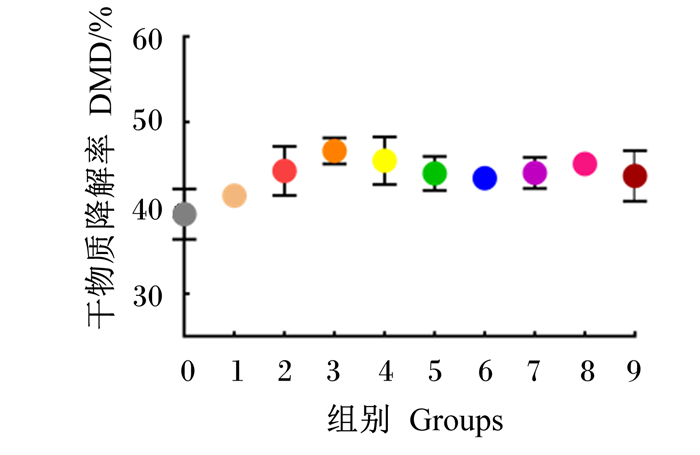
2.4 外源复合非淀粉多糖酶对瘤胃体外发酵特性的影响外源复合非淀粉多糖酶对瘤胃体外发酵特性的影响见表 8。与对照组相比,试验组48 h平均DMD极显著升高6.67%(P<0.01),处理和发酵时间对平均DMD均有极显著影响(P<0.01),且二者互作效应极显著(P<0.01)。由图 5可以看出,在48 h内,随着发酵时间的延长,DMD随之增加,且试验组均不同程度高于对照组,至48 h时,试验组DMD与对照组相似。试验组平均GP高出对照组5.69 mL(P<0.01),处理和发酵时间对平均GP均有极显著影响(P<0.01),且二者互作效应极显著(P<0.01)。由图 5可以看出,在48 h内,随着发酵时间的延长,GP随之增加,且试验组均不同程度高于对照组。
|
|
表 8 外源复合非淀粉多糖酶对瘤胃体外发酵特性(平均值)的影响 Table 8 Effects of exogenous complex non-starch polysaccharidases on rumen fermentation characteristics (average value) in vitro |
|
图 3 不同配比外源复合非淀粉多糖酶对GP的影响 Fig. 3 Effects of different ratios of exogenous complex non-starch polysaccharidases on GP |
|
图 4 不同配比外源复合非淀粉多糖酶对DMD的影响 Fig. 4 Effects of different ratios of exogenous complex non-starch polysaccharidases on DMD |
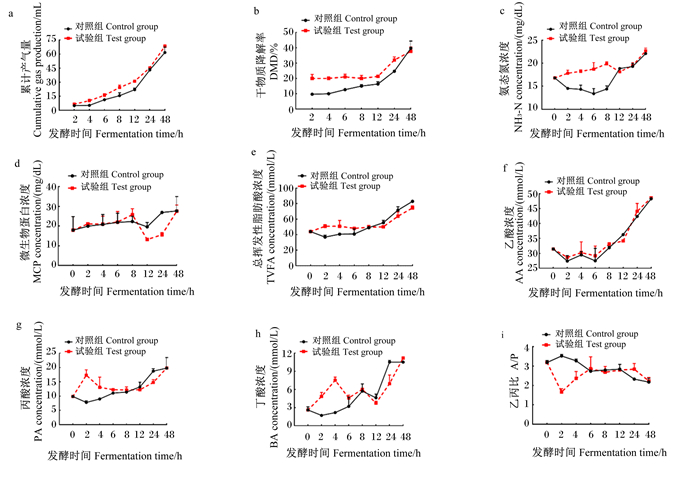
|
图 5 外源复合非淀粉多糖酶对瘤胃体外发酵特性的影响 Fig. 5 Effects of exogenous complex non-starch polysaccharidases on rumen fermentation characteristics in vitro |
试验组平均NH3-N浓度高出对照组2.57 mg/dL(P<0.01),处理和发酵时间对平均NH3-N浓度有极显著影响(P<0.01),且二者互作效应极显著(P<0.01)。由图 5可以看出,0~8 h,试验组NH3-N浓度不同程度高于对照组,12~24 h,试验组NH3-N浓度与对照组相似。试验组平均MCP浓度较对照组低2.16 mg/dL(P>0.05),处理对平均MCP浓度有显著影响的趋势(0.05<P≤0.10),发酵时间对平均MCP浓度有极显著影响(P<0.01),且二者互作效应显著(P<0.05)。由图 5可以看出,试验组与对照组的MCP浓度变化趋势一致,在12和24 h时,试验组MCP浓度低于对照组。
试验组平均TVFA浓度比对照组高2.44 mmol/L(P<0.05),处理对平均TVFA浓度无显著影响(P>0.05),但发酵时间对平均TVFA浓度有极显著影响(P<0.01),且二者互作效应极显著(P<0.01)。由图 5可以看出,随着发酵时间的延长,TVFA浓度整体呈现升高的趋势,在0~8 h,试验组的TVFA浓度高于对照组,在12~24 h,试验组的TVFA浓度低于对照组。试验组平均乙酸浓度与对照组无显著差异(P>0.05),处理对平均乙酸浓度无显著影响(P>0.05),发酵时间对平均乙酸浓度有极显著影响(P<0.01),二者互作效应不显著(P>0.05)。由图 5可以看出,对照组与试验组的乙酸浓度变化趋势一致。试验组平均丙酸与丁酸浓度极显著高于对照组(P<0.01),处理和发酵时间对平均丙酸与丁酸浓度均有极显著影响(P<0.01),且二者互作效应极显著(P<0.01)。由图 5可以看出,在0~8 h,试验组的丙酸和丁酸浓度高于对照组;在12~48 h,试验组的丙酸和丁酸浓度低于对照组。试验组平均A/P极显著低于对照组(P<0.01),处理和发酵时间对平均A/P均有极显著影响(P<0.01),且二者互作效应极显著(P<0.01)。由图 5可知,随着发酵时间的延长,对照组与试验组A/P变化趋势不一致,在2~4 h,各试验组的A/P低于对照组,在6~48 h,对照组与试验组A/P趋于相等。
3 讨论 3.1 单酶添加量对瘤胃体外发酵GP和DMD的影响同一种试验动物,所用酶制剂的添加量不同产生的效果也不同[9-10]。对于酶制剂添加量的高低,并没有统一的标准来衡量。因为酶的添加量需要综合酶的活性、底物和环境等来确定。而酶的活性受多种因素的影响,如酶的来源、浓度、作用的底物及温度、pH等。Sakita等[9]的研究从里氏木霉中提取纤维分解酶,设置了5个剂量(0、5、50、500和5 000 μL),探究其对不同底物的影响,结果表明,高剂量组的DMD、中性洗涤纤维降解率(DNFD)显著高于其他组。Abid等[11]利用瘤胃中的长柄木霉产生的纤维分解酶在体外降解橄榄叶,设置了0、1、2和4 μL/g(干物质基础)4个添加量,结果表明中添加量的纤维分解酶可增加GP、DMD、MCP浓度,而高添加量的纤维分解酶对GP、DMD无显著影响,且导致MCP浓度降低。在本研究中,针对特定底物,对选用的4种酶均设置了7个添加量,结果显示,各酶处理的GP和DMD均随添加量的增加而升高,当超出一定水平时,则表现出不增加或呈现下降趋势,说明随酶添加量的增加加速了底物反应,在达到一定值后,GP和DMD受底物限制,趋于平缓。在实际应用中,酶添加量并非越高越好,前人研究显示酶添加过量会降低营养物质消化率[12]。Arif等[13]研究表明,酶添加过量时,底物被酶解效果下降,这与Parwiyanti等[14]的研究结果一致。因此,本试验以GP和DMD为指标进行综合评价,当纤维素酶为750 U/g、木聚糖酶为125 U/g、葡聚糖酶为750 U/g、甘露聚糖酶为125 U/g(均为干物质基础)时,各酶分别发挥出最佳水平。通过与底物的反应选出各酶的最适添加量,为下一步进行4种酶的复合配比奠定基础。
3.2 不同复合酶酶谱对瘤胃体外发酵GP和DMD的影响由于饲粮中底物成分复杂,运用单酶进行复合配比后产生协同作用,效果通常要优于单一酶制剂[15]。在使用复合酶制剂时应把握好各单酶间的相互作用,发掘不同单酶之间的协同作用,同时降低拮抗作用。有研究表明,复合酶的不同添加量对GP、DMD及瘤胃发酵参数等的影响不一致[16]。Malathi等[5]的研究表明,对于不同的底物,不同的复合酶所产生的效果不一致。酶具有专一性,要根据底物的不同来调节酶的添加量,使其发挥出更好的效果。张顺芬等[17]探究了不同外源酶组合对2种不同来源棕榈粕的体外降解特性的影响,结果表明,不同外源酶组合极显著地影响了棕榈粕的体外干物质消化率、粗蛋白质消化率和能量消化率。刘汇涛等[18]的研究表明,在饲粮中添加不同配比及添加量的复合酶制剂对饲粮的改善效果不一致,其中添加890 mg/kg复合酶制剂Ⅰ时,育成期水貂生长性能、营养物质消化率和氮代谢均明显提高,并由此推测,造成该结果的原因可能为不同配比的复合酶制剂对内源酶的影响不同。本试验结果显示,4种酶的配比为纤维素酶∶木聚糖酶∶β-葡聚糖酶∶甘露聚糖酶=1 000∶250∶500∶50(U/g,干物质基础)时,效果最佳。上述研究结果与本试验结果都表明,不同添加量和种类的外源酶,其适宜配比为提升饲料中营养物质消化吸收作用的关键[19],将外源酶配比使用时互补作用更明显,其对饲料中营养物质消化率的提升效果也更明显。
3.3 外源复合非淀粉多糖酶对瘤胃体外发酵特性的影响 3.3.1 外源复合非淀粉多糖酶对瘤胃体外发酵GP和DMD的影响GP为第一指标,因为产气率与底物降解率成正比,是评估底物降解的简单筛选工具[6],是衡量瘤胃中可发酵物质的含量、微生物活性强弱的重要指标之一[6, 20]。GP越高,饲粮的发酵强度越大[21]。DMD主要用于评价饲料营养价值,DMD越高,说明饲料中营养物质利用更充分[22]。
有研究表明,在饲料中添加外源纤维酶,其发酵过程有利于GP的提高[23]。此外,Colombatto等[24]和Wang等[25]报道,在饲粮中添加外源纤维酶有利于营养物质释放,促进瘤胃发酵,提高底物的降解率,后经瘤胃微生物作用产生能量和VFA以供动物吸收利用,从而提高DMD。本试验结果表明,试验组的GP高于对照组,随着发酵时间延长,各组产气速率均减缓,但试验组发酵后期GP在数值上仍高于对照组。体外培养48 h后,试验组的平均DMD极显著高于对照组。这可能是因为添加外源复合非淀粉多糖酶使细胞壁破解,部分难消化利用的纤维类物质被降解为利于消化吸收的单糖、寡糖等小分子物质,从而提高饲料的利用率,与王红梅[26]的研究结果相似。
3.3.2 外源复合非淀粉多糖酶对瘤胃体外发酵参数的影响瘤胃pH是反刍动物瘤胃发酵最直观的反映和基本指标,其正常范围为5.4~7.5[27]。本研究中各组发酵液pH为6.25~6.40,均在正常范围,且试验组与对照组间无显著差异,说明添加外源复合非淀粉多糖酶对体外瘤胃内环境未造成不良影响。
反刍动物瘤胃中NH3-N是瘤胃微生物降解饲料中蛋白质、氨基酸等含氮成分产生的,是合成MCP的重要原料,也是反映反刍动物氮代谢的主要指标,综合反映了瘤胃内氮代谢的过程[28]。Murphy等[28]的研究表明,瘤胃中NH3-N浓度正常范围是6.3~27.5 mg/dL,过高或过低都对动物机体不利,过高说明氮产生量大于利用量,易造成氨中毒,过低说明MCP的合成率降低即微生物活性降低[29-30]。在本试验中,试验组和对照组各时间点的NH3-N浓度均在正常范围内,说明添加外源复合非淀粉多糖酶不会影响瘤胃氮利用率。但8 h前试验组NH3-N浓度均大于对照组,可能是因为添加外源复合非淀粉多糖酶后加速了瘤胃中降解蛋白质的菌群的增殖,增强了固定分子氮的能力;还可能是因为在模拟瘤胃体外发酵过程中没有瘤胃壁对NH3-N的吸收环节,导致其在培养管中累积[31]。因此,在8 h前试验组NH3-N浓度比对照组高。总体上看,NH3-N浓度的升高表明对底物利用率提高。
瘤胃微生物可将碳水化合物降解为VFA、二氧化碳(CO2)和甲烷(CH4)等,大部分VFA则通过瘤胃壁扩散进入血液,为动物机体提供60%~80%的能量,也是其能量和碳的主要来源[32]。其中,碳原子含量不同,吸收速度也不同,吸收速度为丁酸>丙酸>乙酸[33]。有研究表明,A/P>3时为乙酸发酵,反之,则为丙酸发酵。本试验中,整个发酵过程中试验组丙酸、丁酸浓度均高于对照组,且在4 h前,试验组丙酸、丁酸浓度远超出对照组,A/P则低于对照组,而后,对照组与试验组趋于一致。Wang等[34]和国春艳[31]的研究表明,添加外源纤维素酶后,试验组丙酸浓度增加,瘤胃发酵类型转变为丙酸发酵。而本试验中,在体外培养前对底物进行了24 h预处理,使得外源复合非淀粉多糖酶能够直接作用于底物,释放还原糖,增加微生物对底物的附着能力,从而说明添加外源复合非淀粉多糖酶增加了瘤胃内碳水化合物的降解利用,能够在前期提高培养液中的丙酸和丁酸浓度,改变发酵类型,但作用时间不长,其原因可能是预处理加速了外源复合非淀粉多糖酶破解植物细胞壁,促进了降解产物寡糖的发酵,加快了饲料的利用,这与Malathi等[5]的研究结果相似。
MCP作为反刍动物最主要的氮源供应者,能为动物机体提供所需要蛋白质的40%~90%[35]。瘤胃液中MCP的合成需要提供一定的能量、氮源及其他营养成分。本试验中,在12和24 h时,试验组MCP浓度低于对照组,其他时间2组差异不显著。12和24 h时,试验组丙酸和丁酸浓度也远低于对照组,但NH3-N浓度无显著差异,推断这由于能量和氮利用率之间的不同步造成的。Elghandour等[23]研究外源纤维复合酶处理4种不同纤维饲料时发现,各组除了MCP浓度下降外,GP、DMD、VFA浓度均增加。这与本试验结果一致,进一步说明了添加外源复合非淀粉多糖酶促进了饲粮的发酵。
4 结论① 综合试验结果,在本试验所用饲粮和体外条件下,外源复合非淀粉多糖酶最适添加量及配比为纤维素酶∶木聚糖酶∶β-葡聚糖酶∶甘露聚糖酶=1 000∶250∶500∶50(U/g,干物质基础)。
② 添加适宜配比的外源非淀粉多糖酶可以提高瘤胃体外DMD和GP,改善瘤胃发酵功能。
| [1] |
AVELLANEDA J H, PINOS-RODRÍGUEZ J M, GONZÁLEZ S S, et al. Effects of exogenous fibrolytic enzymes on ruminal fermentation and digestion of Guinea grass hay[J]. Animal Feed Science and Technology, 2009, 149(1/2): 70-77. |
| [2] |
吴爽. 纤维素酶处理荞麦秸秆对其纤维结构以及滩羊生产性能和肉品质的影响[D]. 硕士学位论文. 银川: 宁夏大学, 2021. WU S. Effects of cellulase treatment of buckwheat straw on fiber structure and production performance and meat quality of Tan sheep[D]. Master's Thesis. Yinchuan: Ningxia University, 2021. (in Chinese) |
| [3] |
HRISTOV A N, MCALLISTER T A, CHENG K J. Effect of dietary or abomasal supplementation of exogenous polysaccharide-degrading enzymes on rumen fermentation and nutrient digestibility[J]. Journal of Animal Science, 1998, 76(12): 3146-3156. DOI:10.2527/1998.76123146x |
| [4] |
PALOHEIMO M, PIIRONEN J, VEHMAANPERÄ J. Xylanases and cellulases as feed additives[M]//BEDFORD M R, PARTRIDGE G G. Enzymes in farm animal nutrition. Wallingford: CABI, 2010: 12-53.
|
| [5] |
MALATHI V, DEVEGOWDA G. In vitro evaluation of nonstarch polysaccharide digestibility of feed ingredients by enzymes[J]. Poultry Science, 2001, 80(3): 302-305. DOI:10.1093/ps/80.3.302 |
| [6] |
MENKE K H, STEINGASS H. Estimation of the energetic feed value obtained from chemical analysis and in vitro gas production using rumen fluid[J]. Animal Research and Development, 1988, 28: 7-55. |
| [7] |
冯宗慈, 高民. 通过比色测定瘤胃液氨氮含量方法的改进[J]. 畜牧与饲料科学, 2010(6): 37. FENG Z C, GAO M. Determination of ammonia nitrogen in rumen fluid by colorimetric method[J]. Animal Husbandry and Feed Science, 2010(6): 37 (in Chinese). DOI:10.3969/j.issn.1672-5190.2010.06.015 |
| [8] |
苏利红, 曹雨莉, 李飞, 等. 高效液相色谱测定山羊瘤胃液挥发性脂肪酸条件优化的研究[J]. 动物医学进展, 2013, 34(8): 61-65. SU L H, CAO Y L, LI F, et al. Optimizing condition of high performance liquid chromatography for detecting volatile fatty acids in goat rumen fluid[J]. Progress in Veterinary Medicine, 2013, 34(8): 61-65 (in Chinese). DOI:10.3969/j.issn.1007-5038.2013.08.012 |
| [9] |
SAKITA G Z, BOMPADRE T F V, DINESHKUMAR D, et al. Fibrolytic enzymes improving in vitro rumen degradability of tropical forages[J]. Journal of Animal Physiology and Animal Nutrition, 2020, 104(5): 1267-1276. DOI:10.1111/jpn.13373 |
| [10] |
REFAT B, CHRISTENSEN D A, MCKINNON J J, et al. Effect of fibrolytic enzymes on lactational performance, feeding behavior, and digestibility in high-producing dairy cows fed a barley silage-based diet[J]. Journal of Dairy Science, 2018, 101(9): 7971-7979. DOI:10.3168/jds.2017-14203 |
| [11] |
ABID K, JABRI J, YAICH H, et al. In vitro study on the effects of exogenic fibrolytic enzymes produced from Trichoderma longibrachiatum on ruminal degradation of olive mill waste[J]. Archives Animal Breeding, 2022, 65(1): 79-88. DOI:10.5194/aab-65-79-2022 |
| [12] |
杨丽仙, 年芳, 张志杰, 等. 纤维素酶添加量与中性洗涤纤维体外降解率的关系[J]. 甘肃农业大学学报, 2010, 45(6): 37-42. YANG L X, NIAN F, ZHANG Z J, et al. Relationship of additive amount of cellulase and neutral detergent fiber (NDF) degradation rate in vitro[J]. Journal of Gansu Agricultural University, 2010, 45(6): 37-42 (in Chinese). DOI:10.3969/j.issn.1003-4315.2010.06.008 |
| [13] |
ARIF A B, SASMITALOKA K S, WINARTI C, et al. Effect of liquefaction time and enzyme addition on liquid sugar production from sweet sorghum starch by enzymatic hydrolysis[J]. IOP Conference Series: Earth and Environmental Science, 2019, 250: 012042. DOI:10.1088/1755-1315/250/1/012042 |
| [14] |
PARWIYANTI, PRATAMA F, ARNITA R. Chemical and physical properties of liquid sugar from yam (Dioscorea hispida Dennts) starch[J]. Jurnal Teknologi dan Industri Pangan, 2011, 22(2): 171-176. |
| [15] |
BHASKER T V, NAGALAKSHMI D, RAO D S. Development of appropriate fibrolytic enzyme combination for maize stover and its effect on rumen fermentation in sheep[J]. Asian-Australasian Journal of Animal Sciences, 2013, 26(7): 945-951. DOI:10.5713/ajas.2012.12590 |
| [16] |
孟芳. 外源酶对断奶羔羊瘤胃体外发酵及其营养物质消化代谢的影响[D]. 硕士学位论文. 兰州: 甘肃农业大学, 2018. MENG F. Effects of exogenous enzymes on rumen fermentation and digestion and metabolism of nutrients in weaning lambs[D]. Master's Thesis. Lanzhou: Gansu Agricultural University, 2018. (in Chinese) |
| [17] |
张顺芬, 钟儒清, 张碧峰, 等. 不同外源酶组合对棕榈粕原料体外养分消化率和酶水解物能值的影响[J]. 动物营养学报, 2020, 32(12): 5916-5924. ZHANG S F, ZHONG R Q, ZHANG B F, et al. Effects of different combinations of exogenous enzymes on in vitro nutrient digestibility and enzymatic hydrolyzate gross energy of palm kernel meal ingredients[J]. Chinese Journal of Animal Nutrition, 2020, 32(12): 5916-5924 (in Chinese). |
| [18] |
刘汇涛, 杨颖, 邢秀梅, 等. 饲粮添加不同复合酶制剂对育成期水貂生长性能、营养物质消化率及氮代谢的影响[J]. 动物营养学报, 2014, 26(11): 3517-3524. LIU H T, YANG Y, XING X M, et al. Effects of dietary different compound enzyme preparation on growth performance, nutrient digestibility and nitrogen metabolism of growing minks[J]. Chinese Journal of Animal Nutrition, 2014, 26(11): 3517-3524 (in Chinese). DOI:10.3969/j.issn.1006-267x.2014.11.043 |
| [19] |
ZIJLSTRA R T, OWUSU-ASIEDU A, SIMMINS P H. Future of NSP-degrading enzymes to improve nutrient utilization of co-products and gut health in pigs[J]. Livestock Science, 2010, 134(1/3): 255-257. |
| [20] |
QIAO F Q, WANG F, REN L P, et al. Effect of steam-flaking on chemical compositions, starch gelatinization, in vitro fermentability, and energetic values of maize, wheat and rice[J]. Journal of Integrative Agriculture, 2015, 14(5): 949-955. DOI:10.1016/S2095-3119(14)60913-8 |
| [21] |
MCGINN S M, BEAUCHEMIN K A, COATES T, et al. Methane emissions from beef cattle: effects of monensin, sunflower oil, enzymes, yeast, and fumaric acid[J]. Journal of Animal Science, 2004, 82(11): 3346-3356. DOI:10.2527/2004.82113346x |
| [22] |
刘星. 复合益生菌制剂对奶牛瘤胃体外发酵特性及生产性能的影响[D]. 硕士学位论文. 哈尔滨: 东北农业大学, 2012. LIU X. Effect of composite probiotics on ruminal fermentation in vitro and performance of lactating cows[D]. Master's Thesis. Harbin: Northeast Agricultural University, 2012. (in Chinese) |
| [23] |
ELGHANDOUR M M Y, SALEM A Z M, GONZALEZ-RONQUILLO M, et al. Effects of exogenous enzymes on in vitro gas production kinetics and ruminal fermentation of four fibrous feeds[J]. Animal Feed Science and Technology, 2013, 179(1/4): 46-53. |
| [24] |
COLOMBATTO D, MOULD F L, BHAT M K, et al. Use of fibrolytic enzymes to improve the nutritive value of ruminant diets: a biochemical and in vitro rumen degradation assessment[J]. Animal Feed Science and Technology, 2003, 107(1/2/3/4): 201-209. |
| [25] |
WANG Y, MCALLISTER T A, RODE L M, et al. Effects of an exogenous enzyme preparation on microbial protein synthesis, enzyme activity and attachment to feed in the Rumen Simulation Technique (Rusitec)[J]. British Journal of Nutrition, 2001, 85(3): 325-332. DOI:10.1079/BJN2000277 |
| [26] |
王红梅. 复合酶处理玉米秸秆对肉羊生产性能及破解纤维结构机制的研究[D]. 博士学位论文. 北京: 中国农业科学院, 2017. WANG H M. Effect of exogenous enzyme preparation in corn straw-based diet on growth performance of lambs and mechanism of its action on degradation of fiber structure[D]. Ph. D. Thesis. Beijing: Chinese Academy of Agricultural Sciences, 2017. (in Chinese) |
| [27] |
冀一伦. 实用养牛科学[M]. 北京: 中国农业出版社, 2001. JI Y L. Practical cattle science[M]. Beijing: China Agriculture Press, 2001 (in Chinese). |
| [28] |
MURPHY J J, KENNELLY J J. Effect of protein concentration and protein source on the degradability of dry matter and protein in situ[J]. Journal of Dairy Science, 1987, 70(9): 1841-1849. DOI:10.3168/jds.S0022-0302(87)80223-0 |
| [29] |
SATTER L D, SLYTER L L. Effect of ammonia concentration of rumen microbial protein production in vitro[J]. British Journal of Nutrition, 1974, 32(2): 199-208. DOI:10.1079/BJN19740073 |
| [30] |
韩帅. 育肥方式对呼伦贝尔羊和绒山羊瘤胃发酵及瘤胃微生物数量的影响[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2014. HAN S. Effect of fattening ways on rumen fermentation and the number of several rumen microorganisms in Hulunbeier sheep and cashmere goats[D]. Master's Thesis. Hohhot: Inner Mongolia Agricultural University, 2014. (in Chinese) |
| [31] |
国春艳. 木聚糖酶和纤维素酶对后备奶牛生长代谢、瘤胃发酵及微生物区系的影响[D]. 博士学位论文. 北京: 中国农业科学院, 2010. GUO C Y. The effects of xylanase and cellulose on growth performance, nutrition digestibility, ruminal fermentation and microbial diversity in heifers[D]. Ph. D. Thesis. Beijing: Chinese Academy of Agricultural Sciences, 2010. (in Chinese) |
| [32] |
程延彬. 不同种类铜源及水平对奶牛瘤胃发酵及血液生化指标的影响[D]. 硕士学位论文. 大庆: 黑龙江八一农垦大学, 2010. CHENG Y B. Effects of different types of copper source and level on rumen fermentation and blood biochemical parameters of dairy cows[D]. Master's Thesis. Daqing: Heilongjiang Bayi Agricultural University, 2010. (in Chinese) |
| [33] |
PENNER G B, BEAUCHEMIN K A, MUTSVANGWA T. Severity of ruminal acidosis in primiparous Holstein cows during the periparturient period[J]. Journal of Dairy Science, 2007, 90(1): 365-375. DOI:10.3168/jds.S0022-0302(07)72638-3 |
| [34] |
WANG C, LIU Q, GUO G, et al. Effects of fibrolytic enzymes and isobutyrate on ruminal fermentation, microbial enzyme activity and cellulolytic bacteria in pre- and post-weaning dairy calves[J]. Animal Production Science, 2018, 59(3): 471-478. |
| [35] |
SHABI Z, TAGARI H, MURPHY M R, et al. Partitioning of amino acids flowing to the abomasum into feed, bacterial, protozoal, and endogenous fractions[J]. Journal of Dairy Science, 2000, 83(10): 2326-2334. DOI:10.3168/jds.S0022-0302(00)75120-4 |




