原花青素(proanthocyanidins,PACs)是由黄烷-3-醇经由类黄酮生物合成途径形成的以低聚或多聚形式存在的多酚类化合物[1-2],具有捕获活性氧及其衍生自由基的生物活性[3],是一类重要的天然抗氧化剂。原花青素纯品的抗氧化活性优于维生素C、维生素E、β-胡萝卜素及单体黄烷醇[4],且其活性强弱与单体的聚合程度密切相关,低聚体如原花青素B2(proanthocyanidin B2,PAB2)抗氧化活性最强[5]。动物饲粮中添加原花青素能够减少脂肪沉积、缓解脂质过氧化和调节肠道菌群多样性[6-7],起到改善肉品质和保障肠道健康的作用。Liu等[8]研究表明,葡萄籽原花青素(grape seed proanthocyanidin,GSP)能通过调控肠道菌群的组成,缓解饲喂高脂饲粮小鼠体脂的过度沉积;Wu等[9]研究发现,断奶仔猪饲粮中添加GSP能够改变肠道菌群组成,降低体脂形成和减少脂质过氧化,保持猪肉本来的风味。
原花青素广泛存在于多种植物的果实、种子、花、茎叶或树皮当中[10],天然饲草是原花青素的重要来源之一。紫象草(Pennisetum purpureum Schumab)系禾本科多年生大型草本植物[11],营养价值较同属牧草高,且富含花色苷[12]。饲粮中添加20%发酵紫象草有利于改善桂科黑猪生长性能、屠宰性能及肉品质[13]。紫象草叶片的转录组和代谢组分析揭示,与绿色叶片相比,紫色叶片中花色苷和原花青素的合成通路显著上调[14]。目前尚未见关于紫象草茎叶等各部位原花青素的提取、含量测定及其体外抗氧化活性的研究。因此,本研究拟采用PAB2为标准品,建立对-(二甲基氨基)肉桂醛[p-(dimethylamino) cinnamaldehyde,DMAC]法快速测定紫象草原花青素提取物含量,探究提取溶剂类型、提取溶剂浓度、料液比、温度、时间5个单因素对其含量的影响,并通过响应面优化试验确定最佳提取条件,最后测定紫象草原花青素提取物的体外抗氧化活性,为充分利用紫象草饲草资源、将紫象草原花青素开发为天然抗氧化剂提供一定的基础数据。
1 材料与方法 1.1 试验材料与试剂试验材料紫象草采自四川新津国家牧草试验站,同时采集了同属植物皇竹草(Pennisetum sinese Roxb)作为对照样品(图 1)。

|
a:紫象草Pennisetum purpureum Schumab;b:皇竹草Pennisetum sinese Roxb。 图 1 紫象草和皇竹草 Fig. 1 Pennisetum purpureum Schumab and Pennisetum sinese Roxb |
主要试剂:PAB2标准品(纯度≥98%)购于上海源叶生物科技有限公司,总抗氧化能力(total antioxidant capacity,T-AOC)检测试剂盒、羟自由基(hydroxy radical,OH·)清除能力检测试剂盒、总酚(total phenol,TP)含量检测试剂盒、低聚原花青素(oligomeric proantho cyanidins,OPC)含量检测试剂盒购于生工生物工程(上海)股份有限公司,2, 2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐自由基[2, 2-azino-bis (3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt radical,ABTS·]清除能力检测试剂盒购于北京索莱宝科技有限公司,DMAC(纯度≥98%)购于上海阿拉丁生化科技股份有限公司,盐酸、丙酮、无水乙醇、冰醋酸(均为分析纯)购于成都市科龙化学品有限公司。
1.2 仪器与设备ATY224型电子精密天平[岛津企业管理(中国)有限公司]、Sorvall ST 8R型高速冷冻离心机(热电实验设备有限公司,奥斯特罗德分公司)、KQ5200B型超声波清洗器(昆山超声仪器有限公司)、DS-11/DS-11+型超微量紫外/可见分光光度计(北京倍辉科技有限公司)、RG-3000A型旋转蒸发仪(上海亚荣生化仪器厂)、LYOQUEST-85型冷冻干燥机(泰事达科技有限公司)。
1.3 试验方法 1.3.1 紫象草原花青素提取物的制备将紫象草按全株、茎、叶不同组分分割,于105 ℃烘干至恒重,粉碎、过40目筛,按料液比1∶110(g/mL)加入95%酸性丙酮(冰醋酸∶丙酮∶蒸馏水=1∶190∶9,体积比),超声提取60 min(25 ℃,400 W),55 ℃水浴加热60 min,分别通过中速定量滤纸、0.22 μm有机相尼龙滤膜,滤过液旋转蒸发去除丙酮,冷冻干燥即得紫象草原花青素提取物,置于-80 ℃冰箱备用。皇竹草叶原花青素提取物的制备同上述流程。
1.3.2 紫象草原花青素提取条件单因素试验以DMAC法测定PAB2含量,研究提取溶剂类型(蒸馏水、酸性甲醇、酸性乙醇、酸性丙酮、乙酸水溶液)、提取溶剂浓度(55%、65%、75%、85%、95%)、料液比(1∶5、1∶20、1∶40、1∶60、1∶80、1∶100 g/mL)、提取温度(20、30、40、50 ℃)、提取时间(10、30、50、70、90 min)5个单因素对PAB2含量的影响。每个反应条件下设3个重复。
1.3.3 紫象草原花青素提取条件响应面优化试验根据单因素试验结果,筛选得到提取温度、提取时间、料液比3个因素为自变量,以PAB2含量为因变量,利用Design Expert 8.0.6.1进行响应面优化试验(表 1)。
|
|
表 1 响应面优化试验因素和水平 Table 1 Factors and levels of response surface optimization test |
参照黄雪松等[15]的方法,以PAB2为标准品,测定紫象草原花青素提取物PAB2含量,具体操作如下:配制10 mg/mL的PAB2标准溶液并将其梯度稀释;将标准溶液置于超微量紫外/可见分光光度计于400~700 nm进行全波长扫描;现配现用0.1%(g/mL)的DMAC酸性乙醇溶液(盐酸∶蒸馏水∶乙醇=25∶25∶150,体积比);按照稀释液∶DMAC酸性乙醇溶液=1∶3(体积比)加入96孔板,室温避光静置反应30 min,于643 nm处测定吸光度(OD)值;绘制PAB2标准曲线,建立线性回归方程,代入下列公式计算得到紫象草全株、茎、叶及皇竹草叶提取物PAB2含量:
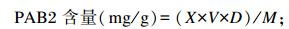
|
式中:X为提取物PAB2浓度(mg/mL);V为提取物溶液体积(mL);D为提取物溶液稀释倍数;M为提取物质量(g)。
1.3.4.2 OPC和TP含量的测定以OPC为标准品,测定液与反应液按1∶4(体积比)混匀,30 ℃水浴避光反应30 min,于500 nm处测定OD值,代入下列公式计算得到提取物OPC含量:
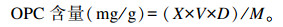
|
式中:X为提取物OPC浓度(mg/mL);V为提取物溶液体积(mL);D为提取物溶液稀释倍数;M为提取物质量(g)。
以没食子酸为标准品,测定液与反应液按1∶10(体积比)混匀,室温避光静置反应10 min,于760 nm处测定OD值,代入下列公式计算得到提取物TP含量:
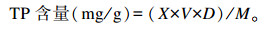
|
式中:X为提取物TP浓度(mg/mL);V为提取物溶液体积(mL);D为提取物溶液稀释倍数;M为提取物质量(g)。
1.3.5 紫象草原花青素提取物体外抗氧化活性的测定以10 mmol/L维生素C为对照,测定液与反应液按1∶19(体积比)混匀,室温避光静置反应6 min,于405 nm处测定OD值,代入下列公式计算得到提取物对ABTS·的清除率:
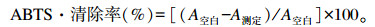
|
式中:A空白为未加提取物时ABTS·溶液的OD值;A测定为提取物与ABTS·反应后溶液的OD值。
以10 mmol/L维生素C为对照,测定液与反应液按1∶19(体积比)混匀,室温避光静置反应20 min,于515 nm处测定OD值,代入下列公式计算得到提取物对1, 1-二苯基-2-三硝基苯肼自由基(1, 1-diphenyl-2-picrylhydrazyl radical,DPPH·)的清除率:
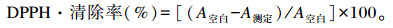
|
式中:A空白为未加提取物时DPPH·溶液的OD值;A测定为提取物与DPPH·反应后溶液的OD值。
以100 mmol/L维生素C为对照,测定液与反应液按1∶6(体积比)混匀,37 ℃孵育60 min,离心后取上清于536 nm处测定OD值,代入下列公式计算得到提取物对OH·的清除率:
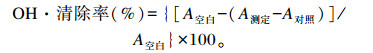
|
式中:A空白为未加提取物时反应体系的OD值;A测定为提取物与体系反应后溶液的OD值;A对照为提取物与同体积的蒸馏水反应后溶液的OD值。
1.4 数据处理与统计分析所有试验数据采用WPS 2019进行整理,采用SPSS 26.0进行单因素方差分析(one-way ANOVA),采用Design Expert 8.0.6软件进行响应面试验数据分析。数据以平均值±标准差表示,P<0.05为差异显著。
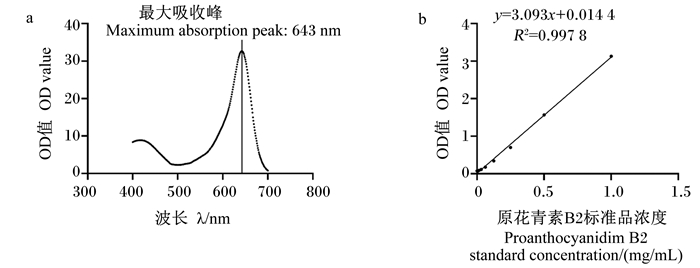
2 结果与分析 2.1 PAB2标准曲线结果PAB2全波长扫描及标准曲线分别见图 2-a、图 2-b,其最大吸收峰值为643 nm,在0~1.0 mg/mL内,PAB2标准品浓度与OD值线性关系良好,回归方程为:
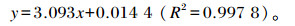
|
|
图 2 PAB2全波长扫描及标准曲线 Fig. 2 Full wavelength scanning and standard curve of PAB2 |
式中:x为PAB2标准品浓度(mg/mL);y为OD值。
2.2 紫象草原花青素提取条件单因素试验结果 2.2.1 提取溶剂类型对PAB2含量的影响由图 3-a可知,以酸性丙酮作为提取剂时PAB2含量最高,达1.964 mg/g;以酸性乙醇作为提取剂时PAB2含量略低,达1.960 mg/g;以酸性丙酮、酸性乙醇作为提取剂时PAB2含量显著高于以蒸馏水、酸性甲醇、乙酸水溶液作为提取剂时(P<0.05),但两者间差异不显著(P>0.05)。考虑到以酸性丙酮作为提取溶剂PAB2含量最高,故以酸性丙酮作为提取溶剂。
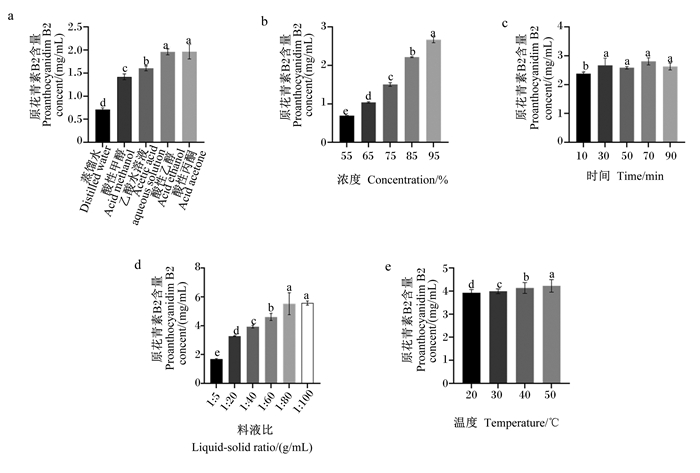
|
数据柱标相同小写字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。图 5、图 6同。 Value columns with the same small letter mean no significant difference (P > 0.05), while with different small letters mean significant difference (P < 0.05). The same as Fig. 5 and Fig. 6. 图 3 紫象草原花青素提取条件单因素试验 Fig. 3 Single factor test of proanthocyanidins extraction conditions in Pennisetum purpureum Schumab |
由图 3-b可知,以95%酸性丙酮进行提取时PAB2含量最高,达2.66 mg/g,显著高于其他浓度(P<0.05),故以95%作为提取溶剂浓度。
2.2.3 提取时间对PAB2含量的影响由图 3-c可知,在50~70 min,PAB2含量随提取时间的增加而增加;90 min时,PAB2含量下降,故以50~70 min作为提取时间。
2.2.4 料液比对PAB2含量的影响由图 3-d可知,料液比为1∶100 g/mL时PAB2含量最高,达5.57 mg/g;料液比为1∶80 g/mL时PAB2含量略低,达5.52 mg/g,料液比为1∶80、1∶100 g/mL时PAB2含量显著高于料液比为1∶5、1∶20、1∶40、1∶60 g/mL时(P<0.05),但料液比为1∶80、1∶100 g/mL之间差异不显著(P>0.05),考虑到料液比为1∶100 g/mL时PAB2含量最高,故以1∶100 g/mL作为提取料液比。
2.2.5 提取温度对PAB2含量的影响由图 3-e可知,PAB2含量随提取温度的增加而增加,50 ℃时最高,达4.22 mg/g,显著高于其他提取温度(P<0.05),故以50 ℃作为提取温度。
2.3 响应面优化提取条件试验结果 2.3.1 Box-Behnken设计结果及响应面优化模型方差分析Box-Behnken设计优化提取紫象草叶原花青素的试验结果见表 2。以提取时间(A)、料液比(B)、提取温度(C)为自变量,以提取物PAB2含量(Y)为因变量,得到二次多项回归方程如下:
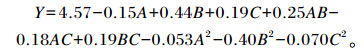
|
|
|
表 2 Box-Behnken设计分组及结果 Table 2 Grouping and results of Box-Behnken design |
对上述模型进行方差分析和显著性检验,结果见表 3,回归模型P<0.05,失拟项P>0.05,相关系数(R2)=0.853,即该模型显著且稳定,可以较好地呈现因变量与自变量、实际值与理论值之间的相关性。综上所述,该试验设计方法可靠,回归方程拟合程度较好,适用于紫象草原花青素提取条件的优化。
|
|
表 3 Box-Behnken试验结果方差分析 Table 3 Variance analysis of Box-Behnken test results |
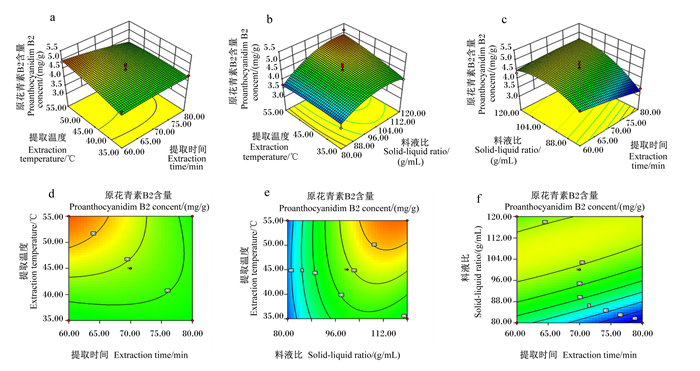
各因素交互作用对提取物PAB2含量的影响见图 4,结果表明,提取时间减小而提取温度或料液比增大的同时,响应曲面变化较平缓,此时影响不明显;各因素轴向等高线椭圆程度不高,说明各因素交互作用影响不明显;影响顺序依次为:料液比>提取温度>提取时间。
|
图 4 提取条件互作对PAB2含量的影响 Fig. 4 Interaction of extraction conditions on PAB2 content |
由表 4可知,按照理论条件提取获得的原花青素提取物含量为5.05 mg/g。为验证上述参数的准确性,并考虑到实际试验的可操作性,按照实际条件提取获得的原花青素提取物含量为5.06 mg/g,与理论条件的相对偏差为0.198%。
|
|
表 4 紫象草原花青素最佳提取条件的确定与验证 Table 4 Determination and verification of optimal extraction conditions of proanthocyanidins in Pennisetum purpureum Schumab |
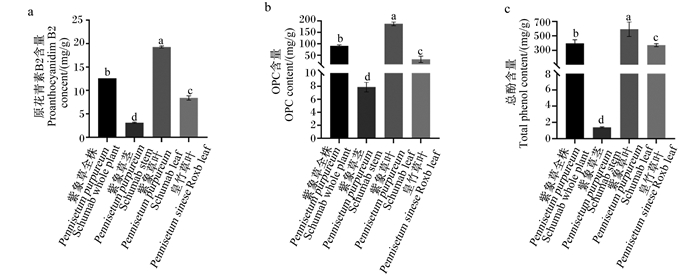
以最佳条件参数提取紫象草全株、茎、叶及皇竹草叶的原花青素,测定提取物PAB2、OPC及TP含量分别见图 5-a、图 5-b、图 5-c,紫象草叶提取物PB2、OPC、TP含量分别为19.26、187.44、594.24 mg/g,均显著高于紫象草全株、茎及皇竹草叶(P<0.05)。
|
图 5 原花青素提取物含量测定 Fig. 5 Determination of proanthocyanidins extract content |
PAB2含量与OPC、TP含量相关性分析见表 5,PAB2含量与TP含量呈显著正相关(R2=0.94,P<0.05)。以上结果表明,以DMAC法测定的PAB2含量能够很好地反映紫象草提取物OPC、TP含量。
|
|
表 5 PAB2含量与OPC、TP含量的Person相关性系数 Table 5 Person correlation coefficient of PAB2 content with OPC and TP contents |
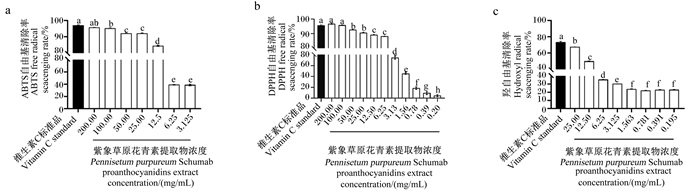
紫象草叶原花青素提取物含量最高,故研究了其对ABTS·、DPPH·、OH·清除能力的影响,分别见图 6-a、图 6-b、图 6-c。在浓度分别为3.125~200 mg/mL、0.2~200 mg/mL、0.195~25 mg/mL内,ABTS·、DPPH·、OH·清除率均随紫象草原花青素提取物浓度增加而增加;当紫象草原花青素提取物浓度为200 mg/mL时,ABTS·、DPPH·清除率最高,分别为95.69%、96.79%,显著高于3.125~50 mg/mL、0.2~50 mg/mL时(P<0.05);当紫象草原花青素提取物浓度为25 mg/mL时,OH·清除率最高,达90.04%,显著高于0.195~12.5 mg/mL时(P<0.05)。
|
图 6 紫象草原花青素提取物体外抗氧化活性 Fig. 6 In vitro antioxidant activity of proanthocyanidins extract in Pennisetum purpureum Schumab |
原花青素性质活泼,组成和结构复杂[16],对其含量进行测定的方法也比较多,目前常用的方法主要分为高效液相色谱(HPLC)法和分光光度法两大类[17],前者专一性好,但速度慢、成本高;后者包括丁醇-盐酸法(Porter法)[18]、硫酸-香草醛法[19]等,所用测定仪器简单,速度快,但专一性差。DMAC是一种淡黄色、有微氨气味的非质子性高极性化合物。DMAC与原花青素的间苯三酚的亲核位点结合,形成蓝色产物,通过建立标准曲线并测定反应后溶液在最大吸收峰处的OD值,即能快速测定原花青素含量[20],以DMAC法测定山竹[15]及曼越橘[21]原花青素含量,结果专一性强、灵敏度高。选择具有代表性的标准品能影响DMAC法的准确度,B型原花青素二聚体因其独特的没食子酸酯结构发生酰化反应所引起的酚羟基增效效应而具有较强的抗氧化清除自由基活性,而高聚体及A型原花青素二聚体由于不具备此结构而生物活性较弱[22-23]。本试验以抗氧化活性最强的组分PAB2作为标准品,建立DMAC法快速准确测定紫象草原花青素提取物的含量,结果与采用商品试剂盒测定的TP、OPC含量相关性良好,表明DMAC法快速灵敏、专一性高,可以用于紫象草提取物中原花青素含量的测定。
目前植物中原花青素的提取主要采用超声波、微波、酶和机械处理辅助的单溶剂和多溶剂萃取法[24-27]。原花青素富含的酚羟基结构易溶于有机溶剂(如乙醇、丙酮)[28];超声波可以破坏植物细胞壁,加速细胞内活性成分的快速溶出[29],提高有机溶剂通过细胞膜的渗透性[30],显著缩短提取时间,超声波辅助有机溶剂提取可显著提高提取效率[31]。Martín-García等[32]采用超声波辅助有机溶剂提取啤酒糟原花青素,在80%丙酮水溶液、超声功率400 W、提取时间55 min的条件下获得了最高含量的原花青素。本试验采用超声波辅助酸性丙酮溶液萃取法提取紫象草原花青素,提取物含量随料液比及温度的增加而增加,这是因为原花青素与酸性丙酮均属极性物质,提高料液比有助于增强植物细胞中原花青素等多酚活性物质的溶解度[33],由于超声波产生的空化效应降低了分子水平上的暴露温度[34],故本试验在55 ℃低温条件下提取即获得了最高提取物含量;然而提取物含量随提取时间的增加而减小,这是因为较长时间的超声波及水浴处理可能导致原花青素的降解[35]。Lv等[36]研究得到猴桃叶原花青素的最优提取条件参数为:料液比30 mL/g、超声功率200 W(70 ℃、15 min),各因素影响顺序依次为:温度>料液比>时间。因为本试验采用丙酮作为提取剂,受制于丙酮溶液沸点较低,本试验仅在35~55 ℃内展开研究,而原花青素在55~70 ℃内并不发生降解,低温范围内对于原花青素的溶解及提取效果不明显,故本试验各因素影响顺序依次为:料液比>温度>时间。
3.2 紫象草叶原花青素提取物体外抗氧化活性畜禽在生产过程中的多种因素都能够引起动物机体发生氧化应激(oxidative stress,OS),产生诸如活性氧自由基(reactive oxygen species,ROS)等[37],从而造成机体损伤,影响动物健康和动物性产品品质。原花青素的酚羟基结构可与氧化物结合并清除自由基,自身则被氧化形成醌式结构,醌式结构通过亲核加成反应生成儿茶酸、焦酚结构类似物,进一步起到抗氧化作用,从而保护脂质、蛋白质等大分子活性物质不被氧化[38]。本试验通过芬顿(Fenton)反应及氧化还原反应体系生成稳定存在的OH·、ABTS·、DPPH·,测定紫象草原花青素提取物的自由基清除能力,用于评估其抗氧化活性。余修亮等[39]研究发现,OPC含量为44.36 mg/g的莲子壳原花青素提取物对DPPH·清除能力与维生素C接近、对ABTS·清除能力强于维生素C;本试验探究得到,紫象草原花青素提取物浓度为200 mg/mL时,对DPPH·、ABTS·清除率分别为95.69%、96.79%;紫象草原花青素提取物为25 mg/mL时,对·OH清除率为90.04%。由此可见,紫象草原花青素提取物能够有效清除自由基,具有提高机体抗氧化活性、缓解氧化应激的潜能。此外,原花青素的纯度对抗氧化活性也有影响,汪玉玲等[40]研究发现,在0~1.0 mg/mL浓度内,青桑葚提取物及各纯化组分对ABTS·、DPPH·清除能力的随浓度增加而增加,且纯度越高,清除自由基能力越强。虽然本试验并未对紫象草原花青素提取物进行纯化处理,提取物中可能存在可溶于有机溶剂的脂类、蛋白质和无机盐等杂质[41],紫象草原花青素提取物的聚合度和各组分含量也有待进一步分析,但是考虑到分离制备纯品将增加生产成本,且粗提取物仍然具备良好的清除自由基活性,故本试验制备的紫象草原花青素提取物仍然具有开发为天然抗氧化饲料添加剂的潜力。
4 结论紫象草原花青素提取物的最优制备条件参数为:料液比1∶110 g/mL、提取温度55 ℃、提取时间60 min,DMAC法测定此条件下提取物PAB2含量为5.06 mg/g。紫象草原花青素提取物浓度为200 mg/mL时对ABTS·、DPPH·清除率分别为95.69%、96.79%,浓度为25 mg/mL时对OH·清除率为90.04%。
| [1] |
DIXON R A, SARNALA S. Proanthocyanidin biosynthesis-a matter of protection[J]. Plant Physiology, 2020, 184(2): 579-591. DOI:10.1104/pp.20.00973 |
| [2] |
RAUF A, IMRAN M, ABU-IZNEID T, et al. Proanthocyanidins: a comprehensive review[J]. Biomedicine & Pharmacotherapy, 2019, 116: 108999. |
| [3] |
HUANG Z A, LIU X H, GAO Y K, et al. Experimental study on the compound system of proanthocyanidin and polyethylene glycol to prevent coal spontaneous combustion[J]. Fuel, 2019, 254: 115610. DOI:10.1016/j.fuel.2019.06.018 |
| [4] |
ODAI T, TERAUCHI M, KATO K, et al. Effects of grape seed proanthocyanidin extract on vascular endothelial function in participants with prehypertension: a randomized, double-blind, placebo-controlled study[J]. Nutrients, 2019, 11(12): 2844. DOI:10.3390/nu11122844 |
| [5] |
覃国新, 李慧玲, 何洁, 等. 固相萃取净化HPLC法同时检测荔枝皮中的几种原花青素[J]. 现代食品科技, 2021, 37(7): 310-314, 73. QIN G X, LI H L, HE J, et al. Determination of several procyanidins in litchi pericarp by HPLC with pass-through extraction[J]. Modern Food Science & Technology, 2021, 37(7): 310-314, 73 (in Chinese). DOI:10.13982/j.mfst.1673-9078.2021.7.0950 |
| [6] |
LU D, WANG L J, ZHANG W, et al. Study on the antioxidant ability of procyanidins and their complexes[J]. E3S Web of Conferences, 2022, 341: 01013. DOI:10.1051/e3sconf/202234101013 |
| [7] |
FARHA A K, YANG Q Q, KIM G, et al. Tannins as an alternative to antibiotics[J]. Food Bioscience, 2020, 38: 100751. DOI:10.1016/j.fbio.2020.100751 |
| [8] |
LIU W, ZHAO S Q, WANG J Q, et al. Grape seed proanthocyanidin extract ameliorates inflammation and adiposity by modulating gut microbiota in high-fat diet mice[J]. Molecular Nutrition & Food Research, 2017, 61(9): 1601082. |
| [9] |
WU Y, MA N, SONG P X, et al. Grape seed proanthocyanidin affects lipid metabolism via changing gut microflora and enhancing propionate production in weaned pigs[J]. The Journal of Nutrition, 2019, 149(9): 1523-1532. DOI:10.1093/jn/nxz102 |
| [10] |
SIERRA-CRUZ M, MIGUÉNS-GÓMEZ A, GRAU-BOVÉ C, et al. Grape-seed proanthocyanidin extract reverts obesity-related metabolic derangements in aged female rats[J]. Nutrients, 2021, 13(6): 2059. DOI:10.3390/nu13062059 |
| [11] |
朱杰, 武炳超, 张欢, 等. 紫色象草辐射诱变M2代的遗传和表型变异研究[J]. 四川农业大学学报, 2021, 39(5): 681-687. ZHU J, WU B C, ZHANG H, et al. Genetic and phenotypic variation of radiation induced M2 generation in purple elephant grass[J]. Journal of Sichuan Agricultural University, 2021, 39(5): 681-687 (in Chinese). DOI:10.16036/j.issn.1000-2650.2021.05.017 |
| [12] |
焦文静. 紫象草花色苷的提取纯化、结构分析及特性研究[D]. 硕士学位论文. 福州: 福建农林大学, 2015. JIAO W J. Study on extraction, purification, identifieation and properties of anthocyanins from purple elephant grass[D]. Master's Thesis. Fuzhou: Fujian Agriculture and Forestry University, 2015. (in Chinese) |
| [13] |
黄志朝, 易显凤, 庞天德, 等. 紫色象草发酵料对桂科黑猪育肥效果分析[J]. 饲料研究, 2021, 44(13): 35-39. HUANG Z C, YI X F, PANG T D, et al. Fattening effect of fermented Pennisetum purpureum Schumab cv. purple on Guike black pigs[J]. Feed Research, 2021, 44(13): 35-39 (in Chinese). DOI:10.13557/j.cnki.issn1002-2813.2021.13.009 |
| [14] |
ZHOU S F, CHEN J, LAI Y S, et al. Integrative analysis of metabolome and transcriptome reveals anthocyanins biosynthesis regulation in grass species Pennisetum purpureum[J]. Industrial Crops and Products, 2019, 138: 111470. DOI:10.1016/j.indcrop.2019.111470 |
| [15] |
黄雪松, 黄文烨. 对-二甲基氨基肉桂醛法测定山竹原花青素[J]. 现代食品科技, 2013, 29(7): 1687-1690. HUANG X S, HUANG W Y. Determination of proanthocyanidins in mangosteen by 4-(dimethylamino) cinnamaldehyde assay[J]. Modern Food Science & Technology, 2013, 29(7): 1687-1690 (in Chinese). DOI:10.13982/j.mfst.1673-9078.2013.07.022 |
| [16] |
MAMET T, GE Z Z, ZHANG Y, et al. Interactions between highly galloylated persimmon tannins and pectins[J]. International Journal of Biological Macromolecules, 2018, 106: 410-417. DOI:10.1016/j.ijbiomac.2017.08.039 |
| [17] |
石磊, 高哲, 刘丽南, 等. 四种原花青素含量测定方法比较[J]. 食品工业科技, 2019, 40(15): 242-247, 253. SHI L, GAO Z, LIU L N, et al. Comparison of four methods for quantitation of proanthocyanidin[J]. Science and Technology of Food Industry, 2019, 40(15): 242-247, 253 (in Chinese). DOI:10.13386/j.issn1002-0306.2019.15.040 |
| [18] |
PORTER L J, HRSTICH L N, CHAN B G. The conversion of procyanidins and prodelphinidins to cyanidin and delphinidin[J]. Phytochemistry, 1985, 25(1): 223-230. DOI:10.1016/S0031-9422(00)94533-3 |
| [19] |
孙芸, 谷文英. 硫酸-香草醛法测定葡萄籽原花青素含量[J]. 食品与发酵工业, 2003, 29(9): 43-46. SUN Y, GU W Y. Determination of procyanidin content in grape seed using H2SO4-vanillin assay[J]. Food and Fermentation Industries, 2003, 29(9): 43-46 (in Chinese). DOI:10.3321/j.issn:0253-990X.2003.09.011 |
| [20] |
严猛. 天然棕色棉色素的液相色谱分离及缩合单宁的定量分析[D]. 硕士学位论文. 杭州: 浙江理工大学, 2016. YAN M. Liquid chromatograph separation of pigments in naturally brown cotton and condensed tannin analysis[D]. Master's Thesis. Hangzhou: Zhejiang Sci-Tech University, 2016. (in Chinese) |
| [21] |
PRIOR R L, FAN E, JI H P, et al. Multi-laboratory validation of a standard method for quantifying proanthocyanidins in cranberry powders[J]. Journal of the Science of Food and Agriculture, 2010, 90(9): 1473-1478. DOI:10.1002/jsfa.3966 |
| [22] |
BASALEKOU M, KYRALEOU M, PAPPAS C, et al. Proanthocyanidin content as an astringency estimation tool and maturation index in red and white winemaking technology[J]. Food Chemistry, 2019, 299: 125135. DOI:10.1016/j.foodchem.2019.125135 |
| [23] |
孙芸. 葡萄籽原花青素聚合度与功效关系的研究[D]. 博士学位论文. 无锡: 江南大学, 2004. SUN Y. Study on the degree of polymerization and bioactivities of grape Seed procyanidins[D]. Ph. D. Thesis. Wuxi: Jiangnan University, 2004. (in Chinese) |
| [24] |
CHEN J, THILAKARATHNA W P D W, ASTATKIE T, et al. Optimization of catechin and proanthocyanidin recovery from grape seeds using microwave-assisted extraction[J]. Biomolecules, 2020, 10(2): 243. DOI:10.3390/biom10020243 |
| [25] |
FERNÁNDEZ K, VEGA M, ASPÉ E. An enzymatic extraction of proanthocyanidins from País grape seeds and skins[J]. Food Chemistry, 2015, 168: 7-13. DOI:10.1016/j.foodchem.2014.07.021 |
| [26] |
CAO J, CHEN L Y, LI M H, et al. Efficient extraction of proanthocyanidin from Ginkgo biloba leaves employing rationally designed deep eutectic solvent-water mixture and evaluation of the antioxidant activity[J]. Journal of Pharmaceutical and Biomedical Analysis, 2018, 158: 317-326. DOI:10.1016/j.jpba.2018.06.007 |
| [27] |
CHEN F L, DU X Q, ZU Y G, et al. Microwave-assisted method for distillation and dual extraction in obtaining essential oil, proanthocyanidins and polysaccharides by one-pot process from Cinnamomi Cortex[J]. Separation and Purification Technology, 2016, 164: 1-11. DOI:10.1016/j.seppur.2016.03.018 |
| [28] |
NETO R T, SANTOS S A O, OLIVEIRA J, et al. Biorefinery of high polymerization degree proanthocyanidins in the context of circular economy[J]. Industrial Crops and Products, 2020, 151: 112450. DOI:10.1016/j.indcrop.2020.112450 |
| [29] |
THILAKARATHNA W P D W, RUPASINGHE H P V. Optimization of the extraction of proanthocyanidins from grape seeds using ultrasonication-assisted aqueous ethanol and evaluation of anti-steatosis activity in vitro[J]. Molecules, 2022, 27(4): 1363. DOI:10.3390/molecules27041363 |
| [30] |
KALLI E, LAPPA I, BOUCHAGIER P, et al. Novel application and industrial exploitation of winery by-products[J]. Bioresources and Bioprocessing, 2018, 5(1): 46. DOI:10.1186/s40643-018-0232-6 |
| [31] |
RANJHA M M A N, IRFAN S, LORENZO J M, et al. Sonication, a potential technique for extraction of phytoconstituents: a systematic review[J]. Processes, 2021, 9(8): 1406. DOI:10.3390/pr9081406 |
| [32] |
MARTÍN-GARCÍA B, PASINI F, VERARDO V, et al. Optimization of sonotrode ultrasonic-assisted extraction of proanthocyanidins from brewers' pent grains[J]. Antioxidants, 2019, 8(8): 282. DOI:10.3390/antiox8080282 |
| [33] |
RAN L, YANG C, XU M L, et al. Enhanced aqueous two-phase extraction of proanthocyanidins from grape seeds by using ionic liquids as adjuvants[J]. Separation and Purification Technology, 2019, 226: 154-161. DOI:10.1016/j.seppur.2019.05.089 |
| [34] |
WANG Y G, ZHANG X, MA X Q, et al. Study on the kinetic model, thermodynamic and physicochemical properties of glycyrrhiza polysaccharide by ultrasonic assisted extraction[J]. Ultrasonics Sonochemistry, 2019, 51: 249-257. DOI:10.1016/j.ultsonch.2018.10.012 |
| [35] |
GOUDA M, EL-DIN BEKHIT A, TANG Y, et al. Recent innovations of ultrasound green technology in herbal phytochemistry: a review[J]. Ultrasonics Sonochemistry, 2021, 73: 105538. DOI:10.1016/j.ultsonch.2021.105538 |
| [36] |
LV J M, GOUDA M, ZHU Y Y, et al. Ultrasound-assisted extraction optimization of proanthocyanidins from kiwi (Actinidia chinensis) leaves and evaluation of its antioxidant activity[J]. Antioxidants, 2021, 10(8): 1317. DOI:10.3390/antiox10081317 |
| [37] |
GALANO A, RAÚL ALVAREZ-IDABOY J. Computational strategies for predicting free radical scavengers' protection against oxidative stress: where are we and what might follow?[J]. International Journal of Quantum Chemistry, 2019, 119(2): e25665. |
| [38] |
张慧文, 张玉, 马超美. 原花青素的研究进展[J]. 食品科学, 2015, 36(5): 296-304. ZHANG H W, ZHANG Y, MA C M. Progress in procyanidins research[J]. Food Science, 2015, 36(5): 296-304 (in Chinese). |
| [39] |
余修亮, 朱志平, 李佳桥, 等. 莲子壳原花青素超声提取工艺优化及其抗氧化活性[J]. 中国食品学报, 2018, 18(12): 99-109. YU X L, ZHU Z P, LI J Q, et al. Optimization of the extraction process of proanthocyanidins from lotus (Nelumbo nucifera Gaertn.) seed epicarp and their antioxidant activities[J]. Journal of Chinese Institute of Food Science and Technology, 2018, 18(12): 99-109 (in Chinese). |
| [40] |
汪玉玲, 蔡为荣, 卓允允, 等. 速逆流色谱分离制备青桑葚中原花青素及其抗氧化活性研究[J/OL]. 天然产物研究与开发: 1-13[2022-04-10]. http://kns.cnki.net/kcms/detail/51.1335.q.20220318.1716.006.html. WANG Y L, CAI W R, ZHUO Y Y, et al. Separation of procyanidins from green mulberry by high-speed countercurrent chromatography and their antioxidant activity[J]. Natural Product Research and Development: 1-13[2022-04-10]. http://kns.cnki.net/kcms/detail/51.1335.q.20220318.1716.006.html. (in Chinese) |
| [41] |
景联鹏, 唐徐禹, 顾丽莉, 等. 植物中黄酮类化合物提取技术研究进展[J]. 纤维素科学与技术, 2021, 29(4): 60-70. JING L P, TANG X Y, GU L L, et al. Research progress on extraction methods of flavonoids from plants[J]. Journal of Cellulose Science and Technology, 2021, 29(4): 60-70 (in Chinese). |




