2. 河北农业大学动物医学院, 保定 071001;
3. 保定市农业农村局, 保定 071000;
4. 宁晋县农业农村局, 宁晋 055550
2. College of Veterinary Medicine, Hebei Agricultural University, Baoding 071001, China;
3. Animal Husbandry Workstation of Baoding, Baoding 070000, China;
4. Ningjin Municipal Bureau of Agriculture, Ningjin 055550, China
牛肉因富含多种人体必需氨基酸、维生素、矿物质等而备受消费者青睐[1]。如今随着人们生活水平的提高,优质牛肉供不应求,因此肉牛生产相关从业者和科研人员应重点关注如何改善牛肉品质以生产优质牛肉。氨基酸营养是反刍动物蛋白质营养的核心,肉中氨基酸的含量和比例是评价肉类蛋白质营养价值的重要指标[2],特别是限制性氨基酸,其平衡与否将会直接影响到蛋白质等含氮物质的利用效率。可通过补饲氨基酸平衡氨基酸比例来提高蛋白质的利用效率,改善肉牛的生产性能及肉品质。蛋氨酸是构成人体的必需氨基酸之一,参与蛋白质的合成,是动物体中的第一大限制性氨基酸,也是动物生长必需氨基酸中唯一的含硫氨基酸,参与动物机体内众多的代谢途径,为动物提供甲基,合成动物生长所需要的蛋白质和活性物质,饲粮中必须添加适量的蛋氨酸以满足动物生长的需要[3]。赖氨酸既是人体的必需氨基酸,也是反刍动物的必需氨基酸。作为反刍动物体内第二大限制性氨基酸,赖氨酸是合成机体蛋白质,形成骨骼肌、酶蛋白的原料。在饲粮中添加赖氨酸可以增加小肠可消化氨基酸总数,提高蛋白质的利用率,减少蛋白质在瘤胃转化过程中的损失[4]。
由于反刍动物瘤胃微生物会消耗机体所摄取的氨基酸,导致到达小肠的氨基酸的量和比例发生显著改变,尤其是限制性氨基酸,因此越来越多研究人员开始研究过瘤胃氨基酸产品,而由于饲粮组成、动物品种、生长阶段及地理位置的不同,不同研究得出的过瘤胃氨基酸的添加量不尽相同[5-9]。
在反刍动物饲粮中添加适量的过瘤胃氨基酸可有效地增加小肠对营养物质的吸收,改善反刍动物的生长性能和自身机体的健康状况,既可在某种程度上缓解蛋白质饲料短缺的问题,又能提高反刍动物氮素沉积率[10-15],改善肉品质。因此,本试验拟在降低饲粮蛋白质水平的基础上补充不同剂量过瘤胃赖氨酸(rumen-protected lysine,RPLys)和过瘤胃蛋氨酸(rumen-protected methionine,RPMet),研究其对荷斯坦公牛生长性能、屠宰性能、肉品质及氮代谢的影响,以期为过瘤胃氨基酸在改善牛肉品质方面的研究提供理论依据。
1 材料与方法 1.1 试验材料RPLys和RPMet购于杭州某公司,瘤胃保护率为60.0%。
1.2 试验设计本试验采用单因素随机试验设计,选用36头体重[(424±15) kg]相近、体况良好、健康无病的荷斯坦公牛作为试验牛,随机分为3组,每组12头。对照组(Ⅰ组)饲喂蛋白质水平为13%的正常饲粮,2个试验组(Ⅱ、Ⅲ组)均饲喂蛋白质水平为11%的低蛋白质饲粮,同时Ⅱ组补充34 g/(d·头)RPLys+2 g/(d·头)RPMet,Ⅲ组补充55 g/(d·头)RPLys+9 g/(d·头)RPMet。预试期7d,正试期83 d。根据NRC(2001)[16]肉牛饲养标准配制试验饲粮,试验饲粮组成及营养水平见表 2。
|
|
表 1 试验饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of experimental diets (DM basis) |
|
|
表 2 引物序列 Table 2 Primer information |
饲养试验于2016年3—6月在河北省保定市宏达牛场进行。试验用奶公牛饲养管理条件一致,每天上午、下午各饲喂1次,自由饮水。饲喂后,认真打扫牛棚,为奶公牛提供洁净的水源和整洁的休息场地。试验期间牛棚定期消毒,维持牛棚内外的干燥和卫生。
1.4 样品的采集与处理 1.4.1 饲料样品的采集与处理在试验期内,采用四分法对饲粮多次取样。将样品置于烘箱烘干(105.0 ℃ 15 min,65.0 ℃ 48 h),取出回潮24 h后制成风干样品,粉碎后分成2份,分别过10和40目筛,储存备测养分含量。粉碎过10目筛的风干样品用于测定中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)含量,粉碎过40目筛的风干样品用于测定水分、粗蛋白质(CP)、粗脂肪(EE)、粗灰分(Ash)、钙(Ca)和磷(P)含量。
1.4.2 粪便样品的采集与处理在正试期末采用全收粪法连续3 d收集试验牛的粪便,每头每天取粪便样品600 g,均匀分成2份,其中一份添加60.0 mL 10%的硫酸溶液,另一份不加酸,烘干粉碎过筛置于室温保存,备测养分含量。粪便中各养分含量的测定方法同饲粮中各养分含量的测定方法一致。
1.4.3 血液样品的采集与处理在正试期结束后晨饲前,每组随机选取4头试验牛通过颈静脉无菌采血,将采集的血液放入促凝管。将装有血样的促凝剂管于37.0 ℃水浴0.5 h后,3 000 r/min离心15 min,收集血清分装至1.50 mL的塑料离心管,置于-20 ℃保存备用。
1.4.4 肌肉样品的采集与处理在正试期结束后称重,每组选3头试验牛用于屠宰试验。测定试验牛宰前活重(空腹状态)、胴体重(活牛屠宰后去皮、头、蹄、尾、内脏及生殖器的躯体,保留肾周脂肪和腹腔脂肪)。屠宰后在排酸车间放置48 h后分割,计算净肉重等屠宰性能指标。在第12~13肋间横截面处取1 kg左右肉样,将肉样分为2份,一份用来测定剪切力、蒸煮损失、失水率、肉色等;另一份剁碎置于-20 ℃冻存,用于常规营养成分含量的测定。
试验牛屠宰后,马上割取背腰最长肌(第12~13肋间肌肉)组织,分成2份,一份置于0.5 mL离心管中加入RNA保存液,用于肌肉中氮代谢相关基因表达的测定。
1.5 测定指标及方法 1.5.1 生长性能正试期开始及结束时,试验牛在早晨空腹进行称重,计算平均日增重(ADG);试验期内每隔15 d,连续3 d测定各组试验牛的干物质采食量(DMI),计算日均干物质采食量(ADDMI);利用日均干物质采食量、平均日增重计算料重比(F/G)。
1.5.2 养分表观消化率根据国标方法测定饲粮和粪便中水分[17]、粗蛋白质[18]、粗脂肪[19]、钙[20]、磷[21]的含量,参照Van Soest等[22]的方法测定饲粮和粪便中中性洗涤纤维、酸性洗涤纤维含量,参照《饲料中盐酸不溶灰分的测定》(GB/T 23742—2009)测定酸不溶灰分(AIA)含量。
养分表观消化率计算公式如下:
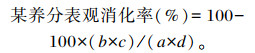
|
式中:a为饲粮中该养分的含量(%);b为粪便中该养分的含量(%);c为饲粮中酸不溶灰分的含量(%);d为粪便中酸不溶灰分的含量(%)。
1.5.3 血清游离氨基酸含量血清游离氨基酸含量采用柱前衍生高效液相色谱法[23]测定。
1.5.4 屠宰性能屠宰性能测定指标主要有胴体重、净肉重、屠宰率、净肉率、胴体产肉率、眼肌面积。
屠宰率、净肉率、胴体产肉率计算公式如下:
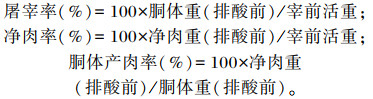
|
眼肌面积:把硫酸纸贴放于第12~13肋骨间的外脊横切面,拿2B铅笔沿肌肉轮廓划线,用KP-90N求积仪计算眼肌面积。
1.5.5 肉品质肌肉的pH使用手持式UB-7型酸度计(美国)测定;蒸煮损失和剪切力的测定参照农业行业标准NY/T 1180—2006测定;失水率使用A7209型压力仪(中国苏州)测定;肉色使用CR-10型色差仪(日本)测定。肌肉水分、粗蛋白质、粗脂肪、粗灰分含量的测定方法同饲粮,氨基酸含量的测定按照《饲料中氨基酸的测定》(GB/T 18246—2000)进行。
1.5.6 肌肉中氮代谢相关基因表达据NCBI中已报道的牛基因序列及引物设计方法来设计引物,引物均由上海生工生物技术有限公司代为合成,引物信息见表 2。反应体系为20 μL:iQ SYBR Green Supermix 10 μL,PCR正向引物(3 μmol/μL)2 μL,PCR反向引物(3 μmol/μL) 2 μL,cDNA 5 μL,ddH2O 1 μL。反应条件:95 ℃预变性3 min,95 ℃变性15 s,60 ℃退火延伸,72 ℃,40个循环。各个样品cDNA重复3次PCR,根据熔解曲线来评判产物特异性。β-肌动蛋白(β-actin)作为内参基因,肌肉中氮代谢相关基因mRNA相对表达量采用2-△△Ct方法[24]计算。
1.6 数据统计与分析先使用Excel 2019进行数据的初步整理分析,然后用SPSS 19.0软件进行单因素方差分析,并采用Duncan氏法进行组间多重比较。P < 0.05表示差异显著,P < 0.01表示差异极显著。试验数据表示为平均值±标准差。
2 结果与分析 2.1 低蛋白质饲粮补充RPLys和RPMet对荷斯坦公牛生长性能的影响由表 3可知,各组间平均日增重、日均干物质采食量、料重比无显著差异(P>0.05)。
|
|
表 3 低蛋白质饲粮补充RPLys和RPMet对荷斯坦公牛生长性能的影响 Table 3 Effects of low protein diet supplemented with RPLys and RPMet on growth performance of Holstein bulls |
由表 4可知,各组间各养分表观消化率均无显著差异(P>0.05)。
|
|
表 4 低蛋白质饲粮补充RPLys和RPMet对荷斯坦公牛养分表观消化率的影响 Table 4 Effects of low protein diet supplemented with RPLys and RPMet on nutrient apparent digestibility of Holstein bulls |
由表 5可知,各组间各屠宰性能指标均无显著差异(P>0.05)。
|
|
表 5 低蛋白质饲粮补充RPLys和RPMet对荷斯坦公牛屠宰性能的影响 Table 5 Effects of low protein diet supplemented with RPLys and RPMet on slaughter performance of Holstein bulls |
由表 6可知,各组间肌肉pH、剪切力、蒸煮损失、失水率、肉色均没有显著差异(P>0.05)。
|
|
表 6 低蛋白质饲粮补充RPLys和RPMet对荷斯坦公牛物理和化学指标的影响 Table 6 Effects of low protein diet supplemented with RPLys and RPMet on muscle physical and chemical indexes of Holstein bulls |
由表 7可知,各组间肌肉常规营养成分含量均无显著差异(P>0.05)。
|
|
表 7 低蛋白质饲粮补充RPLys和RPMet对荷斯坦公牛肌肉常规营养成分含量的影响 Table 7 Effects of low protein diet supplemented with RPLys and RPMet on conventional nutrient contents in muscle of Holstein bulls |
本试验中对照组和试验组共检测出16种氨基酸。由表 8可知,Ⅲ组的异亮氨酸含量极显著高于Ⅰ组(P < 0.01),谷氨酸和天冬氨酸含量显著高于Ⅰ组(P < 0.05),其他氨基酸含量各组间均未表现出显著差异(P>0.05)。
|
|
表 8 低蛋白质饲粮补充RPLys和RPMet对荷斯坦公牛肌肉氨基酸含量的影响 Table 8 Effects of low protein diet supplemented with RPLys and RPMet on amino acid contents in muscle of Holstein bulls |
由表 9可知,对于血清游离氨基酸,Ⅲ组的苏氨酸含量极显著高于Ⅰ和Ⅱ组(P<0.01),总氨基酸、苯丙氨酸和丙氨酸含量显著高于Ⅰ和Ⅱ组(P<0.05),赖氨酸含量显著高于Ⅰ组(P<0.05),甘氨酸含量显著高于Ⅱ组(P<0.05),其他氨基酸含量与Ⅰ和Ⅱ组无显著差异(P>0.05);Ⅰ和Ⅱ组间各血清游离氨基酸含量均无显著差异(P>0.05)。
|
|
表 9 低蛋白质饲粮补充RPLys和RPMet对荷斯坦公牛血清游离氨基酸含量的影响 Table 9 Effects of low protein diet supplemented with RPLys and RPMet on free amino acid contents in serum of Holstein bulls |
由表 10可知,与Ⅰ组相比,Ⅱ和Ⅲ组的胰岛素受体底物1(IRS1)mRNA相对表达量极显著升高(P<0.01);Ⅲ组的肿瘤抑制复合物1(TSC1)和肿瘤抑制复合物2(TSC2)mRNA相对表达量极显著降低(P<0.01),磷脂酰肌醇-3-激酶(PI3K)mRNA相对表达量显著提高(P<0.05)。溶质载体家族3成员2(SLC3A2)、磷脂酰肌醇依赖性蛋白激酶(PDK)、核糖体蛋白S6激酶1(S6K1)、真核细胞翻译起始因子4B(eIF4B)和真核细胞翻译起始因子4E-结合蛋白1(eIF4E-BP1)mRNA相对表达量各组间无显著差异(P>0.05)。
|
|
表 10 低蛋白质饲粮补充RPLys和RPMet对荷斯坦公牛肌肉中氮代谢相关基因表达的影响 Table 10 Effects of low protein diet supplemented with RPLys and RPMet on expression of nitrogen metabolism related genes in muscle of Holstein bulls |
赖氨酸与蛋氨酸分别是反刍动物主要的限制性氨基酸,对动物体内氨基酸的代谢具有协调与平衡作用,可以促进机体蛋白质合成[25]。限制性氨基酸的不足会抑制机体对其他氨基酸的吸收和利用,从而影响机体对营养物质的消化利用率以及生长性能。研究表明降低反刍动物饲粮的蛋白质水平是减少氮排放的措施之一,但可能导致反刍动物的生产性能[26]和粗蛋白质、粗脂肪等养分表观消化率降低[27]。为满足反刍动物的营养需要,并要保证反刍动物的生产性能,在降低饲粮蛋白质水平的同时加入过瘤胃氨基酸可提高小肠可吸收氨基酸利用率,从而达到减排效果。本试验中,Ⅰ、Ⅱ、Ⅲ组荷斯坦公牛的料重比、日均干物质采食量、养分表观消化率等无显著差异,这与殷溪瀚[28]的研究结果基本一致,说明低蛋白质饲粮水平补充RPLys和RPMet不会影响荷斯坦公牛的生长性能。郭伟等[14]的研究发现,在低蛋白质饲粮中添加过瘤胃氨基酸对杜寒杂交肉羊的生长性能无显著影响。殷溪瀚[28]的研究发现,饲粮蛋白质水平降低1.71%的同时补充RPLys和RPMet时荷斯坦奶公牛的增重效果与直接饲喂高蛋白质饲粮基本一致。本试验中,Ⅰ和Ⅱ组荷斯坦公牛的各养分表观消化率均低于Ⅲ组,这大概是因为Ⅲ组饲粮补充的RPLys和RPMet适量,使饲粮限制性氨基酸的比例平衡,从而提高了养分的消化率;此外,Ⅲ组的平均日增重高于Ⅰ和Ⅱ组,这表明Ⅲ组饲粮组成更能满足荷斯坦公牛的生长发育。
3.2 低蛋白质饲粮补充RPLys和RPMet对荷斯坦公牛屠宰性能的影响屠宰率、净肉率、胴体产肉率等是评价肉牛屠宰性能的重要指标。本试验中,虽然低蛋白质饲粮补充55 g/(d·头)RPLys+9 g/(d·头)RPMet组荷斯坦公牛的屠宰率高于其他2组,但3组间并无显著差异,表明在低蛋白质饲粮中补充过瘤胃氨基酸对荷斯坦公牛的屠宰性能无显著影响,这与周玉香等[29]的相关研究结果一致。殷溪瀚[28]研究也表明,在低蛋白质饲粮中补充RPLys和RPMet对荷斯坦奶公牛的屠宰率、净肉率无显著影响。
3.3 低蛋白质饲粮补充RPLys和RPMet对荷斯坦公牛肉品质的影响评价肉品质的物理和化学指标主要有pH、剪切力、蒸煮损失、失水率、肉色及粗蛋白质、粗脂肪等常规营养成分含量。肌肉pH反映肌肉酸度和机体糖酵解速率,其高低与肉色、蒸煮损失及嫩度相关。失水率是指肌肉中的蛋白质经过物理处置后的保水力,其值越小说明肌肉保水力越高,嫩度越好;剪切力也是表现肌肉的嫩度的重点指标,剪切力越小则肌肉嫩度越好[30]。薛丰等[31]研究结果,饲粮中补充适量的RPLys可增加利木赞杂交肉牛肌肉蛋白质含量,降低系水力,对肉色等其他性状没有显著影响。本试验中,虽然3组荷斯坦公牛的肌肉物理和化学指标以及常规营养成分含量无显著差异,但是低蛋白质饲粮补充55 g/(d·头)RPLys+9 g/(d·头)RPMet组的肌肉粗蛋白质、粗脂肪含量均高于其他2组,肌肉剪切力和失水率低于其他2组。
3.4 低蛋白质饲粮补充RPLys和RPMet对荷斯坦公牛血清游离氨基酸含量的影响血清游离氨基酸主要是从小肠吸收的氨基酸以及机体蛋白质分解的氨基酸,其含量具有显示动物氨基酸平衡和代谢的重要作用[32-33]。研究表明,添加过瘤胃氨基酸可增加血液中游离赖氨酸与蛋氨酸以及总游离氨基酸的含量,但是对其他游离氨基酸含量的影响不一致。孙华等[34]在奶牛饲粮中添加RPMet的研究发现,添加60 g/d的RPMet后奶牛血浆总游离氨基酸含量提高12.49%,机体合成乳蛋白的效率提高。韩兆玉等[35]的研究显示,奶牛饲粮中补充RPMet后血清游离蛋氨酸含量显著增加,其他游离氨基酸含量没有显著改变。Lee等[8]的研究表明,泌乳期奶牛饲粮中补充RPMet会增加血浆游离蛋氨酸含量,没有使其他游离氨基酸含量产生较大变化。郭玉琴[36]的研究表明,奶牛饲粮补充RPLys后,血液游离氨基酸中赖氨酸、丙氨酸、甘氨酸、苯丙氨酸含量显著提高,蛋氨酸含量也有提高的趋势。本试验中,低蛋白质饲粮补充55 g/(d·头)RPLys+9 g/(d·头)RPMet组荷斯坦公牛的血清游离赖氨酸、苯丙氨酸、苏氨酸、甘氨酸和丙氨酸含量较对照组显著增加,总游离氨基酸和游离蛋氨酸含量高于其余2组,其他游离氨基酸含量无显著差异,同前人研究结果基本一致。
3.5 低蛋白质饲粮补充RPLys和RPMet对荷斯坦公牛氮代谢的影响大量体内外试验结果表明,氨基酸、胰岛素样生长因子-1(IGF-1)等能通过哺乳动物雷帕霉素靶蛋白(mTOR)信号通路促进动物骨骼肌蛋白、乳腺蛋白等的合成利用。罗钧秋等[37]研究表明,大鼠受到血液IGF-1和血浆氨基酸组成和比例的影响,腓肠肌蛋白合成代谢增强。季昀等[38]认为IGF-1可以提高乳蛋白合成通路中mTOR、S6K1基因的表达量,从而调节κ-酪蛋白的合成。本试验中,低蛋白质饲粮补充55 g/(d·头)RPLys+9 g/(d·头)RPMet组和补充34 g/(d·头)RPLys+2 g/(d·头)RPMet组荷斯坦公牛血清游离氨基酸和亮氨酸含量的增加可能促进了肌肉组织中SLC3A2基因表达量的上调,从而通过哺乳动物雷帕霉素复合物1(mTORC1)信号通路调控机体蛋白质合成代谢。
IGF-1、生长激素(GH)等一些营养因子通过PI3K/丝氨酸/苏氨酸蛋白激酶(Akt)/mTORC1信号通路激活mTORC1,对蛋白质合成发挥作用[39]。本试验中,低蛋白质饲粮补充55 g/(d·头)RPLys+9 g/(d·头)RPMet组荷斯坦公牛肌肉中IRS1、PI3K、PDK mRNA相对表达量增加,且高于其他2组,这可能是因为血清中IGF-1含量的提高激活了IRS1,被激活的IRS1可以磷酸化其下游信号元件PI3K使之活化,激活的PI3K继而活化PDK,然后促进Akt的Ser308位点发生磷酸化,磷酸化的Akt可以激活mTOR及其下游的信号通路[40]。Akt与mTORC1之间的作用还受到TSC1、TSC2的调控。肿瘤抑制复合物(TSC)抑制小G蛋白Rheb的活性,Rheb诱导eIF4E-BP1磷酸化,导致eIF4E-BP1从真核翻译起始因子4E (eukaryotic initiation factor 4E, eIF4E)上分离开,使eIF4E启动5′cap mRNA的翻译,所以Rheb是正向调控mTOR的;而TSC2可以抑制Rheb的活性,从而通过Rheb实现对mTOR的负性调控[41]。Akt可以抑制TSC1、TSC2的活性,因此上调的IRS1、PI3K、PDK基因间接抑制TSC1、TSC2基因的表达,使低蛋白质饲粮补充55 g/(d·头)RPLys+9 g/(d·头)RPMet组TSC1、TSC2 mRNA相对表达量比其余组降低。由于TSC1、TSC2对mTORC1的负性调控,TSC1、TSC2表达的显著下调激活了mTORC1基因。
S6K1和eIF4E-BP1为mTORC1的下游调节蛋白翻译的基因。eIF4E是蛋白质翻译起始因子之一,活化水平低的eIF4E-BP1会和eIF4E紧密结合起来,而活化的mTORC1可以磷酸化4E-BP1,降低了其与eIF4E的亲和力,使eIF4E能与其他翻译起始因子[如真核细胞翻译起始因子4G(eIF4G)、eIF4B、真核细胞翻译起始因子4A(eIF4A)等]结合形成eIF4E复合物,从而启动mRNA的翻译;S6K1是下游的70 kDa核糖体蛋白S6激酶(p70S6K)靶蛋白激酶之一,S6K1基因可以通过刺激下游的eIF4B、核糖体蛋白S6(RPS6)、真核细胞翻译起始因子-2(eIF-2)的磷酸化,从而促进蛋白质的翻译。本试验中,低蛋白质饲粮补充55 g/(d·头)RPLys+9 g/(d·头)RPMet可通过下调肌肉中TSC1、TSC2的表达激活mTORC1基因的表达,与前人相关研究结果相似。Arriola等[42]研究表明,降低饲粮蛋白质水平并补充RPLys和RPMet后,奶牛乳腺组织mTOR通路中的S6K1和eIF4E-BP1基因的相对丰度提高了。桑丹等[43]研究发现,饲粮中补充过瘤胃亮氨酸可以促进绵羊骨骼肌的mTOR信号通路中eIF4E-BP1及p70S6K的磷酸化程度,从而促进骨骼肌蛋白质的合成。综上所述,降低饲粮蛋白质水平的同时补充适量RPLys和RPMet使饲粮达到平衡对荷斯坦公牛肌肉中蛋白质合成通路具有促进作用。
4 结论饲粮蛋白质水平从13%降低至11%条件下,补充55 g/(d·头)RPLys+9 g/(d·头)RPMet能够使荷斯坦公牛的生长性能、养分表观消化率、屠宰性能及肉品质不受影响,并可改善肌肉中氮代谢相关基因的表达。
| [1] |
MARIZ L D S, DE MELO AMARAL P, DE CAMPOS VALADARES FILHO S, et al. Dietary protein reduction on microbial protein, amino acids digestibility, and body retention in beef cattle.Ⅰ.Digestibility sites and ruminal synthesis estimated by purine bases and 15N as markers[J]. Journal of Animal Science, 2018, 96(6): 2453-2467. DOI:10.1093/jas/sky134 |
| [2] |
DE LEMOS M V A, PERIPOLLI E, BERTON M P, et al. Association study between copy number variation and beef fatty acid profile of Nellore cattle[J]. Journal of Applied Genetics, 2018, 59(2): 203-223. DOI:10.1007/s13353-018-0436-7 |
| [3] |
WU G Y. Dietary requirements of synthesizable amino acids by animals: a paradigm shift in protein nutrition[J]. Journal of Animal Science and Biotechnology, 2014, 5(1): 34. DOI:10.1186/2049-1891-5-34 |
| [4] |
赵若含, 李莲, 韩兆玉, 等. 低蛋白氨基酸平衡日粮对产奶牛的生产性能和粪尿氮含量的影响[J]. 畜牧与兽医, 2019, 51(4): 23-29. ZHAO R H, LI L, HAN Z Y, et al. Effect of low protein amino acid balanced diet on production performance and nitrogen content in feces and urine of lactating dairy cows[J]. Animal Husbandry & Veterinary Medicine, 2019, 51(4): 23-29 (in Chinese). |
| [5] |
杨魁. 过瘤胃蛋氨酸和过瘤胃赖氨酸在生长育肥牛中的应用研究[D]. 硕士学位论文. 重庆: 西南大学, 2014. YANG K. Application research of rumen protected methionine and rumen protected lysine on growing-finishing beef cattle[D]. Master's Thesis. Chongqing: Southwest University, 2014. (in Chinese) |
| [6] |
向白菊, 张健, 黄德均, 等. 饲料中添加过瘤胃氨基酸对肉用牛生长性能的影响[J]. 南方农业, 2014, 8(9): 58-60. XIANG B J, ZHANG J, HUANG D J, et al. Effects of adding rumen bypass amino acids in feed on growth performance of beef cattle[J]. South China Agriculture, 2014, 8(9): 58-60 (in Chinese). DOI:10.3969/j.issn.1673-890X.2014.09.020 |
| [7] |
云伏雨. 瘤胃保护赖氨酸对泌乳中期奶牛生产性能和血液生化指标的影响[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2011. YUN F Y. Effects of rumen protected lysine on production performance and blood biochemical parameters in mid-lactating dairy cows[D]. Master's Thesis. Hohhot: Inner Mongolia Agricultural University, 2011. (in Chinese) |
| [8] |
LEE C, GIALLONGO F, HRISTOV A N, et al. Effect of dietary protein level and rumen-protected amino acid supplementation on amino acid utilization for milk protein in lactating dairy cows[J]. Journal of Dairy Science, 2015, 98(3): 1885-1902. DOI:10.3168/jds.2014-8496 |
| [9] |
燕磊, 杨维仁, 杨在宾, 等. 不同水平瘤胃保护性蛋氨酸对小尾寒羊氮代谢及生产性能的影响[J]. 家畜生态学报, 2005, 26(6): 27-30. YAN L, YANG W R, YANG Z B, et al. Effects of different addition levels of rumen-protected methionine on nitrogen metabolism and production performance of small-tail Han sheep[J]. Journal of Domestic Animal Ecology, 2005, 26(6): 27-30 (in Chinese). DOI:10.3969/j.issn.1673-1182.2005.06.007 |
| [10] |
刘环宇, 姜洋, 张龙舟, 等. 过瘤胃氨基酸加工技术及其在动物生产中的应用进展[J]. 饲料研究, 2021, 44(10): 115-118. LIU H Y, JIANG Y, ZHANG L Z, et al. Progress of rumen amino acid processing technology and its application in animal production[J]. Feed Research, 2021, 44(10): 115-118 (in Chinese). |
| [11] |
李国栋. 低蛋白日粮补饲过瘤胃蛋氨酸、亮氨酸、异亮氨酸对后备牛生长及消化性能的影响[D]. 硕士学位论文. 泰安: 山东农业大学, 2020. LI G D. Effects of rumen-protected methionine, leucine, isoleucine supplemental on growth and digestive performance of heifers in low-protein diets[D]. Master's Thesis. Tai'an: Shandong Agricultural University, 2020. (in Chinese) |
| [12] |
牛骁麟. 饲粮蛋白质水平与过瘤胃氨基酸对湖羊生长育肥性能、养分消化和瘤胃发酵的影响[D]. 硕士学位论文. 兰州: 兰州大学, 2020. NIU X L. Effects of dietary protein levels and rumen protected amino acids on growth and fattening performance, nutrient digestion and rumen fermentation of Hu sheep[D]. Master's Thesis. Lanzhou: Lanzhou University, 2020. (in Chinese) |
| [13] |
郭俊强. 不同饲喂水平下添加过瘤胃蛋氨酸和赖氨酸对滩羊生长与肉质的影响[D]. 硕士学位论文. 银川: 宁夏大学, 2019. GUO J Q. Effects of rumen protected methionine (RPMet) and lysine (RPLys) on the growth and meat quality of Tan sheep at different feeding levels[D]. Master's Thesis. Yinchuan: Ningxia University, 2019. (in Chinese) |
| [14] |
郭伟, 王文义, 杨东, 等. 低蛋白质饲粮补充过瘤胃氨基酸对育肥阶段杜寒杂交肉羊生长性能和屠宰性能的影响[J]. 动物营养学报, 2020, 32(3): 1247-1255. GUO W, WANG W Y, YANG D, et al. Effects of supplementation of rumen protected amino acids in low protein diets on growth performance and slaughter performance of Dorper×thin-tailed Han crossbred mutton sheep during fattening stage[J]. Chinese Journal of Animal Nutrition, 2020, 32(3): 1247-1255 (in Chinese). |
| [15] |
李向龙, 陶金忠, 白玲荣, 等. 饲料中添加过瘤胃蛋氨酸对滩羊羊毛品质的影响[J]. 浙江农业科学, 2019, 60(9): 1679-1681, 1685. LI X L, TAO J Z, BAI L R, et al. Effect of rumen-protected methionine on wool quality of Tan sheep[J]. Journal of Zhejiang Agricultural Sciences, 2019, 60(9): 1679-1681, 1685 (in Chinese). |
| [16] |
NRC. Nutrition requirement of dairy cattle[S]. 7th ed. Washington, D.C. : The National Academies Press, 2001.
|
| [17] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 饲料中水分的测定: GB/T 6435-2014[S]. 北京: 中国标准出版社, 2014. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, the China National Standardization Management Committee. Determination of moisture in feedstuffs: GB/T 6435-2014 determination of misture in feedstuffs[S]. Beijing: Standards Press of China, 2014. (in Chinese) |
| [18] |
国家技术监督局. 饲料中粗蛋白测定: GB/T 6432-1994[S]. 北京: 中国标准出版社, 1994. The State Bureau of Quality and Technical Supervision. Method for the determination of crude protein in feedstuffs: GB/T 6432-1994[S]. Beijing: Standards Press of China, 1994. (in Chinese) |
| [19] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 饲料中粗脂肪的测定: GB/T 6433-2006[S]. 北京: 中国标准出版社, 2006. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, the China National Standardization Management Committee. Determination of moisture in feedstuffs: GB/T 6433-2006 determination of crude fat in feeds[S]. Beijing: Standards Press of China, 2006. (in Chinese) |
| [20] |
中华人民共和国国家质量监督检验检疫总局. 饲料中钙的测定: GB/T 6436-2002[S]. 北京: 中国标准出版社, 2002. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. Determination of calcium in feed: GB/T 6436-2002[S]. Beijing: Standards Press of China, 2002. (in Chinese) |
| [21] |
中华人民共和国国家质量监督检验检疫总局. 饲料中总磷的测定分光光度法: GB/T 6437-2002[S]. 北京: 中国标准出版社, 2002. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. Determination of phosphorus in feed-spectphotometry: GB/T 6437-2002[S]. Beijing: Standards Press of China, 2002. (in Chinese) |
| [22] |
VAN SOEST P J, ROBERTSON J B, LEWIS B A. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition[J]. Journal of Dairy Science, 1991, 74(10): 3583-3597. DOI:10.3168/jds.S0022-0302(91)78551-2 |
| [23] |
尤晓蒙. 饲料中氨基酸的HPLC检测方法研究[D]. 硕士学位论文. 保定: 河北农业大学, 2015. YOU X M. Study on determination of amion acids in feeds by high performance liquid chromatography[D]. Master's Thesis. Baoding: Hebei Agricultural University, 2015. (in Chinese) |
| [24] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [25] |
刘倩, 符潮, 周传社, 等. 反刍动物瘤胃微生物限制性氨基酸代谢研究进展[J]. 家畜生态学报, 2017, 38(2): 83-87. LIU Q, FU C, ZHOU C S, et al. Research advances in limiting amino acid metabolism of microorganisms in the rumen[J]. Journal of Domestic Animal Ecology, 2017, 38(2): 83-87 (in Chinese). |
| [26] |
杨海涛, 曲永利, 苗树君. 日粮蛋白水平和过瘤胃蛋氨酸对奶牛泌乳性能及采食量的影响[J]. 黑龙江畜牧兽医, 2016(10): 83-84. YANG H T, QU Y L, MIAO S J. Effects of dietary protein level and rumen methionine on lactation performance and feed intake of dairy cows[J]. Heilongjiang Animal Science and Veterinary Medicine, 2016(10): 83-84 (in Chinese). |
| [27] |
张莹, 郭旭生, 龙瑞军, 等. 饲粮氮水平对牦牛瘤胃发酵及营养物质消化代谢特征的影响[J]. 动物营养学报, 2011, 23(6): 956-964. ZHANG Y, GUO X S, LONG R J, et al. Effects of dietary nitrogen level on ruminal fermentation, digestibility and metabolism of nutrients in yaks[J]. Chinese Journal of Animal Nutrition, 2011, 23(6): 956-964 (in Chinese). DOI:10.3969/j.issn.1006-267X.2011.06.011 |
| [28] |
殷溪瀚. 过瘤胃赖氨酸、蛋氨酸对荷斯坦奶公牛生长性能和胴体品质影响的研究[D]. 硕士学位论文. 大庆: 黑龙江八一农垦大学, 2015. YIN X H. Effects of rumen lysine and methionine on growth performance and carcass quality of Holstein milk bull[D]. Master's Thesis. Daqing: Heilongjiang Bayi Agricultural University, 2015. (in Chinese) |
| [29] |
周玉香, 杨宇为. 过瘤胃赖氨酸、共轭亚油酸和N-氨甲酰谷氨酸对舍饲滩羊产肉性能和肉品质的影响[J]. 动物营养学报, 2015, 27(12): 3904-3911. ZHOU Y X, YANG Y W. Effects of rumen-protected lysine, conjugated linoleic acid and N-carbamyl glutamic acid on meat performance and meat quality of stabling Tan sheep[J]. Chinese Journal of Animal Nutrition, 2015, 27(12): 3904-3911 (in Chinese). DOI:10.3969/j.issn.1006-267x.2015.12.032 |
| [30] |
韩永胜. 肉牛生产力的指标测定与影响因素分析[J]. 现代畜牧科技, 2016(8): 7, 10. HAN Y S. Determination of productivity indexes and analysis of influencing factors of beef cattle[J]. Modern Animal Husbandry Science & Technology, 2016(8): 7, 10 (in Chinese). |
| [31] |
薛丰, 郭晓旭, 郭望山, 等. 日粮添加过瘤胃赖氨酸对利木赞杂交肉牛胴体性状和肉质的影响[J]. 中国农业大学学报, 2010, 15(4): 82-86. XUE F, GUO X X, GUO W S, et al. Effect of dietary rumen-protected lysine supplementation level on carcass characteristics and meat quality of Limousin crossbred beef cattle[J]. Journal of China Agricultural University, 2010, 15(4): 82-86 (in Chinese). |
| [32] |
钱鑫, 李雪艳, 姜淑贞, 等. 氨基酸水平对莱芜黑仔猪生产性能和血清生化指标及游离氨基酸浓度的影响[J]. 中国畜牧杂志, 2016, 52(13): 55-59. QIAN X, LI X Y, JIANG S Z, et al. Effects of dietary amino acid levels on performance, serum biochemical indexes and free amino acids concentration of Laiwu black weaned piglets[J]. Chinese Journal of Animal Science, 2016, 52(13): 55-59 (in Chinese). |
| [33] |
王建华, 王洪荣, 张海鹰, 等. 瘤胃保护性氨基酸对内蒙古白绒山羊氮消化代谢的影响[J]. 畜牧兽医学报, 2006, 37(1): 38-43. WANG J H, WANG H R, ZHANG H Y, et al. Effect of rumen-protected amino acid products on nitrogen metabolism in Inner Mongolia white cashmere goats[J]. Acta Veterinaria et Zootechnica Sinica, 2006, 37(1): 38-43 (in Chinese). DOI:10.3321/j.issn:0366-6964.2006.01.008 |
| [34] |
孙华, 张晓明, 王欣, 等. 过瘤胃保护蛋氨酸对奶牛乳和血浆氨基酸含量及血液生化指标的影响[J]. 中国奶牛, 2010(12): 7-11. SUN H, ZHANG X M, WANG X, et al. Effect of supplementing rumen protected methionine on content and composition of amino acids in milk and plasma, blood biochemical parameters of lactating cows[J]. China Dairy Cattle, 2010(12): 7-11 (in Chinese). DOI:10.3969/j.issn.1004-4264.2010.12.003 |
| [35] |
韩兆玉, 周岩民, 王根林, 等. 过瘤胃蛋氨酸对奶牛产奶量、乳成分以及血液氨基酸的影响[J]. 南京农业大学学报, 2006, 29(3): 54-58. HAN Z Y, ZHOU Y M, WANG G L, et al. Effect of supplementing rumen protected methionine on milk composition and serum amine acids of dairy cow[J]. Journal of Nanjing Agricultural University, 2006, 29(3): 54-58 (in Chinese). |
| [36] |
郭玉琴. 蛋氨酸和赖氨酸过瘤胃保护及其效果评价研究[D]. 博士学位论文. 北京: 中国农业科学院, 2006. GUO Y Q. A study of the protection and effectiveness evaluation on rumen bypass methionine and lysine[D]. Ph. D. Thesis. Beijing: Chinese Academy of Agricultural Sciences, 2006. (in Chinese) |
| [37] |
罗钧秋, 陈代文, 余冰. 不同蛋白源对生长大鼠骨骼肌蛋白质代谢相关基因表达的影响[J]. 中国畜牧杂志, 2012, 48(15): 37-40. LUO J Q, CHEN D W, YU B. Effects of different protein sources on the expression of genes related to protein metabolism in skeletal muscle of growing rats[J]. Chinese Journal of Animal Science, 2012, 48(15): 37-40 (in Chinese). |
| [38] |
季昀, 庞学燕, 田青, 等. 生长激素和胰岛素样生长因子Ⅰ对奶牛乳蛋白合成关键激酶及调节因子mRNA表达量的影响[J]. 动物营养学报, 2013, 25(1): 198-207. JI Y, PANG X Y, TIAN Q, et al. Growth hormone and insulin-like growth factor Ⅰ: effects on mRNA expression levels of key kinases and regulatory factors regulating milk protein synthesis[J]. Chinese Journal of Animal Nutrition, 2013, 25(1): 198-207 (in Chinese). |
| [39] |
HUANG K Z, FINGAR D C. Growing knowledge of the mTOR signaling network[J]. Seminars in Cell & Developmental Biology, 2014, 36: 79-90. |
| [40] |
WATANABE K, FREDEEN A H, ROBINSON P H, et al. Effects of fat coated rumen bypass lysine and methionine on performance of dairy cows fed a diet deficient in lysine and methionine[J]. Animal Science Journal, 2006, 77(5): 495-502. |
| [41] |
张慧锋, 李妍, 白雪, 等. mTOR信号通路及其抑制剂的研究进展[J]. 中国畜牧兽医, 2013, 40(2): 36-41. ZHANG H F, LI Y, BAI X, et al. Reasearch progress on mTOR pathway and its inhibitors[J]. China Animal Husbandry & Veterinary Medicine, 2013, 40(2): 36-41 (in Chinese). |
| [42] |
ARRIOLA A S I, BELL A L, ESTES K, et al. Effects of reduced dietary protein and supplemental rumen-protected essential amino acids on the nitrogen efficiency of dairy cows[J]. Journal of Dairy Science, 2014, 97(9): 5688-5699. |
| [43] |
桑丹, 孙海洲, 郭俊清, 等. 过瘤胃保护性亮氨酸对绵羊骨骼肌哺乳动物雷帕霉素靶蛋白(mTOR) 信号传导通路关键因子的影响[J]. 动物营养学报, 2011, 23(1): 61-65. SANG D, SUN H Z, GUO J Q, et al. Effects of rumen-protected leucine on the key factors controlling mTOR signal transduction pathway in the skeletal muscle of sheep[J]. Chinese Journal of Animal Nutrition, 2011, 23(1): 61-65 (in Chinese). |




