2. 华中农业大学动物科学技术学院动物医学院, 武汉 430000
2. College of Animal Science & Technology, College of Animal Veterinary Medicine, Huazhong Agricultural University, Wuhan 430000, China
纳米氧化锌是通过化学或者物理的方法使氧化锌颗粒直径达到1~100 nm,由于其量子效应、物质的局域性、巨大表面积及界面效应,其与上皮细胞接触位点及与肠绒毛接触面积也随之增加,有效增强小肠对纳米氧化锌吸收利用能力[1]。饲粮添加凹凸棒土负载纳米氧化锌可提高断奶仔猪空肠和回肠微生物α多样性,显著增加回肠拟杆菌属(Bacteroides)、乳杆菌属(Lactobacillus)等益生菌的丰度,改善肠道环境[2]。李洪民等[3]研究证实,断乳仔猪饲粮中添加凹土纳米氧化锌后,其抗氧化酶活性、抗炎因子含量升高,即仔猪抗氧化能力和免疫功能得到强化。Ramiah等[4]研究表明,在热应激肉鸡饲粮添加40和60 mg/kg纳米氧化锌,肉鸡血清中皮质醇含量下降,缓解其应激反应的同时肌肉丙二醛含量下降,抗氧化能力增强,肉品质也得到改善。上述研究表明,纳米氧化锌不但具有改善机体肠道菌群结构、提高肠道黏膜免疫功能的作用,而且具有改善肉品质的功能。
肌内脂肪(IMF)是衡量牛肉品质的关键指标之一,其对肉的风味、多汁性及大理石花纹形成存在至关重要的作用[5]。动物IMF沉积是脂肪合成与脂肪分解动态博弈的结果,受到过氧化物酶增殖激活受体γ(PPARγ)、乙酰辅酶A羧化酶(ACC)、固醇调节元件结合蛋白-1(SREBP-1)、脂肪酸合成酶(FAS)等脂肪合成基因,以及脂蛋白脂肪酶(LPL)、激素敏感脂肪酶(HSL)和肉碱转移酶-1(CPT-1)等脂肪分解基因的共同影响[6]。目前关于纳米氧化锌的研究多集中于改善单胃动物肠道菌群结构、提高肠道黏膜免疫功能等方面[2-3],而鲜见关于纳米氧化锌影响育肥牛背最长肌IMF沉积相关基因表达的报道。因此,本试验旨在探究纳米氧化锌对育肥牛生长性能、屠宰性能、血清指标及背最长肌IMF沉积相关基因表达的影响,以期为在育肥牛饲粮中合理添加纳米氧化锌提供理论依据。
1 材料与方法 1.1 试验动物、试验设计和饲养管理选择健康无病、年龄(12~15月龄)相近和体重相近的西杂阉公牛(西门塔尔牛×本地黄牛)16头,随机分2组,每组8个重复,每个重复为1头牛。对照组饲喂基础饲粮(不添加锌),纳米氧化锌组在基础饲粮的基础上添加80 mg/kg锌(纳米氧化锌形式),该添加量在反刍动物锌需要量的最高限量(120 mg/kg)以内,符合中华人民共和国农业部公告第2625号规定《饲料添加剂安全使用规范》。试验期为60 d。参考我国《肉牛饲养标准》(NY/T 815—2004)[7]中400 kg体重、日增重1 kg肉牛营养推荐值设计基础饲粮配方,基础饲粮组成及营养水平见表 1。每天清洁栏舍,保持栏内卫生,日常管理、消毒与防疫按照常规程序进行。每头试验牛单栏拴养饲喂,喂料时间为08:00和16:00,自由采食和饮水。
|
|
表 1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
记录试验开始和试验终末测定全部试验牛体重,根据测定的体重计算出每组试验牛的平均日增重(ADG),ADG=(末重-初重)/试验天数。试验期间记录每头试验牛每天的精料、粗料实际饲喂量和剩余量,并收集剩余饲粮于-20 ℃低温保存,每15 d测定1次投入饲粮和剩余饲粮中干物质含量,用于试验期内平均日采食量(ADFI)的测定。根据ADFI和ADG计算出料重比(F/G),F/G=ADFI/ADG。试验结束时测定试验牛体重,选择每组中与平均体重接近的5头牛进行屠宰,参照周光宏等[8]的方法测定胴体重、净肉重、屠宰率、胴体产肉率和背膘厚度。
1.2.2 血清生化指标和激素测定于试验结束时分别采集5头肉牛的颈静脉血10 mL,37 ℃水浴30 min,3 000 r/min离心15 min,取血清-20 ℃冻存待测。采用南京建成生物工程研究所试剂盒用Hitachi 7020全自动生化分析仪(Hitachi公司,日本)测定血清总胆固醇、甘油三酯、葡萄糖、高密度脂蛋白、低密度脂蛋白、游离脂肪酸含量。血清瘦素、胰岛素和胰岛样生长因子-Ⅰ(IGF-Ⅰ)含量采用南京建成生物工程研究所生产的试剂盒,参照试剂盒说明书进行测定。
1.2.3 背最长肌IMF含量和脂肪代谢关键酶活性测定每组选择接近组内平均体重的5头牛屠宰,采集牛第12~13肋骨背最长肌样品,于-20 ℃保存,用以IMF含量和脂肪代谢关键酶活性测定。采用索氏脂肪抽提法测定背最长肌IMF含量。脂肪代谢关键酶(FAS、ACC、HSL、CPT-1和LPL)活性测定采用南京建成生物工程研究所生产的试剂盒,参照试剂盒说明书进行测定。
1.2.4 背最长肌IMF沉积相关基因表达分析采集试验屠宰牛背最长肌肌肉样品,立即放入液氮罐冻存,随即保存于-80 ℃超低温冰箱中。采用Trizol法提取背最长肌样品总RNA,通过Nano Drop 2000分光光度计检测RNA浓度与纯度,使用1%琼脂糖凝胶电泳检测RNA完整性。利用逆转录试剂盒(TaKaRa)将样品RNA逆转录为cDNA。参考Zhang等[9]和Livak等[10]的方法合成β-肌动蛋白、FAS、ACC、HSL、CPT-1、SREBP-1和PPARγ基因的特定引物序列,以β-肌动蛋白为内参基因,用2-ΔΔCt法定量计算目的基因表达量。
1.3 统计分析采用SPSS 17.0统计软件对试验数据进行t检验,数据以平均值±标准差表示,0.05≤P < 0.10表示有差异趋势,P < 0.05表示差异显著,P < 0.01表示差异极显著。
2 结果 2.1 生长性能和屠宰性能纳米氧化锌对育肥牛生长性能和屠宰性能的影响见表 2。与对照组相比,添加纳米氧化锌对初重、末重、ADG、ADFI、宰前活重、胴体重、净肉重、屠宰率、胴体产肉率和背膘厚度未产生显著影响(P>0.05),但显著提高了ADG(P < 0.05),显著降低了F/G(P < 0.05)。
|
|
表 2 纳米氧化锌对育肥牛生长性能和屠宰性能的影响 Table 2 Effects of nano-zinc oxide on growth performance and slaughter performance of fattening cattle |
纳米氧化锌对育肥牛血清生化指标和激素含量的影响见表 3。与对照组相比,添加纳米氧化锌极显著提高了血清游离脂肪酸、甘油三酯、总胆固醇、高密度脂蛋白、低密度脂蛋白、葡萄糖和IGF-Ⅰ含量(P < 0.01),显著提高了胰岛素含量(P < 0.05),极显著降低了葡萄糖/胰岛素比值(P < 0.01),对瘦素含量无显著影响(P>0.05)。
|
|
表 3 纳米氧化锌对育肥牛血清生化指标和激素含量的影响 Table 3 Effects of nano-zinc oxide on serum biochemical indexes and hormone contents of fattening cattle |
纳米氧化锌对育肥牛背最长肌IMF含量和脂肪代谢关键酶活性的影响见表 4。与对照组相比,添加纳米氧化锌显著提高了背最长肌IMF含量和ACC活性(P < 0.05),极显著降低了HSL活性(P < 0.01),显著降低了CPT-1和LPL活性(P < 0.05)。
|
|
表 4 纳米氧化锌对育肥牛背最长肌IMF含量及脂肪代谢关键酶活性的影响 Table 4 Effects of nano-zinc oxide on IMF content and lipid metabolism key enzyme activities of longissimus dorsi muscle in fattening cattle |
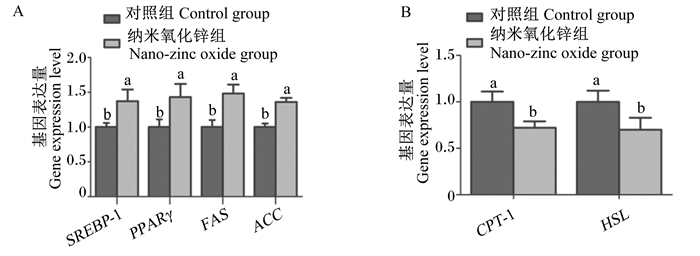
纳米氧化锌对育肥牛背最长肌IMF沉积相关基因表达的影响见图 1。与对照组相比,添加纳米氧化锌显著提高了育肥牛背最长肌SREBP-1、PPARγ、ACC和FAS基因表达量(P < 0.05),显著降低了HSL和CPT-1基因表达量(P < 0.05)。
|
SREBP-1:固醇调节元件结合蛋白-1 sterol regulator element binding protein-1;PPARγ: 过氧化物酶增殖激活受体γ proliferator-activated receptor gamma;FAS:脂肪酸合成酶fatty acid synthetase;ACC:乙酰辅酶A羧化酶acetyl coenzyme A carboxylase;HSL: 激素敏感脂肪酶hormone sensitive lipase;CPT-1:肉碱转移酶-1 carnitine transferase-1。数据柱形标注不同小写字母表示差异显著(P < 0.05)。 Value columns with different small letters mean significant difference (P < 0.05). 图 1 纳米氧化锌对育肥牛背最长肌IMF沉积相关基因表达的影响 Fig. 1 Effects of nano-zinc oxide on expression of IMF deposition related genes in longissimus dorsi muscle of fattening cattle |
在本试验中,饲粮添加纳米氧化锌后,育肥牛ADG升高,与Xia等[11]的研究结果不同。Xia等[11]研究表明,断奶仔猪饲粮分别添加600 mg/kg纳米氧化锌和3 000 mg/kg氧化锌后,ADG均未产生显著变化。不同研究结果的差异可能原因有二:一是试验动物的体况差异,仔猪早期断奶仍处于营养物质消化吸收率低,腹泻等疾病频发的状态,体况更佳的育肥牛ADG呈现上升水平;二是试验动物的主要消化吸收方式不同,纳米氧化锌对反刍动物瘤胃微生物具有改善作用,直接提高了瘤胃对营养物质的消化能力,同时强化机体对营养物质的吸收与转运储备功能,而单胃动物在摄入纳米氧化锌后在胃酸作用下分解为纳米颗粒和Zn2+,经肠绒毛进入上皮细胞后间接发挥调节作用。另外,本试验结果还发现饲粮中添加纳米氧化锌后育肥牛的F/G降低,而对末重、ADFI和屠宰性能(胴体重、净肉重、屠宰率、胴体产肉率和背膘厚度)均无显著影响,这与Sun等[12]和Hussan等[13]的研究结果类似。Sun等[12]研究表明,断奶仔猪饲粮添加纳米氧化锌28 d后,仔猪F/G降低,且末重和ADFI均无显著变化。Hussan等[13]试验表明,在肉鸡饲粮分别添加2.5、5.0、10.0和20.0 mg/kg纳米氧化锌后,其饲粮转化率显著提高,而胴体参数(屠宰率、产肉率及腹脂率等)均未产生显著变化。这可能是因为饲粮添加纳米氧化锌在不影响动物采食量的基础上,增强胃肠道对营养物质的消化吸收能力。综上所述,达到同等屠宰水平时,饲粮添加纳米氧化锌提高育肥牛的ADG,同时降低其F/G,说明纳米氧化锌能够提高饲粮转化效率,改善动物生长性能。
3.2 纳米氧化锌对育肥牛血清指标的影响血液(清)游离脂肪酸、总胆固醇、甘油三酯、高密度脂蛋白和低密度脂蛋白的含量可直接反映机体脂肪代谢的活跃程度,在一定范围内上述数值越大即脂肪合成活动愈发频繁[14]。本试验中,添加纳米氧化锌后提高育肥牛血清甘油三酯、总胆固醇、高密度脂蛋白、低密度脂蛋白、葡萄糖含量。Fathi等[15]试验表明,肉鸡饲粮添加20和40 mg/kg纳米氧化锌后,血清总胆固醇和高密度脂蛋白含量显著上升,甘油三酯含量呈上升趋势;毛俊舟等[16]研究显示,断乳仔猪饲粮添加1 000 mg/kg凹土纳米氧化锌后,血清总胆固醇、高密度脂蛋白和低密度脂蛋白含量均未产生显著影响。上述研究与本试验产生差异的原因可能是由于凹土本身对血液总胆固醇、甘油三酯、高密度脂蛋白及低密度脂蛋白含量无影响,纳米氧化锌分解产生Zn2+形成脂代谢酶类活性中心,促使高密度脂蛋白和低密度脂蛋白转运活跃,增强胆固醇合成酶与甘油三酯合成酶的活性。
胰岛素是调节糖脂代谢的重要激素之一,具有促进肝细胞脂肪合成、抑制脂肪组织脂肪酶活性及降低血糖水平的作用[17]。IGF-Ⅰ为生长介素,糖脂代谢过程中可调控瘦素蛋白表达,抑制糖原、脂肪分解,促使脂肪沉积[18]。在本试验中,育肥牛饲粮添加纳米氧化锌后,其血清葡萄糖、胰岛素和IGF-Ⅰ含量升高,这与Sethy等[19]的研究结果相一致。这可能是纳米氧化锌改善反刍动物瘤胃微生物群后,提高了饲粮转化效率,使血液中游离脂肪酸含量上升,增强了动物体内糖异生活动,升高了血糖水平,刺激胰岛素分泌同时降低脂肪动员,促进脂肪沉积。综上可知,饲粮添加纳米氧化锌对于育肥牛脂质代谢具有积极影响。
3.3 纳米氧化锌对育肥牛背最长肌IMF沉积相关基因表达的影响脂肪酸合成与分解相互平衡制约对IMF沉积具有决定作用,当合成效果强于分解效果时脂肪酸表现累积,此过程受脂肪合成及分解相关酶和基因共同调节。在本试验中,饲粮中添加纳米氧化锌提高了育肥牛背最长肌IMF含量。IMF沉积程度直接表现为肉牛大理石纹形成,肉牛饲粮中添加80 mg/kg锌(蛋氨酸锌)提高了大理石纹评分[20];日本黑牛(阉牛)添加蛋氨酸锌(400 mg/d,以锌计)或碳酸锌(800 mg/d,以锌计)提高了大理石纹评分[21];育肥小公牛饲喂60 mg/kg硫酸锌或60 mg/kg硫酸锌+240 mg/kg氧化锌,有提高大理石纹的趋势[22]。这可能是因为锌进入瘤胃后改善菌群结构,促进饲粮中脂肪酸的释放,后经消化作用分解为游离脂肪酸,随血液循环进入肝脏形成甘油三酯沉积,提高IMF合成速率。
首先,脂肪酸合成酶调控IMF沉积,合成酶活性越强脂肪酸合成代谢越旺盛,即IMF含量提高。FAS是脂肪酸从头合成的关键酶,结构域分别执行缩合、脱水和转移功能,催化脂酰辅酶A和丙二酸单酰辅酶A反应合成棕榈酸酯[23]。ACC为脂肪酸合成的限速酶,催化乙酰辅酶A缩合为丙二酸单酰辅酶A,转变为长链脂肪酸合成的必要原料[24]。本研究结果显示,育肥牛饲粮添加纳米氧化锌后背最长肌中ACC活性升高,FAS活性表现出升高迹象,说明脂肪合成能力正在被强化。这可能是因为纳米氧化锌有效成分经瘤胃微生物作用后,进入机体激活硬脂酰辅酶A去饱和酶(SCD)活性,协同提高FAS和ACC的活性[25]。因此,我们进一步对脂肪酸合成相关基因的表达情况进行了分析。PPARγ基因正向调控脂肪酸合成相关基因,发挥其对脂肪酸合成与释放的调控功能[26]。SREBP-1基因密切参与机体脂代谢,是脂肪酸合成基因ACC和FAS的转录调控因子[27]。本研究中,饲粮添加纳米氧化锌上调了育肥牛脂肪酸合成相关基因(SREBP-1、PPARγ、ACC和FAS)的表达。饲粮中添加2 000 mg/kg包被氧化锌,可以显著提高仔猪背最长肌中IMF含量以及ACC、FAS基因表达量[28]。产生本试验结果的原因可能是纳米氧化锌中Zn2+由血液循环进入组织器官后,上调了SCD基因的表达,导致SREBP-1基因表达的几率增加,随后协同促进PPARγ、ACC和FAS基因的表达[26]。
其次,IMF沉积与脂肪酸分解酶活性密切相关。HSL在脂肪动员中起决定性作用,是脂肪分解的限速酶,可将甘油三酯分解为游离脂肪酸、甘油二酯和甘油[29]。CPT-1为脂酰辅酶A转运进入线粒体的限速酶,转运速率决定了脂肪酸β氧化进程[30]。LPL是IMF形成与沉积的标志性蛋白,主要催化甘油三酯分解为游离脂肪酸和甘油,从而决定脂肪代谢方向[31]。本研究结果显示,添加纳米氧化锌于育肥牛饲粮后,背最长肌HSL、CPT-1和LPL活性下降,说明脂肪酸的分解能力下降,且对比纳米氧化锌进入机体后脂肪酸合成与分解酶活性,发现脂肪酸分解酶被抑制的效果强于合成酶被激动的效果,这可能是育肥牛背最长肌IMF沉积的主要原因。因此,我们进一步对脂肪酸分解相关基因的表达情况进行了分析。本试验中,饲粮添加纳米氧化锌下调了脂肪酸分解相关基因(CPT-1和HSL)的表达量。饲粮中添加锌能够显著降低断奶仔猪背最长肌中HSL和CPT-1等脂肪分解相关基因的表达[32]。其原因可能是纳米氧化锌在胃肠微生物及消化液作用后对动物体产生作用,上调SCD基因的表达,抑制CPT-1和HSL基因的表达,促进IMF沉积[33]。
4 结论① 饲粮中添加纳米氧化锌(80 mg/kg锌)可增加育肥牛的ADG,降低F/G,提高生长性能。
② 饲粮中添加纳米氧化锌(80 mg/kg锌)可提高育肥牛血清中游离脂肪酸、甘油三酯、总胆固醇、高密度脂蛋白、低密度脂蛋白、葡萄糖和IGF-Ⅰ含量,增加胰岛素含量,降低葡萄糖/胰岛素比值,加快胆固醇等类脂物质转化,促进脂肪沉积。
③ 饲粮中添加纳米氧化锌(80 mg/kg锌)可提高育肥牛背最长肌IMF含量,上调SREBP-1、PPARγ、FAS和ACC基因的表达,下调HSL和CPT-1基因的表达,提高ACC活性,降低HSL、CPT-1和LPL活性,促进IMF沉积。
| [1] |
WANG J, CHEN R S, XIANG L, et al. Synthesis, properties and applications of ZnO nanomaterials with oxygen vacancies: a review[J]. Ceramics International, 2018, 44(7): 7357-7377. DOI:10.1016/j.ceramint.2018.02.013 |
| [2] |
毛俊舟. 凹凸棒土负载纳米氧化锌对断奶仔猪生长性能及肠道屏障功能的影响[D]. 硕士学位论文. 扬州: 扬州大学, 2018: 32-45. MAO J Z. Effects attapulgite clay adsorbed nano-ZnO supplementation on growth performance and intestinal barrier function of weaned pigs[D]. Master's Thesis. Yangzhou: Yangzhou University, 2018: 32-45. (in Chinese) |
| [3] |
李洪民, 董丽, 胡真真, 等. 凹土纳米氧化锌对断奶仔猪脾脏抗氧化及免疫功能的影响[J]. 中国畜牧兽医, 2020, 47(11): 3484-3492. LI H M, DONG L, HU Z Z, et al. Effects of attapulgite nano zinc oxide on antioxidant function and immune function in spleen of weaned pigs[J]. China Animal Husbandry & Veterinary Medicine, 2020, 47(11): 3484-3492 (in Chinese). |
| [4] |
RAMIAH S K, AWAD E A, MOOKIAH S, et al. Effects of zinc oxide nanoparticles on growth performance and concentrations of malondialdehyde, zinc in tissues, and corticosterone in broiler chickens under heat stress conditions[J]. Poultry Science, 2019, 98(9): 3828-3838. DOI:10.3382/ps/pez093 |
| [5] |
PIAO M Y, YONG H I, LEE H J, et al. Comparison of fatty acid profiles and volatile compounds among quality grades and their association with carcass characteristics in longissimus dorsi and semimembranosus muscles of Korean cattle steer[J]. Livestock Science, 2017, 198: 147-156. DOI:10.1016/j.livsci.2017.02.021 |
| [6] |
MIR B A, REYER H, KOMOLKA K, et al. Differentially expressed miRNA-gene targets related to intramuscular fat in musculus longissimus dorsi of Charolais×Holstein F2-crossbred bulls[J]. Genes, 2020, 11(6): 700. DOI:10.3390/genes11060700 |
| [7] |
中华人民共和国农业部. 肉牛饲养标准: NY/T 815-2004[S]. 北京: 中国农业出版社, 2004. Ministry of Agriculture of the PRC. Feeding standard of beef cattle: NY/T 815-2004[S]. Beijing: China Agriculture Press, 2004. (in Chinese) |
| [8] |
周光宏, 刘丽, 孙宝忠, 等. 牛肉等级评定方法和标准[J]. 肉类工业, 2001(6): 41-48. ZHOU G H, LIU L, SUN B Z, et al. Beef grading methods and standards[J]. Meat Industry, 2001(6): 41-48 (in Chinese). DOI:10.3969/j.issn.1008-5467.2001.06.017 |
| [9] |
ZHANG H B, DONG X W, WANG Z S, et al. Dietary conjugated linoleic acids increase intramuscular fat deposition and decrease subcutaneous fat deposition in yellow breed×Simmental cattle[J]. Animal Science Journal, 2016, 87(4): 517-524. DOI:10.1111/asj.12447 |
| [10] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [11] |
XIA T, LAI W Q, HAN M M, et al. Dietary ZnO nanoparticles alters intestinal microbiota and inflammation response in weaned piglets[J]. Oncotarget, 2017, 8(39): 64878-64891. DOI:10.18632/oncotarget.17612 |
| [12] |
SUN Y B, XIA T, WU H, et al. Effects of nano zinc oxide as an alternative to pharmacological dose of zinc oxide on growth performance, diarrhea, immune responses, and intestinal microflora profile in weaned piglets[J]. Animal Feed Science and Technology, 2019, 258: 114312. DOI:10.1016/j.anifeedsci.2019.114312 |
| [13] |
HUSSAN F, KRISHNA D, PREETAM V C, et al. Dietary supplementation of nano zinc oxide on performance, carcass, serum and meat quality parameters of commercial broilers[J/OL]. Biological Trace Element Research, 2021: 1-6. (2021-02-12). https://doi.org/10.1007/s12011-021-02635-z.DOI:10.1007/s12011-021-02635-z.
|
| [14] |
ALVES-BEZERRA M, COHEN D E. Triglyceride metabolism in the liver[J]. Comprehensive Physiology, 2017, 8(1): 1-8. |
| [15] |
FATHI M, HAYDARI M T, TANHA T. Effects of zinc oxide nanoparticles on antioxidant status, serum enzymes activities, biochemical parameters and performance in broiler chickens[J]. Journal of Livestock Science and Technologies, 2016, 4(2): 7-13. |
| [16] |
毛俊舟, 董丽, 王淑楠, 等. 凹土纳米氧化锌对断奶仔猪生长性能、器官指数及血液生化指标的影响[J]. 动物营养学报, 2018, 30(4): 1471-1480. MAO J Z, DONG L, WANG S N, et al. Effects of attapulgite nano zinc oxide on growth performance, organ indices and blood biochemical indices of weaned piglets[J]. Chinese Journal of Animal Nutrition, 2018, 30(4): 1471-1480 (in Chinese). DOI:10.3969/j.issn.1006-267x.2018.04.031 |
| [17] |
HOLST J J, GASBJERG L S, ROSENKILDE M M. The role of incretins on insulin function and glucose homeostasis[J]. Endocrinology, 2021, 162(7): bqab065. DOI:10.1210/endocr/bqab065 |
| [18] |
WANG F, WANG L, WANG Y F, et al. Exogenous IGF-1 improves cognitive function in rats with high-fat diet consumption[J]. Journal of Molecular Endocrinology, 2020, 64(2): 115-123. DOI:10.1530/JME-19-0150 |
| [19] |
SETHY K, BEHERA K, MISHRA S K, et al. Effect of organic zinc supplementation on growth, metabolic profile and antioxidant status of Ganjam sheep[J]. Indian Journal of Animal Research, 2018, 52(6): 839-842. |
| [20] |
RODRÍGUEZ-GAXIOLA M A, DOMÍNGUEZ-VARA I A, BARAJAS-CRUZ R, et al. Effects of zilpaterol hydrochloride and zinc methionine on growth performance and carcass characteristics of beef bulls[J]. Canadian Journal of Animal Science, 2015, 95(4): 609-615. DOI:10.4141/cjas-2014-175 |
| [21] |
TAKIZAWA H, MORISHITA M, SAKAKIBARA T, et al. Effects of supplemental zinc on fattening performance and meat quality of Japanese black steers[J]. Research Bulletin of the Aichi Agricultural Research Center, 2007, 39: 51-59. |
| [22] |
VAN BIBBER-KRUEGER C L, MILLER K A, AMACHAWADI R G, et al. Interaction between supplemental zinc oxide and zilpaterol hydrochloride on growth performance, carcass traits, and blood metabolites in feedlot steers[J]. Journal of Animal Science, 2017, 95(12): 5573-5583. DOI:10.2527/jas2017.1761 |
| [23] |
OH D Y, NAM I, HWANG S, et al. In vivo evidence on the functional variation within fatty acid synthase gene associated with lipid metabolism in bovine longissimus dorsi muscle tissue[J]. Genes & Genomics, 2018, 40(3): 289-294. |
| [24] |
MODIRI S, ZAHIRI H S, VALI H, et al. Evaluation of transcription profile of acetyl-CoA carboxylase (ACCase) and acyl-ACP synthetase (AAS) to reveal their roles in induced lipid accumulation of Synechococcus sp. HS01[J]. Renewable Energy, 2018, 129(Part A): 347-356. |
| [25] |
HUANG Y Z, WANG H X, WANG H B, et al. Structure-based virtual screening of natural products as potential stearoyl-coenzyme a desaturase 1 (SCD1) inhibitors[J]. Computational Biology and Chemistry, 2020, 86: 107263. DOI:10.1016/j.compbiolchem.2020.107263 |
| [26] |
ZHANG Y, ZHENG Y, WANG X Y, et al. Bovine stearoyl-CoA desaturase 1 promotes adipogenesis by activating the PPARγ receptor[J]. Journal of Agricultural and Food Chemistry, 2020, 68(43): 12058-12066. DOI:10.1021/acs.jafc.0c05147 |
| [27] |
KHATEEB S, ALBALAWI A, ALKHEDAIDE A. Regulatory effect of diosgenin on lipogenic genes expression in high-fat diet-induced obesity in mice[J]. Saudi Journal of Biological Sciences, 2020, 28(1): 1026-1032. |
| [28] |
张晓明, 王之盛, 周安国, 等. 包被氧化锌对仔猪肌内脂肪合成相关基因表达的影响[J]. 中国畜牧杂志, 2014, 50(5): 41-46. ZHANG X M, WANG Z S, ZHOU A G, et al. Effects of different levels of coated ZnO on expression of lipid anabolism related genes in intramuscular fat of weanling pig[J]. Chinese Journal of Animal Science, 2014, 50(5): 41-46 (in Chinese). DOI:10.3969/j.issn.0258-7033.2014.05.010 |
| [29] |
RECAZENS E, MOUISEL E, LANGIN D. Hormone-sensitive lipase: sixty years later[J]. Progress in Lipid Research, 2021, 82: 101084. DOI:10.1016/j.plipres.2020.101084 |
| [30] |
JONES P, PATEL K, RAKHEJA D. Chapter 26-disorder: carnitine palmitoyltransferase 1 deficiency[M]//JONES P, PATEL K, RAKHEJA D. A quick guide to metabolic disease testing interpretation. 2nd ed. Pittsburgh: Academic Press, 2020: 137-140.
|
| [31] |
GONZÁLEZ-FÉLIX M L, DE LA REÉ-RODRÍGUEZ C, PEREZ-VELAZQUEZ M. Partial characterization, quantification and optimum activity of trypsin and lipase from the sciaenids Cynoscion othonopterus, Cynoscion parvipinnis and Cynoscion xanthulus[J]. Archives of Biological Sciences, 2020, 72(1): 81-93. DOI:10.2298/ABS191127002G |
| [32] |
ZHANG H B, WANG Z S, PENG Q H, et al. Effects of different levels of protein supplementary diet on gene expressions related to intramuscular deposition in early-weaned yaks[J]. Animal Science Journal, 2014, 85(4): 411-419. DOI:10.1111/asj.12161 |
| [33] |
ZHANG J J, HAO J J, ZHANG Y R, et al. Zinc mediates the SREBP-SCD axis to regulate lipid metabolism in Caenorhabditis elegans[J]. Journal of Lipid Research, 2017, 58(9): 1845-1854. DOI:10.1194/jlr.M077198 |




