2. 乌拉特中旗农牧和科技局, 乌拉特中旗 015300
2. Agriculture, Animal Husbandry and Science and Technology Bureau, Wulate Middle Banner 015300, China
肌纤维是肌肉组织的基本组成单位,其组织学特性与畜禽肉品质密切相关[1]。氧化型肌纤维线粒体和肌红蛋白含量较多,有更多的肌血球素和较少的糖原,氧化型肌纤维占比高的肌肉色泽鲜红、细嫩多汁且有较好的持水力。酵解型肌纤维包含更多的糖原且ATP酶活性高,酵解型肌纤维占比高时,肌肉pH下降速率快,易导致白肌肉(PSE肉)[2-4]。在动物出生后,肌纤维基本不会再有数量上的改变,在后期的生长发育过程中,肌纤维的动态变化会表现为直径增粗、横截面积增大以及类型间的双向转化,转化遵循Ⅰ型↔Ⅱa型↔Ⅱx型↔Ⅱb型的顺序[5]。
运动作为一种可以引起骨骼肌的表型重塑的重要外界因素,在生物体完成不同形式的运动过程中,肌纤维类型组成的差异与骨骼肌重塑能力和肌肉蛋白质抗原特异性紧密相关[6],骨骼肌会在肌纤维形态、类型、肌肉能量代谢酶活性等方面产生适应性变化[7]。闫祥林等[8]研究发现,与工厂集约化饲养相比,运动量大的放养多浪羊背最长肌的肌原纤维密度较小、直径较大。汪江先[9]研究了运动量对淮南麻黄鸡生长和肉品质的影响,结果表明,相比于中步行数和低步行数,高步行数能促进淮南麻黄鸡母鸡生长,改善胸肌保水性和剪切力。这是因为运动量增多,能够促进畜禽肌纤维发育、减少脂肪沉积、改善肉色,从而对肉品质和风味产生影响[10]。增加商品肉鸡日活动量,能有效改善鸡肉色泽,随着周龄的延长,鸡肉的蒸煮损失呈下降趋势,说明运动对肉质有所改善[11]。Gangnat等[12]发现,运动量的增加能够影响肉牛体内的新陈代谢,诱导其肌纤维组织学特性发生改变,从而导致肉的嫩度变差。由此可见,适当增加畜禽运动量对肌纤维组织学特性有着重要影响,从而影响肉品质。
目前苏尼特羊传统放牧的方式由于环境保护及集约化生产的要求已经日益向舍饲方式转化,但很多研究表明舍饲羊肉品质下降,而决定放牧和舍饲羊肉品质的最根本区别在于运动量及摄食的差别,然而关于运动影响反刍动物机体内肌纤维类型转变的研究并不多,运动强度、时间等对于调控肌纤维类型转变的具体机制也不清晰。因此,本文通过对苏尼特羊进行6 km/d的驱赶运动训练,以探究运动对苏尼特羊肌纤维特性和肉品质的影响及运动使其发生变化的调控机理。
1 材料与方法 1.1 试验动物及饲养管理所需试验动物于2019年6—9月在内蒙古乌拉特中旗哈拉图嘎查顺遂牧区饲养。选取体况良好、平均体重为(19.77±3.81) kg的3月龄苏尼特羊14只,随机分为2组:运动组和对照组,每组7只。对照组和运动组在相同的圈中集中饲养,运动组苏尼特羊在脖子上佩戴计步器,每日分别于08:00、19:00赶至18.5 m×10.5 m的运动场内进行驱赶运动:每次运动时间40 min,运动速度75 m/min,共计6 km。2组苏尼特羊均饲喂以玉米等精饲料为主的饲粮,试验饲粮组成及营养水平见表 1。试验期间自由采食和饮水。预试期7 d,正试期90 d。屠宰前14只苏尼特羊停水2 h,禁食24 h,然后按照穆斯林阿訇屠宰方法进行宰杀。
|
|
表 1 试验饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the experimental diet (air-dry basis) |
在羊屠宰后取左半胴体背最长肌(longissimus doris muscle, LD)测定各项肉品质指标。使用全自动色差仪测定肌肉红度(a*)、黄度(b*)、亮度(L*)值,并计算肌肉饱和度;使用CLM-3型嫩度仪对肌肉嫩度(用剪切力表示)进行测定;使用pH-STAR型胴体直测式pH计测定肌肉pH;蒸煮损失的测定及计算参照侯普馨等[2]的方法。
1.2.2 肌纤维组织学特性的测定将肌肉沿肌纤维方向切割并修整为约0.5 cm×0.5 cm×1.0 cm的肌肉块(先将其分割成长条状,再用刀片逐个进行修整),放进提前经液氮预冷的异戊烷中脱水干燥30 s,待肉块颜色发白后立即投入液氮中冷冻,然后装入5 mL无酶无菌冻存管中,液氮中保存,带回实验室后在-80 ℃的条件下长期保存,用于后续肌纤维组织的冰冻切片。
将按照上述方法采集好的样品置于-27 ℃冰冻切片机中包埋并冷冻,将其切成10 μm厚的横断面[13],组织切片通过ATP酶(pH 4.55~4.65)组织化学染色法[14]进行染色,染好的组织切片在Leica 4000B荧光倒置显微镜10×10倍下观察,选择2~4个分型清晰的视野,通过Leica Qwin V4.4彩图软件分析肌纤维的各项指标[15]。
1.2.3 基因表达量的测定 1.2.3.1 样品采集将肌肉剪成80~100 mg的小块装在2 mL无酶无菌管里,投入液氮中速冻,保存于-80 ℃的冰箱中,用于后续试验。
1.2.3.2 RNA提取与反转录参考苏琳[16]的试验方法提取苏尼特羊肌肉组织中的总RNA,总RNA浓度和纯度用微量分光光度计和核酸蛋白分析仪测定。所提取的总RNA的完整性用质量分数为1%的琼脂糖凝胶电泳(条件为120 V,15 min)进行检测。参照反转录试剂盒说明书将RNA反转录为cDNA,将合成的质量浓度为50 ng/μL的cDNA稀释到10 ng/μL,用于后续试验[17]。
1.2.3.3 引物序列及合成试验所需肌球蛋白重链(myosin heavy chains,MyHC)Ⅰ、Ⅱa、Ⅱb、Ⅱx引物序列引自尹丽卿[18]和马晓冰[18]的文献,细胞色素C氧化酶Ⅳ(cytochrome C oxidase Ⅳ,COXⅣ)、一磷酸腺苷激活的蛋白激酶(AMP-activated protein kinase,AMPK)α1和α2、过氧化物酶体增殖激活受体γ辅助激活信号因子-1α(peroxisome proliferator-activated receptor gamma co-activator-1α,PGC-1α)、沉默信息调节因子1(sirtuin 1,SIRT1)引物序列利用NCBI网站设计,以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参基因。引物序列由生工生物公司(上海)合成,详见表 2。
|
|
表 2 引物序列 Table 2 Primer sequences |
以质量浓度为10 ng/μL的cDNA为模板,按照TB GreenTM PremixEx TaqTM Ⅱ说明书,配制反应液,进行实时荧光定量PCR。采用2-ΔΔCt法计算目的基因mRNA相对表达量。
1.2.4 代谢酶活性测定肌肉中乳酸脱氢酶(lactate dehydrogenase, LDH)、琥珀酸脱氢酶(succinate dehydrogenase, SDH)以及苹果酸脱氢酶(malate dehydrogenase, MDH)活性的测定依据测试盒说明书操作。
1.3 数据统计分析试验数据用SPSS 25.0进行单因素方差分析统计分析,P < 0.01表示差异极显著,P < 0.05表示差异显著。结果用平均值±标准差表示。
2 结果与分析 2.1 运动对苏尼特羊肌纤维组织学特性的影响 2.1.1 苏尼特羊肌纤维ATP酶染色结果因为不同类型肌纤维内的ATP酶对酸碱的稳定性有所差异,所以可将肌纤维分为3种类型:Ⅰ型、Ⅱa型和Ⅱb型[2, 14]。如图 1所示,颜色最深的黑色部分为Ⅰ型(慢速氧化型)肌纤维,浅色部分为Ⅱa型(快速氧化-酵解型)肌纤维,颜色介于两者之间的棕褐色部分为Ⅱb型(快速酵解型)肌纤维。

|
图 1 对照组(A)与运动组(B)苏尼特羊肌纤维ATP酶染色结果 Fig. 1 ATPase staining result of muscle fiber of Sunit sheep in control group (A) and exercise group (B) |
由表 3可知,运动组苏尼特羊肌纤维密度和Ⅱb型肌纤维面积比例显著低于对照组(P<0.05);Ⅰ型肌纤维直径和Ⅱa型肌纤维数量比例极显著高于对照组(P<0.01);Ⅰ型肌纤维横截面积,Ⅱa型肌纤维直径、横截面积、面积比例显著高于对照组(P<0.05),Ⅱb型肌纤维数量比例极显著低于对照组(P<0.01)。
|
|
表 3 苏尼特羊肌纤维组织学特性各项指标 Table 3 Muscle fiber histological characteristics indexes of Sunit sheep |
由图 2可知,运动组苏尼特羊肌肉中MyHCⅡa、MyHCⅡx mRNA相对表达量均显著高于对照组(P<0.05),MyHCⅠ、MyHCⅡb mRNA相对表达量也较对照组有所提高,但差异不显著(P>0.05)。
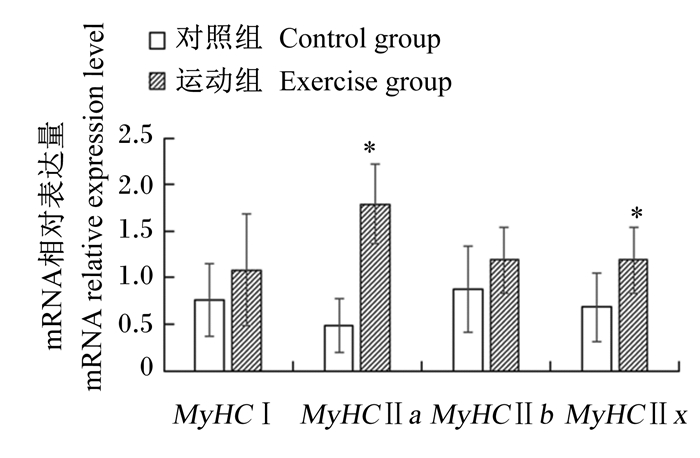
|
MyHC:肌球蛋白重链myosin heavy chains。运动组数据柱标注“*”和“**”分别表示与对照组相比差异显著(P<0.05)和差异极显著(P<0.05)。图 3和图 4同。 Data columns of the exercise group with "*" and "**" superscripts mean significant difference (P < 0.05) and extremely significant difference (P < 0.05) compared with the control group, respectively. The same as Fig. 3 and Fig. 4. 图 2 运动对苏尼特羊肌肉中MyHCmRNA相对表达量的影响 Fig. 2 Effects of exercise on MyHC mRNA relative expression levels in muscle of Sunit sheep |
由图 3可知,肌肉中LDH、SDH活性的差异性表现为运动组显著高于对照组(P<0.05),运动组肌肉中MDH的活性较对照组也有所增高,但差异不显著(P>0.05)。
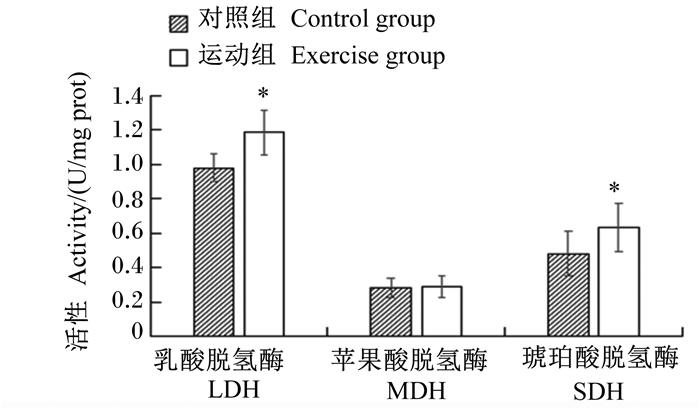
|
图 3 运动对苏尼特羊肌肉中代谢酶活性的影响 Fig. 3 Effects of exercise on metabolic enzyme activities in muscle of Sunit sheep |
由表 4可知,与对照组相比,运动组苏尼特羊肌肉饱和度显著降低(P<0.05),a*、b*、L*值均极显著降低(P<0.01),剪切力显著增大(P<0.05)。运动组苏尼特羊宰后初始肌肉pH为6.13,极显著低于对照组(P<0.01),放冷库静置排酸24 h后,运动组的肌肉pH24 h降至5.49,显著高于对照组的pH24 h(P<0.01)。
|
|
表 4 运动对苏尼特羊肉品质的影响 Table 4 Effects of exercise on meat quality of Sunit sheep |
由图 4可知,运动组苏尼特羊肌肉中AMPKα1 mRNA相对表达量极显著高于对照组(P<0.01),COXⅣ、PGC-1α mRNA相对表达量显著高于对照组(P<0.05),SIRT1 mRNA相对表达量虽也较对照组提高,但差异不显著(P>0.05)。
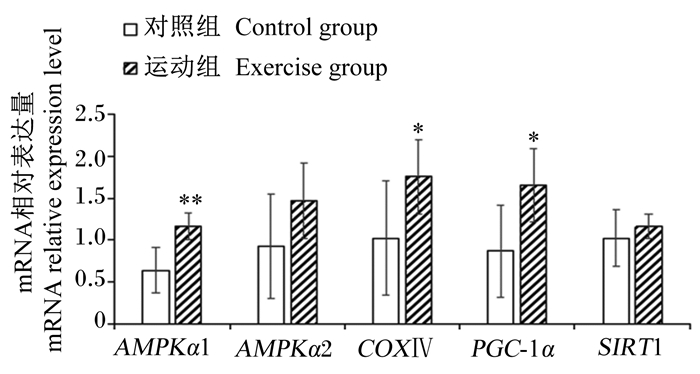
|
AMPK:一磷酸腺苷激活的蛋白激酶AMP-activated protein kinase;COXⅣ:细胞色素C氧化酶Ⅳ cytochrome C oxidase Ⅳ;PGC-1α:过氧化物酶体增殖激活受体γ辅助激活信号因子-1α peroxisome proliferator-activated receptor gamma co-activator-1α; SIRT1:沉默信息调节因子1 sirtuin 1。 图 4 运动对苏尼特羊肌肉中AMPK、COXⅣ、PGC-1α和SIRT1 mRNA相对表达量的影响 Fig. 4 Effects of exercise on mRNA relative expression levels of AMPK, COXⅣ, PGC-1α and SIRT1 in muscle of Sunit sheep |
本试验测定运动组苏尼特羊肌肉中氧化型(Ⅰ型+Ⅱa型)肌纤维数量比例、面积比例分别是54.88%、56.30%,对照组则分别为45.46%、53.46%,这说明对舍饲羊每日进行6 km的人为驱赶运动可以在一定程度上提高氧化型肌纤维的比例。经过长期运动的苏尼特羊各型肌纤维直径和横截面积均要大于半舍饲条件下的苏尼特羊,并且肌纤维直径和横截面积的变化规律相一致。在肉鸡上的研究表明,与笼养方式相比,山地放养方式下的肉鸡肌肉肌纤维密度减小,直径增大,因为山地放养肉鸡的运动量明显高于笼养鸡[20],说明运动改善了肌肉分化的强度,与本试验结果一致。Schmitt等[21]研究运动量对小鼠骨骼肌的影响时发现,训练10周的自愿轮跑方式能有效促进小鼠比目鱼肌中酵解型肌纤维更多的向氧化型肌纤维转化。以上研究结果说明,增加舍饲羊的运动量能增大肌纤维直径和横截面积,从而促进肌肉发育,改善肌肉分化,且促进肌纤维类型间的转化。
3.2 运动对苏尼特羊肌肉中MyHC mRNA相对表达量的影响依据MyHC差异表达的分子分型法比组织化学染色法能更为准确地对肌纤维类型进行划分,可将MyHC分为MyHCⅡa(快速氧化型)、MyHCⅡb(快速酵解型)、MyHCⅠ(慢速氧化型)、MyHCⅡx(中间型)4类[5]。根据2.1.2中ATP酶染色结果得出,运动提高了肌肉中氧化型肌纤维的比例。MyHC mRNA相对表达量分析结果与ATP酶染色结果基本一致。Serrano等[22]通过研究耐力训练诱导马臀中肌中MyHC的转化规律,发现其按照Ⅱx型→Ⅱa型→Ⅰ型的顺序转化,并且该规律与肌肉中代谢特性的变化相一致。汤长发等[23]研究了不同运动方式、时间和强度下大鼠肌纤维类型间变化的差异,从而探究内在转化规律,结果表明,各种强度运动都可以引起比目鱼肌MyHC亚型之间发生变化,小强度运动引起MyHCⅡb向MyHCⅡx、MyHCⅡa、MyHCⅠ转化;中等强度、大强度运动引起MyHCⅠ、MyHCⅡb向MyHCⅡx、MyHCⅡa转化。上述结果产生的原因可能是不同方式、强度及频率的运动可诱导肌肉中MyHC异形体间发生不同方式的转化。
3.3 运动对苏尼特羊肌肉中代谢酶活性的影响MDH和SDH广泛存在于线粒体中,是葡萄糖有氧氧化过程中的关键限速酶,可以体现机体氧化代谢程度,二者都能评价肌肉的氧化活性,且氧化代谢能力与其活性的高低呈正相关[5, 24]。酵解型肌纤维主要通过糖酵解过程产生能量,LDH是一种糖酵解酶,其活性的高低能体现机体无氧酵解的活跃程度[25]。运动组苏尼特羊肌肉中SDH活性升高,说明运动能使细胞内能量即ATP的生成增强,同时Ⅰ型、Ⅱa型肌纤维的比例增加,表明运动在一定程度上能加快机体对糖类的转化利用,进而促进肌纤维向氧化型转化;运动组苏尼特羊肌肉中LDH活性升高,说明机体无氧酵解供能加强,这可能是由于运动加快了肌肉内丙酮酸和乳酸的相互转化所导致,但是尚不能确定是加快了丙酮酸向乳酸的转化还是为了减少物质代谢产物的堆积而加快了乳酸向丙酮酸的转化。本试验得到的结果与赵杰修等[26]的研究结果相一致。以上研究结果表明,增加舍饲羊的运动量能够提高肌肉中LDH和SDH活性,从而影响机体的能量代谢。
3.4 运动对苏尼特羊肉品质的影响pH是反映畜禽屠宰后肌肉糖原酵解程度和速率的肉质指标[27]。宰后初始肌肉pH主要表示肌肉中的乳酸水平,苏尼特羊在屠宰前,机体由糖原的无氧酵解释放能量,随之肌肉pH会随乳酸水平变化受到不同程度的影响,而运动组苏尼特羊经过长时间运动后,体内乳酸水平上升,使得宰后初始肌肉pH较低。静置排酸24 h后,运动组苏尼特羊肌肉pH24 h(5.49)显著高于对照组(5.30),可能是运动组苏尼特羊肌肉pH下降速率和回升速率较对照组更快,加快了肉的成熟速度。肉色是直接通过感官影响消费者是否购买的一个重要肉质评定指标[28]。Jin等[29]报道,在运动场中饲养的皖南三黄鸡腿肌a*值显著高于无运动场的皖南三黄鸡,并且鸡肉风味物质含量也能得到有效改善[30]。本试验中,运动组苏尼特羊肌肉在L*和b*值上优于对照组,但运动后肌肉a*值没有增加,这与Vestergaard等[31]的研究结果相似。本试验采用的是人为驱赶的方式使苏尼特羊完成一定量的运动,而非在其主观下进行的,这会使羊受到不同程度的应激,从而会影响肉品质的多项评定指标。此外,饲养管理、肌肉部位、品种的差异也会对畜禽胴体肉色造成一定的影响。剪切力与嫩度呈负相关,可以直接反映肉质嫩度[32]。肌纤维直径、密度及横截面积的大小都对肌肉嫩度有直接影响[33]。结合2.1.2中肌纤维组织学特性结果,运动量增加会使羊肌纤维密度降低、直径增粗、横截面积增大,而嫩度与肌纤维的直径和横截面积均呈负相关[27, 34],这也恰好解释了运动组苏尼特羊肌肉嫩度降低的原因。
3.5 运动对苏尼特羊肌肉中AMPK、COXⅣ、PGC-1α和SIRT1 mRNA相对表达量的影响AMPK、SIRT1、PGC-1α这3个信号因子在机体内构成能量感应网络,这对于调节能量代谢、线粒体生物发生以及氧化型肌肉表型的代谢变化起到协同作用[35]。COXⅣ的表达程度能作为线粒体生物合成的有效标志[36]。动物在受到一些病理或生理刺激时能激活机体内AMPK的表达,此时细胞内分解代谢增强,合成代谢受阻,ATP水平升高,进一步调节能量感应通路,维持整个机体的代谢稳态[37]。运动强度越大,AMPK的表达量越高[38]。AMPK和SIRT1都可以调控下游因子PGC-1α的表达。另外,AMPK能直接磷酸化PGC-1α,触发以PGC-1α为核心的信号级联,促进线粒体生物发生和氧化型肌纤维的形成[39]。
陈艳华等[40]研究发现,对老年小鼠进行负荷渐增式训练能诱导骨骼肌卫星细胞AMPK磷酸化表达,增强骨骼肌有氧代谢能力,该学者推测其内在调节机理是线粒体相关信号途径:AMPK/SIRT1/PGC-1α。AMPK一经激活,可以直接激活PGC-1α蛋白表达和氧化酶活性增加,减少酵解型肌纤维的生成[41]。Zhang等[42]通过在猪和小鼠中建立PGC-1α特异性表达转基因模型,得到骨骼肌的氧化代谢和脂肪酸氧化程度都能有效增强的效果,同时氧化型肌纤维也就是慢肌纤维比例大幅上调。赵雅娟[43]研究发现,大鼠MyHCⅠ、MyHCⅡa型肌纤维分布与PGC-1α mRNA相对表达量呈显著正相关关系。在本试验中,运动组苏尼特羊的MyHCⅡa和MyHCⅡx mRNA相对表达量显著上调,这说明运动对肌纤维组成的影响可能是由于运动首先激活了AMPK的表达,使得PGC-1α、SIRT1的表达上调,从而促进机体线粒体的生物合成,使肌纤维类型间发生转化,提高肌肉氧化代谢能力。
骨骼肌组织学特性的核心是肌纤维类型分布,运动是调节骨骼肌可塑性的重要因素。在本研究中,增加舍饲苏尼特羊的运动量能有效激活骨骼肌内AMPK的表达,从而触发介导肌肉生长和能量代谢的细胞内信号通路AMPK/SIRT1/PGC-1α的稳态表达,这同样在维持机体能量代谢和介导氧化型纤维生成方面起着不可或缺的调控作用。
4 结论本研究结果发现,增加舍饲苏尼特羊的运动量上调了其肌肉中MyHCⅡa、MyHCⅡx以及PGC-1α、SIRT1、COXⅣ的表达,同时提高了肌肉中代谢酶LDH、SDH的活性,说明运动可激活AMPK信号通路相关基因,促使肌纤维类型间相互转化,增强肌肉线粒体生物发生和氧化代谢能力。虽然对苏尼特羊每日进行6 km的运动可以增强肌肉分化强度,促进氧化型肌纤维生成,有效加快畜禽宰后肉的成熟过程,但对于羊肉的色泽和嫩度没有积极作用。
| [1] |
刘露露, 宋阳, 苏丁丁. 猪肌纤维发育及其对肉品质的影响[J]. 湖南畜牧兽医, 2017(2): 36-38. LIU L L, SONG Y, SU D D. Development of porcine muscle fiber and its effect on meat quality[J]. Hunan Journal of Animal Science & Veterinary Medicine, 2017(2): 36-38 (in Chinese). |
| [2] |
侯普馨, 侯艳茹, 白艳苹, 等. 日粮添加亚麻籽对苏尼特羊肌纤维特性及肉品质的影响[J]. 食品科学, 2020, 41(11): 36-42. HOU P X, HOU Y R, BAI Y P, et al. Effect of dietary linseed supplementation on muscle fiber characteristics and meat quality of Sunit sheep[J]. Food Science, 2020, 41(11): 36-42 (in Chinese). DOI:10.7506/spkx1002-6630-20190625-319 |
| [3] |
苏日娜. 不同饲养方式对苏尼特羊宰后肉品质和骨骼肌卫星细胞分化的影响[D]. 博士学位论文. 呼和浩特: 内蒙古农业大学, 2019: 18-20. SU R N. The effects of feeding systems on meat quality and differentiation of skeletal muscle satellite cells of Sunit sheep[D]. Ph. D. Thesis. Huhhot: Inner Mongolia Agricultural University, 2019: 18-20. (in Chinese) |
| [4] |
白艳苹, 侯艳茹, 孙雪峰, 等. 日粮添加乳酸菌对苏尼特羊肌纤维类型及肉品质的影响[J]. 食品工业科技, 2020, 41(12): 1-6, 13. BAI Y P, HOU Y R, SUN X F, et al. Effects of dietary lactic acid bacteria addition on muscle fiber types and meat quality in Sunit sheep[J]. Science and Technology of Food Industry, 2020, 41(12): 1-6, 13 (in Chinese). |
| [5] |
尹靖东. 动物肌肉生物学与肉品科学[M]. 北京: 中国农业大学出版社, 2011. YIN J D. Animal muscle biology and meat quality[M]. Beijing: China Agricultural University Press, 2011 (in Chinese). |
| [6] |
李燕飞. 耐力运动对青年和老年大鼠骨骼肌纤维类型影响差异的分子生物学机制[D]. 硕士学位论文. 广州: 广州体育学院, 2018. LI Y F. Molecular biological mechanisms of the effects of endurance exercise on skeletal muscle fiber types in young and aged rats[D]. Master's Thesis. Guangzhou: Guangzhou Sport University, 2018. (in Chinese) |
| [7] |
杨堤. 运动性疲劳对大鼠骨骼肌能量代谢的影响及其机制[D]. 硕士学位论文. 兰州: 西北师范大学, 2018: 15-25. YANG D. Effect of exercise fatigue on energy metabolism of skeletal muscle in rats and its mechanism[D]. Master's Thesis. Lanzhou: Northwest Normal University, 2018: 15-25. (in Chinese) |
| [8] |
闫祥林, 任晓镤, 刘瑞, 等. 饲养方式对新疆多浪羊肉品质的影响[J]. 食品科学, 2018, 39(15): 80-87. YAN X L, REN X P, LIU R, et al. Effects of different feeding modes on meat quality of Duolang sheep[J]. Food Science, 2018, 39(15): 80-87 (in Chinese). DOI:10.7506/spkx1002-6630-201815012 |
| [9] |
汪江先. 运动量对淮南麻黄鸡生长和肉质的影响及其候选基因分析[D]. 硕士学位论文. 合肥: 安徽农业大学, 2020: 34-35. WANG J X. Effect of exercise's amount on growth, meat quality and analysis of candidate genes in Huainan chicken[D]. Master's Thesis. Hefei: Anhui Agricultural University, 2020: 34-35. (in Chinese) |
| [10] |
杨烨, 方桂友, 李忠荣, 等. 不同饲养方式对肉鸡肌纤维组织学特性及肌肉嫩度影响的研究[J]. 安徽农业科学, 2009, 37(27): 13101-13102, 13124. YANG Y, FANG G Y, LI Z R, et al. Effects of different rearing modes on the muscular histological traits and meat tenderness of chicken[J]. Journal of Anhui Agricultural Sciences, 2009, 37(27): 13101-13102, 13124 (in Chinese). |
| [11] |
蔡洁琼, 郑月, 朱昊鹏, 等. 运动对肉鸡肉品质及肌纤维发育的影响[J]. 食品科学, 2016, 37(13): 53-59. CAI J Q, ZHENG Y, ZHU H P, et al. Effect of exercise on broiler meat quality and muscle fiber development[J]. Food Science, 2016, 37(13): 53-59 (in Chinese). DOI:10.7506/spkx1002-6630-201613010 |
| [12] |
GANGNAT I D M, LEIBER F, DUFEY P A, et al. Physical activity, forced by steep pastures, affects muscle characteristics and meat quality of suckling beef calves[J]. The Journal of Agricultural Science, 2016, 155(2): 348-359. |
| [13] |
HWANG Y H, KIM G D, JEONG J Y, et al. The relationship between muscle fiber characteristics and meat quality traits of highly marbled Hanwoo (Korean native cattle) steers[J]. Meat Science, 2010, 86(2): 456-461. DOI:10.1016/j.meatsci.2010.05.034 |
| [14] |
BROOKE M H, KAISER K K. Three "myosin adenosine triphosphatase" systems: the nature of their pH lability and sulfhydryl dependence[J]. Journal of Histochemistry & Cytochemistry, 1970, 18(9): 670-672. |
| [15] |
CERISUELO A, SALA R, NVRNBERG G, et al. How many muscle samples are required to obtain reliable estimations of muscle fibre characteristics from pig longissimus muscle?[J]. Meat Science, 2007, 76(3): 583-587. DOI:10.1016/j.meatsci.2007.01.008 |
| [16] |
苏琳. 巴美肉羊肌纤维特性、糖酵解潜力对羊肉品质的影响和MyHC表达量分析[D]. 博士学位论文. 呼和浩特: 内蒙古农业大学, 2015: 26-27. SU L. Effects of muscle fibre characteristics, glycolytic potential on meat quality and myosin heavy chain expression of Bamei sheep[D]. Ph. D. Thesis. Huhhot: Inner Mongolia Agricultural University, 2015: 26-27. (in Chinese) |
| [17] |
BROCKS L, KLONT R E, BUIST W, et al. The effects of selection of pigs on growth rate vs leanness on histochemical characteristics of different muscles[J]. Journal of Animal Science, 2000, 78(5): 1247-1254. DOI:10.2527/2000.7851247x |
| [18] |
尹丽卿. 不同饲养方式下苏尼特羊肌纤维特性和MyHC基因对肉质的影响[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2016: 21-26. YIN L Q. The Effect of muscle fiber characteristics and MyHC gene on meat quality of Sunit sheep in different feeding conditions[D]. Master's Thesis. Huhhot: Inner Mongolia Agricultural University, 2016: 21-26. (in Chinese) |
| [19] |
马晓冰. 饲养方式对宰后苏尼特羊肉AMPK、糖酵解及肉品质的影响[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2016: 20-24. MA X B. The effect of feeding methods on AMPK, glycolysis and meat quality of postmortem Sunit sheep[D]. Master's Thesis. Huhhot: Inner Mongolia Agricultural University, 2016: 20-24. (in Chinese) |
| [20] |
张立永, 董红涛, 李童印. 饲养模式对坝上长尾鸡肌肉组织结构及肉品质的影响[J]. 现代畜牧兽医, 2020(12): 18-22. ZHANG L Y, DONG H T, LI T Y. Effect of breeding modes on muscle tissue structure and muscle quality of Bashang long-tail chicken[J]. Modern Journal of Animal Husbandry and Veterinary Medicine, 2020(12): 18-22 (in Chinese). |
| [21] |
SCHMITT A, HERZOG P, RÖCHNER F, et al. Skeletal muscle effects of two different 10-week exercise regimens, voluntary wheel running, and forced treadmill running, in mice: a pilot study[J]. Physiological Reports, 2020, 8(20): e14609. |
| [22] |
SERRANO A L, QUIROZ-ROTHE E, RIVERO J L. Early and long-term changes of equine skeletal muscle in response to endurance training and detraining[J]. Pflugers Archiv, 2000, 441(2/3): 263-274. |
| [23] |
汤长发, 吴经纬, 刘文锋, 等. 运动改善肌适能的抗逆锻炼机制: 肌纤维MHC亚型转化[C]//湖南省生理科学会2013年度学术年会论文集, 怀化: 中国生理学会, 湖南省生理科学会, 2013: 8-10. TANG C F, WU J W, LIU W F, et al. Mechanism of exercise improving muscle adaptation: MHC subtype transformation of muscle fibers[C]//Proceedings of 2013 Academic Annual Meeting of Hunan Physiological Science Association, Huaihua: Chinese Association for Physiological Sciences, Hunan Physiological Science Association, 2013: 8-10. (in Chinese) |
| [24] |
方程. 隆林黄牛、荷斯坦牛和西林水牛的肉质、肌纤维和酶活性差异的研究[D]. 硕士学位论文. 南宁: 广西大学, 2018: 64-66. FANG C. Study on the differences of meat quality, muscle fiber and enzyme activity of Longlin cattle, Holstein cattle and Xilin buffalo[D]. Master's Thesis. Nanning: Guangxi University, 2018: 64-66. (in Chinese) |
| [25] |
王松, 刘刚, 童涛, 等. 有氧耐力训练对不同周龄大鼠骨骼肌代谢酶的影响[J]. 山东体育学院学报, 2008, 24(4): 60-63. WANG S, LIU G, TONG T, et al. Effects of aerobic training on skeletal muscle metabolic enzymes in different aging rats[J]. Journal of Shandong Institute of Physical Education and Sports, 2008, 24(4): 60-63 (in Chinese). DOI:10.3969/j.issn.1006-2076.2008.04.018 |
| [26] |
赵杰修, 田野, 曹建民, 等. 跑台运动和营养补充对大鼠骨骼肌能量代谢酶的影响[J]. 体育科学, 2007, 27(1): 68-71. ZHAO J X, TIAN Y, CAO J M, et al. Effects of treadmill exercise and nutrition supplement on muscle energy metabolism enzyme in rat[J]. China Sport Science, 2007, 27(1): 68-71 (in Chinese). |
| [27] |
侯普馨. 饲养方式对苏尼特羊肌纤维特性及肉品质的影响[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2020: 48-50. HOU P X. Effects of feeding regimens on muscle fiber characteristics and meat quality of Sunit sheep[D]. Master's Thesis. Huhhot: Inner Mongolia Agricultural University, 2020: 48-50. (in Chinese) |
| [28] |
韩明升, 马思雨, 刘晓贺, 等. 放养鸡肌肉品质和产肉性能分析[J]. 现代食品科技, 2021, 37(2): 268-274. HAN M S, MA S Y, LIU X H, et al. Analysis of meat quality and meat production performance of free-range chickens[J]. Modern Food Science & Technology, 2021, 37(2): 268-274 (in Chinese). |
| [29] |
JIN S H, FAN X F, YANG L, et al. Effects of rearing systems on growth performance, carcass yield, meat quality, lymphoid organ indices, and serum biochemistry of Wannan yellow chickens[J]. Animal Science Journal, 2019, 90(7): 887-893. DOI:10.1111/asj.13220 |
| [30] |
MEYER M M, JOHNSON A K, BOBECK E A. A novel environmental enrichment device improved broiler performance without sacrificing bird physiological or environmental quality measures[J]. Poultry Science, 2019, 98(11): 5247-5256. DOI:10.3382/ps/pez417 |
| [31] |
VESTERGAARD M, OKSBJERG N, HENCKEL P. Influence of feeding intensity, grazing and finishing feeding on muscle fibre characteristics and meat colour of semitendinosus, longissimus dorsi and supraspinatus muscles of young bulls[J]. Meat Science, 2000, 54(2): 177-185. DOI:10.1016/S0309-1740(99)00097-2 |
| [32] |
罗玉龙. 放牧与舍饲条件下苏尼特羊肉风味差异及形成机制研究[D]. 博士学位论文. 呼和浩特: 内蒙古农业大学, 2019: 48-58. LUO Y L. Difference of meat flavor in Sunit lamb (concentrated vs grazing) and primary formation mechanism[D]. Ph. D. Thesis. Huhhot: Inner Mongolia Agricultural University, 2019: 48-58. (in Chinese) |
| [33] |
VESTERGAARD M, THERKILDSEN M, HENCKEL P, et al. Influence of feeding intensity, grazing and finishing feeding on meat and eating quality of young bulls and the relationship between muscle fibre characteristics, fibre fragmentation and meat tenderness[J]. Meat Science, 2000, 54(2): 187-195. DOI:10.1016/S0309-1740(99)00098-4 |
| [34] |
GONDRET F, LEFAUCHEUR L, JUIN H, et al. Low birth weight is associated with enlarged muscle fiber area and impaired meat tenderness of the longissimus muscle in pigs[J]. Journal of Animal Science, 2006, 84(1): 93-103. DOI:10.2527/2006.84193x |
| [35] |
GUADALUPE-GRAU A, RODRÍGUEZ-GARCÍA L, TORRES-PERALTA R, et al. Greater basal skeletal muscle AMPKα phosphorylation in men than in women: associations with anaerobic performance[J]. European Journal of Sport Science, 2016, 16(4): 455-464. DOI:10.1080/17461391.2015.1063701 |
| [36] |
邹彬. 电刺激干预对废用性肌萎缩大鼠线粒体生物合成和呼吸功能的影响[D]. 博士学位论文. 北京: 北京体育大学, 2011: 10-19. ZOU B. Effects of electrostimulation on mitochondria in atrophy rat skeletal muscles of disuse: mitochondrial biogenesis and respiratory function[D]. Ph. D. Thesis. Beijing: Beijing Sport University, 2011: 10-19. (in Chinese) |
| [37] |
EGAN B, ZIERATH J R. Exercise metabolism and the molecular regulation of skeletal muscle adaptation[J]. Cell Metabolism, 2013, 17(2): 162-184. DOI:10.1016/j.cmet.2012.12.012 |
| [38] |
FRIEDRICHSEN M, MORTENSEN B, PEHMØLLER C, et al. Exercise-induced AMPK activity in skeletal muscle: role in glucose uptake and insulin sensitivity[J]. Molecular and Cellular Endocrinology, 2013, 366(2): 204-214. DOI:10.1016/j.mce.2012.06.013 |
| [39] |
CANTÓ C, GERHART-HINES Z, FEIGE J N, et al. AMPK regulates energy expenditure by modulating NAD+ metabolism and SIRT1 activity[J]. Nature, 2009, 458(7241): 1056-1060. DOI:10.1038/nature07813 |
| [40] |
陈艳华, 卜凡, 舒彬, 等. 负荷渐增式训练对老年小鼠骨骼肌卫星细胞AMPK磷酸化的影响[J]. 医用生物力学, 2021, 36(4): 612-617. CHEN Y H, BU F, SHU B, et al. Effects of incremental load training on phosphorylation of AMPK in skeletal muscle satellite cells of aged mice[J]. Journal of Medical Biomechanics, 2021, 36(4): 612-617 (in Chinese). |
| [41] |
SUWA M, NAKANO H, KUMAGAI S. Effects of chronic AICAR treatment on fiber composition, enzyme activity, UCP3, and PGC-1 in rat muscles[J]. Journal of Applied Physiology, 2003, 95(3): 960-968. DOI:10.1152/japplphysiol.00349.2003 |
| [42] |
ZHANG L, ZHOU Y, WU W J, et al. Skeletal muscle-specific overexpression of PGC-1α induces fiber-type conversion through enhanced mitochondrial respiration and fatty acid oxidation in mice and pigs[J]. International Journal of Biological Sciences, 2017, 13(9): 1152-1162. DOI:10.7150/ijbs.20132 |
| [43] |
赵雅娟. AMPK活性调控对纤维类型组成的影响及机制初探[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2017: 12-18. ZHAO Y J. Effect of activity regulation of AMPK on muscle fiber composition and mechanism of preliminary discussion[D]. Master's Thesis. Huhhot: Inner Mongolia Agricultural University, 2017: 12-18. (in Chinese) |




