德州驴是中国大型驴品种,身材高大,结构紧凑,肌肉发达,皮重性能好,具有耐粗饲、适应性强和抗病力高的特点[1]。驴具有特殊且发达的盲结肠结构,栖息着数量庞大、种类繁多的微生物,能够发酵降解饲料纤维生成挥发酸脂肪酸(VFA)而被机体吸收利用[2]。有研究表明,马属动物的盲结肠微生物能够供给宿主机体60%~70%的能量[3]。驴机体本身不能够降解饲料纤维,而是依靠驴盲肠和结肠微生物分泌的一系列纤维素酶与半纤维素酶来消化利用饲料纤维[4]。
驴养殖业中使用较多的纤维粗饲料主要包括玉米秸秆、小麦秸秆、稻秸、花生秧和小麦糠等低质高纤维含量的农作物秸秆及副产品。上述粗饲料的细胞壁则主要由纤维素(40%~50%)、半纤维素(30%~35%)、木质素和果胶等构成[5]。驴盲结肠微生物对于饲料细胞壁的降解需要多种纤维素酶和半纤维素酶的协同参与[6-7]。其中,内切(羧甲基)纤维素酶、外切(微晶)纤维素酶及β-葡萄糖苷酶是驴盲结肠中水解饲料细胞壁纤维素主链的降解酶[8],木聚糖酶(xylanase, XYL)则是降解饲料细胞壁半纤维素结构的主要水解酶。羧甲基纤维素酶(carboxymethyl cellulase, CMAase)是一类可以随机切断纤维素多糖链非结晶区(β-1,4糖苷键)的内切纤维素酶[9]。微晶纤维素酶(avicelase, AVI)作用于纤维素多糖链的非还原末端,释放纤维二糖[9]。β-葡萄糖苷酶能够切开纤维二糖的β-1,4糖苷键,进而从纤维二糖和短的纤维寡糖链中释放葡萄糖[9]。XYL负责将木聚糖分解为木二糖和低聚木糖,反映盲结肠微生物降解饲料半纤维素的能力[9]。此外,驴盲结肠微生物可能与反刍动物瘤胃微生物相似,还能够分泌木质素降解酯酶来催化水解饲料细胞壁的半纤维素与木质素分子间的酯键连接,消除阻碍纤维素和半纤维素分子降解的致密网状交联结构[10-11]。
目前,相关驴盲结肠微生物的纤维降解酶与半纤维素酶活性的研究报道很少。梁婷玉[12]测定了关中驴盲肠、结肠和直肠内容物的XYL活性达0.86~2.50 U/mL。刘利林[9]则测定了新疆驴盲肠液的CMAase和XYL活性,分别为0.21和0.46 U/mL。此外,有关驴盲结肠食糜液FAE、AE活性的研究更未见报道。本研究拟采集德州驴的盲肠、腹结肠和背结肠食糜液,比较分析其纤维素酶、半纤维素酶以及木质素降解酯酶(FAE、AE)活性及VFA含量,以期为深入开展驴内源性纤维素酶学特性及其降解饲料细胞壁的作用机理奠定理论基础,为进一步提高驴机体对纤维粗饲料的能量利用效率提供科学依据。
1 材料与方法 1.1 试验动物选取24月龄左右、体重相近的健康德州驴9头,对比分析德州驴的盲肠、腹结肠和背结肠食糜液中纤维素酶活性及VFA的生成。
1.2 饲养管理与试验饲粮试验德州驴均散栏饲养,每天饲喂2次,饲喂时间分别为07:00和18:00,基础饲粮组成及营养水平见表 1。饲养周期60 d,德州驴自由采食、饮水与运动。试验期间驴只体重与采食量均无显著差异(P>0.05)。
|
|
表 1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
待9头德州驴屠宰后,立即无菌操作采集德州驴的盲肠、腹结肠和背结肠食糜,使用4层灭菌纱布过滤后得到液相样品,分装至灭菌的10 mL离心管,置于-20 ℃保存。
1.4 pH及纤维素酶活性的测定[13]pH:采集德州驴的盲肠、腹结肠和背结肠食糜液后,使用pH计((Model BPP-7800,贝尔分析仪器有限公司)迅速测定其pH,并记录。
FAE活性:以阿魏酸甲酯为底物,使用分光光度计在340 nm检测阿魏酸甲酯和阿魏酸的吸光值,根据二者消光系数差异计算FAE活性。
AE活性:以4-硝基苯乙酯为底物,使用分光光度计在415 nm检测反应产物4-硝基酚的吸光值,根据4-硝基酚的标准曲线(图 1),计算AE活性。
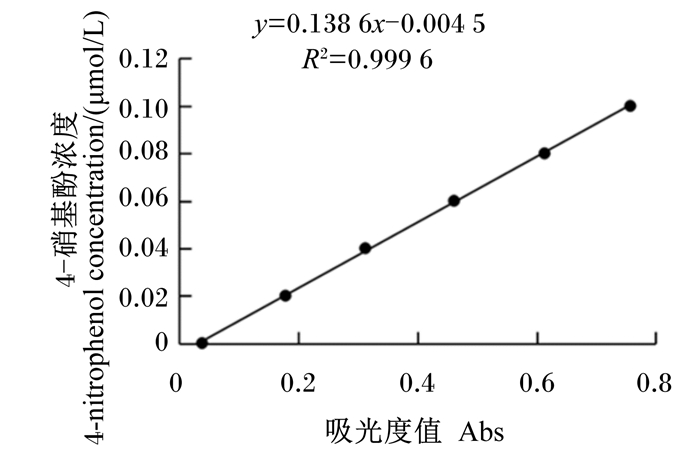
|
图 1 4-硝基酚的标准曲线 Fig. 1 Standard curve of 4-nitrophenol |
CMAase活性:以羧甲基纤维素为底物,使用分光光度计在540 nm检测反应产物葡萄糖的吸光值,根据葡萄糖的标准曲线(图 2),计算CMAase活性。
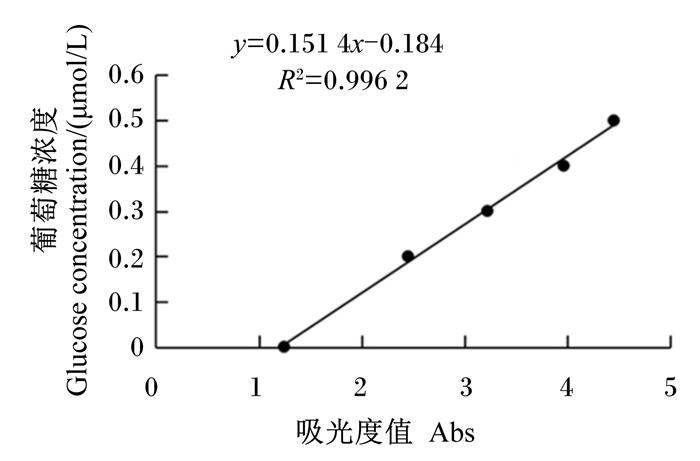
|
图 2 葡萄糖的标准曲线 Fig. 2 Standard curve of glucose |
AVI活性:以微晶纤维素溶液为底物,使用分光光度计在540 nm检测反应产物葡萄糖的吸光值,根据葡萄糖的标准曲线,计算AVI活性。
XYL活性:以木聚糖为底物,使用分光光度计在540 nm检测反应产物木糖的吸光值,根据木糖的标准曲线(图 3),计算XYL活性。
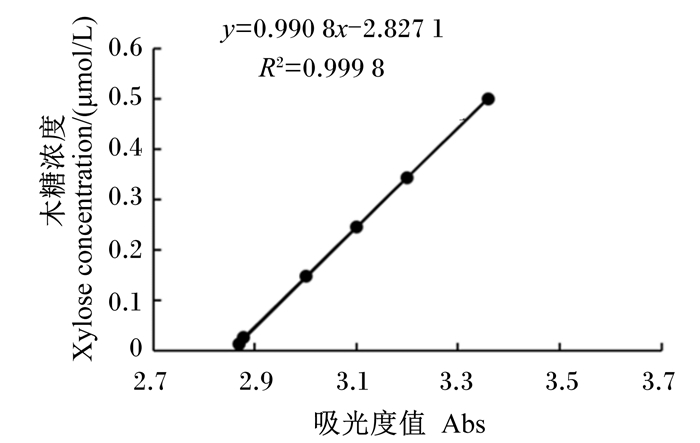
|
图 3 木糖的标准曲线 Fig. 3 Standard curve of xylose |
取1 mL驴盲结肠食糜液,加入300 μL偏磷酸(25%),充分混合后,置于10 000×g离心10 min。取上清液使用气相色谱仪测定驴盲肠、腹结肠和背结肠食糜液中VFA含量,计算乙酸、丙酸、丁酸、异丁酸、戊酸和异戊酸摩尔比例。
1.6 统计分析利用SAS 9.4的一般线性模型(GLM)程序,通过方差分析对数据进行统计分析。使用最小二乘法Lsmeans计算和校正标准误差平均值(SEM)。所有测定指标的平均值之间采用Duncan氏法进行多重比较分析。P < 0.05代表差异显著;0.05 < P < 0.10代表差异有显著的趋势。
2 结果 2.1 德州驴盲肠、腹结肠和背结肠食糜液中纤维素酶活性表 2可知,驴背结肠食糜液中CMCase、AVI、Xylase和AE的活性均显著高于驴盲肠和腹结肠(P < 0.05),但驴盲肠和腹结肠食糜液中纤维素酶活之间无显著差异(P>0.05)。此外,驴盲肠、腹结肠和背结肠食糜液中FAE活性无显著差异(P>0.05)。
|
|
表 2 德州驴盲肠、腹结肠和背结肠食糜液中纤维素酶活性 Table 2 Cellulose activities in cecum, ventral colon and dorsal colon chyme liquid of Dezhou donkeys |
由表 3可知,德州驴盲肠、腹结肠和背结肠食糜液中pH和总挥发性脂肪酸(TVFA)含量均无显著差异(P>0.05)。驴盲结肠的VFA发酵模式存在差异:乙酸摩尔比例在盲肠、腹结肠和背结肠食糜液中依次显著增加(P < 0.05),而丙酸和丁酸摩尔比例在盲肠、腹结肠和背结肠食糜液中依次显著降低(P < 0.05),乙酸/丙酸在驴盲肠、腹结肠和背结肠食糜液中依次显著增加(P < 0.05)。此外,驴盲肠、腹结肠和背结肠食糜液中支链VFA(包括异丁酸和异戊酸)摩尔比例依次显著增加(P < 0.05)。
|
|
表 3 德州驴盲肠、腹结肠和背结肠食糜液中VFA含量 Table 3 Contents of VFA in cecum, ventral colon and dorsal colon chyme liquid of Dezhou donkeys |
驴是典型的单胃食草动物,属后肠发酵类型。后消化道主要包括盲肠和结肠,栖息着数量庞大、种类繁多的微生物,类似于反刍动物瘤胃,对饲料纤维的降解利用具有重要作用。驴对饲料纤维具有较高的降解利用效率,驴对苜蓿干草和燕麦干草的中性洗涤纤维消化率高达2%~10%[14]。而且驴对低质纤维粗饲料的消化率甚至与Bedouin黑山羊相当。这归根结底是由于驴胃肠道中较高的微生物活性,其中,驴盲结肠微生物分泌的纤维素酶可能在饲料纤维的降解消化过程中起到关键作用。Glinsky等[3]指出,马属动物后肠道微生物能够降解羊草纤维素和半纤维素而释放可溶性糖。驴机体本身并不能直接降解饲料纤维,而是依靠盲结肠微生物分泌的一系列纤维素酶来发挥作用。Miyaji等[15]研究发现,盲结肠对于干草饲料中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)的消化率占全消化道饲料纤维消化率的90%,盲结肠微生物具有较高的CMAase和XYL活性。
本研究明确了驴盲结肠微生物能够分泌一系列的纤维素酶。其中,CMAase和AVI是驴盲结肠中水解饲料细胞壁纤维素主链的降解酶[8],反映微生物降解饲料纤维的能力。XYL则是降解饲料细胞壁半纤维素结构的主要水解酶,主要反映盲结肠微生物降解饲料半纤维素的能力[16]。FAE与AE协同作用能够切断饲料细胞壁内的半纤维素与木质素分子间的酯键连接,打破纤维分子间的网状交联结构,促进饲料纤维与酶之间的结合,增加饲料纤维的降解利用[10-11]。驴结肠食糜液中CMAase、AVI、XYL和AE的活性均高于驴盲肠,表明驴的结肠可能在饲料纤维的降解中发挥关键作用。这可能是由于饲料物质随着在驴胃肠道中的后移,容易降解的可溶性淀粉、蛋白质等营养物质在小肠降解,而饲料纤维的含量在盲肠和结肠中不断增加,促进了纤维降解菌的生长繁殖,进而使得驴结肠成为饲料纤维的主要降解场所。
目前有关驴盲结肠食糜的纤维酶活性报道资料有限。梁玉婷[12]测定了关中驴盲肠、结肠和直肠内容物的XYL活性高达0.86~2.50 U/mL,而CMAase和AVI的活性较低[12]。刘利林[9]测定了新疆驴盲肠液的CMAase和XYL活性分别为0.21和0.46 U/mL。本研究中,驴的盲结肠食糜液中CMAase活性达0.12~0.42 U/mL;AVI活性达0.13~0.23 U/mL;XYL活性达2.27~6.82 U/mL,均与上述研究报道相似。此外,本研究测定了驴盲结肠食糜液中木质素降解酯酶活性。其中,FAE活性高达4.2~4.8 mU/mL,高于荷斯坦公牛瘤胃液的FAE活性(3.7 mU/mL)[17]。
3.2 德州驴盲肠、腹结肠和背结肠食糜液中VFA含量饲料纤维经驴盲结肠微生物的纤维素酶水解后可产生VFA,主要包括乙酸、丙酸、丁酸和支链VFA。本研究中,驴盲肠、腹结肠和背结肠食糜液中TVFA含量达96~110 mmol/L。Glinsky等[3]研究表明,马属动物机体盲肠代谢生成的VFA能够为机体供应30%的能量。此外,结肠微生物代谢生成的VFA也可以为机体提供大量能量[18]。
乙酸摩尔比例在驴盲肠、腹结肠和背结肠食糜液中依次显著增加,与之相对应,驴背结肠食糜液中CMCase、AVI、Xlyase和AE活性均高于盲结和腹结肠。这表明驴背结肠与盲肠相比具有更高的纤维降解活性,能够降解饲料纤维生成更多的乙酸。与之相反,驴盲肠、腹结肠和背结肠食糜液中丙酸摩尔比例依次显著降低,说明驴盲肠可能会降解相对较多的精饲料而生成丙酸。此外,BCVFA是纤维分解菌的生长因子,在低质饲粮中添加支链VFA能够增加纤维分解菌的数量,提高微生物对饲料纤维的降解能力[19]。驴盲肠、腹结肠和背结肠食糜液中支链VFA(包括异丁酸、异戊酸和戊酸)逐渐显著增加,这进一步表明,德州驴盲肠、腹结肠和背结肠微生物的纤维降解活性逐渐升高。驴结肠食糜液与盲肠相比,具有更高的纤维降解活性,这可能是由于盲肠和结肠食糜液中微生物群落组成不同造成的。梁玉婷[12]测定了驴盲肠和结肠的微生物群落组成,结果指出,驴盲肠液的厚壁菌门占比达39.7%,而结肠食糜液中厚壁菌门占比高达48.7%。厚壁菌门主要负责降解饲料纤维物质,驴结肠食糜液比盲肠具有更高含量的厚壁菌门进一步印证了我们的试验结果。
4 结论德州驴背结肠食糜液中CMAase、AVI、XYL和AE活性均高于腹结肠和盲肠。与之相对应,乙酸和支链VAF的摩尔比例在德州驴盲肠、腹结肠和背结肠食糜液中逐渐显著增加,丙酸摩尔比例则依次在盲肠、腹结肠和背结肠食糜液中逐渐降低。此外,本研究明确了德州驴盲结肠具有较高的FAE和AE活性。
| [1] |
ZHANG Z W, ZHAN Y D, HAN Y, et al. Estimation of liveweight from body measurements through best fitted regression model in Dezhou donkey breed[J]. Journal of Equine Veterinary Science, 2021, 101: 103457. DOI:10.1016/j.jevs.2021.103457 |
| [2] |
HARRIS P A, ELLIS A D, FRADINHO M J, et al. Review: feeding conserved forage to horses: recent advances and recommendations[J]. Animal, 2017, 11(6): 958-967. DOI:10.1017/S1751731116002469 |
| [3] |
GLINSKY M J, SMITH R M, SPIRES H R, et al. Measurement of volatile fatty acid production rates in the cecum of the pony[J]. Journal of Animal Science, 1976, 42(6): 1465-1470. DOI:10.2527/jas1976.4261465x |
| [4] |
EDWARDS J E, SHETTY S A, VAN DEN BERG P, et al. Multi-kingdom characterization of the core equine fecal microbiota based on multiple equine (sub) species[J]. Animal Microbiome, 2020, 2(1): 6. DOI:10.1186/s42523-020-0023-1 |
| [5] |
YUE Q, YANG H J, CAO Y C, et al. Feruloyl and acetyl esterase production of an anaerobic rumen fungus Neocallimastix sp. YQ2 effected by glucose and soluble nitrogen supplementations and its potential in the hydrolysis of fibrous feedstuffs[J]. Animal Feed Science and Technology, 2009, 153(3/4): 263-277. |
| [6] |
苏少锋. 蒙古马胃肠道细菌群落组成及纤维素分解菌的研究[D]. 博士学位论文. 呼和浩特: 内蒙古农业大学, 2019. SU S F. Characterization of gastrointestinal bacterial community and cellulose-decomposing bacteria in Mongolian horses[D]. Ph. D. Thesis. Hohhot: Inner Mongolia Agricultural University, 2019. (in Chinese) |
| [7] |
白洪志. 降解纤维素菌种筛选及纤维素降解研究[D]. 博士学位论文. 哈尔滨: 哈尔滨工业大学, 2008. BAI H Z. Screening of cellulose degradation fungi and the study of its degradation characteristics[D]. Ph. D. Thesis. Harbin: Harbin Institute of Technology, 2008. (in Chinese) |
| [8] |
荆常亮, 李福昌, 王雪鹏, 等. 日粮ADF水平对断奶至3月龄獭兔生长性能、氮代谢、纤维素酶活和盲肠发酵的影响[J]. 畜牧兽医学报, 2013, 44(9): 1417-1424. JING C L, LI F C, WANG X P, et al. Effects of dietary ADF levels on growth performance, nitrogen metabolism, cellulase activity and caecum fermentation of Rex rabbits from weaning to 3-month-old[J]. Acta Veterinaria et Zootechnica Sinica, 2013, 44(9): 1417-1424 (in Chinese). |
| [9] |
刘利林. 日粮粗饲料水平对新疆驴饲料养分消化代谢与盲肠发酵特性的影响[D]. 博士学位论文. 北京: 中国农业大学, 2020. LIU L L. The effect of dietary forage level on nutrient digestion and metabolism and caecal fermentation characteristics in Xinjiang donkeys[D]. Ph. D. Thesis. Beijing: China Agricultural University, 2020. (in Chinese) |
| [10] |
BARTOLOME B, FAULDS C B, TUOHY M, et al. Influence of different xylanases on the activity of ferulic acid esterase on wheat bran[J]. Biotechnology and Applied Biochemistry, 1995, 22(1): 65-73. |
| [11] |
WILLIAMSON G, KROON P A, FAULDS C B. Hairy plant polysaccharides: a close shave with microbial esterases[J]. Microbiology, 1998, 144(Pt 8): 2011-2023. |
| [12] |
梁婷玉. 驴胃肠道组织形态、酶活及微生物区系研究[D]. 硕士学位论文. 兰州: 甘肃农业大学, 2019. LIANG T Y. Study on gastrointestinal tract mucosal morphology, enzyme activity and microflora of donkeys[D]. Master's Thesis. Lanzhou: Gansu Agricultural University, 2019. (in Chinese) |
| [13] |
任清长. 孕酮在瘤胃的转化及其对微生物消化代谢的调节作用[D]. 博士学位论文. 北京: 中国农业大学, 2014. REN Q C. Microbial transformation of progesterone in the rumen and its regulation in microbial digestion and metabolism[D]. Ph. D. Thesis. Beijing: China Agricultural University, 2014. (in Chinese) |
| [14] |
PEARSON R A, ARCHIBALD R F, MUIRHEAD R H. The effect of forage quality and level of feeding on digestibility and gastrointestinal transit time of oat straw and alfalfa given to ponies and donkeys[J]. The British Journal of Nutrition, 2001, 85(5): 599-606. DOI:10.1079/BJN2001321 |
| [15] |
MIYAJI M, UEDA K, HATA H, et al. Effect of grass hay intake on fiber digestion and digesta retention time in the hindgut of horses[J]. Journal of Animal Science, 2014, 92(4): 1574-1581. DOI:10.2527/jas.2013-6676 |
| [16] |
陈洪洋, 蔡俊, 林建国, 等. 木聚糖酶的研究进展[J]. 中国酿造, 2016, 35(11): 1-6. CHEN H Y, CAI J, LIN J G, et al. Research progress of xylanase[J]. China Brewing, 2016, 35(11): 1-6 (in Chinese). DOI:10.11882/j.issn.0254-5071.2016.11.001 |
| [17] |
黎大洪. 不同日粮饲喂条件下荷斯坦肉牛瘤胃微生物发酵阿魏酸酯酶昼夜变化规律研究[D]. 硕士学位论文. 北京: 中国农业大学, 2009. LI D H. Diurnal variations of ferulic acid esterase activities in rumen fermentation effected by rations intaked in Holstein cattle[D]. Master's Thesis. Beijing: China Agricultural University, 2014. (in Chinese) |
| [18] |
ARGENZIO R A, SOUTHWORTH M, STEVENS C E. Sites of organic acid production and absorption in the equine gastrointestinal tract[J]. The American Journal of Physiology, 1974, 226(5): 1043-1050. DOI:10.1152/ajplegacy.1974.226.5.1043 |
| [19] |
VAN GYLSWYK N O. The effect of supplementing a low-protein hay on the cellulolytic bacteria in the rumen of sheep and on the digestibility of cellulose and hemicellulose[J]. The Journal of Agricultural Science, 1970, 74(1): 169-180. DOI:10.1017/S0021859600021122 |




