缩合单宁是广泛存在于自然界的一类由黄烷-3-醇单体组成的多酚类聚合物,分子质量介于1 000~20 000 u,具有显著的抗氧化、抗炎、抗菌等生物活性[1]。长期以来,单宁被视为“抗营养因子”,从而限制了其在畜禽以及水产动物饲料中的研究和应用,近年来研究发现,低剂量缩合单宁不仅不影响动物的生长性能和养分表观消化率,还能调节肠道微生态平衡,提高动物健康水平[2]。当前,“替抗”成为动物营养学研究的热点,缩合单宁为天然植物提取物,具有无污染、无残留、安全性高的特点,是理想的抗生素替代品,在食品、医药、化妆品、环境治理等方面已得到广泛的应用。
缩合单宁对动物生长性能和机体健康的作用效果取决于缩合单宁的来源、浓度、化学结构及动物品种等因素[1]。例如,Becker等[3]研究表明,饲料中添加2%白坚树缩合单宁抑制了草食性和杂食性鱼类生长。相似地,饲料中缩合单宁添加量超过10 g/kg则降低了欧洲鲈鱼的生长性能[4]。Li等[5]研究表明,饲料中添加30~50 g/kg缩合单宁显著降低了草鱼的生长性能。然而,卢俊姣[6]报道,饲料中添加0.8 g/kg缩合单宁可促进吉富罗非鱼生长。Peng等[7-8]研究表明,饲料中添加0.1~1.0 g/kg葡萄籽缩合单宁不影响花鲈的存活率(survival rate,SR)和生长性能。相关文献就缩合单宁对水产动物体成分的影响的报道也不一致,一部分研究表明缩合单宁不影响鱼类体成分[7-8],另一部分研究表明缩合单宁显著抑制了脂肪在鱼体内的沉积[4, 9]。尽管缩合单宁对水产动物生长和体成分的作用效果存在差异,但其对水产动物的抗氧化作用效果几乎一致。缩合单宁具有良好的抗氧化活性,可提高鱼类血清和肝脏抗氧化酶活性及基因表达水平[7, 10]。
凡纳滨对虾(Litopenaeus vannamei),俗称南美白对虾,是世界三大养殖虾类之一。凡纳滨对虾在我国虾类养殖品种中的产量位居第一,2020年我国凡纳滨对虾养殖产量突破120万t,在促进水产养殖提质增效中发挥巨大作用。当前,仅有极少数文献[11-12]报道了单宁对凡纳滨对虾生长和健康的影响,且都集中在水解单宁,还未见缩合单宁对凡纳滨对虾的应用效果研究。缩合单宁与水解单宁属于不同的单宁种类,其化学结构、分子质量、生物活性及其对动物的作用效果截然不同。本文就缩合单宁对凡纳滨对虾生长性能、体成分、血清生化及抗氧化指标的影响进行研究,旨为缩合单宁的饲料资源开发及其在凡纳滨对虾等甲壳类水产动物中的应用提供理论依据。
1 材料与方法 1.1 试验饲料以鱼粉、豆粕、花生麸、虾壳粉为蛋白质源,面粉为糖源,鱼油和大豆卵磷脂为脂肪源,配制5种等氮等脂饲料,试验饲料组成及营养水平如表 1所示。CT0组为对照组(基础饲料配方),在基础饲料配方基础上分别添加0.5(CT0.5组)、1.0(CT1组)、2.0(CT2组)和4.0 g/kg DM(CT4组)缩合单宁替代等量纤维素制成试验组饲料。缩合单宁来源于葡萄籽,其提取和纯化步骤参照彭凯[13]的方法,缩合单宁溶于水后添加到饲料中。所有饲料原料过60目标准筛,混合均匀后通过SLX-80型双螺杆挤压机制成2.0 mm颗粒饲料,55 ℃烘干后冷却至室温,于-20 ℃冰箱中保存备用。饲料中缩合单宁含量的测定步骤参照Terrill等[14]的方法,以葡萄籽纯化缩合单宁作为标准品,CT0、CT0.5、CT1、CT2和CT4组饲料中缩合单宁含量实测值分别为0、0.46、1.05、1.93、3.94 g/kg DM。
|
|
表 1 试验饲料组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of experimental diets (DM basis) |
本试验于广东省农业科学院动物科学研究所水产研究中心循环水养殖系统中进行。选择初始体重约为1.38 g的凡纳滨对虾幼苗600尾,随机分为5组,每组3个重复,每个重复40尾,以重复为单位随机分配到15个直径80 cm、高70 cm、容积为350 L的圆柱形玻璃纤维缸中,分别投喂5种试验饲料。采取饱食投喂方式,每天投喂3次(08:00、14:00和20:00),每天记录饲料投喂量、死亡情况及水质情况,试验期为56 d。试验期间采取自然光照,盐度5‰~6‰,水温23~26 ℃,溶解氧浓度>5.0 mg/L,氨氮浓度<0.02 mg/L,亚硝酸盐浓度<0.1 mg/L,pH 7.5~8.0。
1.3 样品采集与分析试验结束后,凡纳滨对虾禁食24 h后采样。统计每缸中对虾的数量和总重量,计算存活率、增重率(weight gain rate,WGR)、特定生长率(specific growth rate,SGR)和饲料系数(feed coefficient,FC)。每缸随机取25尾虾进行采样,取其中5尾虾测定体重和体长,解剖取内脏,分离肝胰腺并称重,计算肥满度(condition factor,CF)和肝体比(hepatosomatic index,HSI);取其中5尾虾用于全虾体成分分析,即水分、粗蛋白质、粗脂肪和粗灰分含量测定;取其中5尾虾测定肌肉氨基酸含量;取其中10尾虾,从围心腔采血,室温下静置4 h,然后经3 500 r/min离心10 min,取上层血清,置于-80 ℃保存,用于血清生化和抗氧化指标测定。饲料和全虾营养成分含量参照国标方法检测,其中水分含量采用105 ℃常压干燥法(参照GB/T 6435—2014)测定,粗蛋白质含量采用凯氏定氮法(参照GB/T 6432—2018)测定,粗脂肪含量采用乙醚抽提法(参照GB/T 6432—2006)测定,粗灰分含量采用550 ℃灼烧法(参照GB/T 6438—1992)测定,氨基酸含量采用盐酸水解法(参照GB/T 18246—2019)测定。血清白蛋白、球蛋白、尿酸、葡萄糖、胆固醇、甘油三酯、低密度脂蛋白胆固醇、高密度脂蛋白胆固醇含量以及谷丙转氨酶、谷草转氨酶活性采用日立7600型全自动生化分析仪测定。血清超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)活性与丙二醛(malondialdehyde,MDA)含量采用商业试剂盒(购于南京建成生物工程研究所)依照说明书步骤测定。
1.4 指标计算

|
采用SPSS 17.0统计软件的单因素方差分析(one-way ANOVA)程序对试验数据进行处理。先对数据进行方差齐性检验,若满足方差齐性,采用Duncan氏法进行多重比较;若不满足方差齐性,则采用Dunnett-T3检验法进行多重比较。采用多项式比较分析均值的线性和二次方效应,显著性水平为P<0.05,显著性趋势为0.05<P<0.10[15]。
2 结果 2.1 饲料中添加缩合单宁对凡纳滨对虾生长性能的影响由表 2可知,随着饲料中缩合单宁添加量的增加,凡纳滨对虾的终末体重(P=0.080)、增重率(P=0.075)和特定生长率(P=0.070)线性增加,饲料系数线性降低(P=0.069)。饲料中添加缩合单宁对凡纳滨对虾成活率、摄食量、肥满度和肝体比无显著影响(P>0.05)。
|
|
表 2 饲料中添加缩合单宁对凡纳滨对虾生长性能的影响 Table 2 Effects of dietary condensed tannins on growth performance of Litopenaeus vannamei |
由表 3可知,饲料中添加缩合单宁对凡纳滨对虾全虾水分、粗蛋白质、粗脂肪和粗灰分含量均无显著影响(P>0.05)。
|
|
表 3 饲料中添加缩合单宁对凡纳滨对虾体成分的影响(湿重基础) Table 3 Effects of dietary condensed tannins on body composition of Litopenaeus vannamei (wet weight basis) |
由表 4可知,饲料中添加缩合单宁对凡纳滨对虾肌肉各氨基酸及总氨基酸含量均无显著影响(P>0.05)。
|
|
表 4 饲料中添加缩合单宁对凡纳滨对虾肌肉氨基酸含量的影响(占总氨基酸比例) Table 4 Effects of dietary condensed tannins on amino acid contents in muscle of Litopenaeus vannamei (percentage of total amino acids) |
由表 5可知,饲料中添加缩合单宁对凡纳滨对虾血清生化指标无显著影响(P>0.05)。
|
|
表 5 饲料中添加缩合单宁对凡纳滨对虾血清生化指标的影响 Table 5 Effects of dietary condensed tannins on serum biochemical indexes of Litopenaeus vannamei |
由图 1可知,与CT0组相比,CT0.5~CT2组凡纳滨对虾血清超氧化物歧化酶活性显著增加(P<0.05),CT4组凡纳滨对虾血清超氧化物歧化酶活性无显著变化(P>0.05);CT0.5组凡纳滨对虾血清过氧化氢酶活性无显著变化(P>0.05),CT1和CT2组凡纳滨对虾血清过氧化氢酶活性显著增加(P<0.05),CT4组凡纳滨对虾血清过氧化氢酶活性显著降低(P<0.05);CT0.5组凡纳滨对虾血清丙二醛含量无显著变化(P>0.05),CT1~CT4组凡纳滨对虾血清丙二醛含量显著下降(P<0.05)。
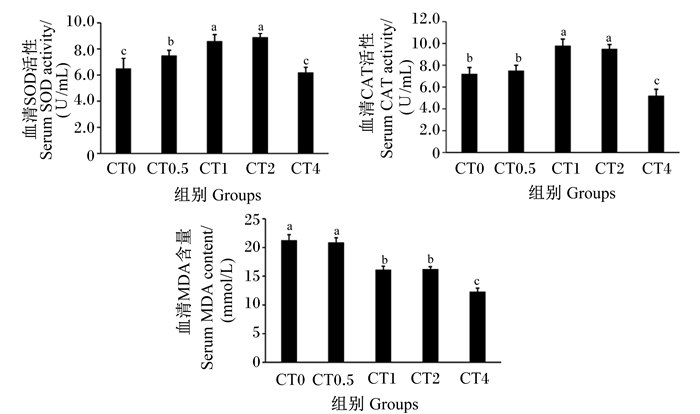
|
数据柱标注不同小写字母表示差异显著(P<0.05)。 Data columns with different small letters mean significant difference (P<0.05). 图 1 饲料中添加缩合单宁对凡纳滨对虾血清抗氧化指标的影响 Fig. 1 Effects of dietary condensed tannins on serum antioxidant indexes of Litopenaeus vannamei |
以凡纳滨对虾血清超氧化物歧化酶活性为评价指标,得到缩合单宁添加量(x)与凡纳滨对虾血清超氧化物歧化酶活性(y)的一元二次回归方程为:y=-0.663x2+2.575x+6.495 4,R2=0.989 8(图 2)。经计算,饲料中缩合单宁的最适添加量为1.94 g/kg DM。
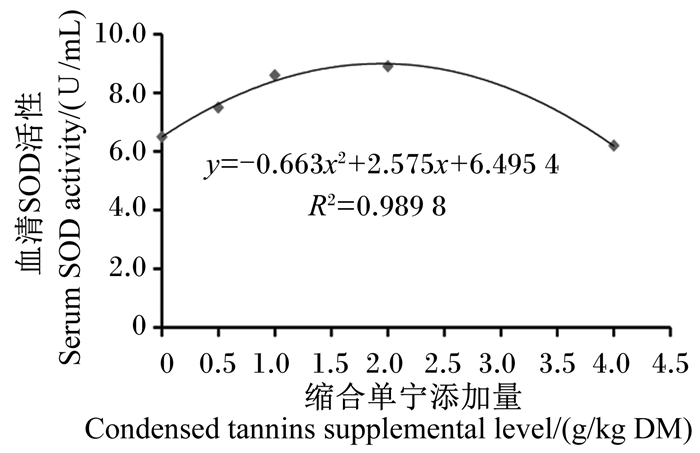
|
图 2 饲料中缩合单宁添加量与凡纳滨对虾血清SOD活性的回归关系 Fig. 2 Regression relationship between dietary condensed tannins supplemental level and serum SOD activity of Litopenaeus vannamei |
本试验研究了缩合单宁对凡纳滨对虾生长性能的影响,结果表明,凡纳滨对虾的成活率各组之间无显著差异,表明饲料中添加0.5~4.0 g/kg DM缩合单宁不影响对虾的正常生长。饲料中添加缩合单宁趋向于提高凡纳滨对虾的增重率和特定生长率,降低饲料系数,表明缩合单宁对凡纳滨对虾具有一定的促生长作用。单宁长期以来被视为“抗营养因子”,近年来研究发现,低剂量单宁能够促进动物生长,增强机体健康水平,提高生产性能[1]。卢俊姣[6]报道,饲料中添加0.8 g/kg缩合单宁可促进吉富罗非鱼生长。郭慧等[11]研究表明,饲料中添加1~3 g/kg水解单宁显著增加了凡纳滨对虾增重率和特定生长率,从而促进对虾生长性能。本试验结果与前人研究结果相似,表明低剂量缩合单宁对对虾生长更有利,可能归因于缩合单宁对肠道菌群的有益作用,如缩合单宁可抑制海鲈肠道致病菌鲸杆菌属(Cetobacterium)生长,减少肠道炎症。Biagia等[16]报道,饲粮中添加4.5 g/kg栗树缩合单宁能够显著提高断奶仔猪的饲料效率,提高生长性能,归因于缩合单宁增加了空肠中乳酸杆菌的数量。郭慧等[11]报道,饲料中添加1~3 g/kg水解单宁显著增加了凡纳滨对虾肠道变形菌门、软壁菌门和厚壁菌门的比例,降低了蓝细菌门、放线菌门和拟杆菌门的比例,有利于促进对虾肠道健康和有益菌群定植。Peng等[17]报道,饲料中添加0.1~0.4 g/kg缩合单宁降低了鲈鱼肠道革兰氏阴性菌Cetobacterium和气单胞菌属(Aeromonas)丰度,增加了梭菌属(Clostridium)和短螺旋体属(Brevinema)丰度,改善了肠道通透性,有益于鲈鱼生长和肠道健康。缩合单宁对凡纳滨对虾的促生长作用及其与肠道菌群的关系有待进一步研究。
3.2 饲料中添加缩合单宁对凡纳滨对虾体成分和肌肉氨基酸含量的影响体成分是鱼类营养学研究的主要内容之一,是评价鱼类营养及生长状况的重要指标。本试验中不同组别之间相似的对虾体成分和肌肉氨基酸含量说明饲料中添加0.5~4.0 g/kg DM缩合单宁不影响对虾的全虾和肌肉营养组成。Peng等[7-8]报道,饲料中添加0.1~1.0 g/kg缩合单宁不会显著影响花鲈全鱼中水分、粗蛋白质、粗脂肪等体成分含量。Przywitowski等[18]报道,饲粮中添加2.35 g/kg蚕豆缩合单宁不会显著影响火鸡的生长性能和肌肉营养成分含量。朱旭枫等[10]研究发现,饲料中添加0.5~2.0 g/kg水解单宁不显著影响珍珠龙胆石斑鱼全鱼体成分。Omnes等[4]报道,饲料中添加高达30 g/kg的单宁酸不会显著影响欧洲鲈鱼全鱼水分、粗蛋白质和粗灰分含量,但却显著降低了全鱼粗脂肪含量。相似地,Buyukcapar等[9]研究表明,饲料中添加5~25 g/kg水解单宁显著抑制了罗非鱼的体脂沉积,这归因于饲料中脂肪表观消化率的下降。相反,姚静婷等[19]报道,饲料中添加7.5和12.5 g/kg水解单宁均显著增加了暗纹东方鲀肌肉粗脂肪含量,降低了肌肉总氨基酸和总必需氨基酸含量。以上研究结果不一致的原因可能归因于动物品种、单宁类别及其添加量的不同。
3.3 饲料中添加缩合单宁对凡纳滨对虾血清生化和抗氧化指标的影响血清生化指标通常反映动物的新陈代谢状况、健康程度及其对营养与环境因素的适应状况[20]。本试验中各组间凡纳滨对虾相似的血清生化指标表明饲料中添加0.5~4.0 g/kg DM缩合单宁不影响对虾的血液新陈代谢。Peng等[7]报道,饲料中添加0.1~0.4 g/kg缩合单宁不会显著影响花鲈的血清生化指标,但却显著增加了血清总抗氧化能力及过氧化氢酶和超氧化物歧化酶的活性,提高了花鲈的抗氧化能力。朱旭枫等[10]研究发现,饲料中添加1~2 g/kg水解单宁显著提高了珍珠龙胆石斑鱼血清和肝脏中超氧化物歧化酶活性以及肝脏中过氧化氢酶和超氧化物歧化酶基因表达量。本试验结果表明,饲料中添加1.0~2.0 g/kg DM缩合单宁显著增加了对虾血清过氧化氢酶和超氧化物歧化酶活性,显著降低了血清丙二醛含量,表明缩合单宁可提高对虾的抗氧化能力。过氧化氢酶和超氧化物歧化酶是机体抗氧化系统中重要的抗氧化酶,如过氧化氢酶通过催化机体内过氧化氢分解,在维持过氧化氢体内平衡中起着关键作用,因此是保护细胞免受氧化损伤的一种非常重要的酶[21];超氧化物歧化酶存在于有氧呼吸生物体中,将超氧化物转化为过氧化氢,去除多余的生物活性氧中间体,从而避免氧化损伤等不利条件[22];丙二醛是机体内多不饱和脂肪酸过氧化的产物,直接反映脂质过氧化水平和内源性氧化损伤程度[23]。体内和体外研究表明,缩合单宁具有较强的抗氧化活性[21, 24]。缩合单宁通过向自由基提供电子而产生更加稳定的且危害更小的自由基结构物质,从而达到清除自由基、过氧化氢和一氧化氮的作用效果[25]。值得一提的是,本试验中当缩合单宁的添加量为4.0 g/kg DM时,对虾血清过氧化氢酶和超氧化物歧化酶活性显著下降,可能是因为对虾机体应对缩合单宁或某种变化的生理反应,值得进一步深入研究。
4 结论① 饲料中添加0.5~4.0 g/kg DM缩合单宁不影响凡纳滨对虾的成活率和体成分,但趋向于提高对虾的增重率和特定生长率,降低饲料系数,表明缩合单宁对凡纳滨对虾具有一定的促生长作用。
② 饲料中添加0.5~4.0 g/kg DM缩合单宁不影响凡纳滨对虾的血清生化指标,但能够提高血清过氧化氢酶和超氧化物歧化酶活性,降低血清丙二醛含量,表明饲料中添加缩合单宁可提高凡纳滨对虾的抗氧化能力。
③ 以血清超氧化物歧化酶活性为评价指标,凡纳滨对虾饲料中缩合单宁的最适添加量为1.94 g/kg DM。
| [1] |
彭凯, 王玉玺, 王国霞, 等. 缩合单宁的生物功能及其在动物生产中的应用[J]. 动物营养学报, 2020, 32(8): 3451-3460. PENG K, WANG Y X, WANG G X, et al. Biological function of condensed tannins and their application in animal production[J]. Chinese Journal of Animal Nutrition, 2020, 32(8): 3451-3460 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.08.001 |
| [2] |
HUANG Q Q, LIU X L, ZHAO G Q, et al. Potential and challenges of tannins as an alternative to in-feed antibiotics for farm animal production[J]. Animal Nutrition, 2018, 4(2): 137-150. DOI:10.1016/j.aninu.2017.09.004 |
| [3] |
BECKER K, MAKKAR H P S. Effects of dietary tannic acid and quebracho tannin on growth performance and metabolic rates of common carp (Cyprinus carpio L.)[J]. Aquaculture, 1999, 175(3/4): 327-335. |
| [4] |
OMNES M H, LE GOASDUFF J, LE DELLIOU H, et al. Effects of dietary tannin on growth, feed utilization and digestibility, and carcass composition in juvenile European seabass (Dicentrarchus labrax L.)[J]. Aquaculture Reports, 2017, 6: 21-27. DOI:10.1016/j.aqrep.2017.01.004 |
| [5] |
LI M, FENG L, JIANG W D, et al. Condensed tannins decreased the growth performance and impaired intestinal immune function in on-growing grass carp (Ctenopharyngodon idella)[J]. The British Journal of Nutrition, 2020, 123(7): 737-755. DOI:10.1017/S0007114519003295 |
| [6] |
卢俊姣. 饲料中添加原花青素对吉富罗非鱼生长及氧化应激的影响[D]. 硕士学位论文. 厦门: 集美大学, 2014. LU J J. The effects of dietary oligomeric proanthocyanidins supplementation on the growth and oxidative stress of juvenile GIFT tilapia (Oreochromis niloticus)[D]. Master's Thesis. Xiamen: Jimei University, 2014. (in Chinese) |
| [7] |
PENG K, WANG G X, WANG Y X, et al. Condensed tannins enhanced antioxidant capacity and hypoxic stress survivability but not growth performance and fatty acid profile of juvenile Japanese seabass (Lateolabrax japonicus)[J]. Animal Feed Science and Technology, 2020, 269: 114671. DOI:10.1016/j.anifeedsci.2020.114671 |
| [8] |
PENG K, ZHOU Y H, WANG Y X, et al. Inclusion of condensed tannins in Lateolabrax japonicus diets: effects on growth, nutrient digestibility, antioxidant and immune capacity and copper sulphate stress resistance[J]. Aquaculture Reports, 2020, 18: 100525. DOI:10.1016/j.aqrep.2020.100525 |
| [9] |
BUYUKCAPAR H M, ATALAY A I, KAMALAK A. Growth performance of Nile tilapia (Oreochromis niloticus) fed with diets containing different levels of hydrolysable and condensed tannin[J]. Journal of Agricultural Science and Technology, 2011, 13: 1045-1051. |
| [10] |
朱旭枫, 黄洋, 黄俊杭, 等. 水解单宁对珍珠龙胆石斑鱼生长性能、抗氧化能力、肠道组织结构与菌群多样性的影响[J]. 动物营养学报, 2021, 33(2): 1020-1035. ZHU X F, HUANG Y, HUANG J H, et al. Effects of hydrolyzable tannins on growth performance, antioxidant capacity, intestinal morphology and bacterial diversity of pearl gentian grouper (Epinephelus lanceolatus ♂×Epinephelus fuscoguttatus ♀)[J]. Chinese Journal of Animal Nutrition, 2021, 33(2): 1020-1035 (in Chinese). DOI:10.3969/j.issn.1006-267x.2021.02.042 |
| [11] |
郭慧, 朱旭枫, 陈锦霖, 等. 水解单宁对凡纳滨对虾生长性能和肠道微生物的影响[J]. 中国水产科学, 2019, 26(5): 883-892. GUO H, ZHU X F, CHEN J L, et al. Effects of hydrolyzable tannins on growth performance and intestinal microflora in Litopenaeus vannamei[J]. Journal of Fishery Sciences of China, 2019, 26(5): 883-892 (in Chinese). |
| [12] |
朱旭枫, 邓秋霞, 郭慧, 等. 水解单宁对副溶血弧菌感染凡纳滨对虾血液及血细胞免疫指标的影响[J]. 广东海洋大学学报, 2021, 41(3): 12-19. ZHU X F, DENG Q X, GUO H, et al. Effect of hydrolyzable tannins on hemolymph and cellular immunological responses of Litopenaeus vannamei challenged by vibrio parahaemolyticus[J]. Journal of Guangdong Ocean University, 2021, 41(3): 12-19 (in Chinese). DOI:10.3969/j.issn.1673-9159.2021.03.002 |
| [13] |
彭凯. 贮藏方式对饲用紫色达利菊缩合单宁的化学结构及生物活性的影响研究[D]. 博士学位论文. 北京: 中国农业大学, 2017. PENG K. Effects of conservation methods on chemical structure and biological activity of condensed tannins in purple prairie clover[D]. Ph. D. Thesis. Beijing: China Agricultural University, 2017. (in Chinese) |
| [14] |
TERRILL T H, ROWAN A M, DOUGLAS G B, et al. Determination of extractable and bound condensed tannin concentrations in forage plants, protein concentrate meals and cereal grains[J]. Journal of the Science of Food and Agriculture, 1992, 58(3): 321-329. DOI:10.1002/jsfa.2740580306 |
| [15] |
PENG K, JIN L, NIU Y D, et al. Condensed tannins affect bacterial and fungal microbiomes and mycotoxin production during ensiling and upon aerobic exposure[J]. Applied and Environmental Microbiology, 2018, 84(5): e02274-17. |
| [16] |
BIAGIA G, CIPOLLINI I, PAULICKS B R, et al. Effect of tannins on growth performance and intestinal ecosystem in weaned piglets[J]. Archives of Animal Nutrition, 2010, 64(2): 121-135. DOI:10.1080/17450390903461584 |
| [17] |
PENG K, ZHAO H X, WANG G X, et al. Effect of condensed tannins on growth performance, intestinal immune capacity and bacterial microbiomes of Lateolabrax japonicus[J]. Aquaculture Research, 2021, 52(11): 5321-5331. DOI:10.1111/are.15402 |
| [18] |
PRZYWITOWSKI M, MIKULSKI D, ZDUNCZYK Z, et al. The effect of dietary high-tannin and low-tannin faba bean (Vicia faba L.) on the growth performance, carcass traits and breast meat characteristics of finisher turkeys[J]. Animal Feed Science and Technology, 2016, 221(Part A): 124-136. |
| [19] |
姚静婷, 孔纯, 华雪铭, 等. 水解单宁对暗纹东方鲀摄食偏好、消化代谢和抗氧化能力的效应[J]. 水产学报, 2019, 43(6): 1449-1462. YAO J T, KONG C, HUA X M, et al. Effects of supplemental hydrolysable tannin on feeding preference, nutrition digestion and antioxidant ability of obscure puffer (Takifugu fasciatus)[J]. Journal of Fisheries of China, 2019, 43(6): 1449-1462 (in Chinese). |
| [20] |
王爱民, 韩光明, 封功能, 等. 饲料脂肪水平对吉富罗非鱼生产性能、营养物质消化及血液生化指标的影响[J]. 水生生物学报, 2011, 35(1): 80-87. WANG A M, HAN G M, FENG G N, et al. Effects of dietary lipid levels on growth performance, nutrient digestibility and blood biochemical indices of gift tilapia (Oreochromis niloticus)[J]. Acta Hydrobiologica Sinica, 2011, 35(1): 80-87 (in Chinese). |
| [21] |
PENG K, SHIRLEY D C, XU Z J, et al. Effect of purple prairie clover (Dalea purpurea Vent.) hay and its condensed tannins on growth performance, wool growth, nutrient digestibility, blood metabolites and ruminal fermentation in lambs fed total mixed rations[J]. Animal Feed Science and Technology, 2016, 222: 100-110. DOI:10.1016/j.anifeedsci.2016.10.012 |
| [22] |
MENG Q G, CHEN J, XU C C, et al. The characterization, expression and activity analysis of superoxide dismutases (SODs) from Procambarus clarkii[J]. Aquaculture, 2013, 406/407: 131-140. DOI:10.1016/j.aquaculture.2013.05.008 |
| [23] |
DING Z L, ZHANG Y X, YE J Y, et al. An evaluation of replacing fish meal with fermented soybean meal in the diet of Macrobrachium nipponense: growth, nonspecific immunity, and resistance to Aeromonas hydrophila[J]. Fish & Shellfish Immunology, 2015, 44(1): 295-301. |
| [24] |
BARREIRA J C M, FERREIRA I C F R, OLIVEIRA M B P P, et al. Antioxidant activities of the extracts from chestnut flower, leaf, skins and fruit[J]. Food Chemistry, 2008, 107(3): 1106-1113. DOI:10.1016/j.foodchem.2007.09.030 |
| [25] |
KOLECKAR V, KUBIKOVA K, REHAKOVA Z, et al. Condensed and hydrolysable tannins as antioxidants influencing the health[J]. Mini Reviews in Medicinal Chemistry, 2008, 8(5): 436-447. DOI:10.2174/138955708784223486 |




