炎症反应是机体受到损伤或有害刺激后产生的一种适应性反应[1],其与许多疾病如肝硬化、癌症和糖尿病等慢性疾病的发展联系密切[2]。巨噬细胞是一种位于组织内的白血球,可以对细胞残片及病原体进行吞噬和消化,当受到脂多糖(LPS)等刺激后会出现炎症反应,表现为一氧化氮(NO)分泌增加,诱导型一氧化氮合酶(iNOS)和肿瘤坏死因子-α(TNF-α)的表达升高[3]。核转录因子-κB(NF-κB)是参与细胞对外界刺激响应的蛋白,在调控机体炎症中发挥了重要作用,同时也是NOD样受体家族含pyrin结构域蛋白3(NLRP3)信号通路激活的启动信号[4]。NF-κB p65通常与核转录因子-κB抑制蛋白α(IκBα)以非活性形式结合在细胞质上。当细胞被细菌或病毒刺激时,IκBα和NF-κB p65被降解,从而进入细胞核执行其功能[5]。研究发现,NLRP3信号通路可识别外来微生物感染和细胞内危险信号[6],通过NLRP3炎性小体的聚集介导宿主对微生物感染和细胞损伤的免疫反应,导致半胱天冬蛋白酶-1(Caspase-1)蛋白转化为活化的Caspase-1以及细胞因子前体白细胞介素-1β(Pro-IL-1β)和前体白细胞介素-18(Pro-IL-18)转化为成熟的白细胞介素-1β(IL-1β)和白细胞介素-18(IL-18)[7]。
金针菇(Flammulina velutipes)学名毛柄金钱菇,因其营养丰富和口感鲜美而备受消费者喜爱[8]。金针菇富含多糖、甾醇、蛋白质和膳食纤维等多种活性物质[9]。金针菇多糖(FVP)是从金针菇中提取的水溶性多糖[10],具有多种生物活性,体现在抗氧化[11]、促进肠道健康[12]、免疫调节[13]等方面。FVP能增强巨噬细胞的吞噬活性,调控巨噬细胞分泌炎性介质、干扰素和细胞因子等,进而增强机体的抗炎能力[14]。Zhao等[15]发现FVP可以减轻溃疡性结肠炎症状,降低炎症基因的表达水平,并增强机体的代谢和免疫能力。
发酵具有周期短、成本低、产量大、有工业化生产前景等优势,金针菇在发酵过程中除产生菌丝体外,还会在发酵液中产生多糖、多肽、生物碱、酶、氨基酸、维生素和植物激素等活性物质[16]。研究表明,很多食用菌液体发酵的菌丝体多糖含量远高于子实体[17]。曾璇竹等[18]研究了香菇多糖发酵工艺的优化及其抗氧化活性,结果表明香菇发酵后多糖提取量和抗氧化活性显著升高。刘自尧等[19]研究发现,槐耳-板蓝根发酵后发酵体系中具有抗炎、抗肿瘤作用的多糖含量逐渐升高,且发酵后的多糖提取物能更明显抑制LPS诱导的RAW 264.7巨噬细胞NO和TNF-α的分泌。
本课题组前期对金针菇进行发酵处理并从发酵金针菇中提取多糖,通过研究发现,相比FVP,发酵金针菇多糖(FFVP)分子聚集作用增强,单糖组成中甘露糖比例显著升高,同浓度下FFVP的抗氧化活性高于FVP[20]。然而,FVP和FFVP调节巨噬细胞炎症反应的作用及可能的机制还未知。本研究采用LPS诱导构建巨噬细胞炎症反应模型,探讨FVP和FFVP抑制巨噬细胞炎症反应的作用及机制,以期为合理利用金针菇提供理论基础,并为抑制炎症反应提供新思路。
1 材料与方法 1.1 材料与试剂FVP和FFVP,由本实验室提取纯化[20];小鼠单核巨噬细胞RAW264.7,购自中国科学院细胞库;LPS,购自Sigma公司;杜氏磷酸缓冲液(DPBS)、胎牛血清、双抗、DMEM培养基、中性红溶液、脱脂奶粉、RIPA裂解液、BAY11-7082(NF-κB抑制剂)、苯甲基磺酰氟(PMSF)、NO试剂盒、活性氧(ROS)试剂盒和CCK-8试剂盒,购自上海碧云天生物有限公司;一抗IκBα、NLRP3、Caspase-1、IL-1β、β-肌动蛋白(β-actin)和二抗山羊抗兔免疫球蛋白G (goat anti-rabbit IgG),购自上海优宁维生物科技股份有限公司;酶联免疫吸附测定(ELISA)试剂盒、总RNA提取试剂盒、逆转录试剂盒和定量PCR(q-PCR)试剂盒,购自南京建成生物工程研究所。
1.2 仪器与设备细胞培养箱(Heracell-240i),购自赛默飞世尔科技公司;荧光显微镜(ECLIPSE NI),购自尼康仪器有限公司;酶标仪(Synergy-2),购自泽泉国际集团有限公司。
1.3 试验方法 1.3.1 细胞培养与处理RAW264.7培养于含10%胎牛血清、1%双抗(100 IU/mL青霉素和100 IU/mL链霉素)和90% DMEM培养基的工作液,置于37 ℃、5% CO2的培养箱中。
1.3.1.1 LPS诱导RAW264.7炎症反应模型的建立将处于对数生长期的RAW264.7按照1×105个/孔的密度接种于96孔板,每孔100 μL。将细胞培养板置于培养箱培养12 h,使细胞贴壁生长。取出细胞培养板,吸去培养基。每孔添加100 μL含LPS的工作液,设置LPS浓度分别为0、0.1、0.5、1.0、1.5和2.0 μg/mL,培养箱中孵育24 h。
1.3.1.2 FVP/FFVP作用浓度的选择细胞接种方式同1.3.1.1,每孔添加100 μL含FVP或FFVP的工作液,设置FVP或FFVP浓度分别为0、25、50、75、100、125和150 μg/mL,培养箱中孵育24 h。
1.3.1.3 FVP/FFVP处理LPS诱导的RAW264.7炎症反应模型细胞接种方式同1.3.1.1,将细胞分为CON组(正常培养基)、LPS组(正常培养基+1 μg/mL LPS)、FVP组(正常培养基+1 μg/mL LPS+25、50或100 μg/mL FVP)和FFVP组(正常培养基+1 μg/mL LPS+25、50或100 μg/mL FFVP),培养箱中孵育24 h。
1.3.1.4 FVP/FFVP及BAY11-7082处理LPS诱导RAW264.7炎症反应模型细胞接种方式同1.3.1.1,将细胞分为CON组(正常培养基)、LPS组(正常培养基+1 μg/mL LPS)、LPS抑制组(正常培养基+1 μg/mL LPS+10 μmol/L BAY11-7082)(BAY11-7082的浓度参考Ghashghaeinia等[21]的研究)、FVP组(正常培养基+1 μg/mL LPS+100 μg/mL FVP)、FVP抑制组(正常培养基+1 μg/mL LPS+100 μg/mL FVP+10 μmol/L BAY11-7082)、FFVP组(正常培养基+1 μg/mL LPS+100 μg/mL FFVP)和FFVP抑制组(正常培养基+1 μg/mL LPS+100 μg/mL FFVP+10 μmol/L BAY11-7082),培养箱中孵育24 h。
1.3.2 测定指标与方法 1.3.2.1 细胞活力按1.3.1.1、1.3.1.2和1.3.1.3处理细胞,弃去上清液,用DPBS洗涤2次,将CCK-8与工作液按照1 ∶ 10的体积比配制CCK-8工作液,每孔加100 μL CCK-8工作液置于培养箱中继续培养1 h,在波长450 nm处测定吸光度(OD)值[22],按下式计算细胞活力:
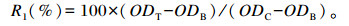
|
式中:R1为细胞活力;ODT为试验组OD值;ODB为空白组OD值;ODC为对照组OD值。
1.3.2.2 ROS与NO含量按1.3.1.3处理细胞,处理完成后,离心取上清,按试剂盒说明书测定各组上清液中的NO含量[23]。细胞用DPBS洗涤2次,将荧光探针2’, 7’-二氯荧光乙酰乙酸盐(DCFH-DA)试剂与工作液按照1 ∶ 1 000的体积比配制DCFH-DA工作液,然后每孔加2 mL(6孔板)和100 μL(96孔板)DCFH-DA工作液,培养箱中孵育20 min。用荧光显微镜观察6孔板各孔的荧光并拍照,用酶标仪测定96孔板各孔的荧光强度[24],根据下式计算ROS含量:
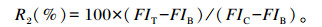
|
式中:R2为ROS含量;FIT为试验组荧光强度;FIB为空白组荧光强度;FIC为对照组荧光强度。
1.3.2.3 吞噬能力按1.3.1.3处理细胞,培养24 h后弃培养基,每孔加入50 μL的0.05%中性红溶液,培养4 h后弃去中性红,DPBS洗3次,加入100 μL细胞裂解液,室温放置2 h,用酶标仪测定540 nm处OD值,根据下式计算吞噬指数:
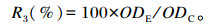
|
式中:R3为吞噬指数;ODE为试验组OD值;ODC为对照组OD值。
1.3.2.4 炎症因子含量按1.3.1.3处理细胞,培养结束后收集上清液离心,按照ELISA试剂盒说明书测定IL-1β、IL-6、IL-18和TNF-α含量[25]。
1.3.2.5 炎症因子mRNA相对表达量按1.3.1.3处理细胞,培养结束后收集细胞,使用TRIzol法提取总RNA,加入RNAase-Free水,应用紫外法测定RNA的纯度和浓度。按试剂盒说明书进行反转录、扩增,以β-actin为内参基因,采用2-ΔΔCt法计算目的基因IL-1β、IL-6、IL-18和TNF-α的mRNA相对表达量。引物由生工生物工程(上海)股份有限公司合成,引物信息见表 1。
|
|
表 1 引物信息 Table 1 Primer information |
BAY11-7082是一种NF-κB抑制剂,抑制TNF-α诱导的IκBα磷酸化(p-IκBα),可以完全且特异性地废除NF-κB的DNA结合,下调细胞因子IL-1β、IL-6和TNF-α的表达[26]。为研究FVP和FFVP通过NF-κB-NLRP3信号通路抑制巨噬细胞炎症反应的机制,选用BAY11-7082作为NF-κB抑制剂开展Western blot。
按1.3.1.4处理细胞,培养结束后每孔加入200 μL的RIPA裂解液(含1 mmol/L的PMSF),4 ℃裂解30 min,离心取上清液。使用BCA法测定蛋白浓度,将上清液与5×十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)蛋白上样缓冲液按照体积比4 ∶ 1混合后置于沸水中煮3~5 min。上样完成后在80(20 min)、120 V(60 min)恒定电压条件下电泳。电泳结束后,将目标蛋白转移至聚偏二氟乙烯(PVDF)膜上。室温下,5%的脱脂奶粉封闭4 h,一抗(IκBα,1 ∶ 1 000稀释;NLRP3,1 ∶ 1 500稀释;Caspase-1,1 ∶ 800稀释;IL-1β,1 ∶ 400稀释;β-actin,1 ∶ 5 000稀释)孵育,4 ℃振荡过夜。次日于室温下二抗(goat anti-rabbit IgG,1 ∶ 5 000稀释)孵育1 h,TBST液洗膜(3次,每次10 min)。加入ECL化学发光液,在凝胶成像系统中显影,利用Image-Pro Plus 6.0软件进行量化。
1.4 数据处理与统计分析每组数据重复3次,取平均值。采用SPSS 18.0软件的单因素方差分析程序进行数据分析,并用LSD法进行多重比较,结果以平均值±标准误(mean±SE)的形式表示,P<0.05表示差异显著,P<0.01表示差异极显著。
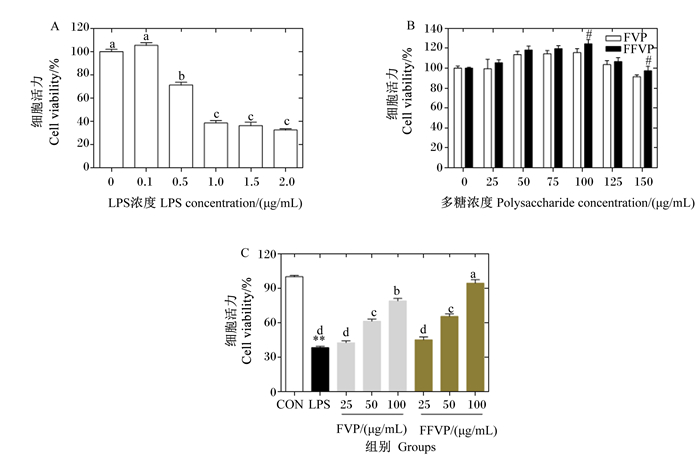
2 结果与分析 2.1 细胞活力LPS对RAW264.7细胞活力的影响如图 1-A所示。相比LPS浓度为0时,LPS浓度等于或超过0.5 μg/mL时细胞活力显著降低(P<0.05);LPS浓度为1.0 μg/mL时细胞活力为LPS浓度为0时的38.52%,再继续升高LPS浓度,细胞活力没有显著变化(P>0.05)。
|
图A:LPS对RAW264.7细胞活力的影响。数据柱标注不同字母表示差异显著(P<0.05)。图B:FVP/FFVP对RAW264.7细胞活力的影响。FFVP组数据柱标注“#”表示与同浓度的FVP组相比差异显著(P<0.05)。图C:FVP/FFVP对LPS诱导RAW264.7细胞活力的影响。LPS组数据柱标注“* *”表示与CON组相比差异极显著(P<0.01)。除CON组外,数据柱标注不同字母表示差异显著(P<0.05)。 Figure A: the effects of LPS on the cell viability of RAW264.7 macrophage. Data columns with different letters mean significant difference (P < 0.05). Figure B: the effects of FVP/FFVP on the cell viability of RAW264.7 macrophage. Data columns of FFVP group with # mean significant difference compared with FVP group at the same concentration (P < 0.05). Figure C: the effects of FVP/FFVP on cell viability of LPS-induced RAW264.7 macrophage. Data columns of LPS group with "* *" mean extremely significant difference compared with the CON group (P < 0.01). Except CON group, data columns with different letters mean significant difference (P < 0.05). 图 1 LPS与FVP/FFVP对RAW264.7细胞活力的影响 Fig. 1 Effects of LPS and FVP/FFVP on cell viability of RAW264.7 |
FVP/FFVP对RAW264.7细胞活力的影响如图 1-B所示。在FVP/FFVP浓度低于100 μg/mL时细胞活力呈升高趋势,并呈剂量依赖性;当FVP/FFVP浓度高于100 μg/mL时细胞活力出现下降趋势,表明FVP和FFVP浓度在100 μg/mL以上时对细胞存在一定毒性作用。浓度为100和150 μg/mL时,FFVP组的细胞活力显著高于FVP组(P<0.05)。因此本研究选取1 μg/mL的LPS和25、50、100 μg/mL的FVP/FFVP进行后续试验。
FVP/FFVP对LPS诱导RAW264.7细胞活力的影响如图 1-C所示。LPS组的细胞活力为CON组的39.41%(P<0.05);与LPS组相比,25 μg/mL FVP/FFVP处理后,细胞活力均无显著变化(P>0.05),50和100 μg/mL FVP/FFVP处理后,细胞活力显著升高(P<0.05);浓度为100 μg/mL时,FFVP组细胞活力显著高于FVP组(P<0.05)。
2.2 ROS和NO含量FVP/FFVP对LPS诱导RAW264.7 ROS和NO含量的影响如图 2所示。相比CON组,LPS组的ROS和NO含量极显著升高(P<0.01);FVP/FFVP处理后,ROS和NO含量出现降低趋势,并呈剂量依赖性。相同浓度下,FFVP组的NO含量均低于FVP组(P>0.05)。浓度为100 μg/mL时,FFVP组的ROS含量显著低于FVP组(P<0.05);其他浓度下,FFVP组的ROS含量均低于FVP组(P>0.05)。
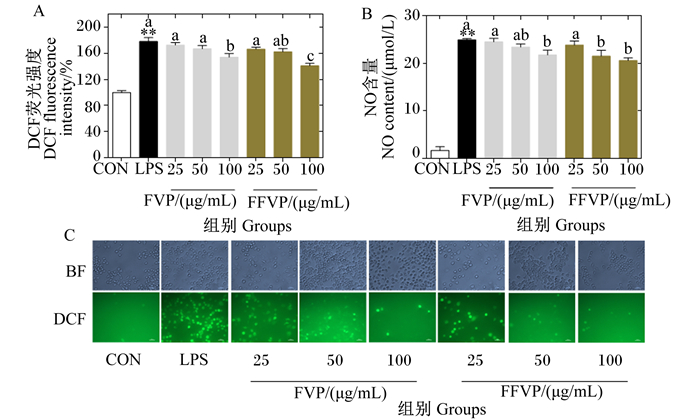
|
图A和图C:FVP/FFVP对LPS诱导RAW264.7 ROS含量的影响;图B:FVP/FFVP对LPS诱导RAW264.7 NO含量的影响。 LPS组数据柱标注“* *”表示与CON组相比差异极显著(P<0.01)。除CON组外,数据柱标注不同字母表示差异显著(P<0.05)。下图同。 Figures A and C: the effects of FVP/FFVP on ROS content in LPS-induced RAW264.7; figure B: the effects of FVP/FFVP on NO content in LPS-induced RAW264.7. Data columns of LPS group with "* *" mean extremely significant difference compared with the CON group (P < 0.01). Except CON group, data columns with different letters mean significant difference (P < 0.05). The same as below. 图 2 FVP/FFVP对LPS诱导RAW264.7 ROS和NO含量的影响 Fig. 2 Effects of FVP/FFVP on ROS and NO contents in LPS-induced RAW264.7 |
FVP/FFVP对LPS诱导RAW264.7吞噬能力(以吞噬指数表示)的影响如图 3所示。相比CON组,LPS组的吞噬能力显著下降(P<0.01),添加FVP和FFVP后,吞噬能力呈升高趋势,存在剂量依赖性,100 μg/mL的FFVP处理细胞后吞噬能力最高。在浓度为50和100 μg/mL时,FFVP组的吞噬能力显著高于FVP组(P<0.05)。
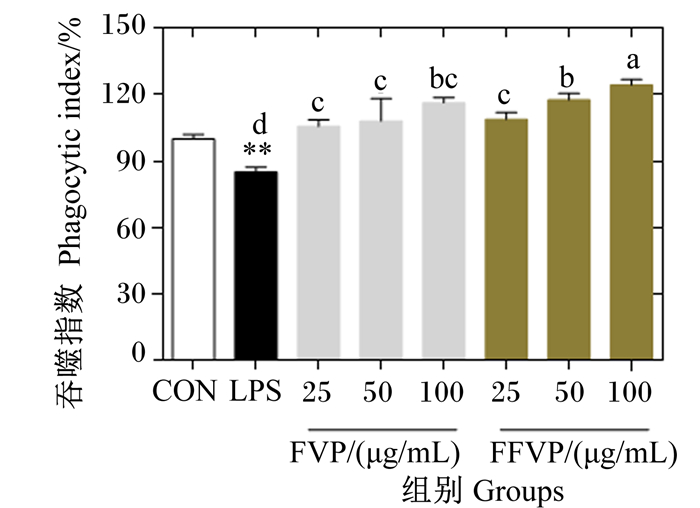
|
图 3 FVP/FFVP对LPS诱导RAW264.7吞噬能力(以吞噬指数表示)的影响 Fig. 3 Effects of FVP/FFVP on phagocytosis phagocytosis ability (shown in phagocytic index) of LPS-induced RAW264.7 |
RAW264.7培养上清液中炎症因子IL-1β、IL-6、IL-18和TNF-α的含量见表 2。与CON组相比,LPS组上清液中上述4种炎症因子的含量均极显著增加(P<0.01),而添加FVP/FFVP后上清液中这4种炎症因子的含量均出现下降趋势,并呈剂量依赖性。在浓度为50 μg/mL时,FFVP组的IL-18含量显著低于FVP组(P<0.05);在浓度为100 μg/mL时,FFVP组的IL-6和TNF-α含量显著低于FVP组(P<0.05)。
|
|
表 2 FVP/FFVP对LPS诱导RAW264.7炎症因子分泌的影响 Table 2 Effects of FVP/FFVP on inflammatory factor secretion of LPS-induced RAW264.7 |
FVP/FFVP对LPS诱导RAW264.7炎症因子基因表达的影响见图 4。与CON组相比,LPS组IL-1β、IL-6、IL-18和TNF-α的mRNA相对表达量极显著升高(P<0.01),添加FVP/FFVP后上述炎症因子的mRNA相对表达量存在下降趋势。FVP和FFVP对IL-1β mRNA相对表达量的影响差异最大,3个浓度下2组间均存在显著差异(P<0.05)。FVP组和FFVP组的IL-18 mRNA相对表达量在浓度为100 μg/mL时差异显著(P<0.05)。
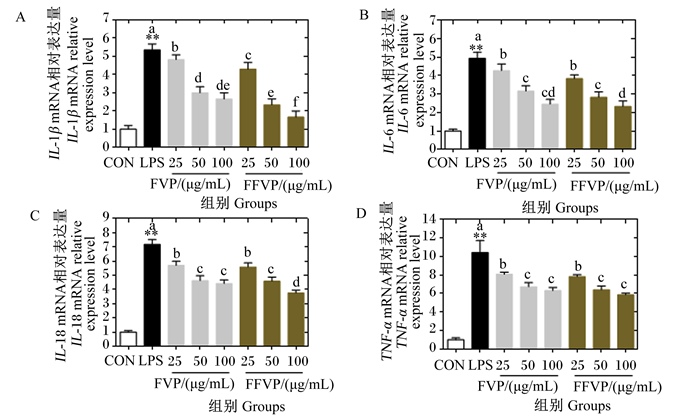
|
图 4 FVP/FFVP对LPS诱导RAW264.7炎症因子基因表达的影响 Fig. 4 Effects of FVP/FFVP on inflammatory factor gene expression of LPS-induced RAW264.7 |
p-IκBα、NLRP3、Caspase-1和IL-1β蛋白表达如图 5所示。相比CON组,LPS组的p-IκBα、NLRP3、Caspase-1和IL-1β的蛋白相对表达量极显著升高(P<0.01)。相比LPS组,单独以BAY11-7082、FVP或FFVP处理后,p-IκBα、NLRP3、Caspase-1和IL-1β的蛋白相对表达量均显著降低(P<0.05)。相比单独以FVP或FFVP处理,同时以BAY11-7082和FVP或FFVP处理后,p-IκBα、NLRP3、Caspase-1和IL-1β的蛋白相对表达量显著降低(P<0.05)。其中,FFVP抑制组与FFVP组p-IκBα、NLRP3、Caspase-1和IL-1β的蛋白相对表达量的比例分别为0.12 ∶ 0.48、0.12 ∶ 0.61、0.08 ∶ 0.47和0.07 ∶ 0.43。相比FVP组,FFVP组的p-IκBα、Caspase-1和IL-1β的蛋白相对表达量均显著降低(P<0.05)。
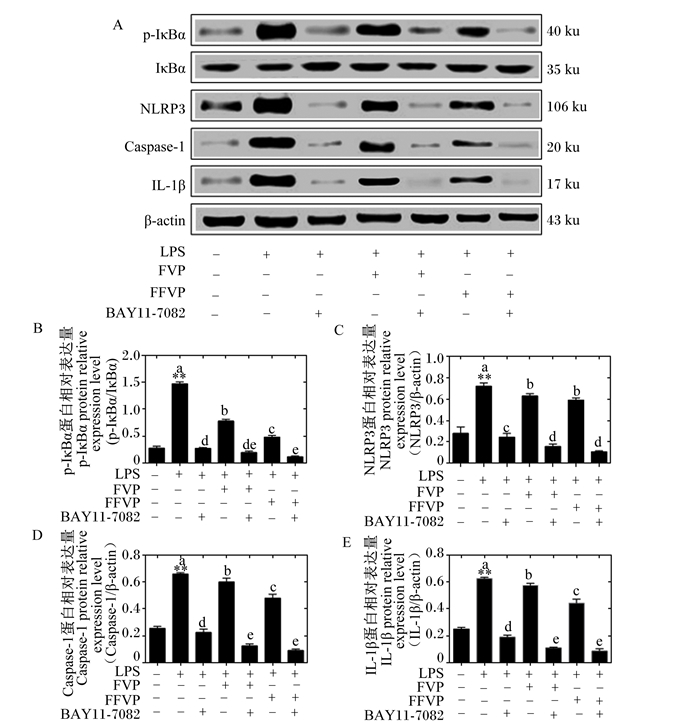
|
p-IκBα:磷酸化核转录因子-κB抑制蛋白α phosphorylated nuclear factor-κB inhibitor α;IκBα:核转录因子-κB抑制蛋白α nuclear factor-κB inhibitor α;NLRP3:NOD样受体家族含pyrin结构域蛋白3 NOD-like receptor family pyrin domain-containing protein 3;Caspase-1:半胱天冬蛋白酶-1 cysteinyl aspartate specific proteinase-1;IL-1β:白细胞介素-1β interleukin-1β;β-actin:β-肌动蛋白;LPS:脂多糖lipopolysaccharide;FVP:金针菇多糖Flammulina velutipes polysaccharide;FFVP:发酵金针菇多糖fermented Flammulina velutipes polysaccharide。 图 5 FVP/FFVP对LPS诱导RAW264.7 p-IκBα、NLRP3、Caspase-1和IL-1β蛋白表达的影响 Fig. 5 Effects of FVP/FFVP on p-IκBα, NLRP3, Caspase-1 and IL-1β protein expression of LPS-induced RAW264.7 |
本研究结果表明,LPS处理RAW264.7后ROS和NO含量极显著升高,吞噬能力极显著降低,IL-1β、IL-6、IL-18和TNF-α含量及其mRNA相对表达量极显著升高;FVP/FFVP处理后,ROS和NO含量以及上述炎症因子的含量和mRNA相对表达量出现降低趋势,吞噬能力呈升高趋势,并呈剂量依赖性。Zhao等[27]研究FVP免疫激活的体内外功能时发现FVP作为一种激活剂可诱导RAW264.7巨噬细胞的M1极化。在动物试验中发现,FVP可以提高小鼠结肠组织免疫调节功能和抗炎活性。苗月[28]研究了FVP对RAW264.7的免疫应答作用,结果表明FVP能显著促进RAW264.7的增殖,提高其吞噬能力,倒置显微镜下观察到FVP处理后RAW264.7的形态由静息变为激活状态,上述研究结果与试验结果一致。
Western blot结果表明,LPS处理RAW264.7后p-IκBα、NLRP3、Caspase-1和IL-1β的蛋白相对表达量极显著升高;相比LPS组,单独以BAY11-7082、FVP或FFVP处理后,p-IκBα、NLRP3、Caspase-1和IL-1β的蛋白相对表达量显著降低;相比单独以FVP或FFVP处理,同时以BAY11-7082和FVP或FFVP处理后,p-IκBα、NLRP3、Caspase-1和IL-1β的蛋白相对表达量显著降低。研究表明,多糖可以通过NF-κB信号通路调控炎症[29]。Shen等[30]研究发现,木槿多糖可以抑制NF-κB信号通路中IκBα和p65的蛋白表达,进而增强RAW264.7的免疫活性。Gan等[31]的研究表明,枸杞多糖通过上调Toll样受体4(TLR4)的蛋白表达来减轻四氯化碳(CCl4)诱导的氧化损伤、炎症反应和NF-κB信号通路的表达。NF-κB信号通路在转录水平上可以启动NLRP3炎症小体[6, 32],其蛋白表达的升高可增强NLRP3蛋白的表达[33]。Li等[34]在小鼠肠道和肠上皮细胞中均检测到NF-κB与NLRP3存在正相关关系。除此之外,多种抗氧化剂都有抑制NF-κB-NLRP3信号通路的作用[35]。ROS的过量产生是导致NF-κB-NLRP3信号通路激活的一个重要原因[36-37]。根据Harijith等[38]的报道,ROS是在线粒体氧化磷酸化过程中由氧还原产生的高活性分子,被认为是NLRP3炎症小体激活的常见触发因素。韩晨阳等[39]研究了樟芝多糖抑制6-羟基多巴胺(6-OHDA)诱导的多巴胺能神经元细胞炎症反应的作用机制,发现樟芝多糖可以通过抑制ROS的分泌降低NF-κB-NLRP3信号通路的活化,进而调节6-OHDA诱导多巴胺能神经元的炎症反应。本研究中,100 μg/mL的FVP/FFVP处理巨噬细胞炎症模型后,ROS含量显著降低,NF-κB-NLRP3信号通路中p-IκBα、NLRP3、Caspase-1和IL-1β的蛋白相对表达量显著降低,与前人研究结果一致。
FVP和FFVP的浓度为25 μg/mL时,FFVP组细胞上清液中IL-6含量显著低于FVP组;浓度为50 μg/mL时,FFVP组的吞噬能力显著高于FVP组,IL-18含量显著低于FVP组;浓度为100 μg/mL时,FFVP组的ROS、TNF-α含量,IL-18 mRNA相对表达量以及IκBα、Caspase-1和IL-1β的蛋白相对表达量显著低于FVP组。本课题组前期研究发现,相比FVP,FFVP呈板状,分子聚集作用增强,单糖组成比例改变,其中甘露糖比例显著升高;同浓度下FFVP的抗氧化活性高于FVP,且浓度越高差异越大[20]。一方面,发酵通过改变FVP的结构增强其抗炎活性。研究报道多糖的抗炎作用与多糖链构象和分子结构等都有关[40]。扫描电镜下FFVP呈板状,说明其分支较多,且聚集键很强[41]。原子力显微镜下FFVP的分子聚合度高于FVP,这是由于羟基的强烈相互作用而产生的[42]。另一方面,发酵通过改变FVP的单糖组成增强其抗炎活性。FFVP中甘露糖比例升高,甘露糖属于功能性糖,具有较高的抗炎活性。吴惠娟等[43]研究了甘露糖对RAW264.7炎症反应的调控及其机制,发现甘露糖可显著抑制LPS诱导的IL-1β、IL-12、TNF-α和IL-6的mRNA及蛋白表达,并抑制丝氨酸/苏氨酸蛋白激酶(AKT)、p65和细胞外信号调节激酶(ERK)磷酸化水平的增加,甘露糖单独处理可抑制AKT、信号转导和转录激活因子3(STAT3)和p65的磷酸化。因此,本研究中FFVP抗炎效果优于FVP的可能原因包括FFVP中多糖链间的强交互作用、多糖分子的高度聚集以及甘露糖比例的升高。
4 结论FVP/FFVP能增强RAW264.7的细胞活力和吞噬能力,降低ROS和NO含量,抑制炎症因子IL-1β、IL-6、IL-18和TNF-α的分泌与基因表达;相同浓度下,FFVP的抗炎效果优于FVP,其可能的机制为通过抑制NF-κB-NLRP3信号通路的激活降低NLRP3炎症小体的活化。
| [1] |
KOSCHMIEDER S, CHATAIN N. Role of inflammation in the biology of myeloproliferative neoplasms[J]. Blood Reviews, 2020, 42: 100711. DOI:10.1016/j.blre.2020.100711 |
| [2] |
WU H T, PANG H Y, CHEN Y P, et al. Anti-inflammatory effect of a polyphenol-enriched fraction from Acalypha wilkesiana on lipopolysaccharide-stimulated RAW 264.7 macrophages and acetaminophen-induced liver injury in mice[J]. Oxidative Medicine and Cellular Longevity, 2018, 2018: 7858094. |
| [3] |
CHEN L P, SHEN X R, CHEN G H, et al. A comparative study of the effects upon LPS induced macrophage RAW264.7 inflammation in vitro of the lipids of Hippocampus trimaculatus leach[J]. Journal of Oleo Science, 2015, 64(12): 1273-1281. DOI:10.5650/jos.ess15190 |
| [4] |
YE Y Z, JIN T, ZHANG X, et al. Meisoindigo protects against focal cerebral ischemia-reperfusion injury by inhibiting NLRP3 inflammasome activation and regulating microglia/macrophage polarization via TLR4/NF-κB signaling pathway[J]. Frontiers in Cellular Neuroscience, 2019, 13: 553. DOI:10.3389/fncel.2019.00553 |
| [5] |
YANG F, CHEN R, LI W Y, et al. D-limonene is a potential monoterpene to inhibit PI3K/Akt/IKK-α/NF-κB p65 signaling pathway in coronavirus disease 2019 pulmonary fibrosis[J]. Frontiers in Medicine, 2021, 8: 591830. DOI:10.3389/fmed.2021.591830 |
| [6] |
HE Y, HARA H, NÚÑEZ G. Mechanism and regulation of NLRP3 inflammasome activation[J]. Trends in Biochemical Sciences, 2016, 41(12): 1012-1021. DOI:10.1016/j.tibs.2016.09.002 |
| [7] |
HOU B H, ZHANG Y H, LIANG P Y, et al. Inhibition of the NLRP3-inflammasome prevents cognitive deficits in experimental autoimmune encephalomyelitis mice via the alteration of astrocyte phenotype[J]. Cell Death & Disease, 2020, 11(5): 377. |
| [8] |
马丹丹, 汪雯翰, 贾薇, 等. 食用菌多糖作为添加剂在养殖业中的应用[J]. 上海农业学报, 2017, 33(3): 166-170. MA D D, WANG W H, JIA W, et al. Application of edible fungus polysaccharide as additives in farming practices[J]. Acta Agriculturae Shanghai, 2017, 33(3): 166-170 (in Chinese). |
| [9] |
JIA W, FENG J, ZHANG J S, et al. Structural characteristics of the novel polysaccharide FVPA1 from winter culinary-medicinal mushroom, Flammulina velutipes (Agaricomycetes), capable of enhancing natural killer cell activity against K562 tumor cells[J]. International Journal of Medicinal Mushrooms, 2017, 19(6): 535-546. DOI:10.1615/IntJMedMushrooms.v19.i6.50 |
| [10] |
KAMASUKA T, MOMOKI Y, SAKAI S. Antitumor activity of polysaccharide fractions prepared from some strains of Basidiomycetes[J]. Gan, 1968, 59(5): 443-445. |
| [11] |
张剑, 弓志青, 贾凤娟, 等. 金针菇多糖制备过程中体外抗氧化活性研究[J]. 食品研究与开发, 2018, 39(12): 1-5. ZHANG J, GONG Z Q, JIA F J, et al. Study on the antioxidant activity of Flammulina velutipes polysaccharides during the preparation process[J]. Food Research and Development, 2018, 39(12): 1-5 (in Chinese). DOI:10.3969/j.issn.1005-6521.2018.12.001 |
| [12] |
HAO Y T, WANG X D, YUAN S J, et al. Flammulina velutipes polysaccharide improves C57BL/6 mice gut health through regulation of intestine microbial metabolic activity[J]. International Journal of Biological Macromolecules, 2021, 167: 1308-1318. DOI:10.1016/j.ijbiomac.2020.11.085 |
| [13] |
刘肖肖, 汪雯翰, 冯婷, 等. 金针菇子实体多糖FVPB1对小鼠T细胞和巨噬细胞的免疫调节作用[J]. 食用菌学报, 2019, 26(4): 123-130. LIU X X, WANG W H, FENG T, et al. Immunoregulatory effect of homogeneous polysaccharide FVPB1 from fruiting body of Flammulina velutipes on mouse T cells and macrophages[J]. Acta Edulis Fungi, 2019, 26(4): 123-130 (in Chinese). |
| [14] |
YAN Z F, LIU N X, MAO X X, et al. Activation effects of polysaccharides of Flammulina velutipes mycorrhizae on the T lymphocyte immune function[J]. Journal of Immunology Research, 2014, 2014: 285421. |
| [15] |
ZHAO R Q, JI Y, CHEN X, et al. Effects of a β-type glycosidic polysaccharide from Flammulina velutipes on anti-inflammation and gut microbiota modulation in colitis mice[J]. Food & Function, 2020, 11(5): 4259-4274. |
| [16] |
汤亚杰, 钟建江. 高等真菌深层发酵生产有用生物活性物质[J]. 华东理工大学学报(自然科学版), 2001, 27(6): 704-711. TANG Y J, ZHONG J J. Submerged fermentation of higher fungi for production of valuable bioactive metabolites[J]. Journal of East China University of Science and Technology (Natural Science Edition), 2001, 27(6): 704-711 (in Chinese). DOI:10.3969/j.issn.1006-3080.2001.06.028 |
| [17] |
CHEUNG P C K. The hypocholesterolemic effect of extracellular polysaccharide from the submerged fermentation of mushroom[J]. Nutrition Research, 1996, 16(11/12): 1953-1957. |
| [18] |
曾璇竹, 雷于国, 胡国元, 等. 富硒香菇多糖发酵工艺的优化及其抗氧化活性[J]. 食品工业科技, 2018, 39(17): 186-192. ZENG X Z, LEI Y G, HU G Y, et al. Optimization of fermentation process and antioxidant activity of polysaccharide from se-enriched Lentinula edodes[J]. Science and Technology of Food Industry, 2018, 39(17): 186-192 (in Chinese). |
| [19] |
刘自尧, 屈青松, 杨芳, 等. 槐耳-板蓝根双向发酵过程中成分含量的变化及菌质抗炎活性研究[J]. 环球中医药, 2019, 12(12): 1799-1804. LIU Z Y, QU Q S, YANG F, et al. Study on changes of component content and antibacterial activity of mycoplasma in bi-directional fermentation process of Huaier and Radix isatidis[J]. Global Traditional Chinese Medicine, 2019, 12(12): 1799-1804 (in Chinese). DOI:10.3969/j.issn.1674-1749.2019.12.006 |
| [20] |
马升, 沈城, 徐建雄. 发酵金针菇菇根多糖提取、结构及抗氧化活性[J]. 食品科技, 2021, 46(3): 147-154. MA S, SHEN C, XU J X. Extraction, structure and antioxidant activity of polysaccharide from fermented Flammulina velutipes root[J]. Food Science and Technology, 2021, 46(3): 147-154 (in Chinese). |
| [21] |
GHASHGHAEINIA M, TOULANY M, SAKI M, et al. The NFκB pathway inhibitors Bay 11-7082 and parthenolide induce programmed cell death in anucleated erythrocytes[J]. Cellular Physiology and Biochemistry, 2011, 27(1): 45-54. DOI:10.1159/000325204 |
| [22] |
LI Y X, YIN P Y, WU K, et al. Self-assembly of a multi-functional hydrogel from a branched peptide amphiphile and its effects on bone marrow mesenchymal stem cells[J]. Journal of Biomaterials and Tissue Engineering, 2020, 10(12): 1731-1737. DOI:10.1166/jbt.2020.2492 |
| [23] |
李艳红, 高志玲, 马金姝. 藜芦酸抑制LPS刺激的RAW264.7细胞中NO表达的研究[J]. 中国免疫学杂志, 2014, 30(3): 326-329. LI Y H, GAO Z L, MA J S. Regulatory effect of veratric acid on NO production in LPS-stimulated RAW 264.7 macrophage cells[J]. Chinese Journal of Immunology, 2014, 30(3): 326-329 (in Chinese). DOI:10.3969/j.issn.1000-484X.2014.03.008 |
| [24] |
BAEK S H, PARK T, KANG M G, et al. Anti-inflammatory activity and ROS regulation effect of sinapaldehyde in LPS-stimulated RAW 264.7 macrophages[J]. Molecules, 2020, 25(18): 4089. DOI:10.3390/molecules25184089 |
| [25] |
ZHENG Y R, TIAN C Y, FAN C L, et al. Sheng-Mai yin exerts anti-inflammatory effects on RAW 264.7 cells and zebrafish[J]. Journal of Ethnopharmacology, 2021, 267: 113497. DOI:10.1016/j.jep.2020.113497 |
| [26] |
ZHANG Q, MAO Z J, SUN J. NF-κB inhibitor, BAY11-7082, suppresses M2 tumor-associated macrophage induced EMT potential via miR-30a/NF-κB/Snail signaling in bladder cancer cells[J]. Gene, 2019, 710: 91-97. DOI:10.1016/j.gene.2019.04.039 |
| [27] |
ZHAO R Q, FANG D L, JI Y, et al. In vitro and in vivo functional characterization of an immune activation Flammulina velutipes polysaccharide based on gut microbiota regulation[J]. Food and Agricultural Immunology, 2020, 31(1): 667-686. DOI:10.1080/09540105.2020.1754345 |
| [28] |
苗月. 金针菇多糖通过TLR4和MR介导的MAPK/NF-κB通路诱导RAW264.7细胞免疫应答[D]. 硕士学位论文. 长春: 吉林农业大学, 2018. MIAO Y. Flammulina velutipes polysaccharide induce immune response in RAW264.7 cells through TLR4 and MR-mediated MAPK/NF-κB pathway[D]. Master's Thesis. Changchun: Jilin Agricultural University, 2018. (in Chinese) |
| [29] |
HAN J, LIU L X, YU N, et al. Polysaccharides from Acanthopanax senticosus enhances intestinal integrity through inhibiting TLR4/NF-κB signaling pathways in lipopolysaccharide-challenged mice[J]. Animal Science Journal, 2016, 87(8): 1011-1018. DOI:10.1111/asj.12528 |
| [30] |
SHEN C Y, ZHANG W L, JIANG J G. Immune-enhancing activity of polysaccharides from Hibiscus sabdariffa Linn. via MAPK and NF-kB signaling pathways in RAW264.7 cells[J]. Journal of Functional Foods, 2017, 34: 118-129. DOI:10.1016/j.jff.2017.03.060 |
| [31] |
GAN F, LIU Q, LIU Y H, et al. Lycium barbarum polysaccharides improve CCl4-induced liver fibrosis, inflammatory response and TLRs/NF-kB signaling pathway expression in wistar rats[J]. Life Sciences, 2018, 192: 205-212. DOI:10.1016/j.lfs.2017.11.047 |
| [32] |
ABAIS J M, XIA M, ZHANG Y, et al. Redox regulation of NLRP3 inflammasomes: ROS as trigger or effector?[J]. Antioxidants & Redox Signaling, 2015, 22(13): 1111-1129. |
| [33] |
CHEN L, YOU Q, HU L, et al. The antioxidant procyanidin reduces reactive oxygen species signaling in macrophages and ameliorates experimental colitis in mice[J]. Frontiers in Immunology, 2017, 8: 1910. |
| [34] |
LI Y, LIU M F, ZUO Z Y, et al. TLR9 regulates the NF-κB-NLRP3-IL-1β pathway negatively in Salmonella-induced NKG2D-mediated intestinal inflammation[J]. The Journal of Immunology, 2017, 199(2): 761-773. DOI:10.4049/jimmunol.1601416 |
| [35] |
CHTOUROU Y, KAMOUN Z, ZARROUK W, et al. Naringenin ameliorates renal and platelet purinergic signalling alterations in high-cholesterol fed rats through the suppression of ROS and NF-κB signaling pathways[J]. Food & Function, 2016, 7(1): 183-193. |
| [36] |
PÉTRILLI V, PAPIN S, DOSTERT C, et al. Activation of the NALP3 inflammasome is triggered by low intracellular potassium concentration[J]. Cell Death and Differentiation, 2007, 14(9): 1583-1589. DOI:10.1038/sj.cdd.4402195 |
| [37] |
ELLIOTT E I, SUTTERWALA F S. Initiation and perpetuation of NLRP3 inflammasome activation and assembly[J]. Immunological Reviews, 2015, 265(1): 35-52. DOI:10.1111/imr.12286 |
| [38] |
HARIJITH A, EBENEZER D L, NATARAJAN V. Reactive oxygen species at the crossroads of inflammasome and inflammation[J]. Frontiers in Physiology, 2014, 5: 352. |
| [39] |
韩晨阳, 官俏兵, 郭丽, 等. 樟芝多糖抑制6-OHDA诱导的多巴胺能神经元细胞炎症反应的作用机制研究[J]. 中国现代应用药学, 2019, 36(2): 172-177. HAN C Y, GUAN Q B, GUO L, et al. Study on mechanism of Antrodia camphorata polysaccharide inhibits inflammatory response of dopaminergic neurons cells induced by 6-OHDA[J]. Chinese Journal of Modern Applied Pharmacy, 2019, 36(2): 172-177 (in Chinese). |
| [40] |
FERREIRA S S, PASSOS C P, MADUREIRA P, et al. Structure-function relationships of immunostimulatory polysaccharides: a review[J]. Carbohydrate Polymers, 2015, 132: 378-396. DOI:10.1016/j.carbpol.2015.05.079 |
| [41] |
ZHENG Y F, ZHANG S, WANG Q, et al. Characterization and hypoglycemic activity of a β-pyran polysaccharides from bamboo shoot (Leleba oldhami Nakal) shells[J]. Carbohydrate Polymers, 2016, 144: 438-446. DOI:10.1016/j.carbpol.2016.02.073 |
| [42] |
GIANNOTTI M I, RINAUDO M, VANCSO G J. Force spectroscopy of hyaluronan by atomic force microscopy: from hydrogen-bonded networks toward single-chain behavior[J]. Biomacromolecules, 2007, 8(9): 2648-2652. DOI:10.1021/bm700592j |
| [43] |
吴惠娟, 韦曲星, 张盛昔, 等. 甘露糖对巨噬细胞炎症反应的双向调节作用[J]. 中山大学学报(医学科学版), 2020, 41(4): 549-557. WU H J, WEI Q X, ZHANG S X, et al. Dual-directional regulation effects of mannose on inflammatory response of macrophages[J]. Journal of Sun Yat-sen University (Medical Sciences), 2020, 41(4): 549-557 (in Chinese). |




