2. 中国热带农业科学院热带作物品种资源研究所, 儋州 571737
2. Institute of Tropical Crop Variety Resources, Chinese Academy of Tropical Agricultural Sciences, Danzhou 571737, China
随着现代集约化养殖业的快速发展以及生猪养殖规模不断扩大,早期断奶技术大规模应用,仔猪断奶时由于饲粮、免疫、生理等因素的变化,都会导致仔猪受到不同程度的应激[1]。肝脏是机体发挥脂质代谢[2]、免疫防御[3]等功能的重要器官。当仔猪处于氧化应激状态下时,体内活性氧大量产生,从而导致机体损伤,抗氧化系统失衡[4]。肠道屏障破坏、免疫功能异常、肠道菌群失调、肝脏线粒体损伤等问题接踵而来,致使仔猪腹泻率、死亡率上升[5-6]。因此,探索一种高效、安全的天然抗氧化剂对于提升养殖业经济效益而言尤为重要。
白藜芦醇(resveratrol,RES)属于二苯乙烯家族,这种植物多酚主要存在于葡萄、花生、浆果、茶叶等植物中,是许多植物受到刺激时分泌的一种抗毒素[7]。大量的研究结果表明,RES具有抗氧化、抗炎、抗癌、心血管保护作用及脂肪沉积调控等广泛的生物学功能[8-12]。本课题组前期研究表明,RES可通过提高氧化应激仔猪回肠抗氧化酶活性,改善回肠黏膜形态结构,抑制肠道炎症的发生,从而达到对仔猪氧化应激的缓解作用[13],对其平均日增重(ADG)及平均日采食量(ADFI)也有显著提升的效果[14]。一些研究表明,RES通过清除自由基及作用于多个细胞靶点,如核因子E2相关因子2(Nrf2)、去乙酰化酶1(SIRT1)和腺苷酸活化蛋白激酶(AMPK),控制氧化应激相关的过程和信号通路,在各种应激条件下对肝脏氧化损伤具有保护作用[15-16],但RES发挥其抗氧化作用的具体分子机制尚不明确。另外,RES可通过调节Nrf2/血红素加氧酶-1(HO-1)/NADPH醌氧化还原酶1(NQO1)信号通路及SIRT1/AMPK/过氧化物酶体增殖活化受体γ辅激活因子-1α(PGC-1α)信号通路来缓解小鼠肾脏衰老导致的炎症[17]。Kelch样ECH关联蛋白1(Keap1)/Nrf2/抗氧化反应元件(ARE)信号通路作为内源性抗氧化应答机制信号通路之一,在氧化应激中占有重要的地位。当细胞受到氧化应激时,Keap1负性调控Nrf2的转录活性,Nrf2与其抑制蛋白Keap1发生解离,转移到细胞核中,进而促进其靶基因表达,如NQO1、HO-1、超氧化物歧化酶1(SOD1)和超氧化物歧化酶2(SOD2)等[18-20]。
目前,RES的研究主要集中在畜禽生长性能、繁殖性能、免疫调节、抗氧化性能等方面。其中,抗氧化性能的研究主要集中在对于仔猪肠道炎症的减轻、肠道菌群的调节以及维持肠黏膜完整性等方面,而对于仔猪肝脏炎症的缓解作用则鲜有报道[21-22]。因此,本研究拟在正常饲养条件下,通过腹腔注射敌草快(diquat)建立仔猪氧化应激模型,验证并比较不同剂量的RES对断奶仔猪肝脏抗氧化酶及细胞因子mRNA表达、Keap1/Nrf2/ARE信号通路的影响,探讨RES对肝脏炎症的缓解作用,以期为RES作为仔猪饲料添加剂的合理使用提供数据支撑。
1 材料与方法 1.1 试验材料RES购于上海某生物科技有限公司,纯度98%;diquat购于Sigma公司;qPCR试剂盒、反转录试剂盒与RNA提取试剂盒均购于南京诺唯赞生物有限公司。Keap1和Nrf2抗体购自艾博抗(上海)贸易有限公司,NQO1和猪甘油醛-3-磷酸脱氢酶(GAPDH)抗体购自武汉三鹰生物技术有限公司。蛋白酶抑制剂及匀浆缓冲液分别购自武汉博士德生物工程有限公司和上海碧云天生物技术有限公司。
1.2 试验动物与试验设计选取健康状况良好、胎次相近的28日龄“杜×长×大”三元杂交断奶仔猪30头,根据体重相近及公母各占1/2原则随机分为5组,分别为对照组(CON组)、diquat组(DIQ组)和试验组(RES-10组、RES-30组、RES-90组),每组6个重复,每个重复1头仔猪。CON组和DIQ组仔猪饲喂基础饲粮,试验组仔猪饲喂在基础饲粮中分别添加10、30、90 mg/kg RES的试验饲粮。试验期共21 d,于试验第15天清晨给除CON组以外的仔猪腹腔注射10 mg/kg BW剂量的diquat溶液,建立氧化应激模型,CON组腹腔注射等量灭菌生理盐水为参照。成功建立氧化应激模型后再继续饲喂7 d,于第22天清晨屠宰,采集肝脏样品。
1.3 试验饲粮与饲养管理基础饲粮参照NRC(2012)仔猪营养需要进行配制,其组成及营养水平见表 1。按照试验设计,在基础饲粮中添加相应剂量的RES配制试验饲粮。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
本试验在中国热带农业科学院热带作物品种资源研究所畜牧基地开展,动物饲养试验开展期间所有仔猪自由采食和饮水,每天饲喂3次。另外,保证仔猪于良好的环境中饲养,每天打扫圈舍、通风换气并定期进行消毒,消毒免疫程序按照猪场常规方法进行。
1.4 样品采集与处理所有仔猪禁食12 h后,于试验第22天清晨将所有仔猪颈静脉放血处死。仔猪屠宰后,迅速分离出肝脏,在肝脏同一叶上固定位置取肝脏样本装入冻存管中,编号,放入液氮速冻,采样结束后于-80 ℃冰箱保存。
1.5 测定指标与方法 1.5.1 肝脏抗氧化酶、细胞因子mRNA表达测定采用实时荧光定量PCR检测肝脏SOD1、SOD2、谷胱甘肽过氧化物酶-1(GPX-1)、过氧化氢酶(CAT)、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、白细胞介素-10(IL-10)、Keap1、Nrf2、NQO1 mRNA相对表达量。引物设计是从NCBI下载已登录的GAPDH、SOD1、SOD2、GPX-1、CAT、IL-1β、IL-6、TNF-α、IL-10、Keap1、Nrf2、NQO1的基因序列,用Primer Premier 5.0软件设计引物,引物序列参见表 2。由广州天一辉远基因科技有限公司合成引物。
|
|
表 2 引物序列 Table 2 Primer sequences |
使用RNAiso Plus试剂盒提取肝脏组织总RNA,利用超微量分光光度计测定仪检测RNA纯度,采用琼脂糖凝胶电泳鉴定RNA的完整性,之后保存于-80 ℃备用。使用HiScript Ⅲ RT SuperMix for qPCR试剂盒合成cDNA,并于-20 ℃保存备用。以反转录的cDNA为模板扩增基因,进行实时荧光定量PCR检测,每个样品做3个重复。反应体系(10 μL):2×ChamQ Universal SYBR qPCR Master Mix 5 μL,Primer 0.4 μL,Template DNA/cDNA 0.6 μL,ddH2O 4 μL。反应程序:95 ℃ 30 s,95 ℃ 10 s,56 ℃ 30 s,72 ℃ 30 s(40个循环);熔解曲线95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s。以GAPDH为内参,采用2-ΔΔCt法计算目的基因mRNA相对表达量。
1.5.2 肝脏Nrf2信号通路蛋白表达测定首先使用匀浆机从40 mg左右的冷冻肝脏中提取蛋白质,含1%蛋白酶抑制剂的RIPA裂解液作为匀浆介质。使用BCA蛋白质浓度测定试剂盒测定蛋白质浓度,并用磷酸盐缓冲液(PBS)将每组蛋白稀释定量,确保每组的蛋白浓度在同一水平。将变性后的蛋白以30 μg总蛋白的上样量进行十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳,电泳结束后转移至聚偏氟乙烯(PVDF)膜上。在室温下用封闭缓冲液(5%脱脂奶粉)封闭膜1 h,然后将膜在含0.5‰ Tween 20的Tris-HCl缓冲盐溶液(TBST)中洗涤3次,并与一抗孵育1.5 h或过夜。接着再次将膜用TBST洗涤3次并与二抗孵育1 h(稀释度1 ∶ 2 000)。用发光图像分析仪ChampChemi系统(北京赛智创业科技有限公司)拍摄照片,并通过Image J软件进行量化分析。
1.6 数据统计分析试验数据经Excel 2016进行初步整理与统计,采用SPSS 26.0软件进行单因素方差分析(one-way ANOVA)和Waller-Duncan多重比较,结果以平均值±标准差(SD)表示,以P<0.05作为显著性判断标准, 0.05<P<0.10则作为有变化趋势判断标准。
2 结果与分析 2.1 RES对氧化应激仔猪肝脏抗氧化酶mRNA相对表达量的影响由表 3可知,与CON组相比,DIQ组肝脏SOD1、SOD2、GPX-1和CAT的mRNA相对表达量均显著降低(P<0.05)。与DIQ组相比,RES-10组、RES-30组、RES-90组肝脏SOD1、SOD2、GPX-1和CAT的mRNA相对表达量均显著上升(P<0.05),且RES-10组、RES-30组、RES-90组与对照组相比差异不显著(P>0.05),3个试验组间差异同样不显著(P>0.05)。
|
|
表 3 RES对氧化应激仔猪肝脏抗氧化酶mRNA相对表达量的影响 Table 3 Effects of resveratrol on mRNA relative expression levels of antioxidant enzyme of liver in oxidative stress piglets (n=3) |
由表 4可知,与CON组相比,DIQ组肝脏IL-1β、IL-6、TNF-α的mRNA相对表达量均显著升高(P<0.05),IL-10的mRNA相对表达量显著降低(P<0.05)。与DIQ组相比,RES-30和RES-90组肝脏IL-1β、IL-6、TNF-α的mRNA相对表达量均显著降低(P<0.05),其中RES-90组与CON组无显著差异(P>0.05)。另外,与DIQ组相比,RES-30组和RES-90组肝脏IL-10的mRNA相对表达量显著升高(P<0.05),且RES-90组同样与CON组无显著差异(P>0.05)。
|
|
表 4 RES对氧化应激仔猪肝脏细胞因子mRNA相对表达量的影响 Table 4 Effects of resveratrol on mRNA relative expression levels of cytokine of liver in oxidative stress piglets (n=3) |
由表 5可知,与CON组相比,DIQ组中肝脏Nrf2、NQO1的mRNA相对表达量均显著降低(P<0.05),Keap1的mRNA相对表达量显著升高(P<0.05)。与DIQ组相比,RES-10组、RES-30组和RES-90组肝脏Nrf2、NQO1的mRNA相对表达量均显著升高(P<0.05),且RES-90组与CON组无显著差异(P>0.05)。另外,RES-30组和RES-90组肝脏Keap1的mRNA相对表达量显著降低(P<0.05),且RES-90组与CON组无显著差异(P>0.05)。
|
|
表 5 RES对氧化应激仔猪肝脏Keap1、Nrf2、NQO1 mRNA相对表达量的影响 Table 5 Effects of resveratrol on mRNA relative expression levels of Keap1, Nrf2 and NQO1 of liver in oxidative stress piglets |
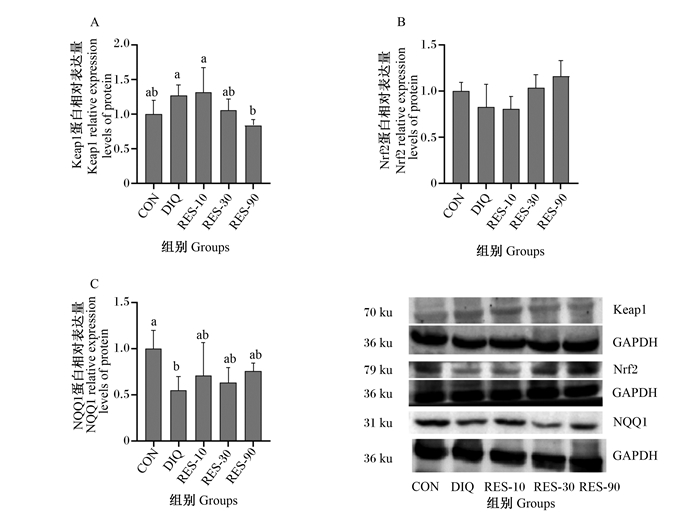
由图 1-A可知,与CON组相比,DIQ组中Keap1蛋白表达量有上升的趋势(P=0.075);图 1-B显示,Nrf2蛋白表达量各组间差异不显著(P>0.05)。图 1-C中NQO1蛋白表达量显著下降(P<0.05)。与DIQ组相比,RES-90组Keap1蛋白表达量显著降低(P<0.05);Nrf2、NQO1蛋白表达量在RES-10组、RES-30组、RES-90组间差异均不显著(P>0.05)。
|
Keap1: Kelch样ECH关联蛋白1 Kelch-like ECH-associated protein 1; Nrf2: 核因子E2相关因子2 nuclear factor erythroid 2 related factor 2; NQO1: NADPH醌氧化还原酶1 NADPH 1 quinone oxidoreductase 1; GAPDH: 甘油醛-3-磷酸脱氢glyceraldehyde-3-phosphate。 数据柱标注不同小写字母表示差异显著(P<0.05)。 Value columns with different small letters mean significant difference (P < 0.05). 图 1 RES对氧化应激仔猪肝脏Keap1、Nrf2、NQO1蛋白表达量的影响 Fig. 1 Effects of resveratrol on expression levels of Keap1, Nrf2 and NQO1 protein of liver in oxidative stress piglets |
diquat是一种联吡啶除草剂,可以利用分子氧生成超氧阴离子自由基,暴露于diquat攻击下的家畜体内活性氧快速产生,导致组织发生氧化损伤,其中肝脏已被证明是diquat诱导氧化应激的主要靶器官[23]。本试验通过对断奶仔猪抗氧化酶基因、细胞因子基因以及Nrf2信号通路相关蛋白等指标的测定,明确了腹腔注射diquat对断奶仔猪肝脏具有氧化损伤的作用,成功建立了氧化应激模型。
肝脏可通过多种抗氧化机制应对机体氧化应激,其中CAT、SOD、GPX-1等抗氧化酶,可以及时清除自由基,保护机体免受氧化损伤。由于肝脏抗氧化系统通常在动物幼龄期不成熟,仔猪难以应对较严重的氧化应激[1]。因此,补充抗氧化剂成为一种可行的治疗策略,以使肝脏氧化损伤和疾病的风险最小化[24]。Cheng等[8]研究表明,在宫内发育迟缓(IUGR)仔猪饲粮中添加80 mg/kg RES显著降低了丙二醛(MDA)含量,提高了过氧化氢酶(CAT)以及谷胱甘肽(GSH)活性,同时显著上调了肝脏GPX-1的mRNA表达水平。Zhuang等[16]研究表明,在暴露于500 μmol/L过氧化氢(H2O2)应激猪小肠上皮细胞(IPEC-J2)中分别添加0、20、50 μmol/L的RES,其SOD1、CAT、GPX-1的mRNA相对表达量均显著上调,其中以50 μmol/L RES效果最佳。魏思宇等[25]研究结果表明,在断奶仔猪基础饲粮中添加300 mg/kg RES上调了仔猪胰腺CAT、SOD1、GSH-Px的mRNA相对表达量。本试验结果表明,在氧化应激状态下的仔猪饲粮中分别添加10、30、90 mg/kg RES,对其肝脏SOD1、SOD2、CAT、GPX-1的mRNA相对表达量均显著上调。这与前人研究结果相似,即适量的RES增强了氧化应激仔猪肝脏抗氧化物酶基因表达水平,从而增强抗氧化能力。
诸多研究表明,细胞因子在仔猪氧化应激过程中起着重要作用,其中包括TNF-α、IL-6、IL-1β、IL-10等,核转录因子-κB (NF-κB)则是调控此类细胞因子基因表达的关键信号通路之一,其激活增强了促炎基因的表达[26]。且已有研究表明,RES可通过促进磷脂酰肌醇-3-激酶/蛋白激酶B/哺乳动物雷帕霉素靶蛋白(PI3K/AKT/mTOR)信号通路和抑制NF-κB信号通路抑制细胞因子的过度产生而减轻炎症反应[27]。Zhao等[28]研究表明,在肠缺血再灌注损伤诱导(IIR)处理下,经15 mg/kg RES预处理5 d的大鼠,其肠黏膜TNF-α、IL-1β、IL-18含量显著下降;进一步评估NOD样受体蛋白3(NLRP3)、半胱天冬酶-1 p20(caspase-1 p20)、白细胞介素-1β p17(IL-1β p17)和白细胞介素-18(IL-18)的肠黏膜蛋白表达量发现,经RES预处理的大鼠其细胞因子蛋白表达量均显著下降。Yu等[29]研究发现,在腹腔注射四氯化碳溶液(CCl4)诱导小鼠肝纤维化的条件下,在CCl4溶液中添加400 mg/kg RES治疗显著上调内源性IL-10基因的表达,并促进巨噬细胞重编程为抗炎白细胞介素-4表型。而Toll样受体激活的巨噬细胞产生的IL-10是炎症的关键调节因子,与炎症消退过程密不可分[30]。本研究结果表明,在氧化应激仔猪饲粮中分别添加30及90 mg/kg RES显著下调了IL-1β、IL-6、TNF-α mRNA相对表达量,且以90 mg/kg RES添加量组下调效果最为显著;同时,RES-30组、RES-90组IL-10的mRNA相对表达量显著上调。此结果与前人研究结果相似,即RES可通过抑制细胞因子表达,缓解肝脏炎症反应。
为了进一步探究RES对diquat诱导仔猪肝脏氧化应激的保护机制,本试验对仔猪肝脏Nrf2信号通路相关mRNA相对表达量及蛋白表达量进行了测定。Keap1/Nrf2/ARE信号通路是细胞内重要的抗氧化应答机制之一,RES作为Nrf2信号通路的激活剂,被报道具有促进Nrf2转录活性的功能[17]。大鼠体内试验表明,RES显著增加了其肾脏Nrf2及其抗氧化反应原件HO-1、NQO1、SOD1、SOD2的蛋白表达量,同时降低了Keap1的蛋白表达量[17]。Zhang等[31]研究结果显示,RES增加了氧化应激仔猪肝脏Nrf2蛋白表达量,同时上调了其HO-1的mRNA相对表达量。本试验研究结果表明,在仔猪氧化应激状态下,RES-30组与RES-90组仔猪肝脏Keap1的mRNA相对表达量均显著下调,其中以RES-90组效果最为显著,RES-30组和RES-90组仔猪肝脏Keap1蛋白表达量显著下降,同样以RES-90组效果最优;同时,随着RES添加剂量的增加,Nrf2的mRNA相对表达量显著上调,且RES-90组与CON组无显著差异,Nrf2蛋白表达量相比DIQ组有上升的趋势;另外,在仔猪氧化应激状态下,RES-10组、RES-30组、RES-90组NQO1的mRNA相对表达量及蛋白表达量均显著增加。本试验表现出与前人相似的结果,初步证实了RES通过提高Nrf2的mRNA相对表达量及蛋白表达量、减少Keap1的mRNA相对表达量及蛋白表达量,进而促进下游抗氧化相关基因如NQO1、SOD1、SOD2、CAT及GPX-1的表达,从而达到增强仔猪肝脏抗氧化能力、减轻炎症的作用。但RES发挥抗氧化分子机制还需进一步研究探讨。
4 结论diquat应激可导致断奶仔猪肝脏抗氧化、抗炎性能显著降低。饲粮中添加RES可有效提高断奶仔猪肝脏抗氧化和抗炎能力,且以添加量为90 mg/kg时效果较好。
| [1] |
YIN J, WU M M, XIAO H, et al. Development of an antioxidant system after early weaning in piglets[J]. Journal of Animal Science, 2014, 92(2): 612-619. DOI:10.2527/jas.2013-6986 |
| [2] |
FOUFELLE F, FERRÉ P. New perspectives in the regulation of hepatic glycolytic and lipogenic genes by insulin and glucose: a role for the transcription factor sterol regulatory element binding protein-1c[J]. Biochemical Journal, 2002, 366(Pt.2): 377-391. |
| [3] |
SCHMÖCKER C, WEYLANDT K H, KAHLKE L, et al. Omega-3 fatty acids alleviate chemically induced acute hepatitis by suppression of cytokines[J]. Hepatology, 2007, 45(4): 864-869. DOI:10.1002/hep.21626 |
| [4] |
NOVAIS A K, DESCHÊNE K, MARTEL-KENNES Y, et al. Weaning differentially affects mitochondrial function, oxidative stress, inflammation and apoptosis in normal and low birth weight piglets[J]. PloS One, 2021, 16(2): e0247188. DOI:10.1371/journal.pone.0247188 |
| [5] |
易宏波, 唐青松, 侯磊, 等. 断奶仔猪肠道健康分级及其无抗营养策略[J]. 动物营养学报, 2020, 32(10): 4501-4517. YI H B, TANG Q S, HOU L, et al. Antibiotic-free nutritional strategies based on intestinal health grade classification of weaned piglets[J]. Chinese Journal of Animal Nutrition, 2020, 32(10): 4501-4517 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.10.004 |
| [6] |
谭碧娥. 饲料禁抗条件下仔猪肠道健康的营养干预手段[J]. 猪业科学, 2020, 37(5): 32-35. TAN B E. Nutritional regulation strategies for intestinal health of pigs in the context of antibiotics free feeding[J]. Swine Industry Science, 2020, 37(5): 32-35 (in Chinese). DOI:10.3969/j.issn.1673-5358.2020.05.010 |
| [7] |
GALINIAK S, AEBISHER D, BARTUSIK-AEBISHER D. Health benefits of resveratrol administration[J]. Acta Biochimica Polonica, 2019, 66(1): 13-21. |
| [8] |
CHENG K, JI S L, JIA P L, et al. Resveratrol improves hepatic redox status and lipid balance of neonates with intrauterine growth retardation in a piglet model[J]. BioMed Research International, 2020, 2020: 7402645. |
| [9] |
MALAGUARNERA L. Influence of resveratrol on the immune response[J]. Nutrients, 2019, 11(5): 946. DOI:10.3390/nu11050946 |
| [10] |
BREUSS J M, ATANASOV A G, UHRIN P. Resveratrol and its effects on the vascular system[J]. International Journal of Molecular Sciences, 2019, 20(7): 1523. DOI:10.3390/ijms20071523 |
| [11] |
NUNES S, DANESI F, DEL RIO D, et al. Resveratrol and inflammatory bowel disease: the evidence so far[J]. Nutrition Research Reviews, 2018, 31(1): 85-97. DOI:10.1017/S095442241700021X |
| [12] |
CHANPIN A, CARPÉNÉ C, MERCADER J. Resveratrol, metabolic syndrome, and gut microbiota[J]. Nutrients, 2018, 10(11): 1651. DOI:10.3390/nu10111651 |
| [13] |
符清瑶, 施力光, 周汉林, 等. 白藜芦醇对氧化应激仔猪回肠黏膜形态、抗氧化能力、紧密连接蛋白及炎性因子mRNA表达的影响[J]. 动物营养学报, 2021, 33(2): 1163-1172. FU Q Y, SHI L G, ZHOU H L, et al. Effects of resveratrol on ileal mucosal morphology, antioxidant capacity, tight junction protein and inflammatory factor mRNA expression in oxidative stress piglets[J]. Chinese Journal of Animal Nutrition, 2021, 33(2): 1163-1172 (in Chinese). DOI:10.3969/j.issn.1006-267x.2021.02.057 |
| [14] |
XUN W J, FU Q Y, HOU G Y, et al. Protective effects of dietary resveratrol supplementation against oxidative stress in diquat-challenged piglets[J]. Italian Journal of Animal Science, 2020, 19(1): 1523-1532. DOI:10.1080/1828051X.2020.1851148 |
| [15] |
FU Q T, CUI Q K, YANG Y, et al. Effect of resveratrol dry suspension on immune function of piglets[J]. Evidence-Based Complementary and Alternative Medicine, 2018, 2018: 5952707. |
| [16] |
ZHUANG Y, WU H R, WANG X X, et al. Resveratrol attenuates oxidative stress-induced intestinal barrier injury through PI3K/Akt-mediated Nrf2 signaling pathway[J]. Oxidative Medicine and Cellular Longevity, 2019, 2019: 7591840. |
| [17] |
KIM E N, LIM J H, KIM M Y, et al. Resveratrol, an Nrf2 activator, ameliorates aging-related progressive renal injury[J]. Aging, 2018, 10(1): 83-99. DOI:10.18632/aging.101361 |
| [18] |
FARKHONDEH T, FOLGADO S L, POURBAGHER-SHAHRI A M, et al. The therapeutic effect of resveratrol: focusing on the Nrf2 signaling pathway[J]. Biomedicine & Pharmacotherapy, 2020, 127: 110234. |
| [19] |
BAIRD L, YAMAMOTO M. The molecular mechanisms regulating the KEAP1-NRF2 pathway[J]. Molecular and Cellular Biology, 2020, 40(13): e00099-20. |
| [20] |
姚娟, 吴平安, 李芸, 等. Keap1-Nrf2-ARE信号通路及其激活剂的研究进展[J]. 中国药理学通报, 2019, 35(10): 1342-1346. YAO J, WU P A, LI Y, et al. Research progress of small molecule activators in Keap1-Nrf2-ARE signaling pathway[J]. Chinese Pharmacological Bulletin, 2019, 35(10): 1342-1346 (in Chinese). DOI:10.3969/j.issn.1001-1978.2019.10.003 |
| [21] |
黄宇健, 温晓鹿, 王丽, 等. 白藜芦醇及其代谢衍生物在畜禽生产中的应用[J]. 动物营养学报, 2021, 33(6): 3097-3105. HUANG Y J, WEN X L, WANG L, et al. Application of resveratrol and its metabolic derivatives in livestock and poultry production[J]. Chinese Journal of Animal Nutrition, 2021, 33(6): 3097-3105 (in Chinese). DOI:10.3969/j.issn.1006-267x.2021.06.012 |
| [22] |
潘鹏, 谢红月, 蒋钦杨, 等. 白藜芦醇抗氧化功能的研究进展[J]. 饲料工业, 2020, 41(2): 8-14. PAN P, XIE H Y, JIANG Q Y, et al. Research progress on antioxidant function of resveratrol[J]. Feed Industry, 2020, 41(2): 8-14 (in Chinese). |
| [23] |
DOAN N, LIU Y H, XIONG X, et al. Organic selenium supplement partially alleviated diquat-induced oxidative insults and hepatic metabolic stress in nursery pigs[J]. The British Journal of Nutrition, 2020, 124(1): 1-11. DOI:10.1017/S0007114520000914 |
| [24] |
LI S, TAN H Y, WANG N, et al. The role of oxidative stress and antioxidants in liver diseases[J]. International Journal of Molecular Sciences, 2015, 16(11): 26087-26124. DOI:10.3390/ijms161125942 |
| [25] |
魏思宇, 甘振丁, 韦文耀, 等. 姜黄素和白藜芦醇联用对断奶仔猪消化酶活性和胰腺抗氧化功能的影响[J]. 南京农业大学学报, 2020, 43(4): 754-761. WEI S Y, GAN Z D, WEI W Y, et al. Effects of curcumin and resveratrol on digestive enzyme activity and pancreatic antioxidant function in weaned piglets[J]. Journal of Nanjing Agricultural University, 2020, 43(4): 754-761 (in Chinese). |
| [26] |
BAKER R G, HAYDEN M S, GHOSH S. NF-κB, inflammation, and metabolic disease[J]. Cell Metabolism, 2011, 13(1): 11-22. DOI:10.1016/j.cmet.2010.12.008 |
| [27] |
MARIER J F, CHEN K G, PRINCE P, et al. Production of ex vivo lipopolysaccharide-induced tumor necrosis factor-alpha, interleukin-1beta, and interleukin-6 is suppressed by trans-resveratrol in a concentration-dependent manner[J]. Canadian Journal of Veterinary Research, 2005, 69(2): 151-154. |
| [28] |
ZHAO W C, HUANG X L, HAN X, et al. Resveratrol suppresses gut-derived NLRP3 inflammasome partly through stabilizing mast cells in a rat model[J]. Mediators of Inflammation, 2018, 2018: 6158671. |
| [29] |
YU B, QIN S Y, HU B L, et al. Resveratrol improves CCL4-induced liver fibrosis in mouse by upregulating endogenous IL-10 to reprogramme macrophages phenotype from M(LPS) to M(IL-4)[J]. Biomedicine & Pharmacotherapy, 2019, 117: 109110. |
| [30] |
SARAIVA M, O'GARRA A. The regulation of IL-10 production by immune cells[J]. Nature Reviews Immunology, 2010, 10(3): 170-181. DOI:10.1038/nri2711 |
| [31] |
ZHANG H, CHEN Y N, CHEN Y P, et al. Comparison of the effects of resveratrol and its derivative pterostilbene on hepatic oxidative stress and mitochondrial dysfunction in piglets challenged with diquat[J]. Food & Function, 2020, 11(5): 4202-4215. |




