2. 贵州省动物遗传育种与 繁殖重点实验室, 贵阳 550025;
3. 贵州大学动物科学学院, 贵阳 550025;
4. 贵州大学科研鸡场, 贵阳 550025
2. Guizhou Provincial Key Laboratory of Animal Genetics, Breeding and Reproduction, Guiyang 550025, China;
3. College of Animal Science, Guizhou University, Guiyang 550025, China;
4. Research Chicken Farm of Guizhou University, Guiyang 550025, China
赖氨酸(Lys)是单胃动物饲粮中的必需氨基酸,也称为“生长性氨基酸”,主要参与酶、多肽激素和蛋白质的合成;赖氨酸也可作为一种生酮氨基酸,参与葡萄糖的代谢;此外,赖氨酸的添加量对体内氨基酸的平衡和其他氨基酸的吸收利用也产生影响[1-2]。而赖氨酸缺乏会造成氮平衡失调、食欲下降、皮下脂肪含量减少、氨基酸代谢受损等不良影响[3-4]。有研究发现,在基础饲粮中添加适量的赖氨酸可促进笼养蛋雏鸭的生长发育,进而提高其采食量[5]。陈志敏等[6]报道,饲粮赖氨酸水平显著影响肉仔鸡采食量。家禽在饲养过程中采食行为受到不同因素的影响,如葡萄糖、脂肪和氨基酸等因素决定采食量,而采食和能量消耗主要受外部环境、激素以及营养物质等信号分子共同调控,其调控过程极其复杂[7-8]。家禽采食行为的调节主要由外周组织和中枢神经控制。外周组织通过感受器反映体内营养代谢,并通过分泌多种肽和类固醇激素来调节采食;中枢神经系统在哺乳动物和家禽的摄食行为中有重要作用,包括下丘脑和脑干[9-10],下丘脑作为最关键的调控中枢,通过多种促食行为和抑食神经肽的共同作用来调节采食。中枢神经和外周组织在受到营养物质和环境因素的刺激后会产生多种信号分子(如神经肽、激素和代谢产物),这些信号分子在下丘脑的特定神经元亚群中启动信号级联,与特定的受体结合形成信号通路,从而在细胞水平上调控家禽采食和能量消耗等生理作用[11]。
转录组测序(RNA-Seq)技术被广泛应用于挖掘畜禽潜在候选基因和生物学通路。例如,Jehl等[12]研究发现,下丘脑作为鸡采食的调节中枢,低能量水平饲粮对脂肪和肝脏组织转录组无作用,但对下丘脑转录组有很大作用,说明低能量水平饲粮影响下丘脑释放、胆固醇合成和突触活动的表达,揭示了下丘脑与营养水平的调节关系。Lv等[13]研究表明,添加高剂量染料木黄酮可降低雏鸡的采食量,导致鸡下丘脑苦味受体的一些差异表达基因下调,从而改变鸡对甜味的感知,激活苦味受体信号通路。Yang等[14]利用RNA-Seq技术研究发现,部分候选基因和信号通路与地方鸡饲料利用效率有关,如血管细胞黏附分子1(vascular cell adhesion molecule 1,VCAM1)、组织蛋白酶S(cathepsin,CTSS)和Toll样受体4(Toll-like receptor 4,TLR4)等是影响饲料利用效率的候选基因,而细胞黏附分子(cell adhesion molecules,CAMs)和氧化磷酸化(oxidative phosphorylation,OXPHOS)是导致饲料利用效率差异的主要通路。上述有关鸡采食量转录组分析已被广泛研究,取得了一定进展。近年来,赖氨酸是营养学领域的一个热门话题,尽管此前已有相关研究,但大多数关于赖氨酸的研究多集中于肉鸡赖氨酸的需要量、生产性能等方面[15-17]。贵州黄鸡作为一个肉蛋兼用型品种,其氨基酸需要量低于快大型肉鸡和肉用的黄羽肉鸡,所以贵州黄鸡对赖氨酸需要量不同于这些鸡种。因此,本研究旨在通过RNA-Seq技术对饲喂不同赖氨酸水平饲粮的贵州黄鸡下丘脑组织进行测序研究,深入了解赖氨酸调控贵州黄鸡采食量的分子机制,挖掘与其采食量相关的关键基因和调控通路。
1 材料与方法 1.1 试验设计选取健康的1日龄贵州黄鸡雏鸡400羽,随机分为4组,每组5个重复,每个重复20羽。各组分别饲喂赖氨酸水平为0.7%、0.9%、1.1%和1.3%的试验饲粮。试验期6周。试验饲粮组成及营养水平见表 1。
|
|
表 1 试验饲粮组成及营养水平(风干基础) Table 1 Composition and nutrients levels of experimental diets (air-dry basis) |
试验前育雏舍全面消毒,封闭48 h,通风1周。采用网上笼养,每笼20只。每天08:00、14:00、20:00进行人工饲喂,自由饮水。舍内红外灯供热,第1周舍内温度平均为32~35 ℃,之后每周降温2~3 ℃,4周后常温饲养,鸡舍相对湿度保持在60%~65%,试验鸡严格按照标准常规免疫进行。记录好1~6周龄的采食量,计算平均日采食重:
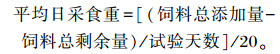
|
以不同赖氨酸水平饲粮饲喂到6周龄的贵州黄鸡为研究对象,根据平均日采食量结果,选取1~6周龄平均日采食量差异极显著(P<0.01)的0.9%赖氨酸水平组(b组)和1.3%赖氨酸水平组(d组)进行测序,从这2组试验鸡只中各挑选活泼健康的3只鸡进行挫骨处死,共6只鸡。置于冰上打开头颅,迅速取出下丘脑,冲洗后装入无酶离心管中,置于液氮中暂存,转入-80 ℃超低温冰箱保存,用于RNA提取。
1.3.2 测序分析用Trizol法提取下丘脑组织总RNA,纯化后对总RNA完整性和浓度进行检测,检测合格后,构建文库,先使用Qubit 2.0 Fluorometer进行初步定量,随后使用Agilent 2100 bioanalyzer对文库的插入片段进行检测,插入片段符合预期后,实时荧光定量PCR(qRT-PCR)对文库有效浓度进行准确定量(文库有效浓度>2 nmol/L),建库合格后,采用Illumina HiSeqTM 2000平台进行上机测序。对原始数据进行过滤、质控,同时,对有效数据(clean data)进行Q20、Q30和GC含量计算。使用HISAT2 v2.0.5软件将过滤后有效读数与鸡参考基因组(Gallus_gallus_5.0)进行比对,获取序列的比对效率和序列在参考基因组上的定位信息。使用DESeq2软件进行差异表达分析(每个组3个重复)。利用Cuffdiff软件进行定量分析,通过以每千个碱基的片段每百万片段映射的转录本(fragments per kilobase of transcript per million fragments mapped,FPKM)值来表示基因的表达水平,根据各样品所有基因的FPKM值计算皮尔逊相关系数(Pearson correlation coefficient,R2),绘制成热图,可直观评估组间或组内样品的重复相关性。以|log2(差异倍数)|>0且P<0.05为标准筛选差异表达基因。采用Cluster Profile软件对差异基因集进行GO功能富集分析,利用KOBAS 2.0软件筛选KEGG数据库中(http://www.genome.jp/kegg/)差异基因富集到信号通路,以P<0.05作为差异显著性的阈值。
1.3.3 测序结果的qRT-PCR验证为了进一步验证测序结果,随机挑选了6个差异表达基因进行qRT-PCR验证,检验测序结果的可靠性。使用Primer 5.0软件设计qPCR引物,以β-肌动蛋白(β-actin)作为相对基因定量的内参基因,引物委托上海生工生物工程股份有限公司合成。反应体系20 μL:10 μL Taq PCR Master Mix,7 μL ddH2O,上、下游引物各1 μL,cDNA 1 μL。反应条件:95 ℃预变性2 min,95 ℃变性15 s,72 ℃延伸60 s,共40个循环;并采用2-ΔΔCt法计算不同组中基因的表达量。基因引物信息见表 2。
|
|
表 2 基因引物信息 Table 2 Gene primer information |
平均日采食量数据利用SPSS 20.0软件进行单因素方差分析(one-way ANOVA),采用Duncan氏法对组间差异进行多重比较,结果以“平均值±标准差”表示,P<0.05表示差异显著,P<0.01表示差异极显著。
以|log2(差异倍数)|>0且P<0.05为标准筛选差异表达基因。采用Cluster Profile软件对差异基因集进行GO功能富集分析,利用KOBAS 2.0软件筛选KEGG数据库中差异基因富集到信号通路,以P<0.05作为差异显著性的阈值。
2 结果与分析 2.1 饲粮赖氨酸水平对1~6周龄贵州黄鸡平均日采食量的影响由表 3可知,4个组1~2周龄平均日采食量差异不显著(P>0.05)。0.7%、0.9%、1.1%赖氨酸水平组3~4周龄平均日采食量极显著高于1.3%赖氨酸水平组(P<0.01),0.9%、1.1%赖氨酸水平组显著高于0.7%赖氨酸水平组(P<0.05)。0.7%、0.9%、1.1%赖氨酸水平组5~6周龄平均日采食量极显著高于1.3%赖氨酸水平组(P<0.01),0.9%、1.1%赖氨酸水平组显著高于0.7%赖氨酸水平组(P<0.05)。0.7%、0.9%、1.1%赖氨酸水平组1~6周龄平均日采食量极显著高于1.3%赖氨酸水平组(P<0.01)。
|
|
表 3 饲粮赖氨酸水平对1~6周龄贵州黄鸡平均日采食量的影响 Table 3 Effects of dietary lysine level on average daily feed intake of Guizhou yellow chickens during 1 to 6 weeks of age |
构建b组和d组各3个下丘脑组织样品的文库,原始数据过滤后,获得了各个样品测序有效序列、有效碱基数、错误率及GC、Q20、Q30含量(表 4)。每个样品产出的原始数据均在43 519 236以上,共获得262 700 782个有效序列和39.41 G有效碱基数,其中,各个样品测序错误率均为0.03%,Q20、Q30含量分别在97%、93%以上,GC含量均在49.78%以上。由表 5可知,每个样品所产的测序读数比对到鸡参考基因组上比对率均大于89%,比对到唯一位置的比对率在88%以上,比对到多个位置的比对率占1.4%~1.7%。上述结果证明RNA-Seq数据的质量良好。
|
|
表 4 测序数据统计 Table 4 Sequencing data statistics |
|
|
表 5 6个样品测序数据与参考基因组比对结果 Table 5 Comparison results of sequencing data of 6 samples to reference genome |
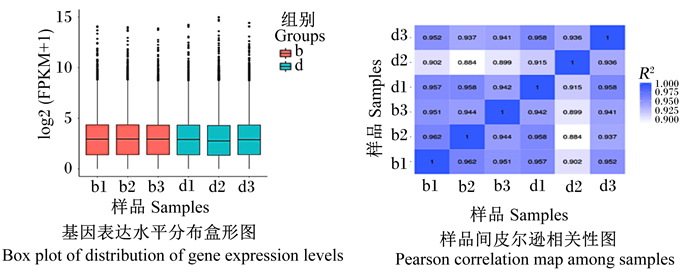
通过盒形图展示6个样品基因表达水平的分布情况。结果表明,每个样品的基因表达量最大值均大于14,上四分位在4~5,中位数接近4,下四分位在1~2,最小值为0;即6个样品的基因表达量趋于一致(图 1-A)。此外,通过计算2组样品内或样品间R2,组内样品R2均在0.90以上(图 1-B),说明2组间表达模式的相似度较好,证明试验样品选择较合理,增加了后续试验的可靠性。
|
FPKM:每千个碱基的片段每百万片段映射的转录本fragments per kilobase of transcript per million fragments mapped;R2:皮尔逊相关系数Pearson correlation coefficient。 图 1 样品基因表达量分布与样品间相关系数 Fig. 1 Distribution of gene expression and correlation coefficient among samples |
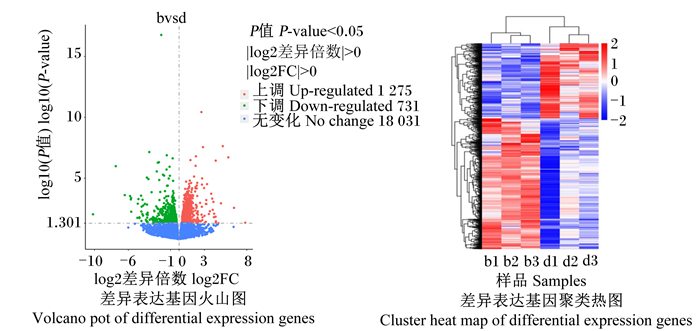
本研究以|log2(差异倍数)|>0且P<0.05为筛选差异基因的标准,共筛选到2 006个差异表达基因,其中,1 275个基因表达上调,731个基因表达下调(图 2-A),前20个差异表达基的因如表 6所示。对差异表达基因进行聚类分析,绘制聚类热图(图 2-B),从图中看出组内两两样品基因的表达量基本趋于一致,说明生物学重复性较好;2组间样品则存在差异基因表达变化,此外,颜色越红代表基因的表达量越高,颜色越蓝代表基因的表达量越低。
|
图 2 差异表达基因分析 Fig. 2 Analysis of differential expression genes |
|
|
表 6 前20个差异表达的基因 Table 6 Top 20 differentially expressed genes |
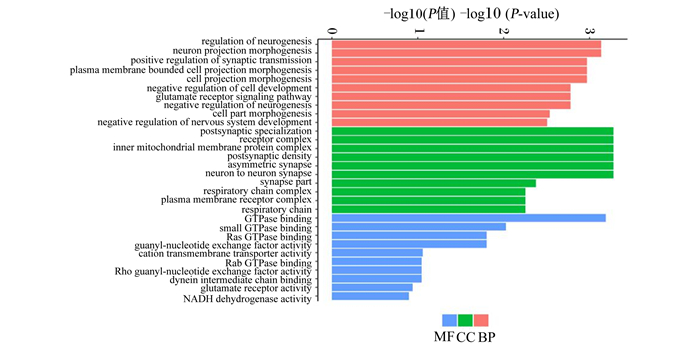
利用GOseq对b组与d组的差异表达基因进行富集分析,由图 3可知,在GO功能注释中分子功能(molecular function,MF)有27个,占21%;细胞组成(cellular component,CC)有38个,占32%;生物过程(biological process,BP)有55个,占47%。差异表达基因主要在调节神经过程、投射神经元形态发生、负调控神经发生等生物学过程极显著富集,上述注释到GO功能中可能与采食行为相关的有可卡因和安非他明调控转录前肽(carcinine transporter prepropeptide,CARTPT)、前阿黑皮素原(proopiomelanocortin,POMC)、刺鼠相关蛋白(agouti-related protein,AgRP)、神经肽Y(neuropeptide Y,NPY)4个候选基因。
|
regulation of neurogenesis:调节神经发生;neuron projection morphogenesis:投射神经元形态发生;positive regulation of synaptic transmission:突触传递正调控;plasma membrane bounded cell projection morphogenesis:质膜的细胞形态发生投影;cell projection morphogenesis:细胞形态发生投影;negative regulation of cell development:细胞发育的负调控;glutamate receptor signaling pathway:谷氨酸受体信号通路;negative regulation of neurogenesis:负调控的神经发生;cell part morphogenesis:细胞形态发生部分;negative regulation of nervous system development:神经系统发育的负调控;postsynaptic specialization:突触后特化;receptor complex:受体复合物;inner mitochondrial membrane protein complex:线粒体膜内蛋白复合物;postsynaptic density:突触后致密物;asymmetric synapse:不对称突触;neuron to neuron synapse:神经元对神经元突触;synapse part:突触部分;respiratory chain complex:呼吸链复合物;plasma membrane receptor complex:质膜受体复合物;respiratory chain:呼吸链;GTPase binding:GTP酶结合区;small GTPase binding:小GTP酶结合;Ras GTPase binding:RAS GTP酶的结合;guanyl-nucleotide exchange factor activity:鸟嘌呤核苷酸交换因子;cation transmembrane transporter activity:阳离子跨膜转运活性;Rab GTPase binding:Rab GTP酶的结合;Rho guanyl-nucleotide exchange factor activity:RHO鸟嘌呤核苷酸交换因子;dynein intermediate chain binding:动力蛋白中间链结合;glutamate receptor activity:谷氨酸受体活性;NADH dehydrogenase activity:NADH脱氢酶活性;MF:分子功能molecular function;BP:生物过程biological process;CC:细胞组成cellular component。 图 3 差异表达基因的GO功能富集分析 Fig. 3 GO function enrichment analysis of differentially expressed genes |
通过KEGG信号通路富集分析,共富集到139条信号通路,选取了富集最显著的前20个通路,以散点图形式展示(图 4)。其中,显著富集的KEGG通路有19条通路,共筛选到磷脂酰肌醇信号系统、叉头框转录因子O(forkhead box O,FoxO)信号传导途径、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路及神经活性配体-受体相互作用、脂肪细胞因子信号通路6条通路可能影响鸡的采食量,涉及到166个差异表达基因(表 7)。其中,KEGG通路富集到神经活性配体-受体相互作用通路上的差异表达基因最多,共有43个差异表达基因。
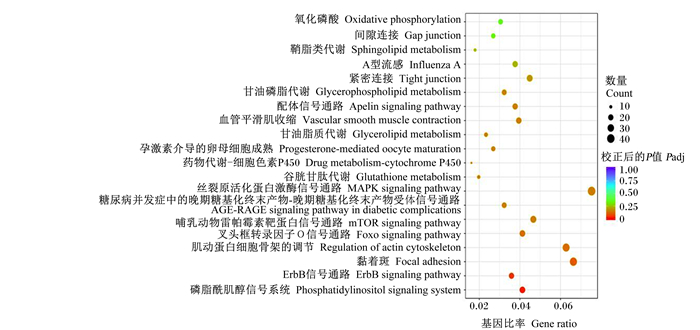
|
图 4 差异表达基因KEGG通路富集分析散点图(前20个) Fig. 4 KEGG pathways enrichment analysis scatter diagram of differentially expressed genes (top 20) |
|
|
表 7 可能与采食量相关差异表达基因的富集通路 Table 7 Enrichment pathways may be related to feed intake of differentially expressed genes |
选取食欲素神经肽前体(hypocretin neuropeptide precursor,HCRT)、AgRP、NPY、猪链球菌2型(strictosidine synthase 2,SS2)、胆囊收缩素A受体(cholecystokinin A receptor,CCKAR)、CARTPT 6个基因进行qRT-PCR验证。结果表明,qRT-PCR验证结果与RNA-Seq表达量变化模式一致(图 5),说明测序数据可靠。
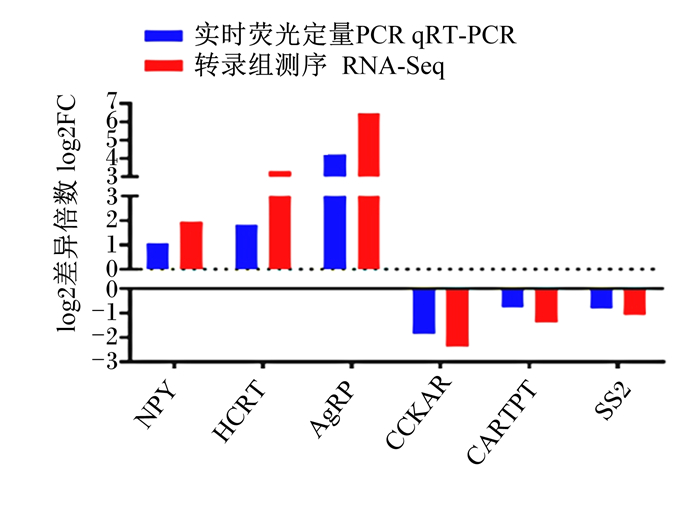
|
NPY:神经肽Y neuropeptide Y;HCRT:食欲素神经肽前体hypocretin neuropeptide precursor;AgRP:刺鼠相关蛋白agouti-related protein;CCKAR:胆囊收缩素A受体cholecystokinin A receptor;CARTPT:可卡因和安非他明调控转录前肽carcinine transporter prepropeptide;SS2:猪链球菌2型strictosidine synthase 2。 图 5 qRT-PCR验证差异表达基因 Fig. 5 Differentially expressed genes verified by qRT-PCR |
家禽采食量是控制生产效率的重要因素之一,食物的摄入与动物的健康和生产效率密切相关。下丘脑是家禽采食最重要的部位,可通过感应、整合不同外周组织来实现对家禽采食的控制,从而调节采食的分子机制[18]。在哺乳动物中已经发现了许多抑制和促进采食的食欲神经肽,类似的功能也在家禽中得到验证。研究表明,饲粮中适宜赖氨酸水平可显著提高家禽的生长速度和采食量[19]。相对于雏鸡,强烈的摄食行为是提高雏鸡采食量的前提[20]。在本研究中,饲粮赖氨酸水平由0.7%增加到1.3%,贵州黄鸡4个组的1~6周龄平均日采食量均呈先升后降的趋势,尤其是0.9%赖氨酸水平组极显著高于1.3%赖氨酸水平组,这种差异可能是由于不同赖氨酸水平导致采食量的变化,或者受遗传因素的影响,说明赖氨酸水平过高或缺乏均会影响家禽采食量。基于此,本文选取采食量差异极显著的0.9%赖氨酸水平组(b组)和1.3%赖氨酸水平组(d组)的6周龄贵州黄鸡进行研究。
通过GO功能注释分析发现,表达上调的基因主要富集在投射神经元形态发生、负调控神经发生、神经肽信号传导途径等生物学过程,如AgRP、NPY、POMC、CART等神经元在中枢神经系统内轴突投射得更广,说明差异表达基因影响着家禽下丘脑对采食量的控制。有研究表明,下丘脑弓状核(ARC)中的NPY/AgRP神经元共同调控γ-氨基丁酸(gamma-aminobutyric acid,GABA),这些神经元在促进采食方面起着重要作用[21]。通过KEGG通路分析,富集到神经活性配体-受体相互作用这条通路的差异表达基因最多,而脂肪细胞因子信号通路是AgRP的关键通路;在这2条通路中筛选到NPY、AgRP、CARTPT、POMC 4个基因可能与不同赖氨酸水平调控鸡的采食量有关。Li等[22]对注射外源性脂肪素雏鸡的下丘脑进行测序,发现与采食相关的差异表达基因显著富集在神经活性配体-受体相互作用通路,且脂肪素可能通过POMC/促肾上腺皮质激素释放激素(corticotropin-releasing hormone,CRH)和NPY/AgRP通路来增加或者抑制采食量。这说明该通路对家禽采食调控极其重要。Bahry等[23]研究表明,下丘脑注射NPY可降低热应激对雏鸡采食量的影响,从而提高雏鸡的采食量。激活AgRP神经元可以快速地诱导小鼠采食和减少能量消耗,最终增加脂肪储存;反之,抑制饥饿小鼠的AgRP神经元活性会减少采食量[24]。本研究发现,与d组相比,b组NPY和AgRP基因表达量显著表达上调,采食量也随之提高。NPY参与GO功能注释到神经肽信号途径和神经活性配体-受体相互作用通路,AgRP富集到脂肪细胞因子信号通路;说明适宜赖氨酸水平组可能通过上调NPY/AgRP表达来促进雏鸡的摄食量,从而通过神经活性配体-受体相互作用通路和脂肪细胞因子信号通路来调控雏鸡的采食。
CARTPT是CART前肽,CART和POMC属于一种厌食性神经肽,在动物的采食和能量平衡调节中起着重要的作用[25]。CART可作用于下丘脑和胃肠道来降低食欲和饲料消化率,抑制采食量[26-27]。CART与POMC神经元起相互协调作用,其主要在下丘脑ARC中表达,在调节葡萄糖代谢和能量消耗方面发挥作用[28]。Alamshah等[29]给大鼠灌胃L-苯丙氨酸(L-Phe)后,在1 h内大鼠采食量显著下降,表明氨基酸对采食量的影响可能与胃肠道饱感激素有关。在肉鸡中,饲粮中赖氨酸水平过高会使肉鸡的采食量、生长发育、腹脂沉积等下降[30]。在本研究中,b组的CARTPT和POMC基因表达量显著高于d组,被富集到GO功能中进食行为和神经活性配体-受体相互作用通路,但b组采食量低于d组,表明雏鸡食欲的下降可能与CARTPT、POMC基因表达下调有关。
mTOR是一种丝氨酸或苏氨酸蛋白激酶,可参与营养信号、体内的基因转录、蛋白质翻译起始等多个生物学过程[31]。陈盼盼[32]发现FoxO信号传导途径和mTOR信号通路与蛋白质代谢和调控采食量有关;且mTOR基因表达量在饲粮赖氨酸缺乏时明显受到抑制,反之,mTOR基因表达量提高,肌肉发育不良,说明mTOR信号通路与不同赖氨酸水平有一定关系。在MAPK信号通路中,脂联素可通过该通路来促进脂肪酸氧化和葡萄糖的吸收,对胰岛素抑制有改善功能。磷脂酰肌醇信号通路是一种细胞跨膜信号系统,如促食因子是通过磷脂酰肌醇信号通路完成对采食的调节[33]。有研究报道,饥饿素对采食的调控是通过激活磷脂酰肌醇信号途径后钙离子(Ca2+)浓度的升高,从而启动雷帕霉素靶蛋白复合物1(rapamycin target protein complex 1,mTORC1)/核糖体S6激酶1(ribosomal S6 kinase 1,S6K1)通路完成[34]。在本试验中,磷脂酰肌醇信号途径、FoxO信号传导途径、mTOR信号通路、MAPK信号通路4条通路都显著富集,说明这些通路可能共同调控贵州黄鸡采食量。
4 结论① 0.7%、0.9%、1.1%赖氨酸水平组1~6周龄平均日采食量极显著高于1.3%赖氨酸水平组。
② 不同水平赖氨酸可能通过下丘脑组织NPY、AgRP、CARTPT和POMC等相关基因的表达,作用于神经活性配体-受体相互作用通路和脂肪细胞因子信号通路,以此来调控贵州黄鸡的采食量。
| [1] |
田颖, 彭景, 陈玉. 人体赖氨酸需要量的研究进展[J]. 现代预防医学, 2014, 41(1): 22-24, 27. TIAN Y, PENG J, CHEN Y. Research progress of human lysine requirement[J]. Modern Preventive Medicine, 2014, 41(1): 22-24, 27 (in Chinese). |
| [2] |
ROY N, LAPIERRE H, BERNIER J F. Whole-body protein metabolism and plasma profiles of amino acids and hormones in growing barrows fed diets adequate or deficient in lysine[J]. Canadian Journal of Animal Science, 2000, 80(4): 585-595. DOI:10.4141/A98-057 |
| [3] |
PALMA-GRANADOS P, SEIQUER I, BENÍTEZ R, et al. Effects of lysine deficiency on carcass composition and activity and gene expression of lipogenic enzymes in muscles and backfat adipose tissue of fatty and lean piglets[J]. Animal, 2019, 13(10): 2406-2418. DOI:10.1017/S1751731119000673 |
| [4] |
YIN J, LI Y Y, HAN H, et al. Effects of lysine deficiency and Lys-Lys dipeptide on cellular apoptosis and amino acids metabolism[J]. Molecular Nutrition & Food Research, 2017, 61(9): 1600754. |
| [5] |
张婷, 王安, 姜丽丽, 等. 饲粮赖氨酸水平对笼养蛋雏鸭生长性能、免疫器官发育及血清生化指标的影响[J]. 饲料工业, 2013, 34(22): 9-12. ZHANG T, WANG A, JIANG L L, et al. Effects of dietary lysine level on growth performance, immune organ development and serum biochemical parameters of caged laying ducklings[J]. Feed Industry, 2013, 34(22): 9-12 (in Chinese). |
| [6] |
陈志敏, 蔡辉益, 刘国华, 等. 不同赖氨酸添加水平对肉仔鸡生产性能和胴体品质的影响[J]. 中国家禽, 2004, 26(11): 11-13. CHEN Z M, CAI H Y, LIU G H, et al. Effects of dietary lysine level on growth performance and carcass quality of broilers[J]. China Poultry, 2004, 26(11): 11-13 (in Chinese). DOI:10.3969/j.issn.1004-6364.2004.11.003 |
| [7] |
RICHARDS M P. Genetic regulation of feed intake and energy balance in poultry[J]. Poultry Science, 2003, 82(6): 907-916. DOI:10.1093/ps/82.6.907 |
| [8] |
RICHARDS M P, ROSEBROUGH R W, COON C N, et al. Feed intake regulation for the female broiler breeder: in theory and in practice[J]. Journal of Applied Poultry Research, 2010, 19(2): 182-193. DOI:10.3382/japr.2010-00167 |
| [9] |
NAHON J L. The melanocortins and melanin-concentrating hormone in the central regulation of feeding behavior and energy homeostasis[J]. Comptes Rendus Biologies, 2006, 329(8): 623-638. DOI:10.1016/j.crvi.2006.03.021 |
| [10] |
CLINE M A, FOUSE D N, PRALL B C. Central and peripheral alytesin cause short-term anorexigenic effects in neonatal chicks[J]. Neuropeptides, 2008, 42(3): 283-291. DOI:10.1016/j.npep.2008.02.004 |
| [11] |
PROSZKOWIEC-WEGLARZ M, RICHARDS M P, RAMACHANDRAN R, et al. Characterization of the AMP-activated protein kinase pathway in chickens[J]. Comparative Biochemistry and Physiology.Part B, Biochemistry & Molecular Biology, 2006, 143(1): 92-106. |
| [12] |
JEHL F, DÉSERT C, KLOPP C, et al. Chicken adaptive response to low energy diet: main role of the hypothalamic lipid metabolism revealed by a phenotypic and multi-tissue transcriptomic approach[J]. BMC Genomics, 2019, 20(1): 1033. DOI:10.1186/s12864-019-6384-8 |
| [13] |
LV Z P, HU C H, JIANG J L, et al. Effects of high-dose genistein on the hypothalamic RNA profile and intestinal health of female chicks[J]. Journal of Agricultural and Food Chemistry, 2019, 67(49): 13737-13750. DOI:10.1021/acs.jafc.9b05162 |
| [14] |
YANG L, HE T T, XIONG F L, et al. Identification of key genes and pathways associated with feed efficiency of native chickens based on transcriptome data via bioinformatics analysis[J]. BMC Genomics, 2020, 21(1): 292. DOI:10.1186/s12864-020-6713-y |
| [15] |
HAN Y, BAKER D H. Effects of sex, heat stress, body weight, and genetic strain on the dietary lysine requirement of broiler chicks[J]. Poultry Science, 1993, 72(4): 701-708. DOI:10.3382/ps.0720701 |
| [16] |
訾宝兵. 基于转录组学分析的日粮蛋白质对略阳乌鸡生长发育调控的分子机制[D]. 硕士学位论文. 杨凌: 西北农林科技大学, 2018. ZI B B. Molecular mechanism of growth and development in Lveyang black-bone chicken by regulating of dietary protein based on the transcriptional analysis[D]. Master's Thesis. Yangling: Northwest A and F University, 2018. (in Chinese) |
| [17] |
李燕蒙. 日粮赖氨酸对肉鸡生长发育、microRNA和circRNA表达谱的影响[D]. 硕士学位论文. 杨凌: 西北农林科技大学, 2020. LI Y M. Effects of dietary lysine in growth and development, microRNA and circRNA expression profiles of broilers[D]. Master's Thesis. Yangling: Northwest A & F University, 2020. (in Chinese) |
| [18] |
WILDING J P H. Neuropeptides and appetite control[J]. Diabetic Medicine, 2002, 19(8): 619-627. DOI:10.1046/j.1464-5491.2002.00790.x |
| [19] |
赵小玲, 张露, 朱庆, 等. 群体和日粮赖氨酸水平对二郎山山地鸡体重和外貌的影响[J]. 四川农业大学学报, 2013, 31(4): 433-437. ZHAO X L, ZHANG L, ZHU Q, et al. Effects of groups and dietary lysine levels on body weight and appearance of Erlang mountainous chickens[J]. Journal of Sichuan Agricultural University, 2013, 31(4): 433-437 (in Chinese). DOI:10.3969/j.issn.1000-2650.2013.04.014 |
| [20] |
MBAJIORGU C A, NG'AMBI J W, NORRIS D D. Voluntary feed intake and nutrient composition in chickens[J]. Asian Journal of Animal and Veterinary Advances, 2011, 6: 20-28. |
| [21] |
SUYAMA S, YADA T. New insight into GABAergic neurons in the hypothalamic feeding regulation[J]. Journal of Physiological Sciences, 2018, 68(6): 717-722. DOI:10.1007/s12576-018-0622-8 |
| [22] |
LI Z A, LIU X L, ZHANG P P, et al. Comparative transcriptome analysis of hypothalamus-regulated feed intake induced by exogenous visfatin in chicks[J]. BMC Genomics, 2018, 19(1): 249. DOI:10.1186/s12864-018-4644-7 |
| [23] |
BAHRY M A, CHOWDHURY V S, YANG H, et al. Central administration of neuropeptide Y differentially regulates monoamines and corticosterone in heat-exposed fed and fasted chicks[J]. Neuropeptides, 2017, 62: 93-100. DOI:10.1016/j.npep.2016.11.008 |
| [24] |
KRASHES M J, KODA S, YE C A I, et al. Rapid, reversible activation of AgRP neurons drives feeding behavior in mice[J]. The Journal of Clinical Investigation, 2011, 121(4): 1424-1428. DOI:10.1172/JCI46229 |
| [25] |
MO C H, LV C, HUANG L, et al. Regulation of pituitary cocaine- and amphetamine-regulated transcript expression and secretion by hypothalamic gonadotropin-releasing hormone in chickens[J]. Frontiers of Physiology, 2019, 10: 882. DOI:10.3389/fphys.2019.00882 |
| [26] |
OKUMURA T, YAMADA H, MOTOMURA W, et al. Cocaine-amphetamine-regulated transcript (CART) acts in the central nervous system to inhibit gastric acid secretion via brain corticotropin-releasing factor system[J]. Endocrinology, 2000, 141(8): 2854-2860. DOI:10.1210/endo.141.8.7588 |
| [27] |
马天瀛, 李怡霖, 董心玥, 等. 食物摄入与下丘脑能量平衡[J]. 畜牧兽医学报, 2021, 52(7): 1789-1799. MA T Y, LI Y L, DONG X Y, et al. Food intake and hypothalamic energy balance[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(7): 1789-1799 (in Chinese). |
| [28] |
王超, 康翠翠, 冯江银, 等. L-精氨酸对大鼠胃肠激素分泌及食欲的影响[J]. 草业学报, 2019, 28(6): 167-174. WANG C, KANG C C, FENG J Y, et al. Gut hormone release and appetite responses to L-Arg in rats[J]. Acta Prataculturae Sinica, 2019, 28(6): 167-174 (in Chinese). |
| [29] |
ALAMSHAH A, SPRECKLEY E, NORTON M, et al. L-phenylalanine modulates gut hormone release and glucose tolerance, and suppresses food intake through the calcium-sensing receptor in rodents[J]. International Journal of Obesity, 2017, 41(11): 1693-1701. DOI:10.1038/ijo.2017.164 |
| [30] |
田大龙, 李燕蒙, 闵育娜, 等. 赖氨酸缺乏或过量对肉鸡生长发育及脂质代谢相关基因表达的影响[J]. 中国畜牧杂志, 2018, 54(10): 95-99. TIAN D L, LI Y M, MIN Y N, et al. Effects of lysine deficiency or excess on growth and gene expression related to lipid metabolism in broilers[J]. Chinese Journal of Animal Science, 2018, 54(10): 95-99 (in Chinese). |
| [31] |
GANGLOFF Y G, MUELLER M, DANN S G, et al. Disruption of the mouse mTOR gene leads to early postimplantation lethality and prohibits embryonic stem cell development[J]. Molecular and Cellular Biology, 2004, 24(21): 9508-9516. DOI:10.1128/MCB.24.21.9508-9516.2004 |
| [32] |
陈盼盼. 基于转录组学分析的赖氨酸调控肉鸡生长发育的分子机制[D]. 硕士学位论文. 杨凌: 西北农林科技大学, 2018. CHEN P P. Molecular mechanism of growth and development in broiler chickens by regulating of lysine based on the transcriptional analysis[D]. Master's Thesis. Yangling: Northwest A & F University, 2018. (in Chinese) |
| [33] |
LUND P E, SHARIATMADARI R, UUSTARE A, et al. The orexin OX1 receptor activates a novel Ca2+ influx pathway necessary for coupling to phospholipase C[J]. Journal of Biological Chemistry, 2000, 275(40): 30806-30812. DOI:10.1074/jbc.M002603200 |
| [34] |
STEVANOVIC D, TRAJKOVIC V, MVLLER-LVHLHOFF S, et al. Ghrelin-induced food intake and adiposity depend on central mTORC1/S6K1 signaling[J]. Molecular and Cellular Endocrinology, 2013, 381(1/2): 280-290. |




