2. 山东隆大生物工程有限公司, 临沂 276400;
3. 山东亚太中慧集团有限公司, 潍坊 262400
2. Shandong Longda Bio-Products Co., Ltd., Linyi 276400, China;
3. Shandong Yatai Zhonghui Group Co., Ltd., Weifang 262400, China
近些年来,我国经济发展迅速,人民生活水平提高,关于肉类的消费理念发生了很大变化。人们在追求肉“量”的同时,更加注重对肉“质”的要求。由于肌内脂肪含量与鸡肉嫩度和风味均呈显著正相关[1],因此想要达到提高鸡肉品质这一要求,增加鸡肉的肌内脂肪含量是必不可少的。目前,抗生素被禁用,益生素和酸化剂等通过调节动物肠道微生物菌群结构发挥功效的饲料添加剂日益得到人们重视。大量研究表明,益生素和酸化剂等动物肠道微生物调节类饲料添加剂具有增加鸡肉的肌内脂肪含量的作用[2-4],但其作用机制尚未明确。血管生成素样蛋白4(angiopoietin-like protein 4,ANGPTL4)是一类具有高效生物活性的分泌蛋白,与动物脂肪代谢密切相关,同时肠道微生物可影响其分泌[5]。由此,我们猜测ANGPTL4可能是益生素和酸化剂等动物肠道微生物调节类饲料添加剂调控肉鸡肌内脂肪沉积的一个重要媒介。肌内脂肪是脂肪合成、转运、分解的净产物。由于本课题组前期已就ANGPTL4对肉鸡胸肌脂肪分解的影响进行了探究[6]。因此,本试验将在前期试验的基础上,以肉鸡肝脏和胸肌为主要研究对象,就ANGPTL4对肉鸡脂肪合成和转运的影响进行研究,以期探明ANGPTL4在肉鸡胸肌肌内脂肪的作用效果,为揭示营养因子调控肉鸡肌内脂肪沉积的作用机制提供理论依据。
1 材料与方法 1.1 试验材料参照赵旭等[4]的方法制备带有组氨酸(histidine,His)-小分子泛素样修饰蛋白(small ubiquitin-like modifier,SUMO)标签的鸡ANGPTL4重组蛋白(浓度为0.1 mg/mL)。
1.2 试验设计和样品采集试验分体内动物试验和体外细胞试验2部分进行。
体内动物试验:选用36只体重[(2.17±0.03) kg]相近的35日龄健康禁食状态下(空腹12 h)爱拔益加肉公鸡,随机分为6个组,每组6个重复,每个重复1只鸡。对照组翅静脉注射灭菌的生理盐水,试验组分别翅静脉注射20、100、500、2 500、12 500 ng/kg BW的鸡ANGPTL4重组蛋白,注射剂量均为550 μL,注射后30 min(ANGPTL4最佳生效时间),所有肉鸡颈静脉放血处死,取相同部位肝脏样品置于非液氮型样品RNA保存液(北京百泰克生物技术有限公司)中,4 ℃保存过夜,第2天后以-20 ℃保存;分别取相同部位肝脏和胸肌样品,液氮速冻,-40 ℃保存。
体外细胞试验:以肉鸡成肌细胞为试验对象,设3个组,分别是灭菌的生理盐水组、His-SUMO标签组和鸡ANGPTL4重组蛋白组,分别在细胞培养基中添加灭菌的生理盐水、His-SUMO标签蛋白(其含量与鸡ANGPTL4重组蛋白组中标签蛋白含量一致)和鸡ANGPTL4重组蛋白(250 pg/mL),添加剂量均为5 μL,5% CO2、37 ℃孵育24 h。采集肉鸡成肌细胞用于测定甘油三酯(TG)含量。整个细胞试验重复3次。
1.3 测定指标和方法 1.3.1 肝脏脂肪代谢相关基因mRNA表达采用TRIzol(Invitrogen Life Technologies公司,美国)方法提取总RNA。按照TaKaRa试剂盒(TaKaRa公司,日本)说明书进行反转录和实时荧光定量PCR。以甘油醛-3-磷酸脱氢酶(GAPDH)为内参基因,采用2-△△Ct法计算肝脏脂肪代谢相关目的基因的mRNA相对表达量,实时荧光定量PCR引物由上海Invitrogen生物技术有限公司合成,引物信息见表 1。
|
|
表 1 实时荧光定量PCR引物信息 Table 1 Primer information of real-time PCR |
使用脂肪酸合成酶(fatty acid synthase,FAS)、苹果酸酶(malic enzyme,ME)、乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC)试剂盒(苏州科铭生物技术有限公司)分别测定FAS、ME、ACC活性,测定过程按照试剂盒说明书进行操作。
1.3.3 胸肌脂蛋白脂酶(lipoprotein lipase,LPL)活性使用总脂酶测定试剂盒(南京建成生物工程研究所)测定胸肌LPL活性,测定过程按照试剂盒说明书进行操作。
1.3.4 成肌细胞TG含量采集成肌细胞使用试剂盒(南京建成生物工程研究所)测定成肌细胞TG含量,测定过程按照试剂盒说明书进行操作。
1.4 数据统计分析数据采用SAS 9.2软件中的one-way ANOVA程序进行分析,多重比较采用Duncan氏法进行。采用正交多项式的分析方法对不同注射剂量鸡ANGPTL4重组蛋白的处理效应进行一次线性和二次曲线回归分析。数据用平均值和均值标准误(SEM)表示,P<0.05为差异显著。
2 结果 2.1 鸡ANGPTL4重组蛋白对肉鸡肝脏脂肪合成相关基因mRNA表达的影响由表 2可知,与对照组相比,20、100、500、2 500 ng/kg BW鸡ANGPTL4重组蛋白组的肝脏FAS mRNA相对表达量显著提高(P<0.05),但20、100、500、2 500 ng/kg BW鸡ANGPTL4重组蛋白组之间无显著差异(P>0.05)。随着鸡ANGPTL4重组蛋白注射剂量增加,肝脏FAS mRNA相对表达量呈现一次线性和二次曲线增加的效应(P<0.05)。与对照组相比,100、500、2 500 ng/kg BW鸡ANGPTL4重组蛋白组的肝脏ME mRNA相对表达量显著降低(P<0.05),但100、500、2 500 ng/kg BW鸡ANGPTL4重组蛋白组之间无显著差异(P>0.05)。与对照组相比,12 500 ng/kg BW鸡ANGPTL4重组蛋白组的肝脏ACC mRNA相对表达量显著降低(P<0.05)。随着ANGPTL4重组蛋白注射剂量增加,肝脏ACC mRNA相对表达量呈现一次线性和二次曲线降低的效应(P<0.05)。
|
|
表 2 鸡ANGPTL4重组蛋白对肉鸡肝脏脂肪合成相关基因mRNA表达的影响 Table 2 Effects of chicken ANGPTL4 recombinant protein on mRNA expression of fat synthesis related genes in liver of broilers |
由表 3可知,不同注射剂量的鸡ANGPTL4重组蛋白对肉鸡肝脏ME和ACC活性均无显著影响(P>0.05)。与对照组相比,500 ng/kg BW鸡ANGPTL4重组蛋白组的肝脏FAS活性显著提高(P<0.05)。随着鸡ANGPTL4重组蛋白注射剂量增加,肝脏FAS活性呈现一次线性和二次曲线增加的效应(P<0.05)。
|
|
表 3 鸡ANGPTL4重组蛋白对肉鸡肝脏脂肪合成相关酶活性的影响 Table 3 Effects of chicken ANGPTL4 recombinant protein on activities of fat synthesis related enzymes in liver of broilers |
由表 4可知,不同注射剂量的鸡ANGPTL4重组蛋白对肉鸡肝脏载脂蛋白B(ApoB)和微粒体甘油三酯转移蛋白(MTTP)mRNA相对表达量均无显著影响(P>0.05)。
|
|
表 4 鸡ANGPTL4重组蛋白对肉鸡肝脏脂肪转运相关基因mRNA表达的影响 Table 4 Effects of chicken ANGPTL4 recombinant protein on mRNA expression of fat transport related genes in liver of broilers |
由表 5可知,与对照组相比,500 ng/kg BW鸡ANGPTL4重组蛋白组的胸肌LPL活性显著增加(P<0.05)。
|
|
表 5 鸡ANGPTL4重组蛋白对肉鸡胸肌LPL活性的影响 Table 5 Effects of chicken ANGPTL4 recombinant protein on breast muscle LPL activity of broilers |
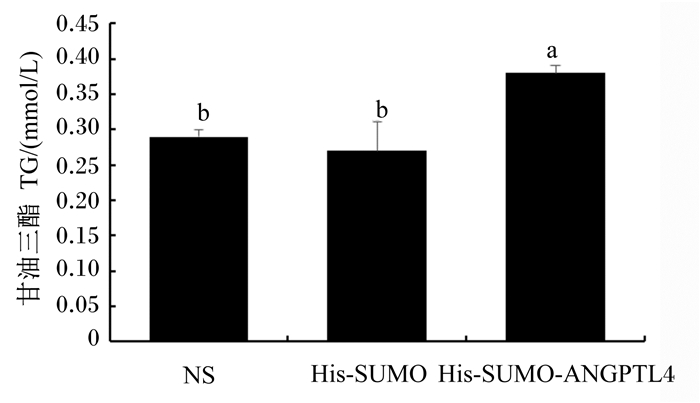
由图 1可知,鸡ANGPTL4重组蛋白组的成肌细胞TG含量显著高于生理盐水组和His-SUMO标签组(P<0.05),但生理盐水组和His-SUMO标签组之间成肌细胞TG含量无显著差异(P>0.05)。
|
NS:生理盐水组normal saline group;His-SUMO:His-SUMO标签组His-SUMO tag group;His-SUMO-ANGPTL4:鸡ANGPTL4重组蛋白组chicken ANGPTL4 recombinant protein group。 数据柱标相同小写字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。Value columns with the same small letter mean no significant difference (P>0.05), while with different small letters mean significant difference (P<0.05). 图 1 鸡ANGPTL4重组蛋白对肉鸡成肌细胞TG含量的影响 Fig. 1 Effects of chicken ANGPTL4 recombinant protein on myoblasts TG content of broilers |
肌内脂肪是脂肪合成、转运、分解的净产物。对于肉鸡而言,其肝脏是合成脂肪酸的主要场所,90%脂肪在此合成[7-9]。脂肪酸合成的过程是首先将线粒体内的乙酰辅酶A利用柠檬酸-丙酮酸循环转运至胞液,然后以乙酰辅酶A为原料合成丙二酸单酰辅酶A,通过循环反应延长碳链得到合成的脂肪酸。在该过程中,ACC、FAS和ME均参与其中。ACC可利用ATP将CO2固定在与酶结合的生物素上并将CO2转移给乙酰辅酶A从而生成丙二酸单酰辅酶A[10]。此反应是脂肪酸合成第一阶段的限速反应,其中ACC发挥了关键性作用[11]。FAS是具备多项功能的一个酶系统,能够催化乙酰辅酶A和丙二酸单酰辅酶A生成棕榈酸,是脂肪酸合成方面主要的限速酶之一,并依靠其数量和活性对动物体脂沉积呈现显著影响[12]。ME参与了柠檬酸-丙酮酸循环,可在胞液中催化苹果酸脱羧,且该过程中产生的烟酰胺腺嘌呤二核苷酸磷酸(NADPH)大多被利用于长链脂肪酸的合成[13]。在本试验中,翅静脉注射500 ng/kg BW鸡ANGPTL4重组蛋白时,FAS mRNA相对表达量和FAS活性显著升高,表明一定剂量的鸡ANGPTL4重组蛋白能通过调控肝脏FAS mRNA表达及其活性来促进脂肪酸碳链的延伸,从而参与脂肪沉积的过程。同时,本试验发现注射一定剂量的鸡ANGPTL4重组蛋白,ME、ACC mRNA相对表达量与无变化的ME、ACC活性呈现出明显的不对应性,其原因可能是鸡ANGPTL4重组蛋白仅参与调控了ME、ACC mRNA的转录,但对其蛋白质翻译无影响。因为脂肪合成过程主要受酶活性的影响,因此,综合ACC、FAS和ME这3种脂肪合成相关酶活性的试验结果可知,鸡ANGPTL4重组蛋白具有促进肉鸡肝脏脂肪合成的作用。
ApoB位于低密度脂蛋白(LDL)的表面,约占总蛋白的97%,是一种在肝脏生成的蛋白质,其能够在乳糜微粒(CM)、极低密度脂蛋白(VLDL)和LDL的合成方面发挥调节作用[14-15],并具有将其转运至肝脏外组织的功能。MTTP是一种位于细胞微粒体和内质网内的脂质转移蛋白,可参与肝细胞中VLDL和小肠细胞中CM的合成和分泌[16],且能在内质网腔作为载体与含有脂蛋白的ApoB结合,以VLDL的形式将脂质转运出肝脏。本试验中,ApoB和MTTP mRNA表达不受鸡ANGPTL4重组蛋白的影响。由此可知,鸡ANGPTL4重组蛋白对于肝脏中脂肪的转出无影响。综合以上肝脏脂肪合成和转出的试验结果可知,鸡ANGPTL4重组蛋白可促进肝脏脂肪的沉积。
目前关于ANGPTL4调控肝脏脂肪代谢的研究主要是集中于鼠上。Mandard等[17]研究发现,高脂饮食状态下,过表达ANGPTL4鼠较野生型鼠的脂肪肝现象更明显。Xu等[18]研究表明,由腺病毒介导的ANGPTL4过表达能够诱发C57小鼠产生高脂血症、肝肿大和脂肪肝症状。由此可见,ANGPTL4与肝脏脂肪代谢密切相关。本试验中,鸡ANGPTL4重组蛋白可促进肝脏脂肪沉积的结果与前人研究结果一致。
LPL是由脂肪细胞、巨噬细胞等实质细胞合成和分泌的一种糖蛋白,多是在紧邻组织器官的小毛细血管内皮管腔面产生作用[19],能将血液中CM和VLDL携带的TG分解出甘油和脂肪酸,并将其作为脂肪组织合成TG的原料,从而促进脂肪沉积。在小鼠和人上已经证实ANGPTL4具有抑制LPL活性的功能[20-23],其抑制LPL活性的机制主要在于其存在His46、谷氨酰胺(Gln)50和Gln53这3个极性氨基酸残基,它们可以将LPL从有活性的二聚体形式转化成无活性的单体形式,从而阻止TG在脂肪细胞的沉积[5, 20]。但在本试验中,翅静脉注射500 ng/kg BW的鸡ANGPTL4重组蛋白显著增加了肉鸡胸肌LPL活性,这与前人的研究结果ANGPTL4抑制人和小鼠LPL活性不一致。通过Uniprot数据可发现,鸡ANGPTL4的1~18氨基酸是信号肽,126~160和171~212氨基酸部位存在不规则卷曲结构,253~473氨基酸是纤维蛋白原样C末端,以BLAST比对发现鸡全长ANGPTL4蛋白序列同人、小鼠的同源性低,均低于45%。由此猜测是因为鸡与人和小鼠的ANGPTL4蛋白序列不同,所以导致不同物种间ANGPTL4对LPL的作用呈现截然不同的效果。另外试验使用的是带有His-SUMO标签的鸡ANGPTL4重组蛋白,这个标签也可能影响鸡ANGPTL4对LPL的作用。通过体外细胞试验证实,鸡ANGPTL4本身具有促进肉鸡胸肌TG沉积的作用,这正与体内动物试验中发现的鸡ANGPTL4促进LPL活性的结果相一致。
4 结论鸡ANGPTL4重组蛋白具有促进肉鸡肝脏和胸肌脂肪沉积的作用,且以500 ng/kg BW注射剂量效果较好。
| [1] |
杨烨. 优质鸡肌内脂肪代谢调控及其与肉质性状关系的研究[D]. 博士学位论文. 北京: 中国农业科学院, 2005. YANG Y. Studies on the metabolism of intramuscular fat in quality chicken and its relationships with meat quality traits[D]. Ph. D. Thesis. Beijing: Chinese Academy of Agricultural Sciences, 2005. (in Chinese) |
| [2] |
司彦培, 刘国华, 刘志云. 益生素的作用机制及其在家禽饲料中的应用进展[J]. 中国家禽, 2016, 38(5): 42-46. SI Y P, LIU G H, LIU Z Y. Research advances on mechanism and application of probiotics in poultry feed[J]. China Poultry, 2016, 38(5): 42-46 (in Chinese). |
| [3] |
张玉仙, 王文利, 曹静, 等. 不同浓度的同源益生素对肉鸡肌肉品质和组织学性状的影响[J]. 中国兽医杂志, 2017, 53(7): 38-41. ZHANG Y X, WANG W L, CAO J, et al. Effects of different concentrations of homologous probiotics on muscle quality and histological properties of broilers[J]. Chinese Journal of Veterinary Medicine, 2017, 53(7): 38-41 (in Chinese). |
| [4] |
赵旭, 丁晓, 杨在宾, 等. 丁酸梭菌对肉鸡腿肌脂肪代谢的影响[J]. 动物营养学报, 2017, 29(8): 2884-2892. ZHAO X, DING X, YANG Z B, et al. Effects of Clostridium butyricum on thigh muscle lipid metabolism of broilers[J]. Chinese Journal of Animal Nutrition, 2017, 29(8): 2884-2892 (in Chinese). DOI:10.3969/j.issn.1006-267x.2017.08.033 |
| [5] |
赵旭, 徐群, 侯彦茹, 等. ANGPTL4在肠道微生物影响动物脂肪代谢中的作用[J]. 生物技术通报, 2020, 36(6): 230-235. ZHAO X, XU Q, HOU Y R, et al. Effects of ANGPTL4 on intestinal microbiota affecting lipid metabolism of animals[J]. Biotechnology Bulletin, 2020, 36(6): 230-235 (in Chinese). |
| [6] |
ZHAO X, HUANG H S, DING X, et al. Angiopoietin-like protein 4 regulates breast muscle lipid metabolism in broilers[J]. Poultry Science, 2021, 100(7): 101159. DOI:10.1016/j.psj.2021.101159 |
| [7] |
ZHANG B, YANG X, GUO Y, et al. Effects of dietary lipids and Clostridium butyricum on serum lipids and lipid-related gene expression in broiler chickens[J]. Animal, 2011, 5(12): 1909-1915. DOI:10.1017/S1751731111001066 |
| [8] |
WEN C, CHEN X, CHEN G Y, et al. Methionine improves breast muscle growth and alters myogenic gene expression in broilers[J]. Journal of Animal Science, 2014, 92(3): 1068-1073. DOI:10.2527/jas.2013-6485 |
| [9] |
张力莉, 徐晓锋. 动物脂肪酸合成酶基因表达调控的研究进展[J]. 畜牧与兽医, 2012, 44(4): 101-103. ZHANG L L, XU X F. Research progress in regulation of fatty acid synthase gene expression in animals[J]. Animal Husbandry & Veterinary Medicine, 2012, 44(4): 101-103 (in Chinese). |
| [10] |
王红, 石宝明. 多不饱和脂肪酸对脂肪代谢酶基因表达的影响[J]. 中国饲料, 2012(1): 5-8. WANG H, SHI B M. Effects of polyunsaturated fatty acid on gene expression of lipid metabolism enzyme[J]. China Feed, 2012(1): 5-8 (in Chinese). DOI:10.3969/j.issn.1004-3314.2012.01.003 |
| [11] |
郑贵花, 夏广军, 尹宝珍. 乙酰辅酶A羧化酶在动物中的研究进展[J]. 现代农业研究, 2019(10): 109-112, 120. ZHENG G H, XIA G J, YIN B Z. Advances in acetyl CoA carboxylase in animals[J]. Modern Agriculture Research, 2019(10): 109-112, 120 (in Chinese). DOI:10.3969/j.issn.1674-0653.2019.10.046 |
| [12] |
杜学海. 影响肉牛肌内脂肪沉积因素及相关基因的研究进展[J]. 现代畜牧兽医, 2020(12): 54-57. DU X H. Brief introduction to the research progress of factors and related genes influencing intramuscular fat deposition in beef cattle[J]. Modern Journal of Animal Husbandry and Veterinary Medicine, 2020(12): 54-57 (in Chinese). |
| [13] |
罗娅, 齐先梅, 王婧. 苹果酸酶1及其对疾病调控的研究进展[J]. 生理科学进展, 2021, 52(3): 181-186. LUO Y, QI X M, WANG J. Advances in malic enzyme 1 and its functions on disease regulation[J]. Progress in Physiological Sciences, 2021, 52(3): 181-186 (in Chinese). DOI:10.3969/j.issn.0559-7765.2021.03.004 |
| [14] |
胡顺霖, 李敏, 叶江锋, 等. 非酒精性脂肪肝患者载脂蛋白B及尿酸水平检测结果分析[J]. 实用临床医药杂志, 2019, 23(8): 25-27. HU S L, LI M, YE J F, et al. Analysis in detection results of apolipoprotein B and uric acid levels in patients with non-alcoholic fatty liver disease[J]. Journal of Clinical Medicine in Practice, 2019, 23(8): 25-27 (in Chinese). |
| [15] |
郭明秋, 殷晓捷, 刁殿琰, 等. 脂质代谢水平与冠状动脉粥样硬化病变的关系[J]. 中国动脉硬化杂志, 2021, 29(2): 149-155. GUO M Q, YIN X J, DIAO D Y, et al. Relationship between the levels of lipid metabolism and coronary atherosclerotic lesions[J]. Chinese Journal of Arteriosclerosis, 2021, 29(2): 149-155 (in Chinese). DOI:10.3969/j.issn.1007-3949.2021.02.010 |
| [16] |
刘黎, 欧阳冬生. 微粒体甘油三酯转移蛋白的功能及临床意义[J]. 国际病理科学与临床杂志, 2009, 29(2): 152-155. LIU L, OUYANG D S. Function and clinical significance of microsomal triglyceride transfer proteins[J]. International Journal of Pathology and Clinical Medicine, 2009, 29(2): 152-155 (in Chinese). |
| [17] |
MANDARD S, ZANDBERGEN F, VAN STRATEN E, et al. The fasting-induced adipose factor/angiopoietin-like protein 4 is physically associated with lipoproteins and governs plasma lipid levels and adiposity[J]. The Journal of Biological Chemistry, 2006, 281(2): 934-944. DOI:10.1074/jbc.M506519200 |
| [18] |
XU A M, LAM M C, CHAN K W, et al. Angiopoietin-like protein 4 decreases blood glucose and improves glucose tolerance but induces hyperlipidemia and hepatic steatosis in mice[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(17): 6086-6091. DOI:10.1073/pnas.0408452102 |
| [19] |
黄海, 米杨, 田苗苗, 等. 膳食脂肪的餐后代谢与脂蛋白脂肪酶研究进展[J]. 食品科学, 2015, 36(9): 235-241. HUANG H, MI Y, TIAN M M, et al. Metabolism of postprandial dietary fat and lipoprotein lipase[J]. Food Science, 2015, 36(9): 235-241 (in Chinese). |
| [20] |
LEI X, SHI F J, BASU D, et al. Proteolytic processing of angiopoietin-like protein 4 by proprotein convertases modulates its inhibitory effects on lipoprotein lipase activity[J]. The Journal of Biological Chemistry, 2011, 286(18): 15747-15756. DOI:10.1074/jbc.M110.217638 |
| [21] |
MATTIJSSEN F, KERSTEN S. Regulation of triglyceride metabolism by Angiopoietin-like proteins[J]. Biochimica et Biophysica Acta, 2012, 1821(5): 782-789. DOI:10.1016/j.bbalip.2011.10.010 |
| [22] |
YAU M H, WANG Y, LAM K S L, et al. A highly conserved motif within the NH2-terminal coiled-coil domain of angiopoietin-like protein 4 confers its inhibitory effects on lipoprotein lipase by disrupting the enzyme dimerization[J]. The Journal of Biological Chemistry, 2009, 284(18): 11942-11952. DOI:10.1074/jbc.M809802200 |
| [23] |
WANG Y, LIU L M, WEI L, et al. Angiopoietin-like protein 4 improves glucose tolerance and insulin resistance but induces liver steatosis in high-fat-diet mice[J]. Molecular Medicine Reports, 2016, 14(4): 3293-3300. DOI:10.3892/mmr.2016.5637 |




