2. 内蒙古农业大学, 呼和浩特 010000
2. Inner Mongolia Agricultural University, Hohhot 010000, China
泌乳开始后,奶牛对葡萄糖的需求增加,因为葡萄糖是合成牛奶所必需的成分。母牛努力弥补能量不足并开始使用体脂肪。快速的脂质动员导致非酯化脂肪酸(NEFA)的浓度增加,其中部分在转移到肝脏后,转化为能量(以ATP的形式),供动物用于所有生命过程。然而,过量的NEFA一部分被代谢生成酮体[丙酮、乙酰乙酸和β-羟丁酸(BHBA)]外,其余部分则以甘油三酯的形式在肝脏中积累。产奶量增加会加剧能量不足和脂肪组织分解,酮体浓度不断增加,最终导致酮症。大多数高产奶牛在泌乳高峰期易发生高酮血症,血浆BHBA浓度显著升高。血浆酮体浓度的升高可增强传染性疾病即子宫炎和乳腺炎的敏感性[1-2]。中性粒细胞(PMN)是先天免疫的第1道防线,并在病原感染的起始中起着重要作用[3]。越来越多的数据表明BHBA在巨噬细胞、单核细胞、脂肪细胞和视网膜色素上皮细胞中具有很强的抗炎活性。体外试验表明,BHBA通过激活G蛋白偶联受体109A(GPR109A)抑制巨噬细胞中促炎细胞因子的产生、低密度脂蛋白摄取和趋化[4]。此外,BHBA可抑制脂多糖(LPS)刺激的单核细胞中肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)和巨噬细胞趋化蛋白-1(MCP-1)的表达[5]。
据报道,与长链脂肪酸相比,短链脂肪酸具有一定的抗炎作用。BHBA是患酮症奶牛脂肪酸在肝脏β-氧化的重要代谢产物,参与奶牛中性粒细胞免疫功能的调节。研究人员发现,BHBA对中性粒细胞功能有毒性作用,奶牛在产后负能量平衡状态下,高浓度BHBA是导致中性粒细胞免疫功能抑制的主要诱因[6-7]。在LPS诱导的乳腺炎中,灌注BHBA和盐水后,白细胞介素-1β(IL-1β)、IL-6、核因子-κB(NF-κB)和TNF-α的mRNA表达水平显著降低,这些结果表明BHBA具有抗炎效应[8]。然而,尚不清楚BHBA对LPS诱导的奶牛中性粒细胞的抗炎作用的详细机制。本研究假设BHBA具有抗炎作用,抑制NF-κBp65蛋白表达,从而抑制促炎细胞因子的分泌。因此,本研究以LPS诱导奶牛中性粒细胞炎症为细胞模型,深入研究BHBA对LPS激活的NF-κB信号通路是否具有抑制作用。
1 材料与方法 1.1 试验材料肝素钠,购于Sigma公司;TNF-α、IL-6和IL-1β酶联免疫吸附测定(ELISA)试剂盒,购于北京索莱宝科技有限公司;Pecoll,购于GE公司;胎牛血清和RPMI-1640培养基,购自于Gibco公司;二十四孔板和滤器等,购自于Corning公司;核因子-κB抑制物激酶β(IKKβ)激酶活性检测试剂盒,购于Genmend公司;LPS和BHBA粉末,购于Sigma公司;抗体NF-κBp65和磷酸化核因子-κBp65(p-NF-κBp65),购于CST公司;化学发光溶液(ECL),购于Millipore公司。
1.2 试验方法 1.2.1 中性粒细胞分离中性粒细胞分离于经产奶牛(内蒙古民族大学),具体操作如下:颈静脉采血50 mL于含0.1 mL肝素作为抗凝剂离心管中,抗凝血用磷酸盐缓冲液(PBS)1 ∶ 1稀释,置于Percoll密度梯度分离液上,800×g离心25 min后,从上至下,液面分为4层,分别为血浆层、淋巴细胞和单核细胞层、中性粒细胞层及红细胞层,去除血浆、淋巴细胞和单核细胞后,加入红细胞裂解液裂解红细胞,经过2次洗涤后除去细胞碎片以及红细胞内容物,沉淀细胞即为中性粒细胞。
1.2.2 细胞培养用含10%胎牛血清的RMI-1640培养基调整细胞密度为2×106个/mL,接种于24孔培养板内,37 ℃、5% CO2预培养30 min,使用0.5、1.0、2.0、4.0 mmol/L BHBA处理细胞6 h后,添加LPS(100 ng/mL)作用1 h,收集细胞及培养液上清,用于RNA提取和指标测定。同时设不进行BHBA和LPS处理的对照组和仅进行LPS处理的LPS组。
1.2.3 实时荧光定量PCR(qRT-PCR)法检测IL-1β、IL-6、TNF-α和NF-κBp65 mRNA表达水平中性粒细胞经不同浓度BHBA和/或LPS处理后,收集细胞样品,提取总RNA,用反转录试剂盒(TaKaRa)将提取的RNA反转录成单链cDNA。根据GenBank中IL-1β、IL-6、TNF-α、NF-κBp65和β-肌动蛋白(β-actin)基因序列和引物设计原则,利用Primer premier 6.0软件设计引物。荧光定量PCR反应体系(20 μL)如下:Rox 10 μL,上游引物1 μL, 下游引物1 μL, 模板cDNA 1 μL,ddH2O 7 μL。反应条件为:95 ℃预变性3 min,95 ℃变性30 s,60 ℃退火15 s,共计40个循环。使用ABI7500型荧光定量PCR扩增仪(美国ABI公司)进行实时荧光定量PCR(qRT-PCR)。
1.2.4 比色法测定IKKβ激酶活性中性粒细胞经不同浓度BHBA和/或LPS处理后,收集细胞样品。在4 ℃条件下,使用清洗液以300×g离心清洗细胞2次,每次5 min;裂解液裂解细胞,冰浴30 min;在4 ℃条件下16 000×g离心5 min,取细胞上清液用于IKKβ激酶活性检测,按照IKKβ激酶活性检测试剂盒说明进行操作。
1.2.5 ELISA法测定促炎细胞因子TNF-α、IL-6和IL-1β分泌量将1.2.2中收集的培养液上清1 000×g离心10 min,按照试剂盒说明检测促炎细胞因子TNF-α、IL-6和IL-1β分泌量。
1.2.6 Western blot法检测NF-κBp65蛋白表达水平中性粒细胞经不同浓度BHBA和/或LPS处理后,收集细胞样品。使用RIPA裂解液提取细胞总蛋白,按照20 μg上样量分装,并加入相应的4×十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS PAGE)蛋白上样缓冲液(SDS PAGE loading buffer),1 000×g离心5 min,混匀后放入95 ℃水浴锅中煮5 min使蛋白质变性,12%分离胶进行电泳,然后将蛋白质电泳转移到聚偏二氟乙烯(PVDF)膜上。在室温下,将膜在5%牛血清白蛋白(BSA)中封闭2 h,然后将膜与特定的抗体NF-κBp65和p-NF-κBp65孵育,4 ℃过夜,然后将膜与二抗孵育1 h,用增强的化学发光溶液检测到免疫反应带,使用Protein Simple Imager分析条带。
1.3 数据处理与分析采用SPSS 17.0软件的单因素方差(one-way ANOVA)程序进行方差分析和LSD多重比较,试验数据用平均值±标准误(mean±SE)表示,每个试验分组3个重复,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析 2.1 BHBA抑制LPS诱导的奶牛中性粒细胞促炎细胞因子mRNA的表达如图 1所示,与对照组相比,LPS处理极显著增加了IL-1β、IL-6和TNF-α mRNA表达水平(P<0.01)。与LPS组相比,0.5 mmol/L BHBA+LPS组中IL-1β、IL-6和TNF-α mRNA表达水平显著降低(P<0.05);1.0 mmol/L BHBA+LPS组中IL-1β mRNA表达水平极显著降低(P<0.01),IL-6和TNF-α mRNA表达水平显著降低(P<0.05);2.0 mmol/L BHBA+LPS组和4.0 mmol/L BHBA+LPS组中IL-1β、IL-6和TNF-α mRNA表达水平均极显著降低(P<0.01)。这些结果表明BHBA可能具有抗炎作用。
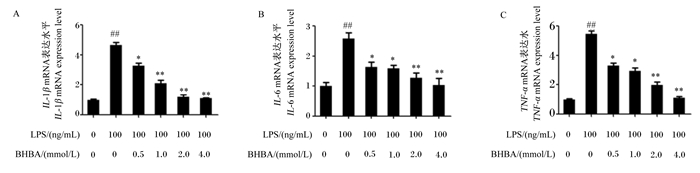
|
LPS: 脂多糖;BHBA: β-羟丁酸。LPS组(0 mmol/L BHBA+100 ng/mL LPS)与对照组(0 mmol/L BHBA+100 ng/mL LPS)相比较:#表示差异显著(P<0.05),##表示差异极显著(P<0.01)。LPS+BHBA组与LPS组相比较:*表示差异显著(P<0.05),* *表示差异极显著(P<0.01)。下图同。 LPS: lipopolysaccharide; BHBA: β-hydroxybutyrate. LPS group (0 mmol/L BHBA+100 ng/mL LPS) vs control group (0 mmol/L BHBA+100 ng/mL LPS): # mean significant difference (P < 0.05), and ## mean extremely significant difference (P < 0.01). LPS+BHBA group vs LPS group: * mean significant difference (P < 0.05), and ** mean extremely significant difference (P < 0.01). The same as below. 图 1 中性粒细胞中IL-1β、IL-6和TNF-α mRNA表达水平 Fig. 1 mRNA expression levels of IL-1β, IL-6 and TNF-α in neutrophils |
如图 2所示,与对照组相比,LPS处理极显著增加IKKβ活性和NF-κBp65 mRNA表达水平(P<0.01)。与LPS组相比较,0.5 mmol/L BHBA+LPS组中IKKβ激酶活性极显著降低(P<0.01),NF-κBp65 mRNA表达水平显著降低(P<0.05);1.0、2.0和4.0 mmol/L BHBA+LPS组中IKKβ激酶活性和NF-κBp65 mRNA表达水平均极显著降低(P<0.01)。这些结果进一步表明BHBA可能通过抑制NF-κBp65信号通路发挥抗炎作用。
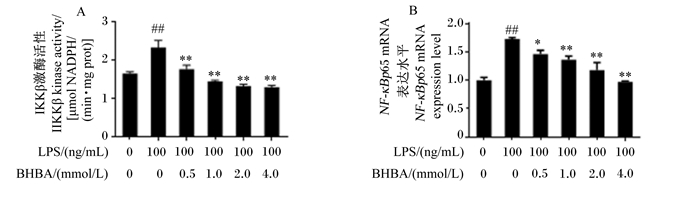
|
图 2 中性粒细胞中IKKβ激酶活性和NF-κBp65 mRNA表达水平 Fig. 2 Activity of IKKβ kinase and NF-κBp65 mRNA expression level in neutrophils |
如图 3所示,与对照组相比,LPS处理极显著增加了NF-κBp65蛋白表达水平(P<0.01)。与LPS组相比较,0.5 mmol/L BHBA+LPS组中NF-κBp65蛋白表达水平显著下降(P<0.05),1.0、2.0和4.0 mmol/L BHBA+LPS组中NF-κBp65蛋白表达水平极显著下降(P<0.01)。这些结果进一步表明BHBA可抑制核转录因子NF-κBp65的表达,从而发挥抗炎作用。
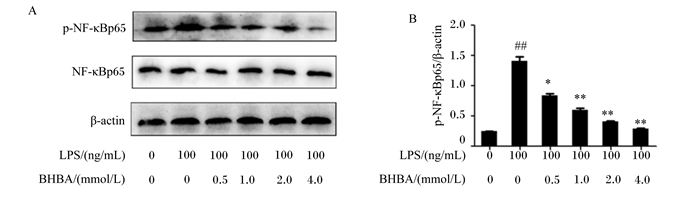
|
p-NF-κBp65: 磷酸化核因子-κBp65 phosphorylated nuclear factor-κBp65;NF-κBp65: 核因子-κBp65 nuclear factor-κBp65;β-actin:β-肌动蛋白。 图 3 中性粒细胞中NF-κBp65蛋白表达水平 Fig. 3 Protein expression level of NF-κBp65 in neutrophils |
如图 4所示,与对照组相比,LPS处理极显著增加了IL-1β和TNF-α的分泌量(P<0.01),显著增加了IL-6的分泌量(P<0.05)。与LPS组相比较,0.5、1.0、2.0和4.0 mmol/L BHBA+LPS组中IL-1β和TNF-α分泌量均极显著降低(P<0.01);0.5和1.0 mmol/L BHBA+LPS组中IL-6分泌量显著降低(P<0.05),2.0和4.0 mmol/L BHBA+LPS组中IL-6分泌量极显著降低(P<0.01)。这些结果进一步确定了BHBA可以抑制LPS诱导的奶牛中性粒细胞炎症信号通路的激活。
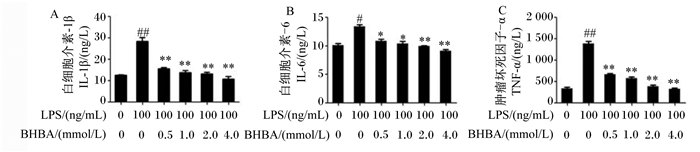
|
图 4 中性粒细胞中IL-1β、IL-6和TNF-α分泌量 Fig. 4 Secretion amounts of IL-1β, IL-6 and TNF-α in neutrophils |
酮症是高产奶牛高发的营养代谢疾病,在围产期表现出负能量平衡,其特征是血液中NEFA和BHBA浓度较高。根据有无临床表现,酮症通常分为临床和亚临床型酮症[9]。酮症主要发生在高产奶牛泌乳的第1阶段,最初,酮症病程较轻,没有明显的临床症状,也称为亚临床酮症,这仅通过血液中BHBA浓度的增加来证明血清和尿液中酮体的存在,通常涉及牛群中大约40%的奶牛,在极端情况下,它甚至可以涉及80%的奶牛[10-11]。亚临床型酮症在没有适当干预的情况下发展最终发展成临床型酮症,其特征是血液中的BHBA浓度增加,尿液和牛奶中存在酮体,以及其他症状,例如食欲不振、体重迅速下降、大便干燥、产奶量下降[12]。酮症使奶牛对传染病、代谢疾病和生殖障碍的易感性增加,从而造成巨大经济损失。患有酮症的奶牛会出现食欲不振、产奶量减少和牛奶成分发生改变[13-15]。酮症发生时,血液中BHBA的浓度会显著增加,从而引起肝脏损伤、氧化应激和一系列生理代谢紊乱。这些因素随后影响奶牛的免疫功能和生殖能力,导致其他产后疾病[16]。血液中BHBA的浓度与传染性疾病的炎症反应应答能力有关,例如牛乳腺炎和子宫炎。研究还显示,与子宫健康的母牛相比,围产期患有产后和亚临床子宫内膜炎的母牛的血液中性粒细胞功能显著受损,血液中BHBA浓度更高[17]。因此,BHBA对炎症反应应答的调节至关重要。
短链脂肪酸是脂肪酸分解代谢的重要中间体,据报道,未羟基化修饰的丁酸可有效治疗多种炎性和自身免疫性疾病,例如结肠炎和实验性变应性脑脊髓炎[18-19]。体内使用BHBA可以部分保护1-甲基-4-苯基-1, 2, 3, 6-四氢吡啶(MPTP)引起的多巴胺能神经退行性病变和运动功能障碍,从而改善线粒体呼吸和ATP的产生[20-21]。有研究者证明BHBA可以延长转基因R6/2小鼠的寿命,减轻运动功能障碍,并防止纹状体组蛋白去乙酰化[22-23]。以上研究进展足以说明BHBA具有正向活性调节功能。免疫学参数的改变取决于BHBA的浓度,它们的浓度会随着酮体浓度的增加而增加[11, 24]。促炎细胞因子通常被用作炎症标志物,在评估这些标志物的基础上,已经证明炎症和代谢性疾病之间存在相关性[25-28]。此外,炎症和免疫反应的标志物作为奶牛健康的标志物可能具有重要的预后功能[29-30]。疾病分期是在BHBA定量评价的基础上确定的,根据文献,BHBA是用于诊断和评价奶牛酮症最有用、最可靠的酮体[15]。此外,疾病严重程度的评估是基于可见的酮症临床体征,这也是至关重要的,因为它有助于加速诊断和适当的治疗程序。在本研究中,关于酮体与免疫系统的关系,比较验证了BHBA对炎症评估参数的影响,表现出BHBA浓度是最重要的,随着疾病的进展(BHBA浓度增加),免疫系统参数的研究有望取得进展[31-32]。本研究中,qRT-PCR检测结果表明,与对照组相比,LPS处理极显著上调了IL-1β、IL-6和TNF-α mRNA的表达,这证明了LPS可以激活炎症信号通路;BHBA和LPS混合处理则表现出抑制促炎细胞因子IL-1β、IL-6和TNF-α mRNA的表达,这证明了BHBA抑制炎症信号通路的活化。
NF-κB是转录因子家族成员,可调节重要生理过程,例如生存、炎症和免疫反应有关基因的表达。在正常细胞中,NF-κB以无活性的异二聚体形式存于细胞质中,该异二聚体由2个亚基p50和p65组成,与其抑制蛋白(IκBα)形成复合物。当细胞被某些炎症刺激激活时,IκBα被磷酸化,引起快速降解,随后NF-κB从IκBα上解离。磷酸化的IκBα被蛋白酶体迅速降解,从而导致NF-κBp65转入细胞核,并与靶基因启动子中存在的特定DNA序列结合[33]。IKKβ激酶具有丝氨酸蛋白激酶的活性,可磷酸化底物IκBα,一旦活性增强,则可激活NF-κB信号通路,释放促炎细胞因子。几项流行病学研究表明,酮症与乳腺炎和子宫炎等传染病的易感性增加之间存在关联[34]。促炎细胞因子在激活全身炎症反应中起关键作用,急性期蛋白已被用作炎症的非特异性生物标志物[35-36]。文献资料显示,IL-6和TNF-α可能影响多种疾病的发生,包括代谢性的和非代谢性的[37-39]。已有研究证明,IL-6浓度升高与脂质和蛋白质代谢受损、脂肪酸代谢受损甚至氧化应激的发生存在严格的相关性。上述一种或所有过程的功能障碍可能导致酮症发展、肝脏损害和衰竭[37]。有研究认为,IL-6在分娩前33和23天出现升高,也可能导致奶牛其他产后疾病的发生,如真胃变位或胎盘滞留[38]。同样,在人类中,TNF-α作为促炎细胞因子参与多种代谢性疾病的发病机制,主要是慢性疾病,如糖尿病导致的胰岛素抵抗和脂肪酸代谢紊乱[39]。在脂肪肝综合征奶牛中,TNF-α浓度增加与胰岛素抵抗和脂肪酸代谢紊乱之间的相关性已被描述[24, 40]。此外,IL-6和TNF-α可能通过减少饲料消耗、诱导胰岛素抵抗和直接启动脂肪分解来刺激机体脂肪组织的分解[41]。这些过程与奶牛的酮症发展密切相关。Zhang等[11]在奶牛分娩前4周发现血液中IL-6和TNF-α浓度升高,这表明,即使在分娩前,也就是酮症发展之前,也存在急性期反应。BHBA是GPR109A的生理配体,相关研究表明BHBA不能抑制TNF-α诱导GGPR109A-/-小鼠原代视网膜色素上皮细胞IL-6的分泌,论证了BHBA可通过GPR109A发挥抗炎作用[42],说明BHBA具有抗炎作用。本研究中,BHBA显著抑制IKKβ活性及NF-κBp65蛋白的表达,这进一步证明BHBA可抑制NF-κBp65的转录,从而抑制下游炎症细胞因子的释放。
4 结论本研究证实,高浓度BHBA抑制LPS诱导的中性粒细胞中NF-κB信号通路的激活,从而抑制炎症反应应答,发挥抗炎作用。
| [1] |
PAAPE M J, CAPUCO A V, GUIDRY A J, et al. Morphology, function, and adaptation of mammary cells in normal and disease states[J]. Journal of Animal Science, 1995, 73(suppl_2): 1-17. DOI:10.2527/1995.73suppl_21x |
| [2] |
CAI T Q, WESTON P G, LUND L A, et al. Association between neutrophil functions and periparturient disorders in cows[J]. American Journal of Veterinary Research, 1994, 55(7): 934-943. |
| [3] |
SAAD A M, CONCHA C, ASTRÖM G. Alterations in neutrophil phagocytosis and lymphocyte blastogenesis in dairy cows around parturition[J]. Journal of Veterinary Medicine.Series B, 1989, 36(5): 337-345. |
| [4] |
ZANDI-NEJAD K, TAKAKURA A, JUREWICZ M, et al. The role of HCA2 (GPR109A) in regulating macrophage function[J]. FASEB Journal, 2013, 27(11): 4366-4374. DOI:10.1096/fj.12-223933 |
| [5] |
CHEN G X, FU S P, FENG W Q, et al. AMP010014A09 in Sus scrofa encodes an analog of G protein-coupled receptor 109a, which mediates the anti-inflammatory effects of beta-hydroxybutyric acid[J]. Cellular Physiology and Biochemistry, 2017, 42(4): 1420-1430. DOI:10.1159/000479206 |
| [6] |
BRONZO V, LOPREIATO V, RIVA F, et al. The role of innate immune response and microbiome in resilience of dairy cattle to disease: the mastitis model[J]. Animals, 2020, 10(8): 1397. DOI:10.3390/ani10081397 |
| [7] |
GRAUGNARD D E, BIONAZ M, TREVISI E, et al. Blood immunometabolic indices and polymorphonuclear neutrophil function in peripartum dairy cows are altered by level of dietary energy prepartum[J]. Journal of Dairy Science, 2012, 95(4): 1749-1758. DOI:10.3168/jds.2011-4579 |
| [8] |
ZARRIN M, WELLNITZ O, VAN DORLAND H A, et al. Induced hyperketonemia affects the mammary immune response during lipopolysaccharide challenge in dairy cows[J]. Journal of Dairy Science, 2014, 97(1): 330-339. DOI:10.3168/jds.2013-7222 |
| [9] |
VANHOLDER T, PAPEN J, BEMERS R, et al. Risk factors for subclinical and clinical ketosis and association with production parameters in dairy cows in the Netherlands[J]. Journal of Dairy Science, 2015, 98(2): 880-888. DOI:10.3168/jds.2014-8362 |
| [10] |
DUFFIELD T. Subclinical ketosis in lactating dairy cattle[J]. Veterinary Clinics of North America: Food Animal Practice, 2000, 16(2): 231-253. DOI:10.1016/S0749-0720(15)30103-1 |
| [11] |
ZHANG G S, HAILEMARIAM D, DERVISHI E, et al. Dairy cows affected by ketosis show alterations in innate immunity and lipid and carbohydrate metabolism during the dry off period and postpartum[J]. Research in Veterinary Science, 2016, 107: 246-256. DOI:10.1016/j.rvsc.2016.06.012 |
| [12] |
GORDON J L, LEBLANC S J, DUFFIELD T F. Ketosis treatment in lactating dairy cattle[J]. Veterinary Clinics of North America: Food Animal Practice, 2013, 29(2): 433-445. DOI:10.1016/j.cvfa.2013.03.001 |
| [13] |
BAIRD D G. Primary ketosis in the high-producing dairy cow: clinical and subclinical disorders, treatment, prevention, and outlook[J]. Journal of Dairy Science, 1982, 65(1): 1-10. DOI:10.3168/jds.S0022-0302(82)82146-2 |
| [14] |
DUFFIELD T F, LISSEMORE K D, MCBRIDE B W, et al. Impact of hyperketonemia in early lactation dairy cows on health and production[J]. Journal of Dairy Science, 2009, 92(2): 571-580. DOI:10.3168/jds.2008-1507 |
| [15] |
MCART J A A, NYDAM D V, OETZEL G R. Epidemiology of subclinical ketosis in early lactation dairy cattle[J]. Journal of Dairy Science, 2012, 95(9): 5056-5066. DOI:10.3168/jds.2012-5443 |
| [16] |
YOUSSEF M, EL-ASHKER M. Significance of insulin resistance and oxidative stress in dairy cattle with subclinical ketosis during the transition period[J]. Tropical Animal Health and Production, 2017, 49(2): 239-244. DOI:10.1007/s11250-016-1211-6 |
| [17] |
HAMMON D S, EVJEN I M, DHIMAN T R, et al. Neutrophil function and energy status in Holstein cows with uterine health disorders[J]. Veterinary Immunology and Immunopathology, 2006, 113(1/2): 21-29. |
| [18] |
SINGH N, GURAV A, SIVAPRAKASAM S, et al. Activation of Gpr109a, receptor for niacin and the commensal metabolite butyrate, suppresses colonic inflammation and carcinogenesis[J]. Immunity, 2014, 40(1): 128-139. DOI:10.1016/j.immuni.2013.12.007 |
| [19] |
CHEN H, ASSMANN J C, KRENZ A, et al. Hydroxycarboxylic acid receptor 2 mediates dimethyl fumarate's protective effect in EAE[J]. The Journal of Clinical Investigation, 2014, 124(5): 2188-2192. DOI:10.1172/JCI72151 |
| [20] |
HAN Y M, RAMPRASATH T, ZOU M H. β-hydroxybutyrate and its metabolic effects on age-associated pathology[J]. Experimental & Molecular Medicine, 2020, 52(4): 548-555. |
| [21] |
TIEU K, PERIER C, CASPERSEN C, et al. D-beta-hydroxybutyrate rescues mitochondrial respiration and mitigates features of Parkinson disease[J]. Journal of Clinical Investigation, 2003, 112(6): 892-901. DOI:10.1172/JCI200318797 |
| [22] |
NORWITZ N G, HU M T, CLARKE K. The mechanisms by which the ketone body D-β-hydroxybutyrate may improve the multiple cellular pathologies of Parkinson's disease[J]. Frontiers in Nutrition, 2019, 6: 63. DOI:10.3389/fnut.2019.00063 |
| [23] |
LIM S, CHESSER A S, GRIMA J C, et al. D-β-hydroxybutyrate is protective in mouse models of Huntington's disease[J]. PLoS One, 2011, 6(9): e24620. DOI:10.1371/journal.pone.0024620 |
| [24] |
AMETAJ B N, BRADFORD B J, BOBE G, et al. Strong relationships between mediators of the acute phase response and fatty liver in dairy cows[J]. Canadian Journal of Animal Science, 2005, 85(2): 165-175. DOI:10.4141/A04-043 |
| [25] |
BRODZKI P, KOSTRO K, KRAKOWSKI L, et al. Inflammatory cytokine and acute phase protein concentrations in the peripheral blood and uterine washings of cows with subclinical endometritis in the late postpartum period[J]. Veterinary Research Communications, 2015, 39(2): 143-149. DOI:10.1007/s11259-015-9635-4 |
| [26] |
PETERSEN H H, NIELSEN J P, HEEGAARD P M H. Application of acute phase protein measurements in veterinary clinical chemistry[J]. Veterinary Research, 2004, 35(2): 163-187. DOI:10.1051/vetres:2004002 |
| [27] |
TÓTHOVÁ C, NAGY O, SEIDEL H, et al. Acute phase proteins in relation to various inflammatory diseases of calves[J]. Comparative Clinical Pathology, 2012, 21(5): 1037-1042. DOI:10.1007/s00580-011-1224-5 |
| [28] |
TOTHOVA C, NAGY O, KOVAC G. Acute phase proteins and their use in the diagnosis of diseases in ruminants: a review[J]. Veterinární Medicína, 2014, 59(4): 163-180. |
| [29] |
AMETAJ B N, HOSSEINI A, ODHIAMBO J F, et al. Application of acute phase proteins for monitoring inflammatory states in cattle[M]//VEAS F. Acute phase proteins as early non-specific biomarkers of human and veterinary diseases. London: IntechOpen, 2011: 299-354.
|
| [30] |
TREVISI E, AMADORI M, COGROSSI S, et al. Metabolic stress and inflammatory response in high-yielding, periparturient dairy cows[J]. Research in Veterinary Science, 2012, 93(2): 695-704. DOI:10.1016/j.rvsc.2011.11.008 |
| [31] |
ABUAJAMIEH M, KVIDERA S K, SANZ FERNANDEZ M V, et al. Inflammatory biomarkers are associated with ketosis in periparturient Holstein cows[J]. Research in Veterinary Science, 2016, 109: 81-85. DOI:10.1016/j.rvsc.2016.09.015 |
| [32] |
EL-DEEB W M, EL-BAHR S M. Biomarkers of ketosis in dairy cows at postparturient period: acute phase proteins and pro-inflammatory cytokines[J]. Veterinarski Arhiv, 2017, 87(4): 431-440. DOI:10.24099/vet.arhiv.160126c |
| [33] |
RUOCCO M G, MAEDA S, PARK J M, et al. IκB kinase (IKK)β, but not IKKα, is a critical mediator of osteoclast survival and is required for inflammation-induced bone loss[J]. Journal of Experimental Medicine, 2005, 201(10): 1677-1687. DOI:10.1084/jem.20042081 |
| [34] |
ERB H N, GROHN Y T. Epidemiology of metabolic disorders in the periparturient dairy cow[J]. Journal of Dairy Science, 1988, 71(9): 2557-2571. DOI:10.3168/jds.S0022-0302(88)79845-8 |
| [35] |
PETERSEN H H, NIELSEN J P, HEEGAARD P M H. Application of acute phase protein measurements in veterinary clinical chemistry[J]. Veterinary Research, 2004, 35(2): 163-187. DOI:10.1051/vetres:2004002 |
| [36] |
DANTZER R, KELLEY K W. Twenty years of research on cytokine-induced sickness behavior[J]. Brain Behavior and Immunity, 2007, 21(2): 153-160. DOI:10.1016/j.bbi.2006.09.006 |
| [37] |
LOOR J J, EVERTS R E, BIONAZ M, et al. Nutrition-induced ketosis alters metabolic and signaling gene networks in liver of periparturient dairy cows[J]. Physiological Genomics, 2007, 32(1): 105-116. DOI:10.1152/physiolgenomics.00188.2007 |
| [38] |
AMADORI M, FUSI F, BILATO D, et al. Disease risk assessment by clinical immunology analyses in periparturient dairy cows[J]. Research in Veterinary Science, 2015, 102: 25-26. DOI:10.1016/j.rvsc.2015.07.002 |
| [39] |
POPA C, NETEA M G, VAN RIEL P L, et al. The role of TNF-alpha in chronic inflammatory conditions, intermediary metabolism, and cardiovascular risk[J]. Journal of Lipid Research, 2007, 48(4): 751-762. DOI:10.1194/jlr.R600021-JLR200 |
| [40] |
OHTSUKA H, KOIWA M, HATSUGAYA A, et al. Relationship between serum TNF activity and insulin resistance in dairy cows affected with naturally occurring fatty liver[J]. The Journal of Veterinary Medical Science, 2001, 63(9): 1021-1025. DOI:10.1292/jvms.63.1021 |
| [41] |
KUSHIBIKI S, HODATE K, SHINGU H, et al. Metabolic and lactational responses during recombinant bovine tumor necrosis factor-alpha treatment in lactating cows[J]. Journal of Dairy Science, 2003, 86(3): 819-827. DOI:10.3168/jds.S0022-0302(03)73664-9 |
| [42] |
GAMBHIR D, ANANTH S, VEERANAN-KARMEGAM R, et al. GPR109A as an anti-inflammatory receptor in retinal pigment epithelial cells and its relevance to diabetic retinopathy[J]. Investigative Ophthalmology & Visual Science, 2012, 53(4): 2208-2217. |




