2. 浙江海洋大学水产学院, 舟山 316000;
3. 中国海洋大学, 海洋生物遗传学与育种教育部重点实验室, 青岛 266003
2. College of Fisheries, Zhejiang Ocean University, Zhoushan 316000, China;
3. Key Laboratory of Marine Genetics and Breeding, Ministry of Education, Ocean University of China, Qingdao 266003, China
肠道不仅是鱼类消化吸收的重要器官,也是其免疫系统的重要组成部分,直接影响鱼体健康。鱼类肠道由多种细胞组成,其中,肠道上皮细胞(intestinal epithelial cell,IECs)是肠道的主要功能细胞,参与肠道内食物的消化、吸收、免疫屏障和应激反应等。因此,肠道上皮细胞是研究肠道生理功能、药物代谢及病理变化的重要细胞模型[1]。其中,体外培养肠道上皮细胞是研究外源物质(如营养素)对肠道上皮细胞作用及各种致病因素导致肠黏膜病理改变的发病机制的重要途径[2]。因此,建立鱼类肠道上皮细胞体外培养方法具有非常重要的意义。
目前,鱼类肠道上皮细胞原代培养方法在多种海、淡水鱼类中已有相关报道,如斑带副鲈(Paralabrax maculatofasciatus)[3]、鲫鱼(Carassius auratus)[1]、鲤鱼(Cyprinus carpio)[4]、大西洋鳕鱼(Gadus morhua)[5]、草鱼(Ctenopharyngodon idellus)[6]和牙鲆(Paralichthys olivaceus)[7]等。尤其在虹鳟(Oncorhynchus mykiss)中,Kawano等[8]首次建立了呈上皮样形态的肠道细胞系——RTgutGC细胞系,已经成功传代100次以上。建立肠道上皮细胞培养方法可为研究鱼类肠道健康问题提供重要的体外试验材料。一些学者利用体外培养的肠道上皮细胞分析了不同抗营养因子[4, 6]或植物化学成分[9]对其细胞活力、形态及功能的影响;在大西洋鳕鱼中,学者们利用肠道上皮细胞研究了益生菌和海藻酸对其免疫调节作用[5, 10];Antony等[11]则利用虹鳟RTgutGC细胞系进行了鱼类营养吸收机制的研究。因此,体外培养肠道上皮细胞在鱼类营养学、免疫学及生理生化等方面的研究中具有非常重要的应用价值。
黄姑鱼(Nibea albiflora)隶属于鲈形目(Perciformes),石首鱼科(Sciaenidae),黄姑鱼属(Nibea),是我国东南沿海重要的海水养殖鱼类。其养殖规模在福建省、浙江省不断扩大,已经成为网箱养殖的重要品种。目前,在黄姑鱼营养饲料研发中,我们发现高比例豆粕饲料会造成黄姑鱼食源性肠道损伤[12],此外,集约化养殖环境下肠道病菌性感染经常引发黄姑鱼的大量死亡,造成了严重的经济损失。然而,由于缺乏黄姑鱼肠道上皮细胞模型,限制了黄姑鱼肠道上皮细胞的生理功能和病菌致病机制的进一步研究。尽管已经在一些鱼类上建立了肠道上皮细胞的原代培养方法,但是由于鱼种的不同,其所用的细胞培养条件和方法亦有所不同,所以需要针对特定的鱼种进行肠道上皮细胞分离及培养条件的摸索工作。因此,本研究旨在建立一种快速有效的黄姑鱼肠道上皮细胞分离培养及鉴定方法,为开展黄姑鱼肠道功能和病理机制等研究提供体外肠道上皮细胞模型,并为海水鱼类肠道功能及其相关发病机制的研究提供技术支撑。
1 材料与方法 1.1 试验材料试验用黄姑鱼取自浙江省海洋水产研究所西轩渔业科技岛,体重为(40.5±2.5) g。取健康活泼的试验鱼饲养于含抗生素的水体中,禁食2 d后用于本试验。
1.2 主要仪器与试剂主要仪器:二氧化碳(CO2)培养箱(371,美国Thermo公司)、倒置显微成像系统(DMi8,德国Leica公司)、正置荧光显微镜(Eclipse C1,日本Nikon公司)、脱色摇床(TSY-B,武汉赛维尔生物科技有限公司)、分光光度计(NanoDrop 2000,美国Thermo公司)。
主要试剂:DMEM/F12培养基(美国Gibco公司)、胎牛血清(美国Gibco公司)、Penicillin-Streptomycin双抗(美国Hyclone公司)、胶原蛋白酶(美国Worthington公司)、透明质酸酶(美国Worthington公司)、胰蛋白酶(美国Worthington公司)、DNAase Ⅰ(日本TaKaRa公司)、青霉素G钠盐和硫酸链霉素(上海生工生物工程有限公司)、磷酸盐缓冲液(PBS,G0002,武汉赛维尔生物科技有限公司)、破膜工作液(G1204,武汉赛维尔生物科技有限公司)、牛血清白蛋白(BSA,G5001,武汉赛维尔生物科技有限公司)、一抗[兔来源细胞角蛋白-18(CK-18),武汉赛维尔生物科技有限公司]、二抗[山羊抗兔免疫球蛋白G(IgG) H&L(Alexa Fluor®488),武汉赛维尔生物科技有限公司]、4', 6-二脒基-2-苯基吲哚二盐酸盐(DAPI)(G1012,武汉赛维尔生物科技有限公司)、抗荧光淬灭封皮剂(G1401,武汉赛维尔生物科技有限公司)。
1.3 试验材料前处理及细胞分离黄姑鱼肠道上皮细胞分离方法参照宋增福等[1]和Zhang等[7]的方法,并经过多次预试验后作了一定修改。具体方法如下:1)在无菌室中,取禁食2 d后的黄姑鱼于托盘中,敲打头部致死,体表及鱼体周围用70%酒精消毒;2)取出肠道,剪除肠系膜,纵行剪开肠壁,浸没在含有Penicillin-Streptomycin双抗的PBS溶液中冲洗数次,然后加适量DMEM/F12培养基于培养皿中,在解剖镜下去除肠道上脂肪和腹膜等;3)将肠道转移至加适量(可完全浸没肠道组织)DMEM/F12培养基的小烧杯中,将肠道组织剪碎至小于1 mm3的组织块;4)用约3倍体积的DMEM/F12培养基清洗肠道组织块,4 ℃、200×g离心5 min,重复3次;5)加入约4倍体积的蛋白酶消化液[胰蛋白酶0.25%、胶原蛋白酶1 mg/mL、透明质酸酶0.16 mg/mL、胎牛血清(FBS)5%、DNase Ⅰ 0.05%溶于DMEM/F12培养基]到15 mL离心管中,置于恒温培养振荡器中27 ℃消化;分别在0、20、40、60、80 min时,用枪轻轻吹打混匀,取适量混匀消化液用台盼蓝染色细胞,在显微镜下检查消化情况,并将同一时间点残留的肠道组织取出适量进行苏木精-伊红(HE)染色,观察肠道消化后的情况,以确定最佳消化终止时间;6)用30 μm细胞筛过滤消化液至50 mL离心管中,4 ℃、200×g离心5 min,重复2次;最后弃上清,加1 mL DMEM/F12培养基重悬细胞。
1.4 黄姑鱼肠道上皮细胞原代培养及传代培养原代培养:将重悬的细胞调整细胞密度为1×105个/孔,并将细胞接种到铺有Ⅰ型胶原蛋白的6孔细胞培养板中。每孔加细胞培养液2 mL[含表皮生长因子(EGF)0.01 mg/L、胎牛血清5%、转铁蛋白0.02 mg/mL、胰岛素220 U/L、胰岛素样生长因子-Ⅰ(IGF-Ⅰ)70 ng/mL、肝素100 mg/mL、Penicillin-Streptomycin双抗100 U/mL],接种后在27 ℃、5% CO2恒温培养箱中进行培养。根据成纤维细胞和上皮细胞的贴壁时间不同,成纤维细胞贴壁速度比上皮细胞快,在培养90 min后,把培养液连同未贴壁的细胞转入新的培养板继续培养。在原代培养过程中,每48 h更换1次培养液,培养7 d后基本铺满底壁。
传代培养:培养7~9 d后,在倒置显微镜下观察细胞生长状态和形态特征,当细胞生长至80%~90%或铺满底壁时,即可进行传代培养。传代培养时移去培养液,加入0.25%胰蛋白酶消化液;在倒置显微镜下观察,1~2 min后当细胞回缩、变圆、成团的漂浮于消化液中时立即用DMEM/F12含5%血清终止消化,稍倾斜6孔板,加入适量培养液,轻柔吹打直至细胞完全脱离孔板;收集细胞,200×g离心5 min,弃上清,PBS清洗2次;加入适量传代细胞培养基(含EGF 0.01 mg/L、胎牛血清5%、转铁蛋白0.02 mg/mL、胰岛素220 U/L、IGF-Ⅰ 70 ng/mL、肝素100 mg/mL、Penicillin-Streptomycin双抗100 U/mL),根据细胞密度以1 ∶ 2继续接种到新的培养板进行传代培养。
1.5 生长曲线绘制用噻唑蓝(MTT)法绘制细胞的生长曲线。将传代培养的细胞以6.0×104个/mL的密度接种于24孔板中,置于27 ℃、5% CO2的细胞培养箱中培养。从第2天起,每天在同一时间分别在24孔板中取3孔细胞,用MTT细胞增殖试剂盒测定在490 nm处的吸光度(OD)值,连续取8 d。以培养时间为横坐标,OD值的平均值为纵坐标,绘制细胞的生长曲线。
1.6 黄姑鱼肠道上皮细胞CK-18鉴定将传代的细胞以2×105个/mL的密度接种至6孔培养板中,进行细胞爬片。具体操作如下:将盖玻片用洗洁剂清洗干净,然后用自来水将洗洁剂冲洗干净,再用纯水冲洗3遍,浸泡在75%的酒精中静置10 min;用镊子夹起盖玻片在酒精灯上将酒精烧干(温度不可过高);将烧干的盖玻片放在6孔板中,待冷却后将细胞悬液(2×105个/mL)滴加在盖玻片上;5 h后轻轻补加1 mL培养基,置27 ℃、5% CO2的细胞培养箱中培养过夜,细胞贴在玻片上良好生长,且细胞间留有空隙,未连接成片,此时弃掉培养基,用PBS清洗3次,每次5 min,4%多聚甲醛固定30 min后,倒掉,然后用PBS清洗3次,每次5 min;爬片稍甩干后加50~100 μL破膜工作液,室温孵育20 min,PBS洗3次,每次5 min;然后滴加3% BSA均匀覆盖组织,室温封闭30 min;轻轻甩掉封闭液,在细胞孔板里滴加一抗(1 ∶ 500稀释),细胞培养板平放于湿盒内4 ℃冰箱过夜孵育;细胞孔板置于脱色摇床上晃动洗涤3次,每次5 min。稍甩干后滴加二抗(1 ∶ 400稀释)覆盖组织,室温孵育50 min;爬片置于PBS(pH 7.4)中在脱色摇床上晃动洗涤3次,每次5 min,切片稍甩干后滴加DAPI染液,避光室温孵育10 min;用抗荧光淬灭封片剂封片,最后在荧光显微镜下观察并采集图像。
1.7 黄姑鱼肠道上皮细胞表面标志性蛋白荧光定量表达分析待传代的黄姑鱼肠道上皮细胞培养密度达到90%以上时,提取细胞总RNA,并用分光光度计测定RNA纯度和浓度,保证RNA样品吸光度(OD)260/280的值在1.8~2.0。提取总RNA样品通过凝胶电泳检测RNA完整性。提取的总RNA样品使用反转录试剂盒(北京全式金生物技术有限公司)反转为cDNA,反应结束后cDNA样品保存-20 ℃备用。
以黄姑鱼β-肌动蛋白(β-actin)为持家基因,根据课题组获得的黄姑鱼转录组结果设计封闭蛋白(Claudin)、闭合蛋白(Occludin)、闭锁小带蛋白-1(zonula occludens protein-1,ZO-1)、碱性磷酸酶(alkaline phosphatase,AKP)和上皮型钙黏蛋白(epithelial cadherin,E-cadherin)的引物,由生工生物工程(上海)股份有限公司合成引物,引物序列如表 1所示。使用TransStart Tip Green qPCR SuperMix(北京全式金生物技术有限公司)进行实时荧光定量PCR(qPCR)。qPCR程序如下:94 ℃下预变性10 min,94 ℃变性5 s,60 ℃退火15 s,40个循环,反应体积10 μL。Claudin、Occludin、ZO-1、AKP和E-cadherin的mRNA相对表达量使用2-ΔΔCt方法[13]计算。
|
|
表 1 黄姑鱼肠道上皮细胞标志性蛋白的qPCR引物序列 Table 1 qPCR primer sequences of intestinal epithelial cell marker protein of Nibea albiflora |
数据采用SPSS 20.0统计软件进行单因子方差分析(one-way ANOVA),以平均值±标准差(mean±SD)表示,P<0.05为差异显著。
2 结果 2.1 黄姑鱼肠道上皮细胞分离本试验采用胰蛋白酶、胶原蛋白酶和透明质酸酶联合消化法对黄姑鱼肠道组织进行不同时间(0、20、40、60、80 min)的消化分离,对所分离的细胞进行了台盼蓝染色,用以检测所得细胞活性,并对消化不同时间点的残留肠道组织进行HE染色。结果发现(图 1),消化0 min时便可以得到少量的肠道上皮细胞,但是此时未见细胞团的出现;消化20 min时得到的肠道上皮细胞也较少;消化40 min时肠道上皮细胞逐渐增多,较小的细胞团开始出现;消化60和80 min时,得到的肠道上皮细胞和细胞团最多,细胞团也较大。相应的HE染色分析可以很好地解释细胞的分离结果,消化20 min时肠道组织的一些肠绒毛被消化下来,但仍有大部分肠绒毛未被消化,消化40 min时肠道组织的绒毛已经有较多的部分被消化下来,消化60 min和80 min时肠道组织的绒毛近乎全部从肠道基膜上消化下来。根据细胞形态和细胞团数目上分析,本研究建议在40~60 min终止细胞消化。
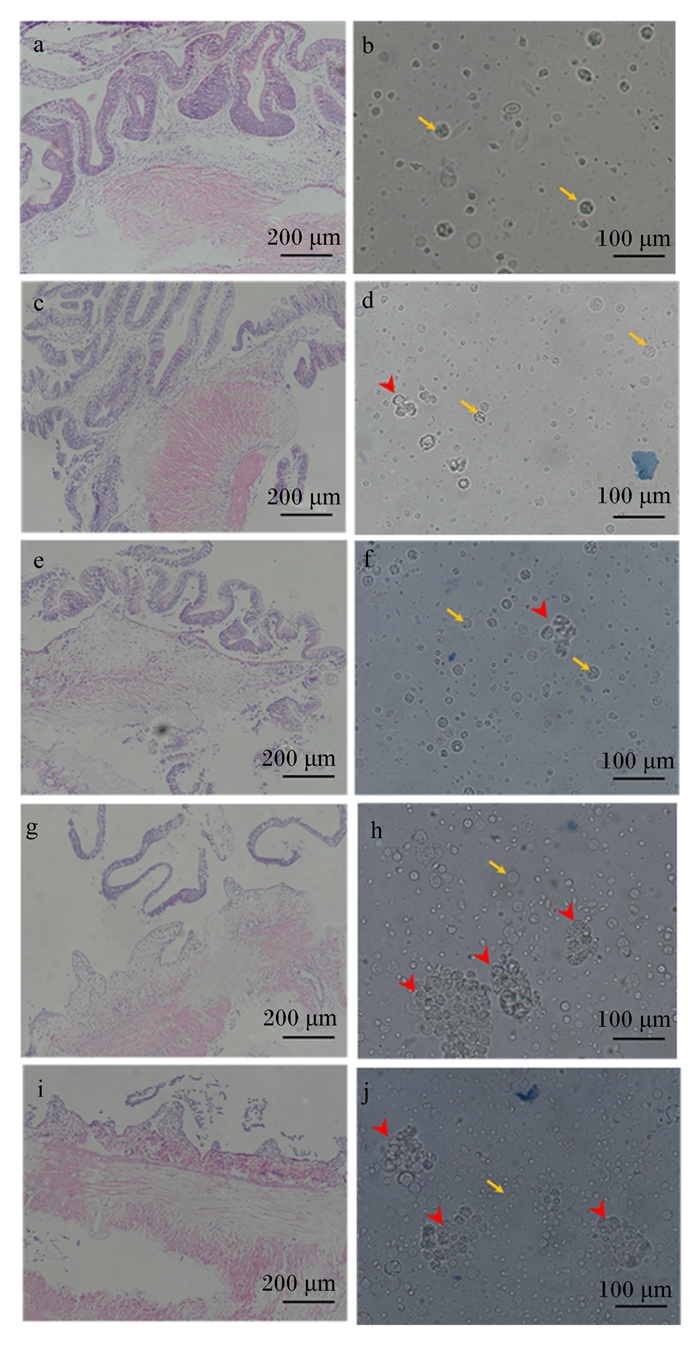
|
a、c、e、g、i分别为肠道组织消化0、20、40、60和80 min时残留肠道组织HE染色图,b、d、f、h、j分别为肠道组织消化0、20、40、60和80 min时所得细胞台盼蓝染色图。黄色箭头为肠道上皮细胞,红色箭头为肠道上皮细胞团。 a, c, e, g and i were HE staining diagrams of residual intestinal tissue at 0, 20, 40, 60 and 80 min digestion, respectively; b, d, f, h and j were trypan blue staining of intestinal tissues at 0, 20, 40, 60 and 80 min digestion, respectively. The yellow arrow was the intestinal epithelial cell, and the red arrow was the intestinal epithelial cell clusters. 图 1 黄姑鱼肠道组织消化不同时间肠道组织HE染色图(10×)和细胞台盼蓝染色图(20×) Fig. 1 HE staining figure (10×) and trypan blue staining figure (20×) of intestinal tissue after digestion at different time of Nibea albiflora |
取消化50 min的黄姑鱼肠道上皮细胞进行原代细胞培养。在培养90 min后,把培养液连同未贴壁的细胞转入新的培养板继续培养。在培养3 d时,黄姑鱼肠道上皮细胞开始贴壁生长,多数细胞单个生长(图 2-a);在培养5 d时,细胞开始铺展开来,呈“铺路石”状(图 2-b);在培养7 d时,黄姑鱼肠道上皮细胞汇合成片,显微镜下观察细胞呈致密单层排列,细胞铺满80%底壁,并呈明显的铺路石状(图 2-c)。传代至第5代培养结果表明,细胞呈圆形,种类较为单一且细胞界限清晰(图 3)。
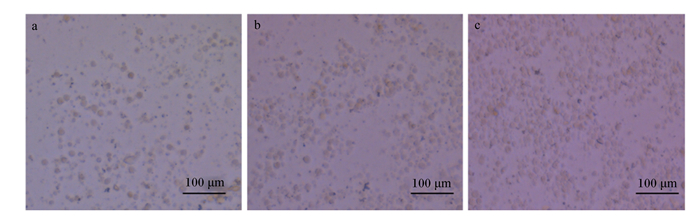
|
a:培养3 d的黄姑鱼肠道上皮细胞;b:培养5 d的黄姑鱼肠道上皮细胞;c:培养7 d的黄姑鱼肠道上皮细胞。 a: IECs of Nibea albiflora cultured for 3 days; b: IECs of Nibea albiflora cultured for 5 days; c: IECs of Nibea albiflora cultured for 7 days. 图 2 黄姑鱼肠道上皮细胞原代培养结果 Fig. 2 Primary culture results of intestinal epithelial cells of Nibea albiflora (20×) |
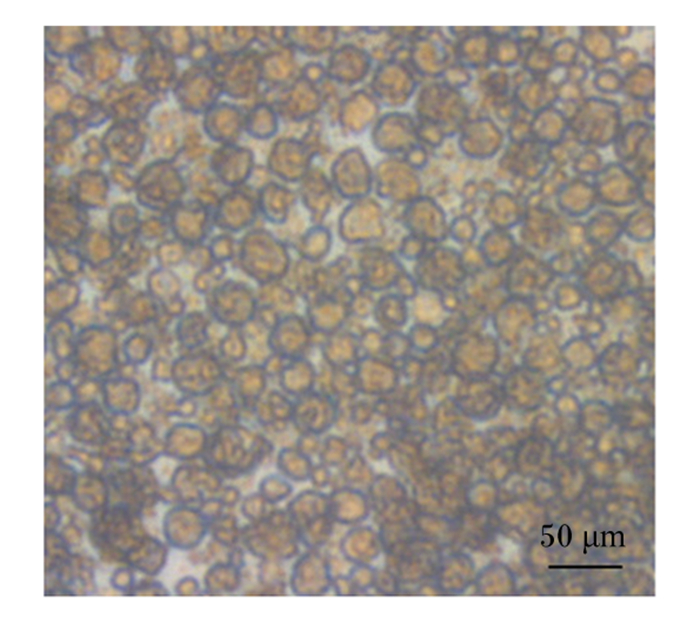
|
图 3 传代至第5代培养的黄姑鱼肠道上皮细胞 Fig. 3 The 5th passage cultured intestinal epithelial cells of Nibea albiflora (40×) |
利用MTT细胞增殖试剂盒测得的OD值作肠道上皮细胞生长曲线图,结果如图 4所示,肠道上皮细胞的生长曲线呈“S”形,在第4天开始呈指数期生长,到第7天趋于平缓。
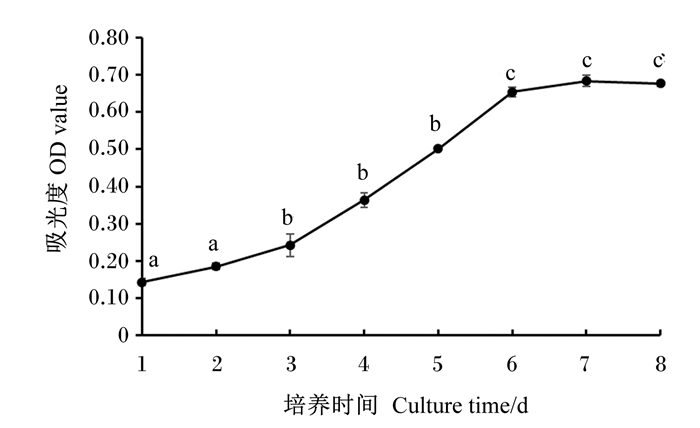
|
相同小写字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。 The same lowercase letters indicated no significant difference (P>0.05), while different lowercase letters indicated significant differences (P < 0.05). 图 4 黄姑鱼肠道上皮细胞生长曲线图 Fig. 4 Growth curve of intestinal epithelial cells of Nibea albiflora (n=3) |
CK-18属于上皮细胞特异性抗原成分之一。本试验用细胞免疫荧光检测方法来鉴定所培养的细胞类型。检测结果显示(图 5),CK-18在传代细胞中的表达呈阳性,表明本试验所培养的传代细胞为肠道上皮细胞。
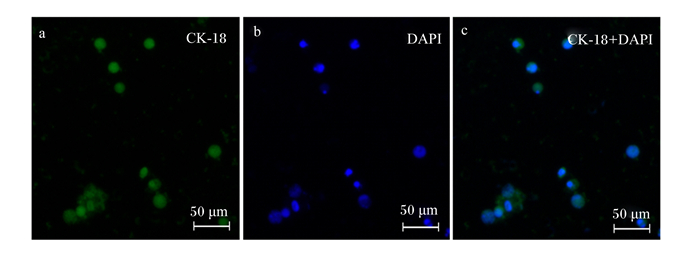
|
a:CK-18显色结果为绿色;b:DAPI细胞核染色为蓝色;c:CK-18和DAPI共显色位置。 a: CK-18 chromogenic result was green; b, DAPI nuclear stain was blue; c: CK-18 and DAPI co-chromogenic position. 图 5 黄姑鱼肠道上皮细胞CK-18鉴定结果 Fig. 5 Identification results of CK-18 in intestinal epithelial cells of Nibea albiflora |
本研究分析了肠道上皮细胞标志性蛋白E-cadherin、Claudin、Occludin、ZO-1和AKP在传代细胞中的表达,qPCR分析显示这些基因在传代培养的细胞中均有表达,进一步证明所培养的细胞是黄姑鱼肠道上皮细胞。
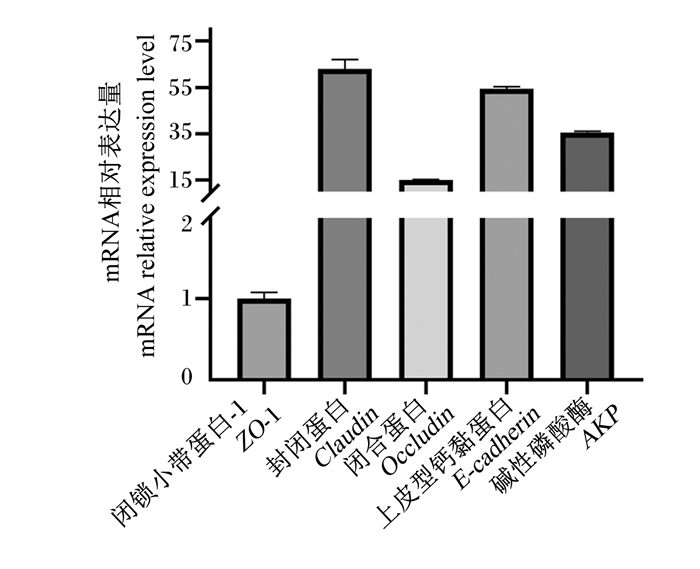
|
图 6 传代培养细胞中肠道上皮细胞标志性蛋白基因的表达 Fig. 6 Intestinal epithelial marker protein gene expression in passage cultured cells |
肠道上皮细胞是鱼类肠道的主要功能细胞,本研究利用酶消化分离法成功从黄姑鱼肠道获得连续生长的肠道上皮细胞。肠道组织中的隐窝具有增殖分化能力,能支持细胞持续增殖,是肠道上皮细胞原代培养成功的关键。消化酶可以将肠黏膜消化成包含隐窝的黏膜细胞团。宋增福等[1]利用胶原蛋白酶Ⅰ 0.2 g/L、乙二胺四乙酸(EDTA)0.02%和胶原蛋白酶Ⅳ 0.2 g/L的消化液,28 ℃水浴振荡消化20 min获得了较多的鲫鱼肠上皮绒毛隐窝单位和细胞团;姚仕彬等[6]利用胶原蛋白酶Ⅰ和Ⅳ联合消化液,28 ℃水浴振荡消化30 min得到了较多的草鱼肠黏膜上皮细胞团。与上述鱼类肠道细胞的分离方法相比,本研究在黄姑鱼肠道上皮细胞分离过程中,除使用了胶原蛋白酶外,还联合使用了胰蛋白酶和透明质酸酶,这样可以加速隐窝的分离并保持隐窝的完整性和细胞活力,减少肠道上皮细胞分离时的损伤[14],获得了大量的黄姑鱼肠道上皮细胞和细胞团。然而,席柔[15]在鸡胚盲肠道上皮细胞分离中发现胶原蛋白酶Ⅰ要显著高于胶原蛋白酶Ⅰ和透明质酸酶联合消化获得的肠道上皮细胞,此结果与本研究结果不同的原因可能是因为鱼类和鸡的肠道上皮细胞的特性有一定的差别[16]。此外,研究表明酶的消化时间越长对细胞的损伤就会越大,胰蛋白酶会破坏细胞膜表面的钙黏蛋白和层黏蛋白,致使细胞无法贴壁而死亡[17-18]。然而,酶消化时间太短则不能得到大量的肠道上皮细胞及细胞团。因此,确定肠道上皮细胞最佳消化时间至关重要。本试验通过设定不同消化时间,联合使用胰蛋白酶(0.25%)、胶原蛋白酶(1 mg/mL)和透明质酸酶(0.16 mg/mL)消化黄姑鱼肠道上皮细胞,得出在消化40~60 min时,可以获得大量的黄姑鱼肠道上皮细胞和细胞团。
成纤维细胞是肠道上皮细胞培养的主要污染细胞,一般采用机械刮除法[19]、反复贴壁法[1, 19]及胰蛋白酶消化排除法[14, 19]等方法进行纯化。本试验根据成纤维细胞贴壁速度比上皮细胞快的特点,在培养90 min后,把培养液连同未贴壁的细胞转入新的培养板继续培养[1],得到了生长良好的贴壁肠道上皮细胞。此外,本试验在黄姑鱼肠道上皮细胞培养液中也添加了适当浓度的EGF[1]、转铁蛋白和胰岛素[20]、IGF-Ⅰ[21]及肝素[22],这些营养素可以促进肠道细胞快速贴壁增殖,并有效抑制成纤维细胞的生长,培养的原代肠道上皮细胞生长状态良好。
3.2 黄姑鱼肠道上皮细胞传代培养及鉴定胰酶可以降低非上皮细胞的贴壁能力,所以细胞在传代培养时一般用胰酶处理。本研究采用0.25%胰酶消化原代培养的黄姑鱼肠道上皮细胞后获得了连续生长的传代细胞,这与Patkaew等[23]结果一致。而古少鹏等[24]采用0.25%胰酶与0.02% EDTA联合消化,并发现加入EDTA后可以降低胰酶对鸡胚盲肠道上皮细胞损伤,传代培养细胞活性高。后续研究可加入EDTA进一步优化黄姑鱼肠道上皮细胞传代条件。本研究中,传代后的黄姑鱼肠道上皮细胞呈“铺路石”样,传代至第5代培养结果表明,细胞呈圆形,种类较为单一且细胞界限清晰。
体外培养肠道上皮细胞的鉴别方法主要有形态学观察[25]、细胞免疫荧光检测法[18, 22]和电子显微镜观察[1, 14]等方法。本研究中,传代培养的肠道上皮细胞呈明显圆形的上皮细胞特征,细胞生长呈铺路石状[1, 25],并利用MTT法检测传代细胞生长曲线,结果显示培养的传代细胞生长曲线符合上皮细胞典型的“S”形生长特性。CK-18是一种特异性细胞骨架蛋白,是上皮细胞生长、分化及成熟的特征性标志物[26-27]。本研究利用特异性抗原细胞CK-18对传至第5代的细胞进行了细胞免疫荧光检测,检测结果表明,传代后的黄姑鱼肠道细胞免疫荧光呈阳性,说明传代的细胞仍为肠道上皮细胞[18]。肠型AKP存在于肠道上皮细胞刷状缘上,是肠道上皮细胞标志酶;E-cadherin、Claudin、Occludin和ZO-1均是参与形成和维持上皮细胞之间的重要的连接蛋白。本研究通过qPCR分析发现这些肠道上皮细胞标志性蛋白在培养的传代细胞中均有表达,进一步证明本试验中培养的传代细胞为黄姑鱼肠道上皮细胞[18, 22]。
4 结论本研究建立了黄姑鱼肠道上皮细胞的原代及传代细胞培养方法,为黄姑鱼肠道功能研究及病理机制的研究提供体外细胞模型试验材料,并为其肠道上皮细胞系的建立奠定了基础,也可为海水鱼类肠道功能的研究提供技术支撑。
| [1] |
宋增福, 吴天星, 潘晓东. 鲫肠道上皮细胞原代培养方法的研究[J]. 淡水渔业, 2008, 38(1): 67-69, 34. SONG Z F, WU T X, PAN X D. Study primary culture methods of intestinal epithelial cells of crucian carp (Carassius auratus)[J]. Freshwater Fisheries, 2008, 38(1): 67-69, 34 (in Chinese). DOI:10.3969/j.issn.1000-6907.2008.01.016 |
| [2] |
王远孝, 王恬. 肠上皮细胞体外培养技术的研究进展[J]. 饲料研究, 2008(12): 24-26. WANG Y X, WANG T. Research progress of intestinal epithelial cell culture in vitro[J]. Feed Research, 2008(12): 24-26 (in Chinese). |
| [3] |
GUZMAN-MURILLO M A, MERINO-CONTRERAS M L, ASCENCIO F. Interaction between Aeromonas veronii and epithelial cells of spotted sand bass (Paralabrax maculatofasciatus) in culture[J]. Journal of Applied Microbiology, 2000, 88(5): 897-906. DOI:10.1046/j.1365-2672.2000.01061.x |
| [4] |
冯琳, 姜俊, 刘扬, 等. 大豆凝集素对鲤鱼肠道上皮细胞结构和功能的影响[J]. 动物营养学报, 2011, 23(7): 1140-1146. FENG L, JIANG J, LIU Y, et al. The influence of soybean agglutinin on the structure and function of carp intestinal epithelial cells[J]. Chinese Journal of Animal Nutrition, 2011, 23(7): 1140-1146 (in Chinese). DOI:10.3969/j.issn.1006-267x.2011.07.011 |
| [5] |
LAZADO C C, CAIPANG C M A. Activation of intestinal epithelial cells in Atlantic cod, Gadus morhua, induced by algal derivatives[J]. Aquaculture Research, 2012, 43(8): 1194-1199. DOI:10.1111/j.1365-2109.2011.02923.x |
| [6] |
姚仕彬, 叶元土, 蔡春芳, 等. 草鱼肠道黏膜上皮细胞的分离与原代培养[J]. 上海海洋大学学报, 2013, 22(1): 33-41. YAO S B, YE Y T, CAI C F, et al. Dissociation and primary culture of Ctenopharyngodon idellus intestinal epithelial cells[J]. Journal of Shanghai Ocean University, 2013, 22(1): 33-41 (in Chinese). |
| [7] |
ZHANG Y J, CHEN W, MAI K S, et al. In vitro assay for evaluating the effects of three anti-nutritional factors on the primary-cultured intestinal epithelial cells isolated from Japanese flounder, Paralichthys olivaceus[J]. Aquaculture Research, 2015, 46(1): 242-251. DOI:10.1111/are.12165 |
| [8] |
KAWANO A, HAIDUK C, SCHIRMER K, et al. Development of a rainbow trout intestinal epithelial cell line and its response to lipopolysaccharide[J]. Aquaculture Nutrition, 2011, 17(2): e241-e252. DOI:10.1111/j.1365-2095.2010.00757.x |
| [9] |
PUMPUTIS P G, DAYEH V R, LEE L E J, et al. Beneficial and detrimental effects of the phytochemical naringenin on rainbow trout intestinal epithelial cells[J]. Journal of Functional Foods, 2020, 64: 103653. DOI:10.1016/j.jff.2019.103653 |
| [10] |
LAZADO C C, CAIPANG C M A. Bacterial viability differentially influences the immunomodulatory capabilities of potential host-derived probiotics in the intestinal epithelial cells of Atlantic cod Gadus morhua[J]. Journal of Applied Microbiology, 2014, 116(4): 990-998. DOI:10.1111/jam.12414 |
| [11] |
ANTONY J P P, STEWART T, SILVA M, et al. Zinc uptake in fish intestinal epithelial model RTgutGC: impact of media ion composition and methionine chelation[J]. Journal of Trace Elements in Medicine and Biology, 2018, 50: 377-383. DOI:10.1016/j.jtemb.2018.07.025 |
| [12] |
WU X, WANG L G, XIE Q P, et al. Effects of dietary sodium butyrate on growth, diet conversion, body chemical compositions and distal intestinal health in yellow drum (Nibea albiflora, Richardson)[J]. Aquaculture Research, 2020, 51(1): 69-79. DOI:10.1111/are.14348 |
| [13] |
SCHMITTGEN T D, LIVAK K J. Analyzing real-time PCR data by the comparative C(T) method[J]. Nature Protocols, 2008, 3(6): 1101-1108. DOI:10.1038/nprot.2008.73 |
| [14] |
REN H J, ZHANG C L, LIU R D, et al. Primary cultures of mouse small intestinal epithelial cells using the dissociating enzyme type Ⅰ collagenase and hyaluronidase[J]. Brazilian Journal of Medical and Biological Research, 2017, 50(5): e5831. DOI:10.1590/1414-431x20175831 |
| [15] |
席柔. 鸡胚盲肠上皮细胞传代条件的筛选与优化[D]. 硕士学位论文. 晋中: 山西农业大学, 2018: 31-32. XI R. Selection and optimization of the passage conditions of the cecum epithelial cells in chicken embryo[D]. Master's Thesis. Jinzhong: Shanxi Agricultural University, 2018: 31-32. (in Chinese) |
| [16] |
王静. 猪小肠黏膜上皮细胞培养方法的建立[D]. 硕士学位论文. 杨凌: 西北农林科技大学, 2009: 20-21. WANG J. Establishment of cultural method for porcine intestinal epithelial cells[D]. Master's Thesis. Yangling: Northwest A & F University, 2009: 20-21. (in Chinese) |
| [17] |
陈东思, 祁秀娟, 刘建新, 等. 人卵巢颗粒细胞分离培养方法的改进[J]. 中国组织工程研究, 2015, 19(46): 7456-7460. CHEN D S, QI X J, LIU J X, et al. Modified isolation and culture methods of human ovarian granulosa cells[J]. Journal of Clinical Rehabilitative Tissue Engineering Research, 2015, 19(46): 7456-7460 (in Chinese). DOI:10.3969/j.issn.2095-4344.2015.46.015 |
| [18] |
金鑫, 张曼, 王云鹤, 等. 绵羊瘤胃上皮细胞的体外分离培养、冻存及复苏方法[J]. 中国农业大学学报, 2019, 24(5): 57-66. JIN X, ZHANG M, WANG Y H, et al. In vitro isolation, culture, cryopreservation and resuscitation of ovine rumen epithelial cells[J]. Journal of China Agricultural University, 2019, 24(5): 57-66 (in Chinese). |
| [19] |
鄂征. 组织培养和分子细胞学技术[M]. 北京: 北京出版社, 1995: 135-136. E Z. Tissue culture and molecular cytology[M]. Beijing: Beijing Publishing House, 1995: 135-136 (in Chinese). |
| [20] |
李雪吟. 赖氨酸对草鱼肠道免疫和结构屏障作用及其机制研究[D]. 博士学位论文. 雅安: 四川农业大学, 2016: 31-32. LI X Y. Effects of lysine on the immune and structural barrier functions and the related mechanisms of intestines in fish[D]. Ph. D. Thesis. Ya'an: Sichuan Agricultural University, 2016: 31-32. (in Chinese) |
| [21] |
伍烽, 金先庆, 吴仕孝, 等. 肠营养素对小肠黏膜上皮细胞分化的影响[J]. 肠外与肠内营养, 1998(2): 36-38, 62-63. WU F, JIN X Q, WU S X, et al. Direct influence of intestinal nutrients over the differentiation of mucosal epithelium of small intestine in primary culture[J]. Parenteral & Enteral Nutrition, 1998(2): 36-38, 62-63 (in Chinese). |
| [22] |
GHISELLI F, ROSSI B, FELICI M, et al. Isolation, culture, and characterization of chicken intestinal epithelial cells[J]. BMC Molecular and Cell Biology, 2021, 22(1): 12. DOI:10.1186/s12860-021-00349-7 |
| [23] |
PATKAEW S, DIREKBUSARAKOM S, TANTITHAKURA O. A simple method for cell culture of'Nemo'ocellaris clownfish (Amphiprion ocellaris, Cuvier 1830)[J]. Cell Biology International Reports, 2014, 21(1): 39-45. |
| [24] |
古少鹏, 赵素芬, 王运盛, 等. 鸡胚盲肠上皮细胞的传代培养[J]. 畜牧兽医学报, 2011, 42(3): 409-415. GU S P, ZHAO S F, WANG Y S, et al. Subculture of chicken embryo cecum epithelial cell[J]. Acta Veterinaria et Zootechnica Sinica, 2011, 42(3): 409-415 (in Chinese). |
| [25] |
刘芳宁, 张彦明. 哺乳动物肠上皮细胞的原代培养[J]. 动物医学进展, 2007, 28(4): 53-57. LIU F N, ZHANG Y M. Primary culture of mammalian intestinal epithelial cells[J]. Progress in Veterinary Medicine, 2007, 28(4): 53-57 (in Chinese). DOI:10.3969/j.issn.1007-5038.2007.04.015 |
| [26] |
张琦, 史文倩, 段步婷, 等. 不同浓度胰岛素对鸡胚盲肠上皮细胞生长的影响[J]. 山西农业科学, 2021, 49(1): 93-96. ZHANG Q, SHI W Q, DUAN B T, et al. Effects of different insulin concentrations on the growth of chicken embryo cecum epithelial cells[J]. Journal of Shanxi Agricultural Sciences, 2021, 49(1): 93-96 (in Chinese). DOI:10.3969/j.issn.1002-2481.2021.01.19 |
| [27] |
王燕琴, 王易之, 智宇. 牛上皮细胞中有效表面标记物的筛选[J]. 动物医学进展, 2019, 40(7): 77-82. WANG Y Q, WANG Y Z, ZHI Y. Screening of effective surface markers in bovine epithelial cells[J]. Progress in Veterinary Medicine, 2019, 40(7): 77-82 (in Chinese). DOI:10.3969/j.issn.1007-5038.2019.07.015 |




