羽毛是养殖业屠宰固废的重要组成部分,我国每年肉鸡和蛋鸡总出栏量可超100亿羽,以羽毛占体重比5%~7%计算,可产生数百万吨羽毛。其中,水禽羽毛可加工为附加值较高的羽绒制品,而鸡羽毛常因附加值较低被废弃。鸡羽毛具有75%以上的粗蛋白质含量,主要由一种“硬蛋白”——羽毛角蛋白构成,这种蛋白由氢键、二硫键和其他交联作用共聚形成复杂稳定的蛋白结构[1],从而具有强大的抗张性[2]、柔韧性和机械强度,难以被常见蛋白酶(如胃蛋白酶、胰蛋白酶等)消化[3],因此也很难被动物直接利用。羽毛的氨基酸、矿物质微量元素和维生素种类丰富,将其抗性物质破坏,则能发挥极高的饲用价值。20世纪末,以高温高压水解法、膨化法、酸解碱解法等传统方法进行羽毛资源饲料化加工,有效解决了羽毛处理问题。但高温高压法导致羽毛中热敏氨基酸的损失[4],酸解碱解法导致氨基酸的破坏[5],使产物品质下降。同时,能耗高、废弃产物多等的特点是传统加工方式引起环境问题的最主要原因,导致羽毛饲料化面临新的挑战和机遇。微生物发酵技术兼具改善饲料原料营养价值结构和环境友好的特点。本研究拟筛选可高效降解羽毛的微生物,对羽毛进行微生物发酵技术处理,改善羽毛营养价值。目前已有研究表明,可分离出不同种属微生物对羽毛具有降解效果,如尖孢镰刀菌[6]、丝状真菌[7]、地衣芽孢杆菌[8-10]、枯草芽孢杆菌[11]、蜡样芽孢杆菌[12-13]、弗氏链霉菌[14]等。本研究通过分离得到的羽毛降解菌进行羽毛微生物发酵,可有效改善羽毛的营养价值结构,提升羽毛利用率和可溶性蛋白及氨基酸含量,为开发动物废弃物资源提供生物材料。
1 材料与方法 1.1 试验材料 1.1.1 菌种牛、羊瘤胃富集菌种,保藏于实验室。
1.1.2 羽毛采集及处理羽毛采集于北京昌平南口试验基地;新鲜废弃的42日龄白羽肉鸡羽毛。羽毛处理:剔除羽毛中鸡肉残渣、血块、脚皮等杂质,用水反复冲洗至洁净状态,暴晒晾干。为保证羽毛底物均匀性和稳定性,剔除粗大成羽,粉碎后过18目筛,取筛上物作为羽毛培养基底物。
1.1.3 培养基1) LB液体培养基:蛋白胨10 g/L、酵母膏5 g/L、NaCl 10 g/L,自然pH,121 ℃灭菌20 min。
2) LB固体培养基:蛋白胨10 g/L、酵母膏5 g/L、NaCl 10 g/L、琼脂15 g/L,自然pH,121 ℃灭菌20 min。
3) 酪蛋白培养基:干酪素(酪蛋白)10 g/L、牛肉浸粉3 g/L、NaCl 5 g/L、KH2PO4 2 g/L、琼脂15 g/L,pH 7.0,115 ℃灭菌30 min。
4) 羽毛培养基1:完整羽毛1根、营养盐溶液10 mL(NaCl 0.5 g/L、K2HPO4 1.4 g/L、KH2PO4 0.7 g/L、MgSO4 0.1 g/L),pH 7.0,121 ℃灭菌20 min。
5) 羽毛培养基2:羽毛粉1%(m/v)、营养盐溶液100 mL(NaCl 0.5 g/L、K2HPO4 1.4 g/L、KH2PO4 0.7 g/L、MgSO4 0.1 g/L),pH 7.0,121 ℃灭菌20 min。
1.2 试验方法 1.2.1 菌种初筛将活化的菌液点图于酪蛋白培养基,设置5个重复,37 ℃培养24 h,观察并测量降解圈直径和菌落直径,计算降解圈直径/菌落直径的比值。选择比值大、透明度高的菌株作为复筛菌株。
1.2.2 菌种复筛将活化的菌液以2%(v/v)的接种量分别接种于羽毛培养基1和2中,37 ℃、180 r/min振荡培养3 d。分别设置无菌空白对照组。观察记录羽毛培养基1中完整羽毛降解情况。试验结束后测定羽毛培养基2的降解液可溶性蛋白含量。
1.2.3 菌种鉴定 1.2.3.1 菌落和细菌形态观察用平板画线法将菌株NLG1接种在LB固体培养基上,37 ℃培养24 h,肉眼观察菌落形状、颜色、表面质地和菌落边缘等形态,并进行革兰氏染色制片观察。
1.2.3.2 细菌生物学鉴定菌株NLG1经多次纯化传代后,送至生工生物工程(上海)股份有限公司进行细菌16S rDNA基因测序。将测得序列结果在NCBI的BLAST软件与GenBank数据库已测标准菌株进行比对。采用MEGA 4构建Neighbor-joining系统发育树。
1.2.4 细菌生长曲线测定将菌株NLG1接种在LB液体培养基中连续培养24 h,每小时取样1次,在600 nm下测定菌液吸光度(OD)并绘制细菌生长曲线。
1.2.5 培养条件优化活化菌液于无菌离心管中4 000 r/min离心10 min,弃上清液,留沉淀,无菌生理盐水反复洗涤重悬2次,制成体积为1 mL、活菌数为107 CFU/mL的菌种重悬液。将菌种重悬液转接于羽毛培养基2中,摇床180 r/min、37 ℃培养3 d。改变温度(25、27、29、31、33、35、37、41、43 ℃)、初始pH(5、6、7、8、9、10、11、12)、活菌数(106、107、108、109 CFU/mL)、底物浓度(0.5%、1.0%、1.5%、2.0%、2.5%、3.0%)、外加2%碳源(葡萄糖、蔗糖、麦芽糖、可溶性淀粉)和发酵时间(0、1、2、3、4、5、6、7、8 d),研究发酵条件对菌株NLG1羽毛降解的影响,测定发酵液可溶性蛋白含量。
1.2.6 可溶性蛋白含量测定采用考马斯亮蓝G250法[15]测定羽毛发酵液中可溶性蛋白含量。
1.2.7 上清液氨基酸成分分析以优化后条件进行羽毛发酵,取培养0(当天)和3 d的发酵液,4 ℃、5 000 r/min离心10 min,弃沉淀,取上清液并过滤膜过滤。参照QB/T 18246—2000,采用全自动氨基酸分析仪(日立L-8900,日本)测定氨基酸总量。取一定量样品上清液与磺基水杨酸均匀混合,于4 ℃静置60 min后采用低温离心机12 000 r/min离心20 min,除去样液中多肽或小肽后采用全自动氨基酸分析仪测定游离氨基酸含量。
1.3 数据统计与分析试验数据采用统计软件SPSS 25.0中one-way ANOVA进行单因素方差分析,采用Duncan氏法进行多重比较。以P<0.05为显著性判断标准。
2 结果与分析 2.1 菌株初筛结果通过酪蛋白培养基进行初筛,共得到16株降解酪蛋白、产生透明圈的菌株。根据透明圈直径/菌落直径的比值大小进行比较,留取50%株菌作为后续试验用菌。初筛结果如表 1和图 1所示。
|
|
表 1 不同菌株酪蛋白平板培养基产圈情况 Table 1 Clearance zone of different strains in casein flat-panel mediums |
|
图 1 初筛菌株产圈能力 Fig. 1 Capacity of flat-panel circle-producing by primary screening strains |
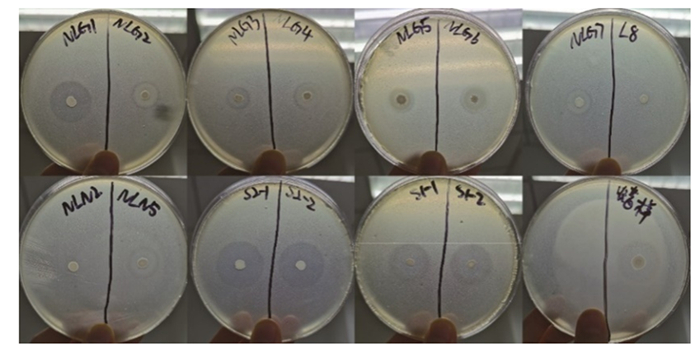
分别接种8株初筛菌株的羽毛培养基1、2的降解情况、降解液可溶性蛋白含量测定结果分别见图 2、图 3。为保证结果可靠性,选择羽毛发育程度、形态、质量相同的单根完整羽毛制作羽毛培养基1。图 2所示,以空白(无菌)培养基为对照,经3 d培养后,除接种NLG2和NLG6的羽毛降解不明显外,其余菌株均能将培养基羽毛不同程度降解,其中NLG1和S2-2可将其降解为细碎粉状,S1-1、LY、S1-2和S2-1则将其降解为羽毛段或仅剩羽干。研究发现在羽毛降解中,菌株NLG1和S2-2降解羽毛速度快、降解完整性更高。

|
图中对应各菌株接种顺序从左到右依次为:空白(无菌)、NLG1、NLG2、NLG6、S1-1、S1-2、S2-1、S2-2、LY。 In the picture, the corresponding inoculation sequence of strains from left to right are blank (sterile), NLG1, NLG2, NLG6, S1-1, S1-2, S2-1, S2-2, LY. 图 2 不同菌株对单根完整羽毛的降解结果(3 d后) Fig. 2 Degradation results of single intact feather by different strains (after 3 days) |
|
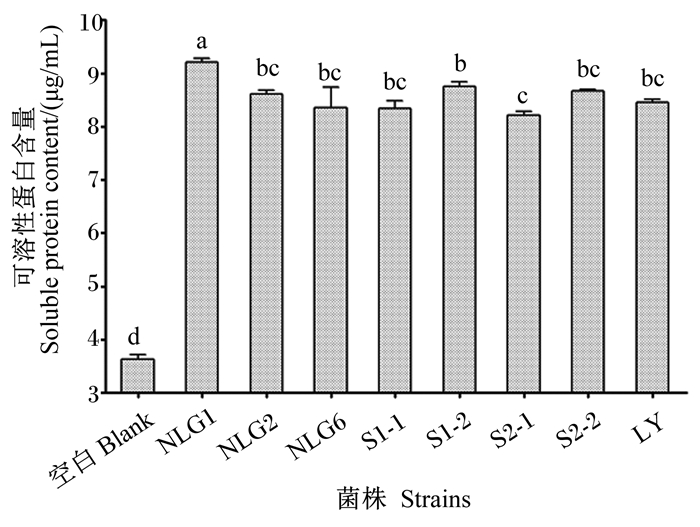
数据柱标注不同小写字母表示差异显著(P<0.05)。下图同。 Value bars with different small letters mean significant difference (P < 0.05). The same as below. 图 3 菌株复筛结果 Fig. 3 Results of re-screening strains |
羽毛培养基2的降解液可溶性蛋白含量测定结果如图 3所示。所有接种菌液的培养基,其降解液可溶性蛋白含量均较空白对照组显著增加(P<0.05)。其中接种NLG1的羽毛降解液可溶性蛋白含量最高,为(9.21±0.06) μg/mL。
结合羽毛培养基1、2的结果,菌株NLG1可快速降解羽毛、可溶性蛋白含量高,确定其为目标菌株。
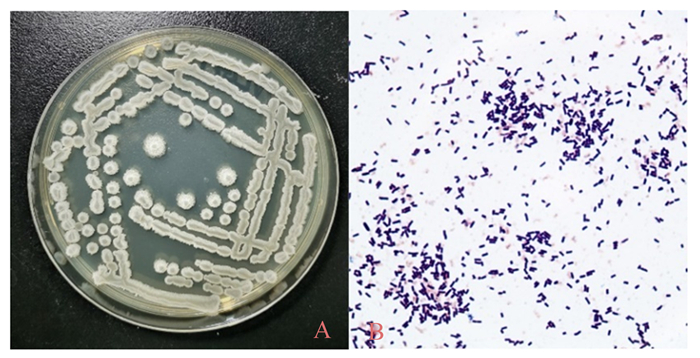
2.3 菌株鉴定结果 2.3.1 菌落形态和染色结果将菌株NLG1接种于LB固体培养基37 ℃恒温培养24 h,肉眼观察结果,如图 4所示,培养初期,菌落形态接近圆形、颜色浅黄且不透明,表面光滑边缘整齐;培养后期,菌落颜色呈白色或乳白色,表面粗糙不规则、有皱褶,中间有突起或凹陷,边缘不整齐,四周云雾状扩散。将该菌进行革兰氏染色,结果如图 4所示,染色后颜色呈紫色,形态为杆状,有芽孢,故该菌株为革兰氏阳性(G+)芽孢杆菌。
|
A:菌株NLG1在LB固体培养基的菌落形态;B:菌株NLG1细菌革兰氏染色结果(100×)。 A: colony morphology of strain NLG1 in LB solid medium; B: gram staining results of strain NLG1 (100×). 图 4 菌落形态和染色结果图 Fig. 4 Colony morphology and staining results |
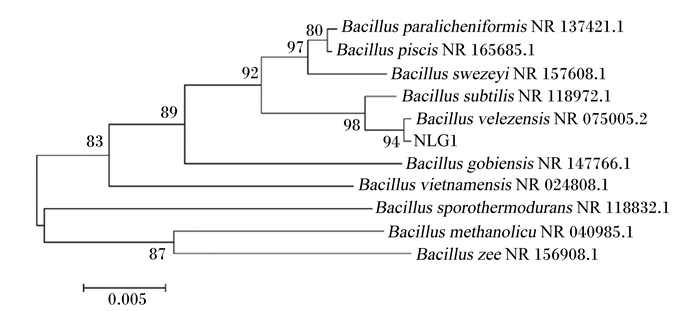
经总DNA的提取、扩增,送至生工基因测序后得到的结果在NCBI的BLAST软件与GenBank数据库已测标准菌株基因序列进行比对分析。结果如图 5所示,菌株NLG1的16S rDNA基因序列与贝莱斯芽孢杆菌NR 075005.2 (Bacillus velezensis NR 075005.2)具有同源性,长度约1 484 bp,GenBank保守序列登录号为MZ 959415。综合形态学和分子鉴定的结果,初步判定并命名为贝莱斯芽孢杆菌NLG1(Bacillus velezensis NLG1)。
|
Bacillus subtilis: 枯草芽孢杆菌; Bacillus velezensis: 贝莱斯芽孢杆菌; Bacillus vietnamensis: 越南芽孢杆菌; Bacillus sporothermodurans: 耐热芽孢杆菌。 图 5 菌株NLG1的Neighbor-joining系统进化树 Fig. 5 Neighbor-joining phylogenetic tree of strain NLG1 |
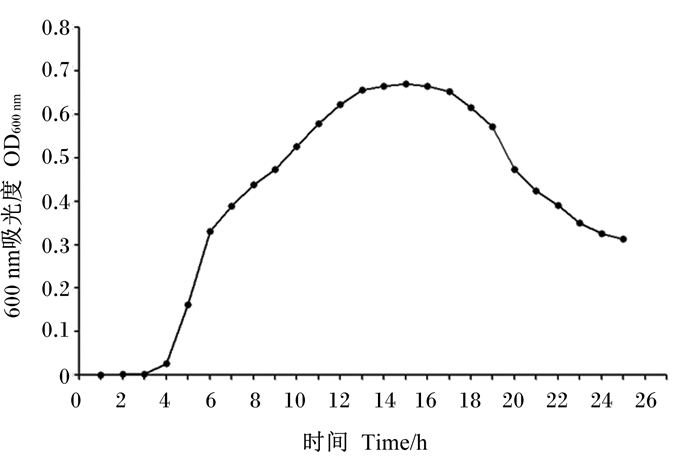
由图 6可知,菌株NLG1在0~3 h进入发育迟缓期;在3~5 h迅速繁殖进入生长对数期;随后生长速度变缓,在13~15 h进入稳定期;培养时长超过15 h后进入衰亡期。
|
图 6 菌株NLG1的生长曲线 Fig. 6 Growth curve of strain NLG1 |
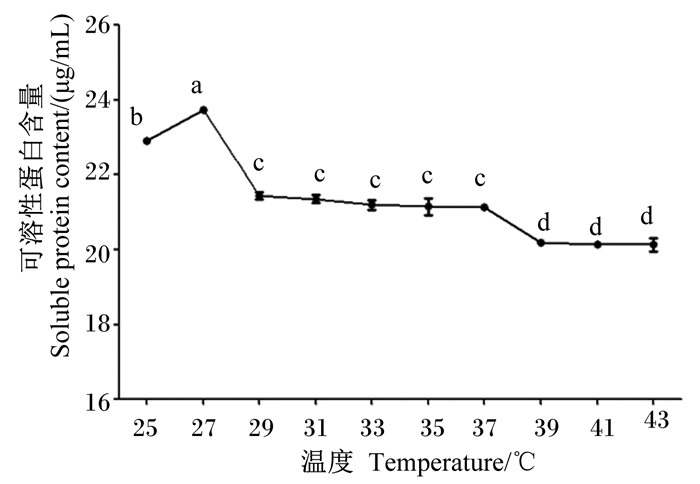
由图 7可知,27 ℃为其降解羽毛的最适温度,测得可溶性蛋白含量最高,为(23.73±0.07) μg/mL,较其他温度条件均差异显著(P<0.05)。
|
图 7 温度对菌株NLG1降解羽毛产可溶性蛋白含量的影响 Fig. 7 Effects of temperature on content of soluble protein by feather degradation of strain NLG1 |
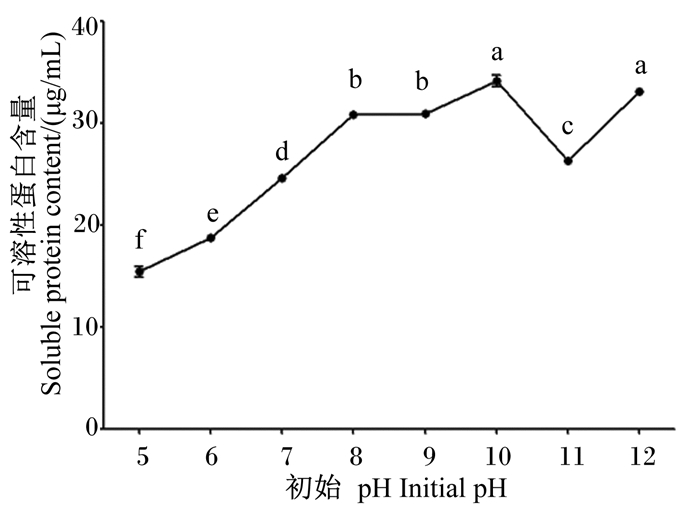
由图 8可知,发酵初始pH由5增加至10时,羽毛降解液中可溶性蛋白含量线性增加,并达到最高值(34.20±0.57) μg/mL;当初始pH增加至11、12时,降解液中可溶性蛋白含量迅速降低后再次增加,且与初始pH为10时可溶性蛋白含量差异不显著(P>0.05)。
|
图 8 初始pH对菌株NLG1降解羽毛产可溶蛋白含量的影响 Fig. 8 Effects of initial pH on content of soluble protein by feather degradation of strain NLG1 |
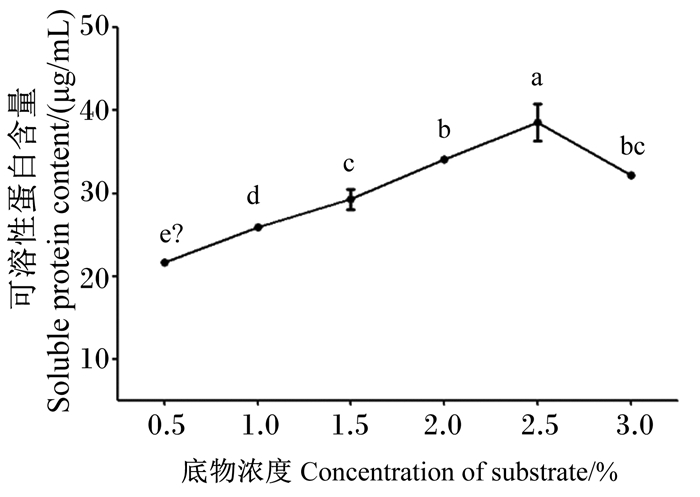
由图 9可知,底物浓度由0.5%增加至3.0%,降解液中可溶性蛋白含量呈先增加后降低,并在底物浓度为2.5%,可溶性蛋白含量抵达峰值为(38.56±2.21) μg/mL,且相对其他底物浓度可溶性蛋白含量均差异显著(P<0.05)。因此,2.5%的底物浓度更利于菌株NLG1降解羽毛。
|
图 9 底物浓度对菌株NLG1降解羽毛产可溶蛋白含量的影响 Fig. 9 Effects of substrate concentration on content of soluble protein by feather degradation of strain NLG1 |
由图 10可知,接种活菌数由106 CFU/mL增加至109 CFU/mL时,降解液中可溶性蛋白含量随接种活菌数浓度增加呈线性增加趋势。以此说明,在时间及其他各条件不变的情况下,接入活菌数越多对羽毛降解和可溶性蛋白产生越有利。
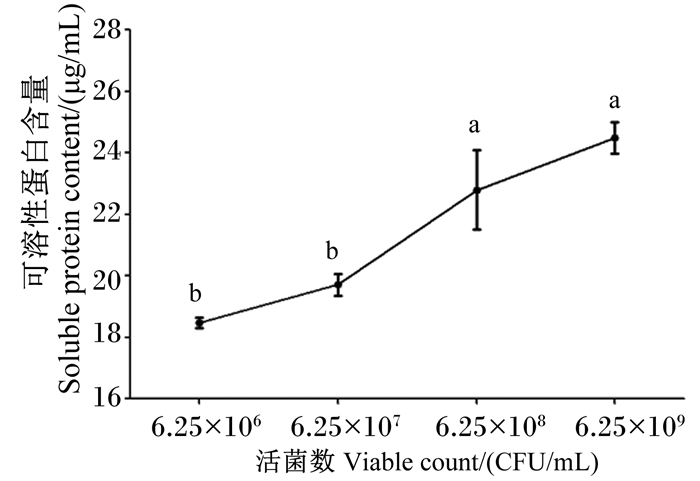
|
图 10 活菌数对菌株NLG1降解羽毛产可溶蛋白含量的影响 Fig. 10 Effects of viable count on content of soluble protein by feather degradation of strain NLG1 |
由图 11可知,不添加任何外加碳源的对照组降解液中可溶性蛋白含量较添加任意外加碳源组均差异显著(P<0.05);可溶性淀粉组与麦芽糖组降解液可溶性蛋白含量之间差异不显著(P>0.05),与其他外加碳源组均差异显著(P<0.05)。因此,其他条件稳定不变的条件下,在菌株NLG1降解羽毛过程中额外补充可溶性淀粉更利于羽毛快速降解、释放可溶性蛋白。
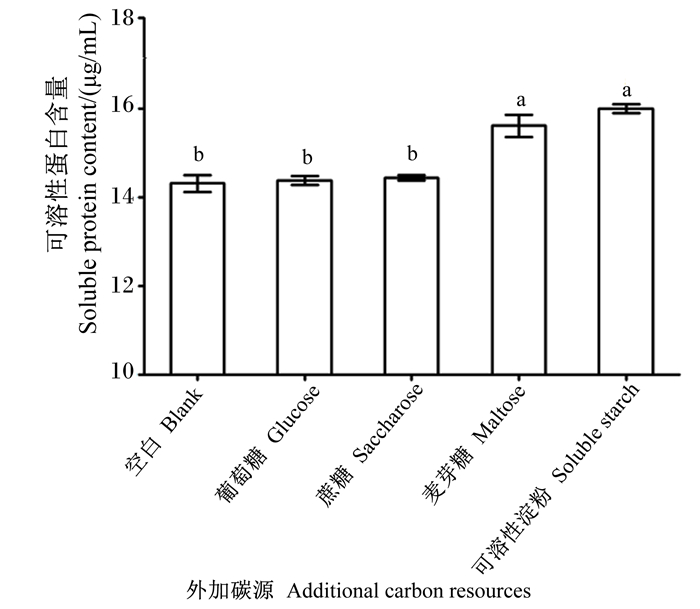
|
图 11 外加碳源对菌株NLG1降解羽毛产可溶蛋白含量的影响 Fig. 11 Effects of additional carbon source on content of soluble protein by feather degradation of strain NLG1 |
由图 12可知,降解液中可溶性蛋白含量呈增加、平稳、降低、再平稳的趋势。在发酵的第3天,可溶性蛋白含量迅速增加到(32.76±0.07) μg/mL;在发酵的第3~5天维持不变,自第6天起可溶性蛋白含量降低且平稳。
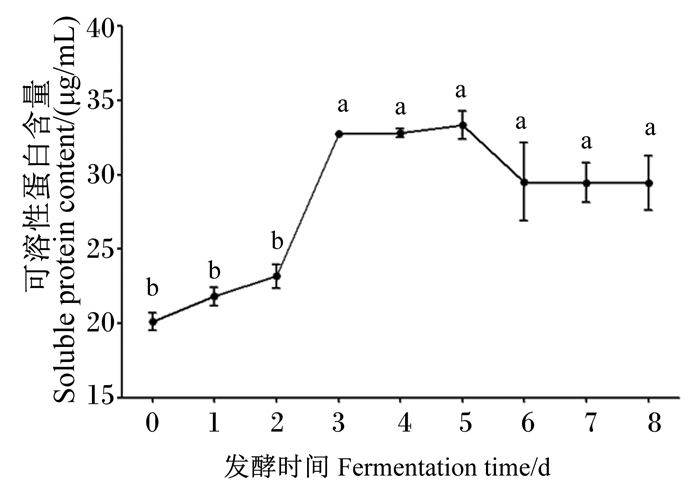
|
图 12 发酵时间对菌株NLG1降解羽毛可溶性蛋白含量的影响 Fig. 12 Effects of fermentation time on content of feather soluble protein by strain NLG1 |
图 13为菌株NLG1在0~8 d内羽毛降解变化图。瓶中羽毛随时间推移,羽干、羽枝逐渐被降解,降解液颜色变深、液体变浑浊。

|
图 13 菌株NLG1羽毛降解过程 Fig. 13 Degrading process of feather by strain NLG1 |
由表 2可知,在第0天的羽毛发酵液中虽然能检测出17种氨基酸,但各个氨基酸的检出量极低,氨基酸总量也仅为27.41 mg/g;在第3天的羽毛发酵液中检测出的氨基酸种类保持不变,但各个氨基酸的检出量和总氨基酸含量均有所增加。除组氨酸、蛋氨酸含量增加较少外,其余各个氨基酸含量都有较大幅度提高,尤其半胱氨酸含量增加了14.24 mg/g。
|
|
表 2 羽毛上清液中总氨基酸组成及含量变化 Table 2 Changes of total amino acid composition and contents in feather degradation broth |
在NLG1降解的第0天,从上清液中检测到包括基础游离氨基酸及其他游离氨基酸在内的游离氨基酸共计23种。除此之外检测出尿素、牛磺酸和肌肽,但未检测出胱氨酸和苯丙氨酸这2种基础游离氨基酸。降解第3天在羽毛降解上清液中可检测出18种基础氨基酸及其另外10种游离氨基酸衍生物、尿素、牛磺酸和肌肽。经3 d降解后的上清液中除甘氨酸、鸟氨酸和羟脯氨酸含量分别降低了0.012 2、0.000 5和0.561 0 mg/g外,其余游离氨基酸、衍生物等均有较大程度的增加。基础氨基酸中缬氨酸、苯丙氨酸、亮氨酸、酪氨酸、异亮氨酸谷氨酸和丙氨酸含量增加明显。而其他氨基酸中β-丙氨酸含量有大幅增加,羟脯氨酸和鸟氨酸含量降低;通过检测发现尿素、牛磺酸和肌肽含量也有增加。
|
|
表 3 羽毛上清液中游离氨基酸组成及含量变化 Table 3 Changes of free amino acid composition and contents in feather degradation broth |
温度、初始pH、底物浓度、活菌数和发酵时间以及适合的碳源是影响羽毛降解的必要条件,更是影响微生物生长及代谢的重要因素。尹静等[16]从腐烂蓝藻中分离的粘质沙雷氏菌SYBC YH(Serratia marcescens SYBC YH)降解羽毛产可溶性蛋白最适温度为40 ℃,最适pH为7。本研究所采用的菌株产可溶性蛋白的发酵温度、初始pH作用范围更广,温度可为25.0~43.0 ℃,最适温度为27.0 ℃;初始pH可为5~12,最适pH为10。通过调节温度以及初始pH发现,该菌的羽毛降解能力在接近室温、初始pH为碱性时更强。傅伟[9]在研究中证明,用0.1% Ca(OH)2处理3 h对微生物降解羽毛具有促进作用。本试验研究发现,初始pH 10~12出现折线趋势可能也是这一原因引起。羽毛作为唯一碳、氮源底物,浓度低时微生物最大限度利用羽毛、释放可溶性蛋白,底物消耗殆尽后,可溶性蛋白可充当二次底物导致消耗现象;底物过剩,导致培养基密集度和黏度增加,致使通氧量不足,引发微生物的底物消耗能力受限,影响可溶性蛋白含量[17]。当微生物降解羽毛的作用时间以及底物浓度一定时,添加的活菌越多羽毛降解速度越快、可溶性蛋白产量越多。额外添加的碳源及时缓解了羽毛底物碳源匮乏问题,同时也能诱导微生物产生诱导型羽毛降解酶[18]。本试验研究发现,添加可溶性淀粉与添加麦芽糖的可溶性蛋白含量差异不显著,而结果优于添加麦芽糖组,可能是可溶性淀粉水解过程中产生多种类碳源均能进一步促进菌株生长、作用,且可溶性淀粉取材廉价,更适作为试验研究的优选外加碳源。发酵是微生物降解羽毛保持动态平衡的过程。郭刚等[19]所采用的地衣芽孢杆菌在发酵第3天时可溶性蛋白含量增长至最高后迅速降低。本研究所采用菌株发酵3~5 d亦使可溶性蛋白含量维持稳定状态,羽毛分解更彻底。
3.2 羽毛上清液氨基酸成分及含量变化的分析羽毛是由多种氨基酸组成的复杂蛋白质,羽毛降解菌将其分解成小分子质量蛋白质、多肽类、游离氨基酸及其他物质。本试验测定发酵前后的氨基酸组分,发现不同发酵条件和微生物可影响羽毛降解液的氨基酸种类[13, 20-21]。发酵后上清液中氨基酸含量增加,其中半胱氨酸含量最多;除色氨酸未检出外,其余7种必需氨基酸占氨基酸总含量的34.83%。半胱氨酸的产生意味着存在大量二硫键的羽毛结构被打开,通过微生物降解将其还原成胱氨酸,推测本研究采用的菌株NLG1具有二硫键还原作用,同样在涂国全等[7]的研究中发现羽毛降解液中存在大量二硫键还原酶。色氨酸在羽毛降解过程中可能被微生物作为二次底物消耗转化为其他物质。在游离氨基酸检测中,除检测出了大量的尿素外还检测出β-丙氨酸等氨基酸衍生物,因此说明,氨基酸总量降低、游离氨基酸含量增加,是由于微生物降解羽毛过程中发生了大量的转氨基、脱氨基作用。发酵后羽毛上清液中检测出必需游离氨基酸总量占总检出量的85.07%,如缬氨酸、苯丙氨酸、赖氨酸、异亮氨酸、亮氨酸、苏氨酸等。缬氨酸是一种支链氨基酸,也是动物必需氨基酸之一,是动物体蛋白质的重要组成成分[22],也是蛋白质合成代谢中的重要参与者[23],能促进机体生长[24]、能量供给[25]、增强免疫[26]及改善畜产品品质[27]。苯丙氨酸既属于芳香族氨基酸又属于必需氨基酸,是药物的中间体和原料,同时也应用于化工和食品领域生产护肤品和添加剂阿斯巴甜的原料[28]。可见,羽毛降解液是一种氨基酸来源,也是必需氨酸的非常重要来源,为后期应用奠定基础。
4 结论① 本试验筛选出1株可降解羽毛的天然微生物菌株,鉴定并命名为贝莱斯芽孢杆菌NLG1。
② 基于羽毛培养基,贝莱斯芽孢杆菌降解羽毛培养条件优化为:温度27 ℃,初始pH 10,接种活菌数109 CFU/mL,底物浓度2.5%,外加碳源为可溶性淀粉,培养时间3 d。
③ 贝莱斯芽孢杆菌可降解羽毛,羽毛发酵液上清液中可溶性蛋白含量为(32.76±0.07) μg/mL,水解氨基酸总量提高了87.67 mg/g,游离氨基酸及衍生物总量提高了62.36 mg/g,改善了羽毛的营养价值和氨基酸组成结构。
| [1] |
郭清兵, 莫瑞奕, 何明, 等. 羽毛角蛋白的提取与应用研究进展[J]. 仲恺农业工程学院学报, 2017, 30(2): 52-57. GUO Q B, MO R Y, HE M, et al. Research progress on extraction and application of feather keratin[J]. Journal of Zhongkai University of Agriculture and Engineering, 2017, 30(2): 52-57 (in Chinese). DOI:10.3969/j.issn.1674-5663.2017.02.009 |
| [2] |
贾如琰, 何玉凤, 王荣民, 等. 角蛋白的分子构成、提取及应用[J]. 化学通报, 2008(4): 265-271. JIA R Y, HE Y F, WANG R M, et al. Advanced in structure, extract and applications of keratins[J]. Chemistry, 2008(4): 265-271 (in Chinese). |
| [3] |
PAPADOPOULOS M C. The effect of enzymatic treatment on amino acid content and nitrogen characteristics of feather meal[J]. Animal Feed Science and Technology, 1986, 16(1/2): 151-156. |
| [4] |
刘玉芬, 仇德勇, 徐伟, 等. 羽毛粉加工工艺[J]. 农村新技术, 2011(2): 61-63. LIU Y F, QIU D Y, XU W, et al. Processing technology of feather meal[J]. New Rural Technology, 2011(2): 61-63 (in Chinese). DOI:10.3969/j.issn.1002-3542.2011.02.053 |
| [5] |
陈盈霖, 李佳凝, 刘洋, 等. 羽毛粉加工及应用的研究进展[J]. 黑龙江畜牧兽医, 2017(19): 78-82. CHEN Y L, LI J N, LIU Y, et al. Research progress of feather meal processing and application[J]. Heilongjiang Animal Science and Veterinary Medicine, 2017(19): 78-82 (in Chinese). |
| [6] |
柳焕章, 刘建钗, 刘彦威, 等. 角蛋白分解真菌KDF-11的筛选与鉴定[J]. 饲料研究, 2014(15): 71-74. LIU H Z, LIU J C, LIU Y W, et al. Screening and identification of keratinolytic fungus KDF-11[J]. Feed Research, 2014(15): 71-74 (in Chinese). |
| [7] |
涂国全, 孙宇晖, 郭美锦, 等. 链霉菌分解角蛋白的生化机制研究[J]. 江西农业大学学报, 1998(2): 14-19. TU G Q, SUN Y H, GUO M J, et al. Study on the biochemical mechanism of degrading keratins by Streptomyces fradiae[J]. Acta Agriculturae Universitis Jiangxiensis, 1998(2): 14-19 (in Chinese). |
| [8] |
HADDAR A, HMIDET N, GHORBEL-BELLAAJ O, et al. Alkaline proteases produced by Bacillus licheniformis RP1 grown on shrimp wastes: application in chitin extraction, chicken feather-degradation and as a dehairing agent[J]. Biotechnology and Bioprocess Engineering, 2011, 16(4): 669-678. DOI:10.1007/s12257-010-0410-7 |
| [9] |
傅伟. 地衣芽孢杆菌降解羽毛角蛋白及其发酵产角蛋白酶的研究[D]. 硕士学位论文. 杭州: 浙江大学, 2007: 28-36. FU W. Research on biodegradation of poultry feather by Bacillus licheniformis and its keratinase fermentation[D]. Master's Thesis. Hangzhou: Zhejiang University, 2007: 28-36. (in Chinese) |
| [10] |
李金婷, 路福平, 李玉, 等. 高效降解羽毛角蛋白菌株的筛选与鉴定[J]. 天津科技大学学报, 2010, 25(6): 14-17, 29. LI J T, LU F P, LI Y, et al. Screening and identification of a high efficient keratin-degrading strain[J]. Journal of Tianjin University of Science & Technology, 2010, 25(6): 14-17, 29 (in Chinese). DOI:10.3969/j.issn.1672-6510.2010.06.004 |
| [11] |
蔡成岗. 角蛋白酶生产菌株选育、发酵与分离纯化研究[D]. 博士学位论文. 杭州: 浙江大学, 2007: 16-30. CAI C G. The study of strain screening, fermentation and purification of keratinase[D]. Ph. D. Thesis. Hangzhou: Zhejiang University, 2007: 16-30. (in Chinese) |
| [12] |
吕常旭. 蜡状芽孢杆菌X5降解羽毛角蛋白的发酵优化[D]. 硕士学位论文. 泰安: 山东农业大学, 2012: 50-56. LV C X. Fermentation optimization of feather-degrading by Bacillus cereus X5[D]. Master's Thesis. Taian: Shandong Agricultural University, 2012: 50-56. (in Chinese) |
| [13] |
周杰. 羽毛降解菌的筛选、发酵条件优化及降解特性研究[D]. 硕士学位论文. 合肥: 合肥工业大学, 2017: 19-22. ZHOU J. Screening and fermentation conditions optimizing of a feather-degrading strain and its characterization of degradation[D]. Master's Thesis. Hefei: Hefei University of Technology, 2017: 19-22. (in Chinese) |
| [14] |
NOVAL J J, NICKERSON W J. Decomposition of native keratin by Streptomyces fradiae[J]. Journal of Bacteriology, 1959, 77(3): 251-263. DOI:10.1128/jb.77.3.251-263.1959 |
| [15] |
BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72: 248-254. DOI:10.1016/0003-2697(76)90527-3 |
| [16] |
尹静, 蔡宇杰, 廖祥儒, 等. 一株从腐烂蓝藻中分离的细菌的鉴定及其发酵产蛋白酶研究[J]. 食品与生物技术学报, 2011, 30(6): 911-916. YIN J, CAI Y J, LIAO X R, et al. Identification of a bacterium isolated from the decayed cyanobacteria and its fermentation for protease production[J]. Journal of Food Science and Biotechnology, 2011, 30(6): 911-916 (in Chinese). |
| [17] |
张智, 滕婷婷, 王淼. 溶氧对发酵的影响及控制[J]. 科学咨询, 2008(21): 63-64. ZHANG Z, TENG T T, WANG M. The influence and control of dissolved oxygen on fermentation[J]. Scientific Consult, 2008(21): 63-64 (in Chinese). |
| [18] |
李江, 姚斌, 范云六. 微生物角蛋白酶的分子生物学研究进展[J]. 工业微生物, 2006, 36(3): 37-42. LI J, YAO B, FAN Y L. Research advances in molecular biology of microbial keratinase[J]. Industrial Microbiology, 2006, 36(3): 37-42 (in Chinese). DOI:10.3969/j.issn.1001-6678.2006.03.009 |
| [19] |
郭刚, 楚杰, 王君高, 等. 产角蛋白酶菌株的筛选、鉴定和发酵特性的初步研究[J]. 中国畜牧兽医, 2012, 39(3): 125-129. GUO G, CHU J, WANG J G, et al. Screening, identification of a strain with high keratinase production and the primary study of its characterization of fermentation[J]. China Animal Husbandry & Veterinary Medicine, 2012, 39(3): 125-129 (in Chinese). DOI:10.3969/j.issn.1671-7236.2012.03.028 |
| [20] |
JEONG J H, JEON Y D, LEE O M, et al. Characterization of a multifunctional feather-degrading Bacillus subtilis isolated from forest soil[J]. Biodegradation, 2010, 21(6): 1029-1040. DOI:10.1007/s10532-010-9363-y |
| [21] |
MATSUI T, YAMADA Y, MITSUYA H, et al. Sustainable and practical degradation of intact chicken feathers by cultivating a newly isolated thermophilic Meiothermus ruber H328[J]. Applied Microbiology and Biotechnology, 2009, 82(5): 941-950. DOI:10.1007/s00253-009-1880-4 |
| [22] |
袁森泉. 产蛋母鸡的第三限制性氨基酸[J]. 国外畜牧科技, 1990(1): 36. YUAN S Q. The third limiting amino acid of laying hens[J]. Animal Science Abroad, 1990(1): 36 (in Chinese). |
| [23] |
SHIMOMURA Y, YAMAMOTO Y, BAJOTTO G, et al. Nutraceutical effects of branched-chain amino acids on skeletal muscle[J]. The Journal of Nutrition, 2006, 136(2): 529S-532S. |
| [24] |
冯尚连. 支链氨基酸对母猪的营养作用[J]. 饲料广角, 2009(15): 26-27, 40. FENG S L. The nutritional function of branched-chained amino acid (BCAA) in sows[J]. Feed China, 2009(15): 26-27, 40 (in Chinese). |
| [25] |
代腊, 邹晓庭. 缬氨酸在畜禽生产中的应用[J]. 饲料与畜牧, 2012(12): 20-23. DAI L, ZOU X T. Application of valine in livestock and poultry production[J]. Feed and Husbandry, 2012(12): 20-23 (in Chinese). |
| [26] |
YUDKOFF M. Brain metabolism of branched-chain amino acids[J]. Glia, 2015, 21(1): 92-98. |
| [27] |
李吉祥. 日粮中添加缬氨酸对哺乳母猪生产性能的影响[J]. 黑龙江畜牧兽医, 2010(15): 73-74. LI J X. Effect of adding valine in diet on the performance of lactating sows[J]. Heilongjiang Animal Science and Veterinary Medicine, 2010(15): 73-74 (in Chinese). |
| [28] |
汪多仁. L-苯丙氨酸生产与应用[J]. 发酵科技通讯, 2011, 40(1): 29-36. WANG D R. Production and application of L-phenylalanine[J]. Bulletin of Fermentation Science and Technology, 2011, 40(1): 29-36 (in Chinese). |




