2. 中国农业科学院 北京畜牧兽医研究所, 动物营养学国家重点实验室, 北京 100193;
3. 温氏食品集团股份有限公司, 云浮 527400
2. State Key Laboratory of Animal Nutrition, Institute of Animal Sciences, Chinese Academy of Agricultural Sciences, Beijing 100193, China;
3. Wen's Food Group Co., Ltd., Yunfu 527400, China
在体外模拟鸡对蛋白质的消化试验中,模拟小肠液(simulated small intestinal fluid,SSIF)相对于体内小肠液(endogenous small intestinal fluid,ESIF)的仿真程度对整个胃-小肠的仿生消化有着重要的影响。比较2种小肠液在体外对饲料消化后蛋白质分子量分布的差异是检验SSIF是否接近ESIF的重要基础。在体外模拟蛋白质的消化试验中,SSIF通常采用试剂级胰液素配制[1-3],体外模拟消化的效果通过其氨基酸消化率与体内法测值的接近程度或相关性判断[1-4]。然而,仅从氨基酸消化率的差异仍难以说明体外消化对蛋白质的水解程度与体内消化程度的相似性。十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)是分离、鉴定蛋白质的通用方法[5]。在饲料蛋白质、消化酶与植酸的互作[6],瘤胃液对不同保护处理豆粕蛋白质的降解[7],酶菌复合处理对麸皮蛋白质降解的影响[8]等研究中,SDS-PAGE可以清晰地分辨试验处理对蛋白质分子量变化的影响。多个实验室间同时采用SDS-PAGE分析胃蛋白酶体外消化食品后产物的分子量分布,获得测定结果的一致性最高达91%[9]。近年来,在体外模拟饲料或食品蛋白质的消化中,消化液水解蛋白质后的上清液采用凝胶电泳可以进一步分析不同处理条件下蛋白质降解后的分子量大小分布,并可根据分子量鉴定蛋白质片段的性质[10-12]。因此,通过凝胶电泳鉴别体外模拟消化后未消化物中蛋白质片段大小的相似性,可以用于比较模拟消化液与体内消化液对蛋白质水解特性的差异。为此,本试验采用鸡ESIF和SSIF分别对5种常用蛋白质饲料原料进行仿生消化后,通过SDS-PAGE分析残渣中蛋白质片段分布的差异,以明确SSIF对ESIF水解蛋白质程度的代表性。
1 材料与方法 1.1 试验设计采用两样本比较试验设计,即小肠液设2个处理,分别为鸡ESIF和SSIF。ESIF为在卵黄囊憩室附近安装空肠套管的成年京星黄羽肉鸡(中国农业科学院北京畜牧兽医研究所育成品种)收集食糜后在4 ℃、1 250×g下离心10 min获得的上清小肠液;SSIF是将成年京星黄羽肉鸡的小肠液根据党方坤[13]的方法纯化消化酶蛋白质,经冻干成粉剂后,加入少量的胰蛋白酶(Amresco 0785)和糜蛋白酶(Amresco 0164)制备而成。按Dahlqvist[14]、Rick等[15-16]描述的方法分别测定淀粉酶、胰蛋白酶和糜蛋白酶的活性,然后,根据与鸡体内空肠液消化酶的活性相等的原则,配制SSIF。ESIF和SSIF中淀粉酶、胰蛋白酶和糜蛋白酶的活性分别为401、26和14 U/mL。以豆粕、棉籽粕、菜籽粕、玉米蛋白粉(由温氏食品集团股份有限公司提供)和酪蛋白(由甘肃华羚乳品股份有限公司提供)为蛋白质饲料原料的代表性底物。在SDS-Ⅱ单胃动物仿生消化系统(湖南中本智能科技发展有限公司生产)中以2种小肠液对每个饲料原料进行仿生消化,每个处理5个重复,每个重复1根消化管。
1.2 饲料原料及其营养水平采集饲用豆粕、棉籽粕、菜籽粕、玉米蛋白粉及食品级酪蛋白作为小肠液仿生消化的底物。按GB/T 6435—2014[17]测定样品中水分含量并计算其干物质含量,分别按GB/T 6432—2018[18]、GB/T 6433—2006[19]、GB/T 20806—2006[20]和NY/T 1459—2007[21]测定样品中粗蛋白质、粗脂肪、中性洗涤纤维和酸性洗涤纤维含量;饲料原料总能(GE)的测定根据ISO 9831 ∶ 19982[22]的方法进行。5种饲料原料的营养水平见表 1。
|
|
表 1 饲料原料的营养水平(干物质基础) Table 1 Nutrient levels of feed ingredients (DM basis) |
鸡仿生消化过程参照Zhao等[23]的描述进行。将1 g蛋白质饲料原料装入透析袋中,然后加入20 mL小肠液。在仿生消化系统中,温度设置为41 ℃,小肠前段消化4 h,小肠后段消化4 h。其中小肠前段缓冲液为0.2 mol/L、pH为6.50的磷酸盐溶液,小肠后段缓冲液为0.2 mol/L、pH为7.99的磷酸盐溶液。消化结束后,将透析袋残渣转移至培养皿中,经冷冻干燥机干燥后制备成样品,装入15 mL离心管中-20 ℃保存。
1.4 仿生消化残渣蛋白质SDS-PAGE分析仿生消化残渣中蛋白质的提取:参照傅淑宏等[24]的方法,从每个仿生消化的残渣样品中取0.2 mg加入5 mL 0.15 mol/L的生理盐水,在室温下回旋混合30 min后,以1 000×g离心10 min,取上清液再以2 700×g离心10 min,得到上清液,用于凝胶电泳。
SDS-PAGE分析:将160 μL蛋白质提取液与40 μL SDS-PAGE Loading buffer(CWBIO,货号:CW0027S)混合成200 μL,95 ℃金属浴加热裂解5 min,恢复至室温后取30 μL注入胶孔。将凝胶(GenScript,4%~20% Mops分离胶)保持在110 mA的恒定电流下,直到buffer染料到达凝胶底部为止。使用考马斯亮蓝溶液完成蛋白质染色。使用500 mL脱色液(50 mL甲醇+50 mL乙酸+400 mL蒸馏水)溶液脱色,然后使用GS-900 Calibrated Densitometer(Bio-Red Laboratories,Inc)图像系统进行凝胶成像。通过和标准蛋白(BiostepTM Prestained Protain Marker, Tanon, 180-6003)SDS-PAGE的结果进行比较,即可获得仿生消化残渣中蛋白质分子量的分布情况。
1.5 数据统计分析采用Quantity One 4.2软件对小肠液消化的饲料残渣蛋白质提取液进行SDS-PAGE后的蛋白质分子量分布的相似性进行比较(Dice相似性系数)。使用Image Lab 5.2.1(Bio-Red Laboratories,Inc)软件获得不同分子量蛋白质的占比,采用SAS 9.2的MEANS模块计算基本统计量,t检验模块对每一个饲料原料用2种小肠液消化后残渣蛋白质分子量分布的占比进行两样本比较。
2 结果与分析 2.1 鸡ESIF和SSFI对饲料仿生消化残渣蛋白质片段的相似性比较由图 1可知,在鸡ESIF和SSIF淀粉酶、胰蛋白酶和糜蛋白酶活性都一致的条件下,对豆粕消化残渣的蛋白质提取液通过SDS-PAGE后,蛋白质片段均分布在132 ku以下,其中ESIF的消化残渣共计分布了10个条带[5个重复相似性变异系数(CV)=6.92%],SSIF的消化残渣共计分布了11个条带(5个重复相似性CV=4.94%),两者的相似性为69.9%;棉籽粕消化残渣的蛋白质提取液通过SDS-PAGE后,蛋白质片段均分布在190 ku以下,其中ESIF的消化残渣共计分布了8个条带(5个重复相似性CV=7.72%),SSIF的消化残渣共计分布了9个条带(5个重复相似性CV=6.57%),两者的相似性为30.8%;菜籽粕消化残渣的蛋白质提取液通过SDS-PAGE后,蛋白质片段均分布在126 ku以下,其中ESIF的消化残渣共计分布了10个条带(5个重复相似性CV=4.84%),SSIF的消化残渣共计分布了12个条带(5个重复相似性CV=1.96%),两者的相似性为90.1%;玉米蛋白粉消化残渣的蛋白质提取液通过SDS-PAGE后,蛋白质片段均分布在122 ku以下,其中ESIF的消化残渣共计分布了7个条带(5个重复相似性CV=5.01%),SSIF的消化残渣共计分布了8个条带(5个重复相似性CV=4.03%),两者相似性为77.7%;酪蛋白消化残渣的蛋白质提取液通过SDS-PAGE后,蛋白质片段均分布在118 ku以下,其中ESIF的消化残渣共计分布了9个条带(5个重复相似性CV=10.91%),SSIF的消化残渣共计分布了10个条带(5个重复相似性CV=1.61%),两者的相似性为74.2%。
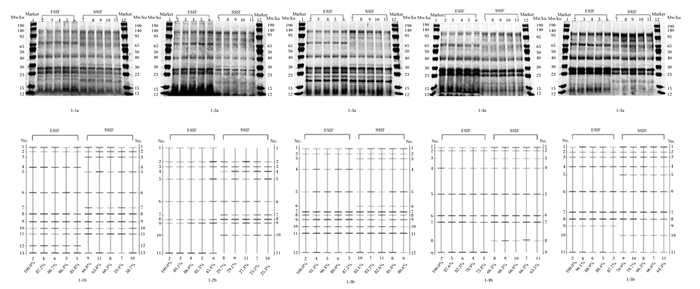
|
图中第1条和第12条泳道为参照标记(marker),第2、3、4、5和6泳道为鸡ESIF消化残渣,第7、8、9、10和11泳道为鸡SSIF消化残渣。图 1-1a、图 1-2a、图 1-3a、图 1-4a和图 1-5a分别为豆粕、棉籽粕、菜籽粕、玉米蛋白粉和酪蛋白消化残渣蛋白质的电泳条带。图 1-1b、图 1-2b、图 1-3b、图 1-4b和图 1-5b分别为豆粕、棉籽粕、菜籽粕、玉米蛋白粉和酪蛋白消化残渣蛋白质的电泳条带通过Quantity One软件进行相似性分析。No.: 条带总数;Mw:分子量。 In the figure, lanes 1 and 12 were marker. Lanes 2, 3, 4, 5 and 6 and lanes 7, 8, 9, 10 and 11 were residue digested by ESIF and SSIF form chicken, respectively. Figures 1-1a, 1-2a, 1-3a, 1-4a and 1-5a were electrophoretic bands of proteins from soybean meal, cottonseed meal, rapeseed meal, corn gluten meal and casein digestion residue, respectively. Figures 1-1b, 1-2b, 1-3b, 1-4b and 1-5b were similarity analysis conducted in Quantity One software of electrophoretic bands of proteins from soybean meal, cottonseed meal, rapeseed meal, corn gluten meal and casein digestion residue, respectively.No.: total band number; Mw: molecular weight. 图 1 鸡ESIF和SSFI对饲料仿生消化残渣蛋白质片段的相似性比较 Fig. 1 Similarity comparison of protein fragments in feed bionic digestion residue by ESIF and SSFI from chicken |
由表 2可知,在小肠液对饲料仿生消化后的残渣蛋白质提取液中,ESIF消化豆粕残渣中分子量为21~22 ku、24~25 ku和63~74 ku的蛋白质片段占比极显著高于SSIF(P<0.01),而为118~132 ku的蛋白质片段占比极显著低于SSIF(P<0.01);ESIF消化棉籽粕残渣中分子量为118~132 ku的蛋白质片段占比极显著低于SSIF(P<0.01);ESIF消化菜籽粕残渣中分子量为39~43 ku和63~74 ku的蛋白质片段占比显著或极显著高于SSIF(P<0.05或P<0.01),而为104~117 ku和118~132 ku的蛋白质片段占比极显著或显著低于SSIF(P<0.01或P<0.05);ESIF消化玉米蛋白粉残渣中分子量为13~15 ku和24~25 ku的蛋白质片段占比极显著或显著高于SSIF(P<0.01或P<0.05);ESIF消化酪蛋白残渣中分子量为13~15 ku和24~25 ku的蛋白质片段占比显著或极显著高于SSIF(P<0.05或P<0.01),而为17~20 ku、53~57 ku和84~94 ku的蛋白质片段占比显著或极显著低于SSIF(P<0.05或P<0.01)。
|
|
表 2 鸡ESIF和SSFI对饲料仿生消化残渣蛋白质分子量分布的差异比较 Table 2 Comparison of ESIF and SSFI from chicken on protein molecular weight distribution in feed bionic digestion residue |
在比较鸡SSIF与ESIF对饲料消化能力的差异上,传统的方法是在体外模拟消化下比较两者对同一个饲料样品能量[25-27]或蛋白质[28]水解率的差异。然而,饲料中的供能物质或蛋白质均是由不同组分的有机物组成,SSIF相对于ESIF消化能力的差异仅从对饲料养分的水解率来比较仍难以说明水解后底物分子变化的差异。在饲料蛋白质的消化中,分子量由大变小,通过SDS-PAGE可以较好地检测蛋白质分子量的分布情况。由于凝胶中十二烷基硫酸钠使蛋白质样品带上了大量的负电荷,从而掩盖了蛋白质分子原有的电荷量,因此,通过SDS-PAGE可以使不同分子量的蛋白质分离。Rosa-Sibakov等[11]、Duodu等[29]、Collier等[30]和Nurfaidah等[31]就利用SDS-PAGE鉴别生化反应途径中蛋白质的释放量、加工工艺对饲料蛋白质变化的影响以及动物粪便中不同分子量蛋白质排泄量的变化。由此可见,在饲料蛋白质的消化过程研究中,SDS-PAGE正成为鉴别不同大小蛋白质的手段。在SDS-PAGE分离饲料来源的蛋白质分子中,如何提取蛋白质非常关键。从植物性饲料原料或食物中提取蛋白质的处理因样品的特性不同可能需要采用不同的方式,如Sousa等[12]从小麦麸、高粱、花生、木豆和乳清中提取蛋白质的方法在溶剂的选择、蛋白质的沉淀等步骤上各不相同。本试验也曾采用Elkin等[32]的方法,对仿生消化残渣中的蛋白质用缓冲液(0.012 5 mol/L硼酸钠、1%十二烷基硫酸钠、10 mmol/L苯甲基磺酰氟、2%β-巯基乙醇,pH=10)在室温下震荡提取2 h,再10 000×g离心20 min后取上清液。然而,SDS-PAGE染色后未出现任何蛋白质条带,而采用傅淑宏等[24]的方法以生理盐水溶液提取仿生消化残渣则能显示蛋白质条带。考虑到本试验比较2种小肠液对饲料样品进行消化后残渣中蛋白质片段的差异,虽然生理盐水没有提取残渣中所有的蛋白质,但在相同的提取条件下,可以说明2种小肠液对饲料消化后残渣中溶解于生理盐水的蛋白质分子量大小的差异。
3.2 SSIF对ESIF的仿真程度在动物体内消化中,小肠是饲料养分消化吸收的主要场所。目前,研究人员通常采用胰液素[33-34]或几种单一消化酶试剂[23]混合后制备SSIF,而对SSIF与ESIF在酶学特性及消化能力的差异鲜见相关报道。Zhang等[35]采用从鸭空肠液提取消化酶制备SSIF,相对于鸭ESIF对玉米、小麦、豆粕和棉籽粕能量消化率的比值为96%~101%,其中2种肠液对棉籽粕的能量消化率相差稍大(比值为96%~98%)。任立芹[36]研究表明,采用淀粉酶、胰蛋白酶和糜蛋白酶制备的SSIF对16个鸡饲料样品进行胃-小肠2阶段模拟消化后的氨基酸消化率比体内消化率约低8.5%。而SSIF相对于ESIF对饲料水解后蛋白质分子量变化的差异,尚显见相关报道。本研究中,SSIF与ESIF对5个饲料样品进行水解后,豆粕、菜籽粕、玉米蛋白粉和酪蛋白消化残渣中蛋白质分子量分布的相似性为69.9%~90.1%,而棉籽粕残渣中蛋白质分子量分布的相似性仅为30.8%。这主要是由于ESIF水解饲料后残渣中分子量相对低的蛋白质占比高,而SSIF水解残渣中分子量相对高的蛋白质占比高,这一现象在棉籽粕中尤为明显。上述结果表明,SSIF与ESIF对饲料蛋白质水解后分子量分布的差异可能远大于仿生消化法测定蛋白质消化率的差异。ESIF水解饲料后残渣的蛋白质分子量比SSIF更低,且对不同的饲料原料表现的差异不一致,这也部分说明了Zhang等[35]的试验中SSIF与ESIF在棉籽粕的消化率上差异大于其他饲料,以及任立芹[36]的试验中模拟消化测定的鸡饲料氨基酸消化率低于体内法测值。在本研究的关联试验中,虽然SSIF与ESIF在消化液蛋白质的分子量分布相似性高,对玉米淀粉和小麦淀粉中淀粉水解动力学及大豆浓缩蛋白和酪蛋白的蛋白质水解动力学也比较接近,但对饲料粗蛋白质的消化率的差异仍因饲料不同而异(豆粕,3.87%;棉籽粕,3.35%;菜籽粕,-0.32%;玉米蛋白粉,-0.70%;酪蛋白,-1.01%),且消化率的差异程度与本试验中消化残渣蛋白质分子量分布的相似性高低相对应,但粗蛋白质消化率的差异程度远低于消化残渣蛋白质分子量分布的相似性。这也表明制备SSIF的消化酶来源及酶学特性与ESIF的细微差异可能会引起蛋白质水解程度较大的差异。
4 结论ESIF与SSIF水解饲料后残渣中蛋白质分子量分布的相似性因饲料来源的不同而呈现较大的差异。ESIF水解饲料后残渣中分子量相对低的蛋白质占比高,而SSIF水解残渣中分子量相对高的蛋白质占比高。
| [1] |
BOISEN S, FERNÁNDEZ J A. Prediction of the apparent ileal digestibility of protein and amino acids in feedstuffs and feed mixtures for pigs by in vitro analyses[J]. Animal Feed Science and Technology, 1995, 51(1/2): 29-43. |
| [2] |
BRYAN D D S L, ABBOTT D A, CLASSEN H L. Digestion kinetics of protein sources determined using an in vitro chicken model[J]. Animal Feed Science and Technology, 2019, 248: 106-113. DOI:10.1016/j.anifeedsci.2019.01.002 |
| [3] |
BOISEN S. In vitro analyses for predicting standardised ileal digestibility of protein and amino acids in actual batches of feedstuffs and diets for pigs[J]. Livestock Science, 2007, 109(1/3): 182-185. |
| [4] |
ROCHELL S J, KUHLERS D L, DOZIER W A 3RD. Relationship between in vitro assays and standardized ileal amino acid digestibility of animal protein meals in broilers[J]. Poultry Science, 2013, 92(1): 158-170. DOI:10.3382/ps.2012-02365 |
| [5] |
SHEEN H, ALI-KHAN Z. Protein sample concentration by repeated loading onto SDS-PAGE[J]. Analytical Biochemistry, 2005, 343(2): 338-340. DOI:10.1016/j.ab.2005.05.033 |
| [6] |
KIES A K, DE JONGE L H, KEMME P A, et al. Interaction between protein, phytate, and microbial phytase.In vitro studies[J]. Journal of Agricultural and Food Chemistry, 2006, 54(5): 1753-1758. DOI:10.1021/jf0518554 |
| [7] |
SADEGHI A A, NIKKHAH A, SHAWRANG P, et al. Protein degradation kinetics of untreated and treated soybean meal using SDS-PAGE[J]. Animal Feed Science and Technology, 2006, 126(1/2): 121-133. |
| [8] |
ARTE E, RIZZELLO C G, VERNI M, et al. Impact of enzymatic and microbial bioprocessing on protein modification and nutritional properties of wheat bran[J]. Journal of Agricultural and Food Chemistry, 2015, 63(39): 8685-8693. DOI:10.1021/acs.jafc.5b03495 |
| [9] |
THOMAS K, AALBERS M, BANNON G A, et al. A multi-laboratory evaluation of a common in vitro pepsin digestion assay protocol used in assessing the safety of novel proteins[J]. Regulatory Toxicology and Pharmacology, 2004, 39(2): 87-98. DOI:10.1016/j.yrtph.2003.11.003 |
| [10] |
BRYAN D D S L, ABBOTT D A, CLASSEN H L. Development of an in vitro protein digestibility assay mimicking the chicken digestive tract[J]. Animal Nutrition, 2018, 4(4): 401-409. DOI:10.1016/j.aninu.2018.04.007 |
| [11] |
ROSA-SIBAKOV N, RE M, KARSMA A, et al. Phytic acid reduction by bioprocessing as a tool to improve the in vitro digestibility of faba bean protein[J]. Journal of Agricultural and Food Chemistry, 2018, 66(40): 10394-10399. DOI:10.1021/acs.jafc.8b02948 |
| [12] |
SOUSA R, PORTMANN R, DUBOIS S, et al. Protein digestion of different protein sources using the INFOGEST static digestion model[J]. Food Research International, 2020, 130: 108996. DOI:10.1016/j.foodres.2020.108996 |
| [13] |
党方坤. 生长猪肠内消化酶的纯化与肠液体外模拟的研究[D]. 硕士学位论文. 北京: 中国农业科学院, 2018. DANG F K. Study on purification of digestive enzymes in intestinal tract and in vitro simulation of intestinal fluid for growing pigs[D]. Master's Thesis. Beijing: Chinese Academy of Agricultural Sciences, 2018. (in Chinese) |
| [14] |
DAHLQVIST A. A method for the determination of amylase in intestinal content[J]. Scandinavian Journal of Clinical & Laboratory Investigation, 1962, 14(2): 145-151. |
| [15] |
RICK W. Chymotrypsin: measurements with N-benzoyl-L-tyrosine ethyl ester as substrate[M]//BERGMEYER H U. Methods of enzymatic analysis. 2nd ed. Pittsburgh: Academic Press, 1974: 1009-1012.
|
| [16] |
RICK W. Trypsin: measurement with Nα-p-toluenesulfonyl-L-arginine methyl ester as substrate[M]//BERGMEYER H U. Methods of enzymatic analysis. 2nd ed. Pittsburgh: Academic Press, 1974: 1021-1024.
|
| [17] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 饲料中水分的测定: GB/T 6435—2014[S]. 北京: 中国标准出版社, 2014. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. Determination of moisture in feedstuffs: GB/T 6435—2014[S]. Beijing: Standards Press of China, 2014. (in Chinese) |
| [18] |
国家市场监督管理总局, 国家标准化管理委员会. 饲料中粗蛋白的测定凯氏定氮法: GB/T 6432—2018[S]. 北京: 中国标准出版社, 2018. State Administration for Market Regulation, Standardization Administration of the People's Republic of China. Determination of crude protein in feeds—Kjeldahl method: GB/T 6432—2018[S]. Beijing: Standards Press of China, 2018. (in Chinese) |
| [19] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 饲料中粗脂肪的测定: GB/T 6433—2006[S]. 北京: 中国标准出版社, 2006. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. Determinaiion of crude fat in feeds: GB/T 6433—2006[S]. Beijing: Standards Press of China, 2006. (in Chinese) |
| [20] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 饲料中中性洗涤纤维(NDF) 的测定: GB/T 20806—2006[S]. 北京: 中国标准出版社, 2006. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. Determination of neutral detergent fiber in feedstuffs: GB/T 20806—2006[S]. Beijing: Standards Press of China, 2006. (in Chinese) |
| [21] |
中华人民共和国农业部. 饲料中酸性洗涤纤维的测定: NY/T 1459—2007[S]. 北京: 农业出版社, 2007. The ministry of agriculture of the People's Republic of China. Determination of acid detergent fiber in feedstuff (ADF): NY/T 1459—2007[S]. Beijing: Agricultural Publishing House, 2007. (in Chinese) |
| [22] |
International Organization for Standardization. Animal feeding stuffs, animal products, and faeces or urine-determination of gross calorific value-Bomb calorimeter method: US ISO 9831: 1998[S]. Geneva: ISO, 1998.
|
| [23] |
ZHAO F, REN L Q, MI B M, et al. Developing a computer-controlled simulated digestion system to predict the concentration of metabolizable energy of feedstuffs for rooster[J]. Journal of Animal Science, 2014, 92(4): 1537-1547. DOI:10.2527/jas.2013-6636 |
| [24] |
傅淑宏, 魏开华, 李晓霞, 等. 胃腺癌患者粪便蛋白质的提取及初步质谱分析[J]. 现代检验医学杂志, 2015(4): 14-20. FU S H, WEI K H, LI X X, et al. Protein extraction and preliminary research on proteins in stools from patients with gastric adenocarcinoma[J]. Journal of Modern Laboratory Medicine, 2015(4): 14-20 (in Chinese). DOI:10.3969/j.issn.1671-7414.2015.04.004 |
| [25] |
彭运智, 谭会泽, 刘松柏, 等. 基于仿生消化系统估测肉鸭饲料原料代谢能的研究[J]. 动物营养学报, 2020, 32(2): 881-889. PENG Y Z, TAN H Z, LIU S B, et al. A study of feed ingredient metabolisable energy of meat ducks predicted with simulated digestion system[J]. Chinese Journal of Animal Nutrition, 2020, 32(2): 881-889 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.02.043 |
| [26] |
魏杰, 谢明, 赵峰, 等. 豆粕的鸭代谢能与酶水解能相关性研究[C]//中国畜牧兽医学会2018年学术年会禽病学分会第十九次学术研讨会论文集. 南宁: 中国畜牧兽医学会, 2018: 311. WEI J, XIE M, ZHAO F, et al. Correlation between metabolizable energy and enzymatic hydrolysis energy of soybean meal in ducks[C]//Proceedings of the 19th Symposium of Avian Epidemiology Branch of the Chinese Society of Animal Science and Veterinary Medicine. Nanning: Chinese Association of Animal Science and Veterinary Medicine, 2018: 311. (in Chinese) |
| [27] |
张莉, 赵峰, 卞国志, 等. 两种模拟肠液在仿生消化法估测鸭饲料能量消化率中的比较研究[C]//中国畜牧兽医学会动物营养学分会第七届中国饲料营养学术研讨会论文集. 郑州: 中国畜牧兽医学会动物营养学分会, 2014: 254-255. ZHANG L, ZHAO F, BIAN G Z, et al. Comparative study of two kinds of simulated intestinal fluids in estimating energy digestibility of duck feed by bionic digestion method[C]//Proceedings of the 7th Chinese Feed Nutrition Academic Symposium, Animal Nutrition Branch, Chinese Society of Animal Science and Veterinary Medicine. Zhengzhou: Animal Nutrition Branch of China Institute of Animal Husbandry and Veterinary Medicine, 2014: 254-255. (in Chinese) |
| [28] |
王亚. 基于模拟生长猪胃-小肠消化过程测定谷实类饲料原料蛋白质效价的研究[D]. 硕士学位论文. 北京: 中国农业科学院, 2019. WANG Y. Study on determination of protein availability in cereal g rains based on simulated gastro-small intestinal digestion process for growing pigs[D]. Master's Thesis. Beijing: Chinese Academy of Agricultural Sciences, 2019. (in Chinese) |
| [29] |
DUODU K G, TAYLOR J R N, BELTON P S, et al. Factors affecting sorghum protein digestibility[J]. Journal of Cereal Science, 2003, 38(2): 117-131. DOI:10.1016/S0733-5210(03)00016-X |
| [30] |
COLLIER K, BARBER L, LOTT J N A. A study of indigestible protein fractions of rice (Oryza sativa, L.) endosperm fed to mice (Mus musculus) and sheep (Ovis musimon): a qualitative and quantitative analysis[J]. Journal of Cereal Science, 1998, 27(1): 95-101. DOI:10.1006/jcrs.1997.0148 |
| [31] |
NURFAIDAH, METUSALACH, MAHENDRADATTA M, et al. Analysis of molecular weight albumin concentrate on various types of freshwater fish using SDS-page electrophoresis method[J]. IOP Conference Series: Earth and Environmental Science, 2020, 564: 012057. DOI:10.1088/1755-1315/564/1/012057 |
| [32] |
ELKIN R G, FREED M B, HAMAKER B R, et al. Condensed tannins are only partially responsible for variations in nutrient digestibilities of sorghum grain cultivars[J]. Journal of Agricultural and Food Chemistry, 1996, 44(3): 848-853. DOI:10.1021/jf950489t |
| [33] |
VALDES E V, LEESON S. Measurement of metabolizable energy in poultry feeds by an in vitro system[J]. Poultry Science, 1992, 71(9): 1493-1503. DOI:10.3382/ps.0711493 |
| [34] |
BOISEN S, FERNÁNDEZ J A. Prediction of the total tract digestibility of energy in feedstuffs and pig diets by in vitro analyses[J]. Animal Feed Science and Technology, 1997, 68(3/4): 277-286. |
| [35] |
ZHANG L, ZHAO F, ZHANG H, et al. Validation of in vitro digestion using simulated small intestinal fluid with specific digestive activity to predict the metabolizable energy of feed ingredients for duck[J]. Poultry Science, 2019, 98(3): 1280-1287. |
| [36] |
任立芹. 仿生法评定黄羽肉鸡常用饲料代谢能和可消化氨基酸研究[D]. 博士学位论文. 北京: 中国农业科学院, 2012. REN L Q. Study on the method to predict the metabolizable energy and digestible amino acid of ingredients in yellow chickens using the simulative digestion system[D]. Ph. D. Thesis. Beijing: Chinese Academy of Agricultural Sciences, 2012. (in Chinese) |




