牛磺酸,化学名为β-氨基乙磺酸,化学式为C2H7NO3S,分子结构式为H2N-CH2-CH2-SO3H。1975年,研究者首次发现牛磺酸是早产儿必需的营养物质,随后牛磺酸相关研究大量开展。牛磺酸是母猪乳中含量最丰富的游离氨基酸,初乳中含量约为903 μmol/mL,哺乳第8天可高达1 474 μmol/mL;而初乳中和哺乳第8天赖氨酸含量仅分别约为20和35 μmol/mL[1],提示乳中牛磺酸在泌乳期对母猪和仔猪营养可能起着至关重要的作用。母猪机体牛磺酸主要有2种来源:1)饲粮中直接摄取;2)利用体内其他含硫氨基酸(半胱氨酸和蛋氨酸)间接合成。传统母猪饲粮中牛磺酸含量极低,难以检出,而且体内合成牛磺酸的关键限速酶(半胱氨酸双加氧酶和半胱亚磺酸脱羧酶)活性较低,导致含硫氨基酸转化为牛磺酸的效率较低,因此外源性添加牛磺酸对于提高母猪繁殖性能和仔猪生长性能很有必要。牛磺酸作为一种含硫的非蛋白氨基酸,不参与体内蛋白质的生物合成,但参与许多重要的生理过程[2]。近年来牛磺酸在母猪生产中的应用研究报道较少,陆续有研究发现饲粮添加牛磺酸对母猪乳腺发育、抗氧化能力以及仔猪生长性能、免疫功能有积极的调控作用。因此,本文就近年来牛磺酸在母猪生产中的应用效果及其作用机制作一综述,为牛磺酸在母猪生产中更好的应用提供参考。
1 牛磺酸在母猪和仔猪生产中的作用 1.1 提高母猪泌乳性能母猪泌乳性能高低直接决定仔猪断奶前的存活率及生长速度,是影响年产断奶仔猪数及生猪上市日龄的关键。母猪泌乳期采食量、泌乳量、仔猪日增重等是量化母猪泌乳性能的关键指标。研究表明,妊娠后期和泌乳期母猪饲粮中添加1%牛磺酸显著提高了其泌乳期平均日采食量(5.23 kg vs. 4.84 kg)[3]。同时,也有研究显示泌乳母猪饲粮中添加低剂量(0.1%)的牛磺酸对其平均日采食量也有显著的提升作用(5.46 kg vs. 5.00 kg)[4]。究其原因可能与牛磺酸添加缓解母猪因热应激导致的氧化应激有关,因为上述2项研究均在夏季开展,已有研究证实牛磺酸对提升机体抗氧化能力有显著促进作用[5]。哺乳仔猪生长性能方面,泌乳母猪饲粮中添加1%的牛磺酸对仔猪初生重和产仔数无显著影响,但可显著提高仔猪平均日增重(230.11 g vs. 194.62 g)[3];陈钊等[4]研究也发现类似的结果,即泌乳母猪饲粮中添加0.1%的牛磺酸可显著提高仔猪平均日增重(222.13 g vs. 202.63 g)和断奶个体重(6.30 kg vs. 5.87 kg)。研究显示,母猪泌乳期采食量与仔猪断奶个体重和平均日增重显著正相关[6],因此仔猪断奶个体重的增加可能是母猪饲粮添加牛磺酸促进采食量提高的结果。同时,母猪饲粮中添加牛磺酸可显著提高仔猪断奶存活率(98% vs. 94%)[4]。Picone等[7]利用代谢组学分析不同品种猪的乳成分时,也发现乳中牛磺酸含量与仔猪存活率呈正相关关系,与上述研究结果一致。牛磺酸除通过提高母猪采食量改善哺乳仔猪生长性能外,其本身对仔猪增重也有促进作用。牛磺酸被认为是新生仔猪条件性必需氨基酸,且必须从母乳中摄取,因为新生仔猪体内合成牛磺酸的限速酶半胱氨酸亚磺酸脱羧酶活性极低,牛磺酸被新生仔猪从乳中获取后,可快速到达机体的各个组织器官,发挥其生理功能。母猪饲粮中添加1%的牛磺酸可显著提高初乳和常乳中牛磺酸含量[3],仔猪断奶个体重提升可能是乳中牛磺酸含量增加的结果,相关研究已证实此观点。仔猪饲粮中添加0.4%的牛磺酸可促进仔猪肠道发育,从而提高断奶仔猪生长速度[8];类似研究发现,断奶仔猪饲粮中添加0.1%的牛磺酸可显著提高仔猪生长速度和饲料转化率[9]。由此可见,母猪饲粮中添加牛磺酸可通过提高母猪采食量和提高乳中牛磺酸含量的方式提高仔猪生长性能,然而,当前饲粮中添加牛磺酸对母猪泌乳性能调控的研究报道极少,饲粮中牛磺酸适宜添加量还需进一步研究。
1.2 促进母猪乳腺发育母猪泌乳量和乳质量主要由母猪乳腺上皮细胞数量和细胞分泌效率决定[10]。母猪乳腺细胞增殖主要集中于妊娠后期(妊娠第75天至分娩),泌乳期主要是乳腺细胞的增大而造成乳腺组织重量增加。母猪乳腺组织DNA、RNA、蛋白质含量是乳腺发育的重要衡量指标,乳腺组织DNA含量反映乳腺上皮细胞数量和增殖率,RNA含量反映单位乳腺组织中乳腺细胞的分泌活性,蛋白质含量反映单位体积乳腺实质部重量[11]。近期研究表明,妊娠后期和泌乳期母猪饲粮中添加1%牛磺酸可增加泌乳母猪乳腺组织DNA和蛋白质含量,但对RNA含量无显著影响[3],提示牛磺酸对母猪乳腺细胞增殖具有促进作用,但并不能改善细胞的分泌活性。牛磺酸促进乳腺细胞增殖可能有两方面原因:一方面,牛磺酸可能通过增加能量代谢促进乳腺细胞增殖,研究表明牛磺酸可显著提升谷氨酸的含量[12],随后谷氨酸通过脱氢生成α-酮戊二酸,参与三羧酸循环产生ATP供能[13];另一方面,牛磺酸可能通过刺激机体繁殖激素的分泌,从而激活与乳腺组织生长相关信号通路,提高乳腺细胞增殖率[14]。
1.3 提高母猪和仔猪免疫和抗氧化能力母猪妊娠后期由于乳腺组织发育加快,导致合成和分解代谢旺盛,活性氧(reactive oxygen species,ROS)生成量增多而造成氧化应激[15],加上分娩应激促进应激激素皮质甾类激素释放,极易通过降低免疫细胞(中性粒细胞和淋巴细胞)的功能,损伤免疫系统,导致母猪更易面临氧化应激风险[16]。大量研究报道了牛磺酸具有提高哺乳动物免疫力、促进机体健康的功能。牛磺酸在免疫细胞中含量丰富,其在中性粒细胞含量高达50 mmol/L[17],表明牛磺酸对机体免疫调控关系密切。张建斌等[18]研究表明,饲粮中添加牛磺酸显著提高了血浆中T淋巴细胞和B淋巴细胞阳性率,从而增强了仔猪细胞免疫能力。然而,目前尚缺乏牛磺酸对母猪免疫细胞增殖的影响研究,母猪不同繁殖阶段,牛磺酸添加量及对免疫系统的调控作用仍需进一步研究。研究表明,母猪饲粮中添加牛磺酸可显著提高初乳中免疫球蛋白(Ig)含量,同时对细胞因子增加及免疫应答均具有重要调节作用。Xu等[3]研究发现,妊娠后期和泌乳期母猪饲粮添加1%的牛磺酸,母猪初乳及新生仔猪血浆中IgG含量显著升高,表明牛磺酸可提高母猪和仔猪免疫力。类似研究表明,饲粮中添加0.3%牛磺酸可有效提高断奶仔猪经脂多糖刺激后血清中IgA、IgM、IgG含量[19]。此外,牛磺酸还具有提高母猪抗氧化能力、抗病能力和抗应激能力的功能。母猪妊娠后期和泌乳期饲粮中添加1%牛磺酸显著提高了血浆和乳中总抗氧化能力,同时显著降低了母猪血浆和乳中丙二醛含量[3]。刘悦[8]在仔猪饲粮中添加0.4%的牛磺酸,结果发现添加牛磺酸显著增加了血清超氧化物歧化酶活性,并显著提高了肝脏组织总抗氧化能力。文超越[20]研究表明,饲粮中添加0.6%牛磺酸可显著提高断奶仔猪肌肉组织和血浆中牛磺酸含量,同时有效缓解农药敌草快攻毒诱导的氧化应激所引起的肌纤维及线粒体形态异常,提高血浆相关抗氧化酶活性和肌肉组织中抗氧化基因表达。
此外,母猪饲粮中添加一定量的牛磺酸可对哺乳仔猪肠道发育发挥积极调控作用。Xu等[3]利用妊娠后期母猪进行试验,结果发现母猪饲粮中添加1%牛磺酸显著提高了哺乳仔猪第1、7、21天肠道的绒毛高度。分析原因可能是由于母猪处于妊娠后期和泌乳期,胎儿发育及泌乳需求使母猪合成代谢旺盛,导致细胞代谢产生各种ROS,促使ROS产生量增加,直接降低乳质量,从而破坏仔猪肠上皮细胞,最终导致肠道氧化损伤;而牛磺酸可有效降低氧化损伤,改善仔猪肠道屏障功能[21]。这一观点与张建斌等[18]通过直接在断奶仔猪饲粮中添加0.1%的牛磺酸显著提高了十二指肠的绒毛高度并降低了十二指肠的隐窝深度的研究结果相一致。因此,母猪或仔猪饲粮添加牛磺酸改善仔猪肠道发育可能与其抗氧化作用有关。
2 牛磺酸提高母猪泌乳性能的作用机制 2.1 牛磺酸促生长的作用机制能量是动物繁殖、生长的基础,新近研究发现牛磺酸可参与机体能量代谢[22]。如图 1所示,正常生理状态下,牛磺酸通过提高电子传递链活性和防止线粒体产生过量的过氧化物,加速蛋白质合成,促进机体生长发育[23]。饲粮中添加牛磺酸可增加雌性ob/ob小鼠腓肠肌肉组织腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)活性,小鼠的高甘油三酯血症降低,糖耐量和胰岛素敏感性得到改善;同时AMPK活性增加可提高脂肪酸的利用率,增加机体能量供给[24]。此外,牛磺酸摄入还可通过调控体内激素水平,影响繁殖组织的生长发育。妊娠后期是母猪乳腺发育的关键阶段,主要受相关激素及营养物质的影响。催乳素在妊娠后期和泌乳期的乳腺发育和泌乳启动过程发挥门控作用,研究表明,母猪饲粮中添加1%的牛磺酸可显著增加血浆催乳素含量,同时试验观察到乳腺腺泡体积增大、泌乳量提高[3]。生长激素可通过生长激素-胰岛素样生长因子-Ⅰ(growth hormone-insulin growth factor-Ⅰ,GH-IGF-Ⅰ)轴影响繁殖组织生长发育[25]。已有研究发现,新生仔鼠奶品中添加牛磺酸或者母体哺乳期补充牛磺酸均可通过调节GH-IGF-Ⅰ信号通路促进其骨骼肌发育[26]。生殖激素是雌性动物繁殖组织赖以发育的必要条件,促卵泡刺激素(follicle stimulating hormone,FSH)、促黄体生成激素(luteinizing hormone,LH)等激素共同调节,构成哺乳动物繁殖组织最重要的调节器。研究表明,饲粮中添加牛磺酸调控部分相关激素水平,从而影响繁殖组织发育。例如,饲粮中添加牛磺酸可提高雌性大鼠卵巢中LH受体及颗粒细胞中FSH受体的基因表达水平,促进卵泡发育[27];饲粮中添加牛磺酸还可通过提高血浆中FSH、LH水平改善母鸡性成熟前的卵巢形态发育和卵巢重量[28]。然而,目前牛磺酸通过调控生殖激素水平影响母猪繁殖性能未见报道,有待研究。病理状态下,牛磺酸可通过增加损伤肌肉组织中谷氨酸的含量间接供能[12]。牛磺酸通过能量代谢调控细胞增殖和组织生长的具体机制可能为:牛磺酸首先上调谷氨酰胺合成酶的表达增加谷氨酸的含量,随后谷氨酸通过脱氢生成α-酮戊二酸,进一步参与三羧酸循环产生ATP供能[13],从而促进肌纤维生长(图 1)。
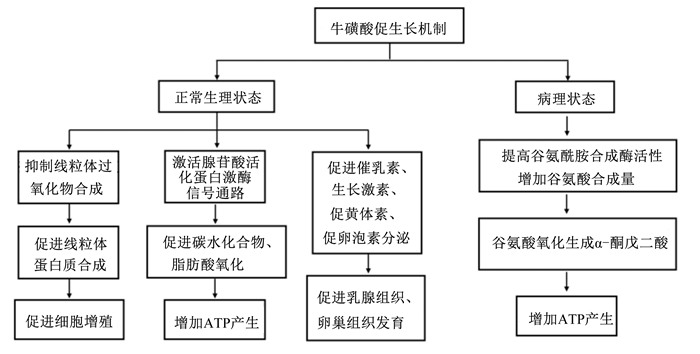
|
图 1 牛磺酸促生长的作用机制 Fig. 1 Mechanism of taurine promoting growth |
动物摄食足量的牛磺酸后,机体逐渐以外源性牛磺酸替代内源性合成牛磺酸,减少了机体内蛋氨酸和半胱氨酸(用于内源性合成牛磺酸)的损失,从而提高谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)活性,保证机体具有良好的抗氧化及ROS清除能力,最终保护细胞免受氧化应激造成的损伤[29](图 2)。目前大量研究已证实,牛磺酸主要通过调节细胞抗氧化防御系统发挥作用[5]。研究发现,对动物进行攻毒处理后,牛磺酸可导致部分抗氧化酶活性恢复;Bai等[30]研究发现,三氧化二砷(As2O3)会引起大鼠后代胰腺细胞发生自噬,导致ROS产生量增加并诱发氧化应激,而饲粮中添加牛磺酸可以缓解As2O3引起的细胞自噬,此研究表明牛磺酸可逆转毒素对抗氧化酶活性的负面影响。同时,部分研究证实,牛磺酸可能具有直接促进抗氧化酶上调的功能。Lee等[31]研究发现,饲粮中添加牛磺酸可提高电击小鼠过氧化氢酶、谷胱甘肽过氧化物酶和谷胱甘肽-S-转移酶活性,提示牛磺酸可通过调控抗氧化酶活性,保护细胞免受氧化应激造成的损伤。另有研究表明,牛磺酸以剂量依赖的方式增加抗氧化酶活性,缓解药物处理对肝脏、睾丸、大脑和肾脏等组织氧化损伤[32]。此外,越来越多的研究表明牛磺酸除了提高机体酶系统抗氧化能力外,还可通过激活细胞或生物体内的各种信号通路来发挥抗氧化作用,其中核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)信号通路是参与氧化应激最密切的信号通路[33]。Lu等[34]研究发现,饲粮中添加牛磺酸可显著降低热应激造成的肉鸡胸肌肉品质的下降,而这种保护作用随着Nrf2和血红素氧合酶-1(heme oxygenase-1,HO-1)蛋白表达水平的增加而提高。牛磺酸激活细胞内的Nrf2信号通路,发挥抗氧化作用的机制也在大量体外试验中被证实。Sun等[35]在肾上腺酮诱导人神经母细胞瘤细胞氧化损伤模型中发现,牛磺酸可通过增加Nrf2的核转位,并上调损伤细胞中的Nrf2和HO-1蛋白表达水平,提高细胞的存活率。进一步研究发现,牛磺酸通过激活Nrf2缓解氧化损伤主要依赖于牛磺酸-氯胺(taurine haloamines,TauCl)的合成。牛磺酸在机体可与内源性次氯酸(hypochlorite,HOCl)反应生成TauCl,TauCl可直接与Nrf2抑制剂蛋白Kelch样ECH关联蛋白1(Kelch-like ECH-associated protein 1,Keap1)结合,促使细胞质中Nrf2转移到细胞核[36]。而Nrf2一旦进入细胞核,将和位于编码抗氧化酶的各种基因启动子区域的抗氧化反应元件(antioxidant response elements,ARE)DNA序列结合,诱导抗氧化酶的基因表达(图 2)。然而,目前牛磺酸介导Nrf2信号通路调控母猪乳腺氧化应激的具体分子机制未见报道,有待研究。
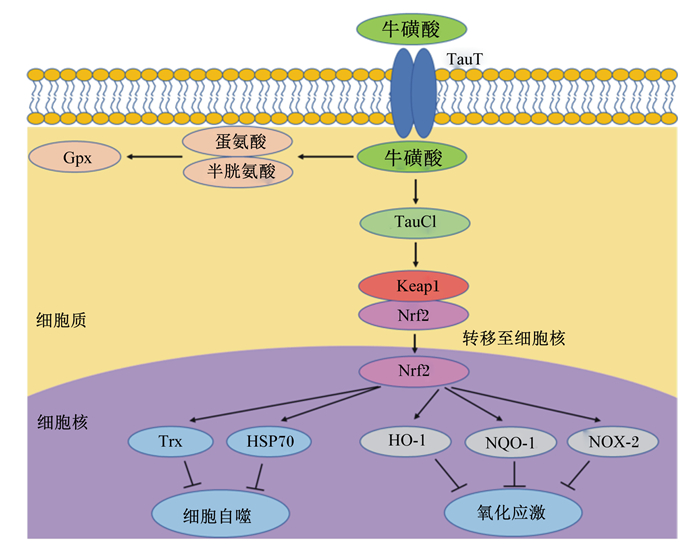
|
TauT:牛磺酸转运载体taurine transporter;Gpx:谷胱甘肽过氧化物酶glutathione peroxidase;TauCl:牛磺酸-氯胺taurine haloamines;Keap1:Kelch样ECH关联蛋白1 Kelch-like ECH-associated protein 1;Trx:硫氧还蛋白thioredoxin;HSP70:热休克蛋白70 heat shock protein 70;HO-1:血红素氧合酶-1 heme oxygenase-1;NQO-1:醌氧化还原酶-1 quinine oxidoredutase-1;NOX-2:烟酰胺腺嘌呤二核苷酸磷酸氧化酶2 nicotinamide adenine dinucleotide phosphate oxidase 2。 图 2 牛磺酸抗氧化的作用机制 Fig. 2 Mechanism of taurine antioxidation |
目前,牛磺酸调控母猪和仔猪免疫功能的作用机制研究未见报道,但在其他动物上的研究已证实牛磺酸对机体免疫功能有重要调控作用,其机制如图 3所示。研究表明,牛磺酸对免疫抑制小鼠肠道稳态有积极的调控作用[37],这一现象与炎症反应过程中牛磺酸转运载体(taurine transporter,TauT)的表达上调有关[38]。在人体上的研究表明,淋巴细胞中TauT基因表达量降低可导致细胞外牛磺酸含量增加,随之增加其代谢物牛磺酸-溴胺(taurine bromamine,TauBr)和TauCl的含量来抵御氧化应激和抑制细胞促炎因子介导的损伤。次溴酸(hypobromous acid,HOBr)是由炎症部位激活的中性粒细胞和嗜酸性粒细胞产生的ROS。牛磺酸易与HOBr反应生成毒性较小的TauBr,TauBr具有保护细胞免受损伤、抗菌、抗炎和抗氧化的作用[39]。一方面,TauBr主要通过抑制核转录因子-κB抑制蛋白α(nuclear transcription factor-kappa B inhibitor α,IκBα)的氧化和降解,下调肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)诱导核转录因子-κB(nuclear transcription factor-kappa B,NF-κB)产生的炎症反应,发挥抗炎作用[40];另一方面,TauBr可降低免疫细胞TNF-α、白细胞介素-6(interleukin-6,IL-6)、白细胞介素-10(interleukin-10,IL-10)的产生[41],上调HO-1蛋白表达[42]。HOCl是由炎症过程中巨噬细胞、中性粒细胞和嗜酸性粒细胞分泌产生的ROS,牛磺酸与HOCl反应可生成TauCl[42]。与TauBr相似,TauCl也具有细胞保护特性,TauCl可通过抑制TNF-α和诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)mRNA的上调,对炎症引起的组织损伤起重要保护作用[43]。此外,TauCl也可通过调节NF-κB信号转导发挥抗炎作用。研究发现,TauCl处理大鼠的巨噬细胞,可有效防止NF-κB的激活及NF-κB向细胞核迁移[44]。但牛磺酸转运蛋白是否介导TauBr或TauCl发挥抗炎作用不甚清楚,有待研究。
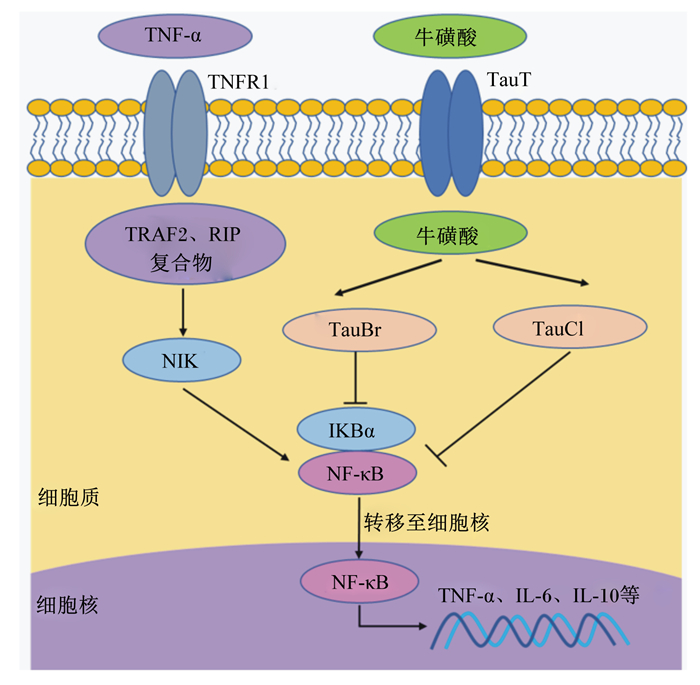
|
TNF-α:肿瘤坏死因子tumor necrosis factor-α;TNFR1:肿瘤坏死因子受体1 tumor necrosis factor transporter 1;TauT:牛磺酸转运载体taurine transporter;TRAF2:肿瘤坏死因子受体相关因子2 tumor necrosis factor receptor related factor 2;RIP:受体互作蛋白receptor interacting protein;TauBr:牛磺酸-溴胺taurine bromamine;TauCl:牛磺酸-氯胺taurine haloamines;NIK:核转录因子-κB诱导激酶nuclear transcription factor-kappa B inducible kinase;IKBα:核转录因子-κB抑制蛋白α nuclear transcription factor-kappa B inhibitor α;NF-κB:核转录因子-κB nuclear transcription factor-kappa B。 图 3 牛磺酸提高免疫力的作用机制 Fig. 3 Mechanism of taurine improving immunity |
综上所述,牛磺酸是一种具有特殊营养活性的功能性氨基酸,调控母猪繁殖性能,通过细胞信号转导机制促进细胞增殖、缓解氧化应激,在促进母猪乳腺发育、改善仔猪肠道屏障功能、提高母猪和仔猪抗氧化能力和免疫功能发挥重要作用。母猪是生猪生产的源头,但当前牛磺酸调控母猪繁殖性能的研究鲜有报道,其机制不甚清楚,可继续开展相关体内和体外研究,重点解决以下问题:1)进一步探讨牛磺酸在母猪繁殖周期中的适宜添加时间;2)进一步确定牛磺酸的适宜添加量;3)进一步探讨牛磺酸在母猪不同生产水平(不同产仔性能)和生产环境(不同环境温度)中的作用效果;4)进一步探索牛磺酸调控细胞增殖、免疫功能、抗氧化能力的分子机制,为牛磺酸在养猪生产中的应用提供研究数据。
| [1] |
WU G, KNABE D A. Free and protein-bound amino acids in sow's colostrum and milk[J]. The Journal of Nutrition, 1994, 124(3): 415-424. DOI:10.1093/jn/124.3.415 |
| [2] |
SEIDEL U, HUEBBE P, RIMBACH G. Taurine: a regulator of cellular redox homeostasis and skeletal muscle function[J]. Molecular Nutrition & Food Research, 2019, 63(16): e1800569. |
| [3] |
XU M M, CHE L, GAO K G, et al. Effects of dietary taurine supplementation to gilts during late gestation and lactation on offspring growth and oxidative stress[J]. Animals, 2019, 9(5): 220. DOI:10.3390/ani9050220 |
| [4] |
陈钊, 王明江, 兰家暖, 等. 牛磺酸对夏季母猪哺乳期生产性能影响的研究[J]. 广西畜牧兽医, 2017, 33(5): 252-253. CHEN Z, WANG M J, LAN J N, et al. Effect of taurine on performance of sows during lactation in summer[J]. Guangxi Journal of Animal Husbandry & Veterinary Medicine, 2017, 33(5): 252-253 (in Chinese). DOI:10.3969/j.issn.1002-5235.2017.05.011 |
| [5] |
BALIOU S, ADAMAKI M, IOANNOU P, et al. Protective role of taurine against oxidative stress (review)[J]. Molecular Medicine Reports, 2021, 24(2): 605. DOI:10.3892/mmr.2021.12242 |
| [6] |
CHE L, XU M M, GAO K G, et al. Effects of dietary valine supplementation during late gestation on the reproductive performance and mammary gland development of gilts[J]. Journal of Animal Science and Biotechnology, 2020, 11(1): 15. DOI:10.1186/s40104-019-0420-z |
| [7] |
PICONE G, ZAPPATERRA M, LUISE D, et al. Metabolomics characterization of colostrum in three sow breeds and its influences on piglets' survival and litter growth rates[J]. Journal of Animal Science and Biotechnology, 2018, 9: 23. DOI:10.1186/s40104-018-0237-1 |
| [8] |
刘悦. 牛磺酸对断奶仔猪生长性能、组织病理学和肠道健康影响的研究[D]. 硕士学位论文. 雅安: 四川农业大学, 2014: 35-36. LIU Y. Effects of taurine on growth performance, histopathology and intestinal health of weaned piglets[D]. Master's Thesis. Ya'an: Sichuan Agricultural University, 2014: 35-36. (in Chinese) |
| [9] |
黄仁术, 彭志玲. 日粮类型及牛磺酸添加对断奶仔猪生长性能的影响[J]. 粮食与饲料工业, 2008(9): 44-45. HUANG R S, PENG Z L. Effects of dietary types and taurine supplementation on growth performance of weaned piglets[J]. Cereal & Feed Industry, 2008(9): 44-45 (in Chinese). DOI:10.3969/j.issn.1003-6202.2008.09.018 |
| [10] |
AKERS R M. Lactation and the mammary gland[M]. Ames: Iowa State University Press, 2002: 105-128.
|
| [11] |
NIELSEN O L, PEDERSEN A R, SØRENSEN M T. Relationships between piglet growth rate and mammary gland size of the sow[J]. Livestock Production Science, 2001, 67(3): 273-279. DOI:10.1016/S0301-6226(00)00197-4 |
| [12] |
XIAO D F, ZENG L M, YAO K, et al. The glutamine-alpha-ketoglutarate (AKG) metabolism and its nutritional implications[J]. Amino Acids, 2016, 48(9): 2067-2080. DOI:10.1007/s00726-016-2254-8 |
| [13] |
JIANG Q, HE L Q, HOU Y Q, et al. Alpha-ketoglutarate enhances milk protein synthesis by porcine mammary epithelial cells[J]. Amino Acids, 2016, 48(9): 2179-2188. DOI:10.1007/s00726-016-2249-5 |
| [14] |
许蒙蒙, 高开国, 王丽, 等. 妊娠后期和泌乳期饲粮牛磺酸添加对母猪繁殖性能和乳腺发育的影响[C]//第三届中国猪业科技大会暨中国畜牧兽医学会2019年学术年会论文集. 青岛: 中国畜牧兽医学会, 2019: 125. XU M M, GAO K G, WANG L, et al. Effects of taurine supplementation in late pregnancy and lactation on reproductive performance and mammary gland development of sows[C]//Proceedings of the Third China Pig Technology Conference and Animal Nutrition Branch of Chinese Association of Animal and Veterinary Sciences. Qingdao: Chinese Association of Animal Science and Veterinary Medicine, 2019: 125. (in Chinese) |
| [15] |
KIM S W, WEAVER A C, SHEN Y B, et al. Improving efficiency of sow productivity: nutrition and health[J]. Journal of Animal Science and Biotechnology, 2013, 4(1): 26. DOI:10.1186/2049-1891-4-26 |
| [16] |
HUNG I F. The effect of dietary nucleotides in sow and nursery piglet diets on reproduction, growth, and immune response[D]. Ph. D. Thesis. Lexington: University of Kentucky, 2015: 21-23.
|
| [17] |
GREEN T R, FELLMAN J H, EICHER A L, et al. Antioxidant role and subcellular location of hypotaurine and taurine in human neutrophils[J]. Biochimica et Biophysica Acta, 1991, 1073(1): 91-97. DOI:10.1016/0304-4165(91)90187-L |
| [18] |
张建斌, 车向荣, 陈娟娟. 谷氨酰胺和牛磺酸对断奶仔猪外周血液免疫功能的影响[J]. 中国畜牧兽医, 2011, 38(10): 45-47. ZHANG J B, CHE X R, CHEN J J. Effect of glycyl-glutamine and taurine on the immune function of peripheral blood in early weaned piglets[J]. China Animal Husbandry & Veterinary Medicine, 2011, 38(10): 45-47 (in Chinese). |
| [19] |
薛可. 牛磺酸对LPS诱导仔猪炎症激活的抑制作用研究[D]. 硕士学位论文. 沈阳: 沈阳农业大学, 2018: 32-33. XUE K. Inhibitory effect of taurine on LPS induced inflammatory activation in piglets[D]. Master's Thesis. Shenyang: Shenyang Agricultural University, 2018: 32-33. (in Chinese) |
| [20] |
文超越. 氧化应激对猪肌肉组织的损伤以及牛磺酸的缓解作用机制[D]. 硕士学位论文. 长沙: 湖南师范大学, 2019: 18-19. WEN C Y. The mechanism of taurine alleviate muscle injury induced by oxidative stress in pig[D]. Master's Thesis. Changsha: Hunan Normal University, 2019: 18-19. (in Chinese) |
| [21] |
FARMER C, LAPOINTE J, PALIN M F. Effects of the plant extract silymarin on prolactin concentrations, mammary gland development, and oxidative stress in gestating gilts[J]. Journal of Animal Science, 2014, 92(7): 2922-2930. DOI:10.2527/jas.2013-7118 |
| [22] |
WEN C Y, LI F N, ZHANG L Y, et al. Taurine is involved in energy metabolism in muscles, adipose tissue, and the liver[J]. Molecular Nutrition & Food Research, 2019, 63(2): e1800536. |
| [23] |
JONG C J, AZUMA J N H, SCHAFFER S. Mechanism underlying the antioxidant activity of taurine: prevention of mitochondrial oxidant production[J]. Amino Acids, 2012, 42(6): 2223-2232. DOI:10.1007/s00726-011-0962-7 |
| [24] |
BORCK P C, VETTORAZZI J F, BRANCO R C S, et al. Taurine supplementation induces long-term beneficial effects on glucose homeostasis in ob/ob mice[J]. Amino Acids, 2018, 50(6): 765-774. DOI:10.1007/s00726-018-2553-3 |
| [25] |
HASAN M S, CRENSHAW M A, LIAO S F. Dietary lysine affects amino acid metabolism and growth performance, which may not involve the GH/IGF-1 axis, in young growing pigs[J]. Journal of Animal Science, 2020, 98(1): skaa004. DOI:10.1093/jas/skaa004 |
| [26] |
ROMAN-GARCIA P, QUIROS-GONZALEZ I, MOTTRAM L, et al. Vitamin B12-dependent taurine synthesis regulates growth and bone mass[J]. The Journal of Clinical Investigation, 2014, 124(7): 2988-3002. DOI:10.1172/JCI72606 |
| [27] |
牟藤. 牛磺酸对雌性大鼠生殖激素分泌及卵泡发育作用的研究[D]. 博士学位论文. 沈阳: 沈阳农业大学, 2015: 73-76. MU T. Effects of taurine on the secretion of reproductive hormones and follicular development in female rats[D]. Ph. D. Thesis. Shenyang: Shenyang Agricultural University, 2015: 73-76. (in Chinese) |
| [28] |
肖世平, 傅伟龙, 江青艳. 饲粮中添加牛磺酸对黄鸡性腺发育及其内分泌的影响[J]. 华南农业大学学报, 1997(2): 97-102. XIAO S P, FU W L, JIANG Q Y. Effects of taurine on development and endocrine of gonads of Yuehuang broilers[J]. Journal of South China Agricultural University, 1997(2): 97-102 (in Chinese). |
| [29] |
TIAN R, GENG Y P, YANG Y, et al. Oxidative stress drives divergent evolution of the glutathione peroxidase (GPx) gene family in mammals[J]. Integrative Zoology, 2021, 16(5): 696-711. DOI:10.1111/1749-4877.12521 |
| [30] |
BAI J, YAO X F, JIANG L P, et al. Taurine protects against As2O3-induced autophagy in pancreas of rat offsprings through Nrf2/Trx pathway[J]. Biochimie, 2016, 123: 1-6. DOI:10.1016/j.biochi.2016.01.002 |
| [31] |
LEE D S, JO H G, KIM M J, et al. Antioxidant and anti-stress effects of taurine against electric foot-shock-induced acute stress in rats[J]. Advances in Experimental Medicine and Biology, 2019, 1155: 185-196. |
| [32] |
INCE S, ARSLAN-ACAROZ D, DEMIREL H H, et al. Taurine alleviates malathion induced lipid peroxidation, oxidative stress, and proinflammatory cytokine gene expressions in rats[J]. Biomedicine & Pharmacotherapy, 2017, 96: 263-268. |
| [33] |
MA Q. Role of Nrf2 in oxidative stress and toxicity[J]. Annual Review of Pharmacology and Toxicology, 2013, 53: 401-426. DOI:10.1146/annurev-pharmtox-011112-140320 |
| [34] |
LU Z, HE X F, MA B B, et al. Dietary taurine supplementation improves breast meat quality in chronic heat-stressed broilers via activating the Nrf2 pathway and protecting mitochondria from oxidative attack[J]. Journal of the Science of Food and Agriculture, 2019, 99(3): 1066-1072. DOI:10.1002/jsfa.9273 |
| [35] |
SUN Q R, JIA N, YANG J, et al. Nrf2 signaling pathway mediates the antioxidative effects of taurine against corticosterone-induced cell death in human SK-N-SH cells[J]. Neurochemical Research, 2018, 43(2): 276-286. DOI:10.1007/s11064-017-2419-1 |
| [36] |
KIM W, KIM H U, LEE H N, et al. Taurine chloramine stimulates efferocytosis through upregulation of Nrf2-mediated heme oxygenase-1 expression in murine macrophages: possible involvement of carbon monoxide[J]. Antioxidants & Redox Signaling, 2015, 23(2): 163-177. |
| [37] |
FANG H, MENG F P, PIAO F Y, et al. Effect of taurine on intestinal microbiota and immune cells in Peyer's patches of immunosuppressive mice[J]. Advances in Experimental Medicine and Biology, 2019, 1155: 13-24. |
| [38] |
KAESLER S, SOBIESIAK M, KNEILLING M, et al. Effective T-cell recall responses require the taurine transporter Taut[J]. European Journal of Immunology, 2012, 42(4): 831-841. DOI:10.1002/eji.201141690 |
| [39] |
MARCINKIEWICZ J. Taurine bromamine (TauBr)-its role in immunity and new perspectives for clinical use[J]. Journal of Biomedical Science, 2010, 17(Supp.l1): S3. |
| [40] |
TOKUNAGA S, KANAYAMA A, MIYAMOTO Y. Modification of ikappa B alpha by taurine bromamine inhibits tumor necrosis factor alpha-induced NF-kappa B activation[J]. Inflammation Research, 2007, 56(11): 479-486. DOI:10.1007/s00011-007-7016-3 |
| [41] |
KONTNY E, CHORAżY-MASSALSKA M, RUDNICKA W, et al. Comparison of taurine chloramine and taurine bromamine effects on rheumatoid arthritis synoviocytes[J]. Amino Acids, 2007, 32(3): 447-452. DOI:10.1007/s00726-006-0368-0 |
| [42] |
OLSZANECKI R, MARCINKIEWICZ J. Taurine chloramine and taurine bromamine induce heme oxygenase-1 in resting and LPS-stimulated J774.2 macrophages[J]. Amino Acids, 2004, 27(1): 29-35. |
| [43] |
KLAMT F, SHACTER E. Taurine chloramine, an oxidant derived from neutrophils, induces apoptosis in human B lymphoma cells through mitochondrial damage[J]. Journal of Biological Chemistry, 2005, 280(22): 21346-21352. |
| [44] |
KIM K S, CHOI H M, OH D H, et al. Effect of taurine chloramine on the production of matrix metalloproteinases (MMPs) in adiponectin- or IL-1 beta-stimulated fibroblast-like synoviocytes[J]. Journal of Biomedical Science, 2010, 17(Suppl.1): S27. |




