2. 沈阳市康普利德生物科技有限公司, 沈阳 110161;
3. 辽宁康普利德生物科技有限公司, 铁岭 112600;
4. 沈阳市现代农业研发服务中心 (沈阳市农业科学院), 沈阳 110025;
5. 辽宁省农业发展服务中心, 沈阳 110003
2. Shenyang Complete Biotechnology Co., Ltd., Shenyang 110161, China;
3. Liaoning Complete Biotechnology Co., Ltd., Tieling 112600, China;
4. Shenyang Modern Agricultural Research and Development Service Center (Shenyang Academy of Agricultural Sciences), Shenyang 110025, China;
5. Agricultural Development Service Center of Liaoning Province, Shenyang 110003, China
随着我国农业农村部2020年无抗、禁抗政策的发布,人们对饲料品质提出了更高的要求。酶解蛋白肽是一种通过酶解工艺将蛋白质原料中部分大分子蛋白质降解成活性小分子肽和游离氨基酸的产品,产物中还包括大量的生物活性因子,如益生菌、酶类和酸类等[1]。与普通蛋白质饲料相比,酶解蛋白肽能够促进氨基酸吸收和蛋白质合成,起到维持肠道健康、提高免疫力和降低料重比等作用,得到广大饲料企业的认可,因此被列为无抗时代下有效的营养方案之一,并逐渐成为部分替代饲料中鱼粉、豆粕的重要原料,在动物生产养殖上得到广泛应用[2-3]。
目前有关在家畜饲粮中添加酶解蛋白肽的研究已经有很多。Ma等[4]在断奶仔猪基础饲粮中添加7.5%和9.0%的酶解豆粕蛋白发现,与添加金霉素的阳性对照组相比,酶解豆粕蛋白对断奶仔猪的抗氧化能力、免疫力和肠道屏障功能均有一定的改善作用,可以作为一种与抗生素一样有效的功能性饲料添加剂来降低断奶仔猪的腹泻率和提高生长性能。崔家军等[5]将添加1%~3%酶解蛋白肽T30的饲粮饲喂给生长育肥猪,其平均日采食量(ADFI)和平均日增重(ADG)显著增长,同时血液总蛋白和球蛋白含量也有提高。赵娜等[6]将仔猪基础饲粮中的10%豆粕用豆粕酶解发酵物替代,发现仔猪的生长性能提高,机体抗氧化能力增强,腹泻率降低,同时试验组仔猪盲肠、大肠中乳酸杆菌数量显著提高,十二指肠中总细菌数量降低,这有利于乳酸杆菌在肠道内形成优势菌群。
不过,学者们围绕小肽的探究普遍关注点都是其在动物生长过程中的作用,极少有人研究动物饲粮中小肽的适宜添加水平。因此,本试验通过在饲粮中添加不同水平的酶解蛋白肽,研究其对断奶仔猪生长性能、血清免疫指标和肠道菌群的影响,并确定酶解蛋白肽的适宜添加水平,为酶解蛋白肽在生产中的应用提供科学依据。
1 材料与方法 1.1 试验材料试验所用酶解蛋白肽购自辽宁某公司,是以高蛋白质豆粕为原料,采用组合异步酶解技术加工而成的优质蛋白质原料。酶解蛋白肽中相对分子质量小于1 000 ku的肽组分占64.6%,其中小肽含量达16%,其营养成分见表 1。
|
|
表 1 酶解蛋白肽营养成分 Table 1 Nutrients in enzymatic protein peptide |
试验在沈阳博睿科研猪场进行,选取150头21日龄体重为(7.01±0.17) kg的健康“杜×长×大”三元杂交断奶仔猪作为试验动物,采用单因素随机试验设计,按照体重相近、公母一致的原则将150头断奶仔猪随机分为5个组,每组5个重复,每个重复6头(公母各占1/2)。各组断奶仔猪分别饲喂在基础饲粮中添加0(对照组)、2%、4%、6%和8%酶解蛋白肽的饲粮。试验所用基础饲粮按照NRC(1998)标准配制。各组饲粮均等氮等能,其组成及营养水平见表 1。
|
|
表 1 饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of diets (air-dry basis) |
试验共35 d,其中预试期7 d、正试期28 d。预试期饲喂基础饲粮进行过渡(从粥料过渡到颗粒料),正试期按分组饲喂相应饲粮。试验期间所有的断奶仔猪于同一栋猪舍保育床上进行分栏饲养,舍内温度维持在25~28 ℃,自由采食和饮水,按照猪场常规管理和免疫接种,记录仔猪每天采食和腹泻情况。
1.3 指标测定 1.3.1 生长性能测定分别于正试期开始、结束及第14天对仔猪进行称重,记录每组试验猪每天的饲粮供给和隔天余料情况,计算各组试验猪ADG、ADFI和料重比(F/G)。试验期间每天观察并记录试验猪的腹泻情况,根据粪便情况给予评分:1分=硬粪;2分=正常粪便;3分=软粪,部分形成粪便;4分=半液状、浆糊状粪便;5分=水样粪便。将粪便得分为4分、5分者确定为腹泻,试验结束后计算每组腹泻率。
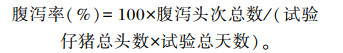
|
正试期第14天和第28天,分别从每个组的每个重复选取1头体况良好、接近平均体重的仔猪,前腔静脉采血,离心分离血清,将收集的血清分装于离心管中,保存于-20 ℃冰箱中。使用试剂盒检测血清中免疫球蛋白M(IgM)和免疫球蛋白G(IgG)含量,试剂盒由南京建成生物工程研究所提供,严格按照说明书规定的方法进行操作。
1.3.3 肠道菌群结构测定正试期第28天,采集新鲜且未被污染的粪便,每重复至少采集3头,每个组至少保存3份样品。粪便采集时间尽量选择在仔猪排泄高峰期,仔猪排泄时,用无菌采样器及时接住,用无菌牙签去掉前端1~2 cm,采集5 g左右,用无菌取样袋封存,立刻置于冰盒中,迅速冻存。对于未及时处理而遗落在地上的粪便,判为已被污染,不予收集。
使用DNA试剂盒(美国OMEGA公司)提取仔猪粪便的基因组DNA,步骤参照说明书。利用Qubit 3.0 DNA检测试剂盒对基因组DNA精确定量,并采用16S rRNA高通量测序测定菌群结构。样品测序使用的引物是341F/805R,引物序列为:341F,CCCTACACGACGCTCTTCCGATCTG(barcode)CCTACGGGNGGCWGCAG;805R,GACTGGAGTTCCTTGGCACCCGAGAATTCCAGACTACHVGGGTATCTAATC。测序区域为V3~V4,测序平台为MiSeq。对测序结果进行相应的高级信息学分析,获得样品菌群组成及相对丰度。
1.3.4 粪便中有机酸含量测定各组取粪样2.0 g,加4 mL蒸馏水,在研磨器中充分研磨后,离心取上清液1 mL,加0.2 mL浓度为25%的偏磷酸,4 ℃下20 000 r/min离心10 min,过0.45 μm滤膜。采用高效液相色谱法测定乙酸、丙酸、丁酸和乳酸含量。
1.4 数据统计分析试验数据经Excel 2010进行整理后,采用SPSS 17.0软件进行单因素方差分析(one-way ANOVA),并利用Tukey’s法进行多重比较,数据以平均值(mean)和均值标准误(SEM)表示,P < 0.05表示差异显著,P < 0.01表示差异极显著。
2 结果与分析 2.1 酶解蛋白肽对断奶仔猪生长性能的影响由表 3可知,试验第14天,与对照组相比,饲粮添加6%和8%酶解蛋白肽极显著提高断奶仔猪体重(P<0.01)。试验第1~14天,与对照组相比,饲粮添加6%和8%酶解蛋白肽极显著提高断奶仔猪ADFI和ADG(P<0.01),极显著降低断奶仔猪腹泻率(P<0.01);饲粮添加6%酶解蛋白肽显著降低断奶仔猪F/G(P<0.05)。试验第28天,与对照组相比,饲粮添加2%~8%酶解蛋白肽极显著提高断奶仔猪体重(P<0.01),其中6%和8%酶解蛋白肽添加组断奶仔猪体重极显著高于2%和4%酶解蛋白肽添加组(P<0.01)。试验第15~28天,与对照组相比,饲粮添加6%和8%酶解蛋白肽极显著提高断奶仔猪ADFI和ADG(P<0.01),显著或极显著降低断奶仔猪F/G(P<0.05或P<0.01);饲粮添加6%酶解蛋白肽极显著降低断奶仔猪腹泻率(P<0.01)。试验第1~28天,与对照组相比,饲粮添加6%和8%酶解蛋白肽极显著提高断奶仔猪ADFI和ADG(P<0.01),极显著降低断奶仔猪腹泻率(P<0.01);饲粮添加6%酶解蛋白肽显著降低断奶仔猪F/G(P<0.05)。
|
|
表 3 酶解蛋白肽对断奶仔猪生长性能的影响 Table 3 Effects of enzymatic protein peptide on growth performance of weaned piglets |
由表 4可知,试验第14天,与对照组相比,饲粮添加2%~6%酶解蛋白肽极显著提高断奶仔猪血清IgG含量(P < 0.01);饲粮添加2%、4%和8%酶解蛋白肽极显著提高断奶仔猪血清IgM含量(P < 0.01),其中2%酶解蛋白肽添加组断奶仔猪血清IgM含量极显著高于4%和8%酶解蛋白肽添加组(P < 0.01)。试验第28天,与对照组相比,饲粮添加2%和4%酶解蛋白肽显著或极显著提高断奶仔猪血清IgG含量(P<0.05或P<0.01),饲粮添加2%~8%酶解蛋白肽显著或极显著提高断奶仔猪血清IgM含量(P<0.05或P<0.01),且均以2%酶解蛋白肽添加组含量最高。
|
|
表 4 酶解蛋白肽对断奶仔猪血清免疫指标的影响 Table 4 Effects of enzymatic protein peptide on serum immune indices of weaned piglets |
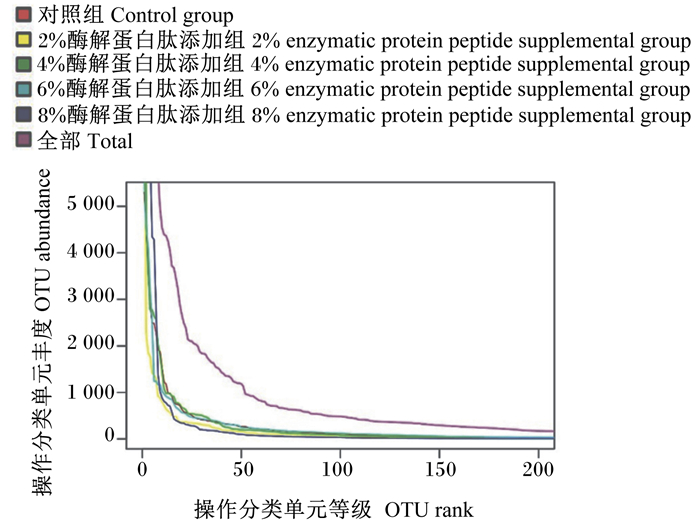
如图 1所示,6%和8%酶解蛋白肽添加组断奶仔猪肠道菌群物种组成更丰富,8%酶解蛋白肽添加组断奶仔猪肠道菌群物种分布最均匀。
|
图 1 断奶仔猪肠道菌群丰度等级曲线 Fig. 1 Rank abundance curve of intestinal flora of weaned piglets |
由表 5可知,各组断奶仔猪肠道菌群测序覆盖率均在0.99以上,说明本次测序结果可以代表各组样本菌群多样性的真实情况。与对照组相比,饲粮添加2%和4%酶解蛋白肽显著提高断奶仔猪肠道菌群Chao1指数(P < 0.05),饲粮添加酶解蛋白肽对断奶仔猪肠道菌群Ace指数、Simpson指数和Shannon指数均无显著影响(P>0.05)。
|
|
表 5 酶解蛋白肽对断奶仔猪肠道菌群丰度及多样性的影响 Table 5 Effects of enzymatic protein peptide on abundance and diversity of intestinal flora of weaned piglets |
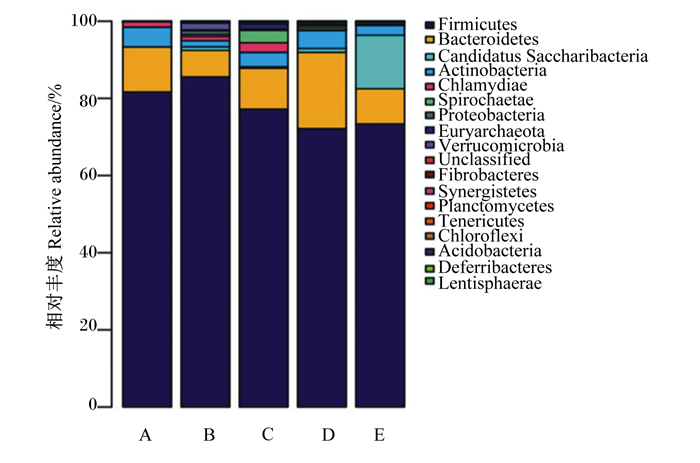
如图 2所示,各组断奶仔猪肠道菌群在门水平上相对丰度大于0.1%的共检测出:厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、暂定螺旋体门(candidatus Saccharibacteria)、螺旋菌门(Spirochaetae)、衣原体门(Chlamydiae)、变形菌门(Proteobacteria)、广古菌门(Euryarchaeota)、疣微菌门(Verrucomicrobia)和未分类菌门,其中优势菌门是厚壁菌门。由表 6可知,与对照组相比,饲粮添加6%酶解蛋白肽显著提高断奶仔猪肠道菌群拟杆菌门相对丰度(P<0.05)。
|
Firmicutes:厚壁菌门;Bacteroidetes:拟杆菌门;Candidatus Saccharibacteria:暂定螺旋体门;Actinobacteria:放线菌门;Chlamydiae:衣原体门;Spirochaetae:螺旋菌门;Proteobacteria:变形菌门;Euryarchaeota:广古菌门;Verrucomicrobia:疣微菌门;Unclassified:未分类;Fibrobacteres:纤维杆菌门;Synergistetes:互养菌门;Planctomycetes:浮霉菌门;Tenericutes:软壁菌门;Chloroflexi:绿弯菌门;Acidobacteria:酸杆菌门;Deferribacteres:脱铁杆菌门;Lentisphaerae:黏胶球形菌门。 A:对照组control group;B:2%酶解蛋白肽添加组2% enzymatic protein peptide supplemental group;C:4%酶解蛋白肽添加组4% enzymatic protein peptide supplemental group;D:6%酶解蛋白肽添加组6% enzymatic protein peptide supplemental group;E:8%酶解蛋白肽添加组8% enzymatic protein peptide supplemental group。图 3同the same as Fig. 3。 图 2 断奶仔猪肠道菌群在门水平上的分布 Fig. 2 Distribution of intestinal flora at phylum level of weaned piglets |
|
|
表 6 酶解蛋白肽对断奶仔猪肠道菌群在门水平上相对丰度的影响 Table 6 Effects of enzymatic protein peptide on relative abundance of intestinal flora at phylum level of weaned piglets |
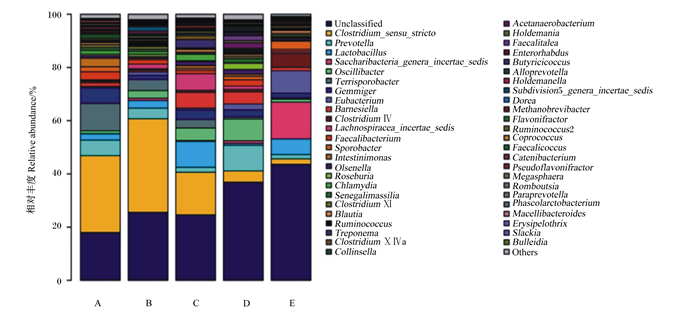
如图 3所示,除去未分类菌属和其他菌属,各组断奶仔猪肠道菌群在属水平上相对丰度大于1%的有:狭义梭菌属(Clostridium_sensu_stricto)、乳酸菌属(Lactobacillus)、芽殖菌属(Gemmiger)、普雷沃菌属(Prevotella)、Terrisporobacter、颤杆菌克属(Oscillibacter)、优杆菌属(Eubacterium)、Lachnospiracea_incertae_sedis、粪杆菌属(Faecalibacterium)、巴氏杆菌属(Barnesiella)、Saccharibacteria_genera_incertae_sedis、梭状芽孢杆菌Ⅳ属(Clostridium Ⅳ)、Sporobacter、Intestinimonas和衣原体属(Chlamydia)。由表 7可知,与对照组相比,饲粮添加4%和8%酶解蛋白肽极显著提高断奶仔猪肠道菌群乳酸菌属相对丰度(P < 0.01),饲粮添加2%~8%酶解蛋白肽显著降低肠道菌群Intestinimonas相对丰度(P < 0.05),饲粮添加4%~8%酶解蛋白肽显著降低肠道菌群狭义梭菌属相对丰度(P < 0.05);此外,饲粮添加8%酶解蛋白肽极显著提高肠道菌群优杆菌属相对丰度(P < 0.01),显著提高Lachnospiracea_incertae_sedis相对丰度(P < 0.05),显著降低普雷沃菌属相对丰度(P < 0.05);饲粮添加6%和8%酶解蛋白肽显著或极显著降低肠道菌群衣原体属相对丰度(P < 0.05或P < 0.01)。
|
Unclassified:未分类;Acetanaerobacterium:厌氧发酵产氢细菌属;Clostridium_sensu_stricto:狭义梭菌属;Holdemania:霍尔德曼氏菌属;Prevotella:普雷沃菌属;Faecalitalea:屎豆属菌;Lactobacillus:乳酸菌属;Enterorhabdus:肠杆菌属;Butyricicoccus:丁酸球菌属;Oscillibacter:颤杆菌克属;Gemmiger:芽殖菌属;Eubacterium:优杆菌属;Dorea:多尔氏菌属;Barnesiella:巴氏杆菌属;Methanobrevibacter:甲烷短杆菌属;Clostridium Ⅳ:梭状芽孢杆菌Ⅳ属;Flavonifractor:黄杆菌属;Ruminococcus2:瘤胃球菌2属;Faecalibacterium:粪杆菌属;Coprococcus:粪球菌属;Olsenella:欧陆森氏菌属;Roseburia:罗氏菌属;Megasphaera:巨球型菌属;Chlamydia:衣原体属;Romboutsia:罗姆布茨菌属;Senegalimassilia:塞内加尔马西利亚属;Paraprevotella:帕拉普氏菌属;Clostridium Ⅺ:梭状芽孢杆菌Ⅺ属;Phascolarctobacterium:考拉杆菌属;Blautia:布劳特氏菌属;Macellibacteroides:屠场杆状菌属;Ruminococcus:瘤胃球菌属;Erysipelothrix:丹毒丝菌属;Treponema:密螺旋体属;Slackia:史雷克氏菌属;Clostridium ⅩⅣa:梭状芽胞杆菌ⅩⅣa属;Bulleidia:布雷德菌属;Collinsella:柯林斯菌属;Others:其他。 图 3 断奶仔猪肠道菌群在属水平上的分布 Fig. 3 Distribution of intestinal flora at genus level of weaned piglets |
|
|
表 7 酶解蛋白肽对断奶仔猪肠道菌群在属水平上相对丰度的影响 Table 7 Effects of enzymatic protein peptide on relative abundance of intestinal flora at genus level of weaned piglets |
由表 8可知,与对照组相比,饲粮添加2%~8%酶解蛋白肽均极显著提高断奶仔猪粪便中乳酸、乙酸和丙酸含量(P < 0.01),其中4%酶解蛋白肽添加组粪便中乳酸含量最高,6%酶解蛋白肽添加组粪便中乙酸和丙酸含量最高。由于粪便中丁酸含量太低,因此均未检测到丁酸。
|
|
表 8 酶解蛋白肽对断奶仔猪粪便中有机酸含量的影响 Table 8 Effects of enzymatic protein peptide on organic acid content in feces of weaned piglets |
研究表明,当给动物提供氮源的形式为小分子肽时,其能够直接被动物体吸收利用,蛋白质的体内沉积率和动物对饲粮的转化利用率也高于以其他形式氮源,有利于促进动物生长;同时,由于小分子肽中抗营养因子的降低及其较好的适口性,使其有助于提高仔猪采食量,从而提高仔猪生长性能[1-2]。刘峰等[7]在断奶仔猪的饲粮中添加2%的玉米肽,可以显著提高断奶仔猪的ADG,显著降低F/G和腹泻率。张爱民等[8]研究还显示,大豆酶解蛋白肽由于其抗营养因子的降低及其较好的适口性,能够起到促进断奶仔猪采食的效果。这与以上研究结果相似。本试验结果表明,在断奶仔猪饲粮中添加不同水平的酶解蛋白肽可以显著提高断奶仔猪ADG和ADFI,显著降低F/G,且以添加6%和8%酶解蛋白肽时效果较好。
此外,酶解蛋白肽还可以促进小肠发育,提高免疫力,降低猪腹泻的发生率。周相超等[9]将玉米-豆粕进行菌酶协同处理,并以10%的比例替代未处理的原料后饲喂给生长肥育猪,发现猪的腹泻率与添加了抗生素的阳性对照组无显著差异。于海涛等[10]在断奶仔猪饲粮中添加12.5%的体外酶解豆粕后能够降低腹泻率和粪便评分。本试验结果表明,饲粮添加酶解蛋白肽可显著降低断奶仔猪腹泻率,且当饲粮中添加6%酶解蛋白肽时效果最好。
3.2 酶解蛋白肽对断奶仔猪血清免疫指标的影响免疫球蛋白是一种具有抗体活性或化学结构的球蛋白,是动物体内免疫系统的重要组成部分,包括IgM和IgG等[11]。某些小肽可以刺激机体分泌消化酶,调节机体免疫应答,提高血清免疫球蛋白含量,从而增强机体免疫力。Xu等[12]研究了抗菌肽对健康仔猪和攻毒仔猪的影响,结果表明,抗菌肽能够显著改善仔猪生长性能,提高血清IgM和IgG含量,增强机体免疫力。Ma等[4]研究发现,与普通豆粕相比,给断奶仔猪饲喂酶解豆粕后,血清IgM和免疫球蛋白A含量显著提高,免疫力增强。本试验结果表明,饲粮添加酶解蛋白肽可提高断奶仔猪血清IgG和IgM含量,这说明在饲粮中添加酶解蛋白肽可提高断奶仔猪免疫性能,进而改善断奶仔猪的健康状况。
3.3 酶解蛋白肽对断奶仔猪肠道菌群的影响仔猪肠道的健康对动物的生长起着至关重要的作用。本试验结果表明,6%和8%酶解蛋白肽添加组断奶仔猪肠道菌群丰度更高,这说明饲粮添加6%和8%酶解蛋白肽有利于提高断奶仔猪肠道菌群的物种丰富度。alpha多样性分析可以反映肠道菌群的丰度和多样性,覆盖率数值越高,表示样本中序列没有被测出的概率越低,进而能够判断出测序结果是否能够代表样本的真实情况;Chao1指数和Ace指数可以大致反映物种总数;Shannon指数和Simpson指数能够反映样品中菌群的多样性,Shannon指数越大,Simpson数值越小,表示群落多样性越高[13]。本试验结果表明,饲粮添加2%和4%酶解蛋白肽能够显著提高断奶仔猪肠道菌群Chao1指数,这说明酶解蛋白肽能够丰富肠道菌群,提高菌群物种数量;且当添加水平为4%和6%时,Shannon指数升高、Simpson指数降低,表明肠道菌群多样性有所提高。以上结果提示,饲粮添加酶解蛋白肽能够提高断奶仔猪肠道菌群多样性,从而增强肠道屏障体系防御能力,保护仔猪断奶时的肠道健康,这也可能是酶解蛋白肽能够提高断奶仔猪血清免疫指标的原因之一。
本试验对肠道菌群在门水平和属水平上进行了分析。在门水平上的结果显示,厚壁菌门占79.67%,为最主要菌门;第2位是拟杆菌门,占12.10%。这两者是断奶仔猪肠道菌群中的优势菌门,且在仔猪断奶之前厚壁菌门丰度最高,而在断奶后拟杆菌门逐渐增加成为最主要的门类[14]。在属水平上的结果显示,饲粮添加酶解蛋白肽能够显著降低断奶仔猪肠道菌群Intestinimonas、狭义梭菌属和衣原体属相对丰度,这三者均属于肠道有害菌。大肠杆菌过多,会和肠道内的氨基酸、蛋白质作用释放胺,从而刺激黏膜,加速毒素吸收,提高渗透压,严重可导致畜禽出现下痢[15-16];梭菌属可产生毒素危害机体[17];衣原体属可导致动物呼吸系统疾病。酶解蛋白肽的加入可以抑制这3种有害菌的增殖,减少仔猪发病概率[18]。本试验还发现,饲粮添加酶解蛋白肽能够增加肠道有益菌的数量,即显著提高肠道菌群中乳酸菌属和Lachnospiracea_incertae_sedis相对丰度。乳酸菌属可产生乳酸,降低肠道环境pH,从而阻止胃肠内一些致病菌的生长繁殖[19];毛螺菌属可利用肠道内葡萄糖发酵产生乙酸等有机酸,有利于增加肠道内有机酸含量[20-21]。
此外,本试验在对断奶仔猪饲粮中添加酶解蛋白肽后粪便中有机酸含量的检测中发现,乳酸、乙酸和丙酸含量均有极显著升高,这可能与酶解蛋白肽导致的肠道有益菌的增殖有关。粪便中有机酸含量越高,表示小肠中有机酸的分泌量越高,分解发酵过程越旺盛。另外,有机酸还可以改善小肠形态,提高肠道紧密连接蛋白水平,促进饲粮养分的消化吸收,进而提高动物的生产性能[22],这也部分解释了本试验中饲粮添加酶解蛋白肽能够促进断奶仔猪生长性能提高的结果。
4 结论本试验条件下,饲粮添加酶解蛋白肽能够降低断奶仔猪腹泻率,提高免疫性能,从而提高生长性能,且以添加水平为6%~8%时效果较优;这种对断奶仔猪的改善效果与丰富肠道菌群多样性,改善肠道菌群结构,即增加有益菌数量、降低有害菌数量有关。
| [1] |
崔家军, 张鹤亮, 张维金, 等. 低蛋白日粮添加酶解蛋白肽对生长育肥猪生长性能、血液指标、养分消化率的影响[J]. 中国畜牧杂志, 2017, 53(11): 80-85. CUI J J, ZHANG H L, ZHANG W J, et al. Effects of low protein diet supplemented with enzymatic hydrolyzed protein peptide on growth performance, blood indexes and nutrient digestibility of growing-finishing pigs[J]. Chinese Journal of Animal Science, 2017, 53(11): 80-85 (in Chinese). |
| [2] |
王诗琦. 酶解蛋白肽的体外评定及在仔猪生产中的应用研究[D]. 硕士学位论文. 沈阳: 沈阳农业大学, 2019. WANG S Q. Evaluation of enzymatic protein peptide in vitro and its application in Piglet production[D]. Master's Thesis. Shenyang: Shenyang Agricultural University, 2019. (in Chinese) |
| [3] |
王诗琦, 刘显军, 陈静, 等. 蛋白质饲料的酶解工艺及酶解蛋白在畜牧生产中的应用[J]. 动物营养学报, 2019, 31(4): 1547-1553. WANG S Q, LIU X J, CHEN J, et al. Enzymolysis technology of protein feed and application of enzymolysis protein in animal husbandry production[J]. Chinese Journal of Animal Nutrition, 2019, 31(4): 1547-1553 (in Chinese). |
| [4] |
MA X K, SHANG Q H, WANG Q Q, et al. Comparative effects of enzymolytic soybean meal and antibiotics in diets on growth performance, antioxidant capacity, immunity, and intestinal barrier function in weaned pigs[J]. Animal Feed Science and Technology, 2019, 248: 47-58. DOI:10.1016/j.anifeedsci.2018.12.003 |
| [5] |
崔家军, 张鹤亮, 张维金, 等. 酶解蛋白肽对生长育肥猪生长性能、血液生化指标及养分表观消化率的影响[J]. 中国畜牧兽医, 2017, 44(8): 2342-2347. CUI J J, ZHANG H L, ZHANG W J, et al. Effect of protein hydrolysate on growth performance, blood biochemical indexes and nutrient apparent digestibility in growing-finishing pigs[J]. China Animal Husbandry & Veterinary Medicine, 2017, 44(8): 2342-2347 (in Chinese). |
| [6] |
赵娜, 杨雪海, 陈芳, 等. 豆粕酶解发酵物对仔猪生长性能、血清指标及肠道菌群结构的影响[J]. 动物营养学报, 2016, 28(12): 242-249. ZHAO N, YANG X H, CHEN F, et al. Effects of soybean enzymatic fermentation product on growth performance, serum indices and intestinal microflora structure of piglets[J]. Chinese Journal of Animal Nutrition, 2016, 28(12): 242-249 (in Chinese). DOI:10.3969/j.issn.1006-267x.2016.12.030 |
| [7] |
刘峰, 姚康, 袁学宾, 等. 玉米肽对断奶仔猪生长性能及免疫特性的影响[J]. 饲料研究, 2020, 43(10): 41-43. LIU F, YAO K, YUAN X B, et al. Effect of corn peptide on growth performance and immune characteristics of weaned piglets[J]. Feed Research, 2020, 43(10): 41-43 (in Chinese). |
| [8] |
张爱民, 唐玲, 尹佳, 等. 大豆酶解蛋白对仔猪生长性能、矿物质利用及消化道健康的影响[J]. 动物营养学报, 2015, 27(2): 541-550. ZHANG A M, TANG L, YIN J, et al. Effects of enzymolytic soybean meal on growth performance, mineral availability and intestine health of piglets[J]. Chinese Journal of Animal Nutrition, 2015, 27(2): 541-550 (in Chinese). DOI:10.3969/j.issn.1006-267x.2015.02.026 |
| [9] |
周相超, 陈文斌, 王冰. 抑菌型菌酶协同生物饲料在生长肥育猪中的替抗应用研究[J]. 湖南饲料, 2020(3): 21-24. ZHOU X C, CHEN W B, WANG B. Study on the application of antibacterial enzyme synergistic biological feed in growing and finishing pigs[J]. Hunan Feed, 2020(3): 21-24 (in Chinese). DOI:10.3969/j.issn.1673-7539.2020.03.005 |
| [10] |
于海涛, 周智旋, 耿正颖, 等. 角蛋白酶体外酶解豆粕的营养价值及其在断奶仔猪生产中的应用研究[J]. 中国畜牧杂志, 2019, 55(7): 122-127. YU H T, ZHOU Z X, GENG Z Y, et al. Nutritional value of soybean meal enzymatically hydrolyzed by keratinase and its application to weaned piglets[J]. Chinese Journal of Animal Science, 2019, 55(7): 122-127 (in Chinese). |
| [11] |
KUMAR N, ARTHUR C P, CIFERRI C, et al. Structure of the human secretory immunoglobulin M core[J]. Structure, 2021, 29(6): 564-571. DOI:10.1016/j.str.2021.01.002 |
| [12] |
XU B C, FU J, ZHU L Y, et al. Overall assessment of antimicrobial peptides in piglets: a set of meta-analyses[J]. Animal, 2020, 14(12): 2463-2471. DOI:10.1017/S1751731120001640 |
| [13] |
ZHAO X, FU H Y, QIU S N, et al. Effects of early protein restriction on the growth performance and gut development of pigs fed diets with or without antibiotic[J]. Animal, 2020, 14(7): 1392-1401. DOI:10.1017/S1751731119002921 |
| [14] |
KARASOVA D, CRHANOVA M, BABAK V, et al. Development of piglet gut microbiota at the time of weaning influences development of postweaning diarrhea-a field study[J]. Research in Veterinary Science, 2021, 135: 59-65. DOI:10.1016/j.rvsc.2020.12.022 |
| [15] |
崔银雪, 敖日格乐, 王纯洁, 等. 致病性大肠杆菌诱发腹泻对犊牛早期肠道黏膜通透性及免疫功能的影响[J]. 黑龙江畜牧兽医, 2020(12): 16-19, 27. CUI Y X, AO R G L, WANG C J, et al. Effect of diarrhea induced by pathogenic Escherichia coli on early intestinal mucosal permeability and immune function in calves[J]. Heilongjiang Animal Science and Veterinary Medicine, 2020(12): 16-19, 27 (in Chinese). |
| [16] |
张美华, 林治钰, 李克鑫, 等. 猪大肠杆菌病的诊断与防治[J]. 猪业科学, 2021, 38(3): 34-37. ZHANG M H, LIN Z Y, LI K X, et al. Diagnosis and treatment of swine Escherichia coil disease[J]. Swine Industry Science, 2021, 38(3): 34-37 (in Chinese). |
| [17] |
向荣, 陈朝江, 李文斌, 等. 霉菌毒素对鸡的危害及其控制措施[J]. 家禽科学, 2014(6): 40-42. XIANG R, CHEN C J, LI W B, et al. The harm of mycotoxins to chickens and their control measures[J]. Poultry Science, 2014(6): 40-42 (in Chinese). |
| [18] |
ENTROCASSI A C, CATALANO A V, OUVIÑA A G, et al. In vitro inhibitory effect of Hydrocotyle bonariensis Lam. extracts over Chlamydia trachomatis and Chlamydia pneumoniae on different stages of the chlamydial life cycle[J]. Heliyon, 2021, 7(5): e06947. |
| [19] |
RYBARCZYK A, BOGUSŁAWSKA-WAS E, ŁUPKOWSKA A. Effect of EM ® probiotic on gut microbiota, growth performance, carcass and meat quality of pigs[J]. Livestock Science, 2020, 241: 104206. |
| [20] |
勒系意. 不同C/N物料连续厌氧发酵特性及菌群结构变化的研究[D]. 硕士学位论文. 南昌: 江西师范大学, 2017. LE X Y. Research on characteristics and the change of microbial community structure in continuous anaerobic fermentation from different C/N-contained materials[D]. Master's Thesis. Nanchang: Jiangxi Normal University, 2017. (in Chinese). |
| [21] |
李冉. 肠道菌群与长链脂肪酸代谢关键酶表达的相关性研究[D]. 硕士学位论文. 杭州: 浙江工业大学, 2018. LI R. Study on the relationship between gut microbiota and expression of key enzymes in long chain fatty acid metabolism[D]. Master's Thesis. Hangzhou: Zhejiang University of Technology, 2018. (in Chinese) |
| [22] |
MA J Y, PIAO X S, SHANG Q H, et al. Mixed organic acids as an alternative to antibiotics improve serum biochemical parameters and intestinal health of weaned piglets[J]. Animal Nutrition, 2021, 7(3): 737-749. |




