2. 岭南现代农业科学与技术广东省实验室茂名分中心, 茂名 525000
2. Maoming Branch, Guangdong Laboratory for Lingnan Modern Agriculture, Maoming 525000, China
在生猪养殖过程中,臭气污染一直制约着养猪业的生态可持续发展。臭气物质实质是微生物在一定条件下厌氧发酵碳水化合物、含氮和含硫化合物产生的不完全代谢产物,按照化学性质可分为氨和挥发性生物胺类、含硫化合物、酚和吲哚类以及挥发性脂肪酸类物质[1],这些臭气物质不仅会降低生猪的生长性能和健康水平,还容易导致饲养人员以及养殖场周边的居民患慢性支气管炎等呼吸道疾病[2]。
在生猪养殖过程中,臭气物质一般产生在饲料存放与投喂、生猪的饲喂和粪便堆肥3个阶段[3]。在现代规模化和集约化养殖场,可分别通过规范饲养技术和优化无害化处理技术控制饲料存放与投喂以及粪便贮存过程中产生的臭气。而饲养阶段中生猪自身所排和未及时清理粪尿所产生的臭气,在现阶段很难处理。肠道微生物在畜禽粪便臭气物质产生和减少的过程中发挥着举足轻重的作用。因此,通过营养手段调控肠道微生物组成,进而改变微生物的发酵模式,从源头减少养猪业中该阶段臭气排放显得尤为重要,对于满足国家构建“资源节约型、环境友好型社会”为导向的畜禽生态健康养殖生产方式具有重要的科学意义。
饲粮淀粉是畜禽维持正常生长所需能量的重要来源,主要有支链和直链2种形式存在,其中支链淀粉在前肠已被消化吸收,直链淀粉在前肠不易被消化而进入后肠作为微生物发酵底物而被利用[4-6]。因此,不同来源淀粉由于其结构的不同,影响机体消化道内淀粉消化吸收的速率和部位也不一致,进而改变肠道微生物的组成和代谢活性。本试验前期研究结果表明,与摄食含有高支链的木薯淀粉饲粮相比,给育肥猪饲喂含有高直链的豌豆淀粉饲粮可提高其生长性能[7]和对粗蛋白质的表观消化率[8],同时改变了育肥猪后肠微生物的数量和代谢模式,如提高了有利于代谢碳水化合物的微生物增殖和碳水化合物代谢产物的含量,降低了代谢氮代谢化合物微生物的增殖和氮代谢产物的含量[9-10]。然而,到目前为止,不同直/支链淀粉比饲粮对育肥猪粪样微生物的组成以及主要臭气物质排放的动态变化规律研究还相对缺乏。基于此,本试验旨在探讨不同直/支链淀粉比饲粮对育肥猪粪样中主要微生物数量和臭气物质排放的动态影响,为在育肥猪生产中通过营养调控肠道微生物活性进而从源头减少臭气物质排放提供理论依据。
1 材料与方法 1.1 试验设计本试验设计同前期已发表文献[9-10],即选取健康的“杜×长×大”三元杂交阉公猪72头,按初始体重[(77.00±0.52) kg]相近的原则,随机分为木薯淀粉组、玉米淀粉组和豌豆淀粉组,每组8个重复(栏),每个重复3头猪。3组饲粮的直/支链淀粉的比值分别为0.11、0.25和0.44。试验期间,猪只自由饮水和采食,饲养管理按照广东省农业科学院动物科学研究所动物试验场饲养要求进行。试验预试期4 d,正试期40 d。饲粮参考NRC(2012)育肥猪营养需要进行配制,其组成及营养水平见表 1。
|
|
表 1 饲粮组成及营养水平(饲喂基础) Table 1 Composition and nutrient levels of diets (as-fed basis) |
在正试期的第1、10、20、30和40天晨饲前采集育肥猪粪样,每栏采集3头猪直肠的新鲜粪样,混合后取200 g剔除毛屑后,立即测定pH,然后-20 ℃保存待提取细菌DNA和测定相关代谢物。
1.3 测定指标与方法 1.3.1 粪便中细菌DNA的提取以及其实时荧光定量PCR检测各粪便样品中DNA提取严格按照试剂盒(QIAamp Power Fecal,Qiagen,德国)说明书进行,样品合格标准参照前期试验[9-10]的方法。
粪便中总菌、瘤胃球菌属(Ruminococcus)、大肠杆菌(Escherichia coli)、乳酸杆菌(Lactobacillus)、双歧杆菌(Bifidobacterium)、梭菌Ⅳ(Clostridium cluster Ⅳ)、梭菌ⅩⅣ(Clostridium cluster ⅩⅣ)和普雷沃氏菌属(Prevotella)的16S rRNA基因拷贝数采用实时荧光定量PCR仪(CFX96 Real-Time PCR System,Bio-Rad Laboratories,Hercules,CA,美国)分析。所用引物序列、PCR反应体系、扩增程序以及计算方法均参照余苗等[11]和Yu等[12]的方法。
1.3.2 粪便pH的测定采用pH计(HI 9024C,HANNA Instruments,Woonsocket,美国)测定粪便样品的pH。
1.3.3 粪便中乳酸含量的测定采用南京建成生物工程研究所的试剂盒测定粪便中乳酸的含量。
1.3.4 粪便中挥发性脂肪酸含量的测定参照Yu等[13]的方法,采用气相色谱仪(7890B,Agilent Technologies Inc,美国)测定粪便中乙酸、丙酸、丁酸、戊酸、异丁酸和异戊酸的含量。
1.3.5 粪便中氨态氮(NH3-N)含量的测定采用比色法测定粪便中NH3-N的含量,具体操作步骤参照Chaney等[14]的方法。
1.3.6 粪便中挥发性生物胺含量的测定采用Wates Alliance高效液相色谱仪测定粪便中甲胺、色胺、酪胺、腐胺、尸胺、精胺和亚精胺的含量,并计算总挥发性生物胺含量,具体操作步骤参照Yang等[15]的方法。
1.3.7 粪便中酚和吲哚类物质含量的测定参照Yu等[16]的方法,采用Wates Alliance高效液相色谱仪测定粪便中对甲酚、苯酚、吲哚和粪臭素的含量。
1.4 数据处理与统计分析采用SPSS 26.0软件包中的GLM模型重复测量方差分析统计不同因素(时间、饲粮)的显著性影响,采用单因素方差分析(one-way ANOVA)比较同一时间下不同饲粮间的差异,P < 0.05表示差异显著。主要微生物数量、pH和臭气物质(挥发性脂肪酸、乳酸、NH3-N、挥发性生物氨、酚和吲哚)含量分别用SIMCA-P 13.0软件中的偏最小二乘分类分析(partial least-squares discriminant analysis,PLS-DA)方法进行多元变量分析,以此评估不同组间主要微生物数量和臭气物质之间的相似性。
2 结果与分析 2.1 不同直/支链淀粉比饲粮对育肥猪粪便主要微生物数量动态变化的影响不同直/支链淀粉比饲粮对育肥猪粪便主要微生物数量动态变化的影响如图 1所示。由图可知,第20天,与木薯淀粉组相比,豌豆淀粉组粪便中梭菌ⅩⅣ的数量显著增加(P < 0.05),而粪便中大肠杆菌的数量显著减少(P < 0.05)。第30天,与木薯淀粉组相比,豌豆淀粉组粪便中双歧杆菌的数量显著增加(P < 0.05),而粪便中大肠杆菌的数量显著减少(P < 0.05)。第40天,与木薯淀粉组相比,豌豆淀粉组粪便中梭菌ⅩⅣ、乳酸杆菌、普雷沃氏菌属和双歧杆菌的数量显著增加(P < 0.05),而粪便中大肠杆菌的数量显著减少(P < 0.05)。第40天,与玉米淀粉组相比,豌豆淀粉组粪便中双歧杆菌的数量显著增加(P < 0.05),而粪便中大肠杆菌的数量显著减少(P < 0.05)。在整个试验期内,各组粪便中总菌、瘤胃球菌属和梭菌Ⅳ的数量之间均无显著差异(P > 0.05)。
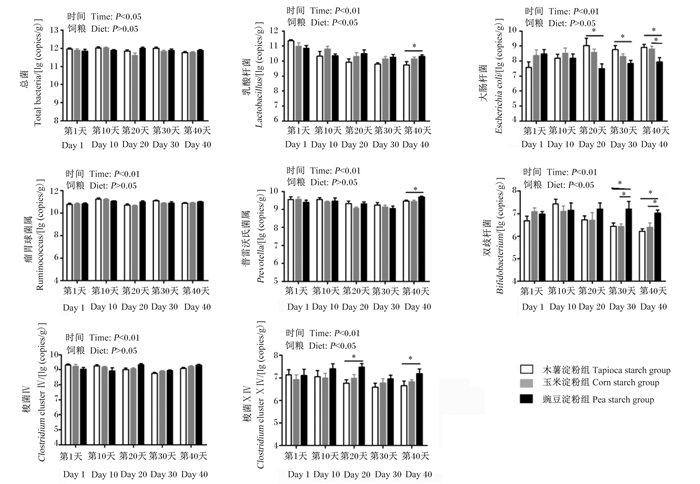
|
数据柱标注*表示差异显著(P < 0.05)。 Data columns with * mean significant difference (P < 0.05). 图 1 不同直/支链淀粉比饲粮对育肥猪粪便主要微生物数量动态变化的影响 Fig. 1 Effects of diets with different amylose to amylopectin ratios on dynamic change of major microorganism number in feces of finishing pigs |
不同直/支链淀粉比饲粮对育肥猪粪便pH动态变化的影响如图 2所示。由图可知,饲粮和时间均影响了育肥猪粪便pH,其中粪便pH随着时间的推移呈现出先降低后升高再降低的趋势。此外,豌豆淀粉组第20、30和40天粪便pH显著低于木薯淀粉组(P < 0.05),同时第40天粪便pH显著低于玉米淀粉组(P < 0.05);而在整个试验期内,木薯淀粉组和玉米淀粉组粪便pH无显著差异(P > 0.05)。
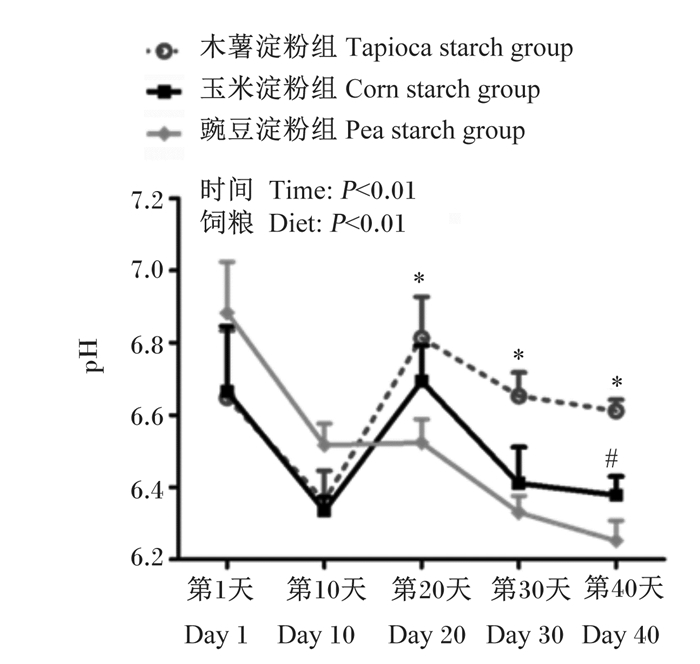
|
*表示木薯淀粉组和豌豆淀粉组差异显著(P < 0.05),#表示玉米淀粉组和豌豆淀粉组差异显著(P < 0.05),$表示木薯淀粉组和玉米淀粉组差异显著(P < 0.05)。下图同。 * mean significant difference between tapioca starch group and pea starch group (P < 0.05), # mean significant difference between corn starch group and pea starch group (P < 0.05), and $ mean significant difference between tapioca starch group and corn starch group (P < 0.05). The same as below. 图 2 不同直/支链淀粉比饲粮对育肥猪粪便pH动态变化的影响 Fig. 2 Effects of diets with different amylose to amylopectin ratios on pH dynamic change in feces of finishing pigs |
不同直/支链淀粉比饲粮对育肥猪粪便中乳酸含量动态变化的影响如图 3所示。由图可知,与木薯淀粉组相比,豌豆淀粉组第30和40天粪便中乳酸含量显著提高(P < 0.05);而在整个试验期内,玉米淀粉组粪便中乳酸含量与木薯淀粉组和豌豆淀粉组无显著差异(P > 0.05)。
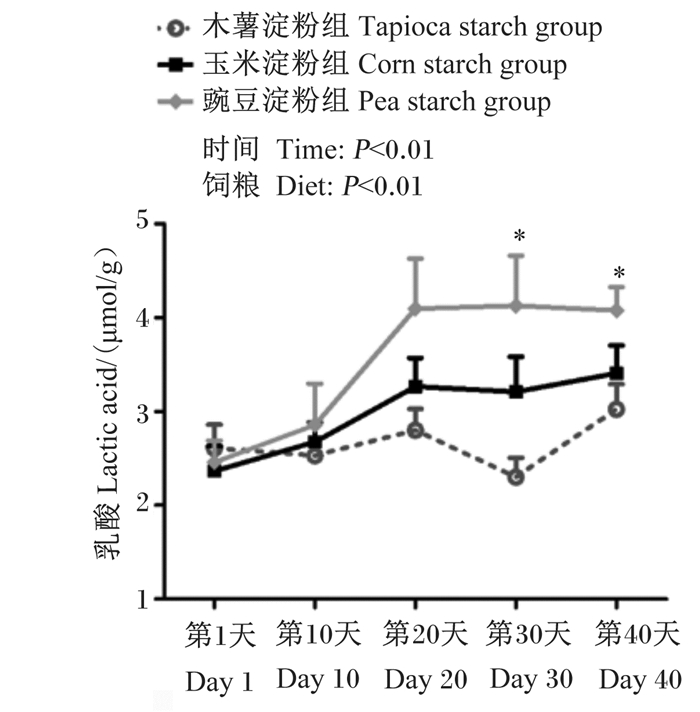
|
图 3 不同直/支链淀粉比饲粮对育肥猪粪便中乳酸含量动态变化的影响 Fig. 3 Effects of diets with different amylose to amylopectin ratios on dynamic change of lactic acid content in feces of finishing pigs |
不同直/支链淀粉比饲粮对育肥猪粪便中挥发性脂肪酸含量动态变化的影响如图 4所示。由图可知,第30和40天,与木薯淀粉组相比,豌豆淀粉组粪便中乙酸含量显著增加(P < 0.05)。3组粪便中丁酸含量随着时间的延长逐渐增加(P < 0.05),其中在第20、30和40天,豌豆淀粉组粪便中丁酸含量均显著高于木薯淀粉组(P < 0.05)。玉米淀粉组第40天粪便中戊酸含量显著高于木薯淀粉组(P < 0.05)。3组粪便中总挥发性脂肪酸含量随着时间的延长呈现先上升后下降再上升的趋势,豌豆淀粉组第30和40天粪便中总挥发性脂肪酸含量显著高于木薯淀粉组(P < 0.05)。此外,在整个试验期内,各组粪便中其他挥发性脂肪酸含量之间均无显著差异(P > 0.05)。
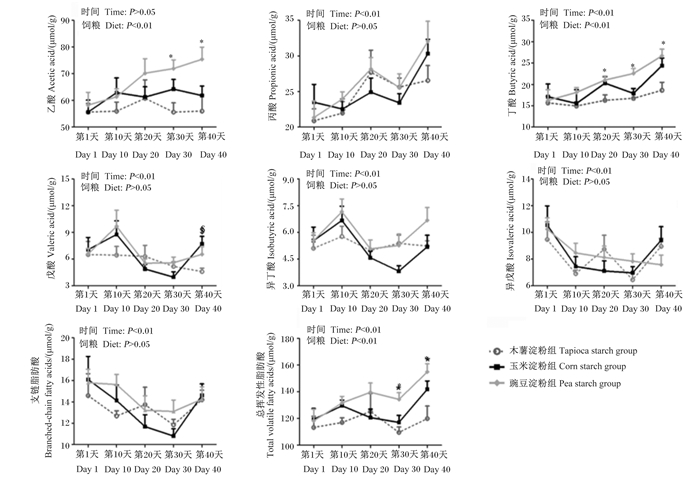
|
图 4 不同直/支链淀粉比饲粮对育肥猪粪便中挥发性脂肪酸含量动态变化的影响 Fig. 4 Effects of diets with different amylose to amylopectin ratios on dynamic change of volatile fatty acid content in feces of finishing pigs |
不同直/支链淀粉比饲粮对育肥猪粪便中NH3-N含量动态变化的影响如图 5所示。由图可知,与木薯淀粉组相比,豌豆淀粉组第20、30和40天粪便中NH3-N含量显著降低(P < 0.05),玉米淀粉组第20和40天粪便中NH3-N含量也显著降低(P < 0.05)。此外,在整个试验期内,各组第10和20天粪便中NH3-N含量之间无显著差异(P > 0.05)。
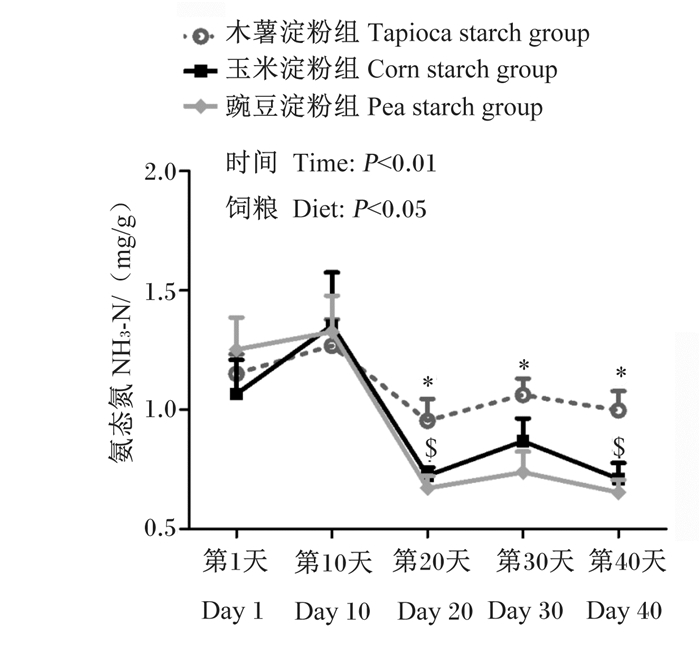
|
图 5 不同直/支链淀粉比饲粮对育肥猪粪便中NH3-N含量动态变化的影响 Fig. 5 Effects of diets with different amylose to amylopectin ratios on dynamic change of NH3-N content in feces of finishing pigs |
不同直/支链淀粉比饲粮对育肥猪粪便中挥发性生物胺含量动态变化的影响如图 6所示。由图可知,第20天,豌豆淀粉组粪便中总挥发性生物胺含量显著低于玉米淀粉组和木薯淀粉组(P < 0.05);与木薯淀粉组相比,豌豆淀粉组粪便中腐胺和尸胺含量显著降低(P < 0.05)。第30天,与木薯淀粉组相比,豌豆淀粉组粪便中总挥发性生物胺、色胺和尸胺含量显著降低(P < 0.05),玉米淀粉组粪便中色胺和总挥发性生物胺含量也显著降低(P < 0.05)。第40天,玉米淀粉组粪便中精胺含量显著低于木薯淀粉组(P < 0.05),豌豆淀粉组粪便中总挥发性生物胺和腐胺含量显著低于木薯淀粉组(P < 0.05)。此外,在整个试验期内,各组其他挥发性生物胺含量之间无显著差异(P > 0.05)。
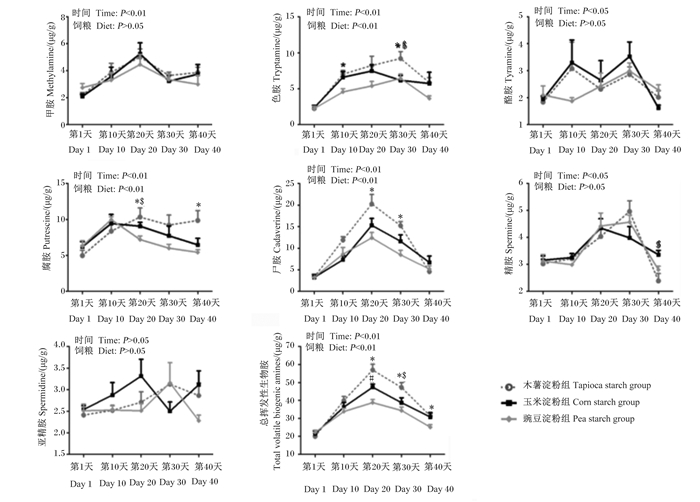
|
图 6 不同直/支链淀粉比饲粮对育肥猪粪便中挥发性生物胺含量动态变化的影响 Fig. 6 Effects of diets with different amylose to amylopectin ratios on dynamic change of volatile biogenic amine content in feces of finishing pigs |
不同直/支链淀粉比饲粮对育肥猪粪便中酚和吲哚类物质含量动态变化的影响如图 7所示。由图可知,豌豆淀粉组第10、20、30和40天粪便中吲哚含量显著低于木薯淀粉组(P < 0.05),第40天粪便中粪臭素含量显著低于玉米淀粉组和木薯淀粉组(P < 0.05)。此外,在整个试验期内,各组粪便中苯酚和对甲酚含量之间无显著差异(P > 0.05)。
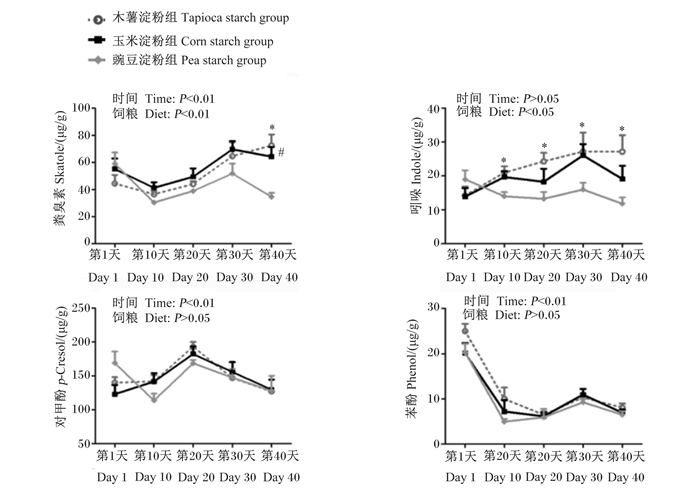
|
图 7 不同直/支链淀粉比饲粮对育肥猪粪便中酚和吲哚类物质含量动态变化的影响 Fig. 7 Effects of diets with different amylose to amylopectin ratios on dynamic change of content of phenol and indoles in feces of finishing pigs |
为了直观显示不同饲粮对粪便中主要微生物数量和臭气物质含量影响的差异,我们采用SIMCA-P 13.0软件中的PLS-DA方法进行多元变量分析发现,豌豆淀粉组和木薯淀粉组粪便中的主要微生物数量(图 8-A)和臭气物质含量(图 8-B)明显分开,这表明饲喂含有高直链淀粉的豌豆淀粉饲粮和高支链淀粉的木薯淀粉饲粮改变了育肥猪粪便中微生物的数量和臭气物质的组成。
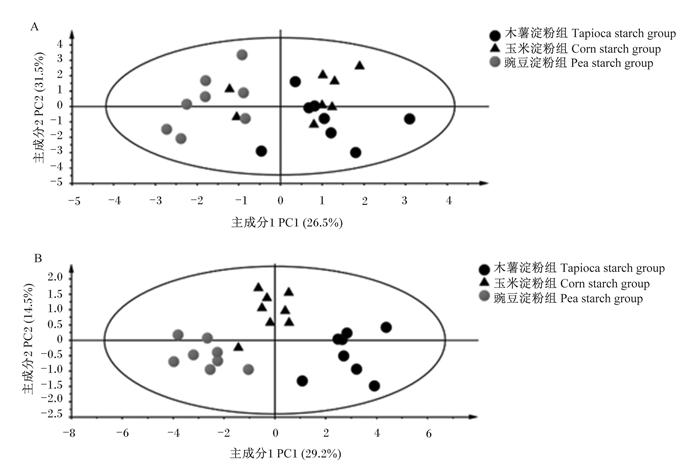
|
图 8 不同直/支链淀粉比饲粮对育肥猪粪便中主要微生物数量(A)和臭气物质含量(B)的PLS-DA Fig. 8 PLS-DA of diets with different amylose to amylopectin ratios on major microorganism number (A) and odorous substance content (B) in feces of finishing pigs |
宿主肠道内的微生物数量和种类主要受饲粮结构和组成的影响。本试验结果发现,与木薯淀粉组相比,豌豆淀粉组育肥猪粪便中梭菌ⅩⅣ、双歧杆菌、乳酸杆菌和普雷沃氏菌属的数量会显著增加,同时粪便中大肠杆菌的数量会显著减少,这与本试验前期的研究结果[9-10]相似,也与Lefter等[17]在生长猪上以及Ren等[18]在育肥猪上的研究结果相似,即饲喂含有高直链淀粉的饲粮可显著增加粪便中乳酸杆菌和梭菌ⅩⅣ的数量,同时减少大肠杆菌的数量。大肠杆菌属于蛋白质降解菌,其数量与NH3-N、挥发性生物胺和吲哚类等物质含量呈正相关的关系,而且对酸敏感,其数量会随着pH降低而降低[9, 19]。双歧杆菌和乳酸杆菌是乳酸分泌菌,可通过分泌乳酸而实现抑制蛋白质的腐败发酵[20-21]。梭菌ⅩⅣ可以通过代谢粪便中未被消化完的淀粉和膳食纤维产生大量丁酸[22]。普雷沃氏菌属属于淀粉利用菌,可以降解淀粉产生挥发性脂肪酸[23]。因此,本试验中碳水化合物降解菌数量的增加以及蛋白质降解菌数量的减少表明豌豆淀粉可改变育肥猪粪便中微生物的结构,一定程度上减少臭气的排放,这也验证了本试验中臭气排放减少的结果。
此外,饲粮是影响宿主肠道微生态平衡的主要因素之一,而胃肠道微生态处于稳态可维系其机体健康,进而改善其生长性能。本试验中,豌豆淀粉组产乳酸菌和产短链脂肪酸菌数量的增加,以及蛋白质降解菌数量的减少,表明豌豆淀粉可调控微生物菌群的结构,并从肠道微生态稳态层面进一步了解释本试验的前期研究结果,即豌豆淀粉饲粮可促进育肥猪的生长[7]。
3.2 不同直/支链淀粉比饲粮对育肥猪粪便中NH3-N和挥发性生物胺动态排放的影响粪便中的NH3-N主要是通过粪便中微生物对氨基酸的脱氨基反应而产生的[24]。本试验结果发现,与木薯淀粉组相比,豌豆淀粉组粪便中NH3-N含量显著降低,这与本试验在盲肠中的试验结果[9]相似。NH3-N极其不稳定,容易转变成氨气(NH3)排放到空气中,动物机体吸入NH3呼吸道会产生碱性化学灼伤,导致呼吸系统损伤,严重会麻痹中枢神经系统[25-26]。同时,NH3-N的生成与pH密切相关,当pH降低时,NH3-N和铵根离子(NH4+)之间动态平衡被打破,主要生成NH4+,从而减少NH3-N的生成[27]。本试验中,豌豆淀粉组粪便中NH3-N含量的降低,表明豌豆淀粉具有降低氨气排放的潜力。本试验结果还发现,从第20天开始,豌豆淀粉组粪便中NH3-N含量开始显著降低,这可能是在本试验的第20天,粪便pH出现降低,影响NH3-N和NH4+之间的平衡,进而减少NH3-N的生成。
挥发性生物胺主要是微生物通过对氨基酸的脱羧反应而生成的一类臭气物质[28-30]。动物过量吸入挥发性生物胺容易引发机体呼吸困难,严重会导致神经中毒[31]。本试验结果发现,与木薯淀粉组相比,豌豆淀粉组粪便中色胺、尸胺、腐胺和总挥发性生物胺含量降低,这表明豌豆淀粉可抑制氨基酸的脱羧反应,进而影响挥发性生物胺的生成,从而减少臭气对动物的不良影响。本试验结果还发现,从第20天开始,豌豆淀粉组粪便中挥发性生物胺含量开始降低,这可能是由于大肠杆菌数量与挥发性生物胺含量呈正相关性[9],在本试验的第20天,豌豆淀粉组粪便中大肠杆菌的数量显著减少,进而减少了粪便中挥发性生物胺的含量。此外,本试验前期研究结果也表明,豌豆淀粉饲粮显著提高了粗蛋白质的表观消化率[8],表明其可能促进了机体对蛋白质的消化吸收,进而减少了其到达后肠被微生物发酵产生生物胺等含氮化合物的含量。
3.3 不同直/支链淀粉比饲粮对育肥猪粪便中吲哚和粪臭素动态排放的影响吲哚和粪臭素是微生物代谢色氨酸而生成的一类恶臭阈值很低的物质[32]。本试验中,与木薯淀粉组相比,豌豆淀粉组粪便中吲哚和粪臭素含量显著降低。吲哚和粪臭素不仅会引发猪肉膻味,还污染空气、水源和土壤等[33]。因此,本试验中豌豆淀粉组粪便中吲哚和粪臭素含量的降低表明豌豆淀粉可以减少臭气的污染。此外,本试验还发现,从第10天开始,豌豆淀粉组粪便中吲哚含量开始降低,这可能与粪便中微生物代谢变化有关。本试验的前期试验证实,豌豆淀粉可以提高育肥猪后肠段中碳水化合物含量,进而改变粪便中碳水化合物含量[9-10]。当粪便中碳水化合物含量增加时,微生物可优先发酵碳水化合物,从而抑制粪便中蛋白质的腐败发酵,进而减少吲哚和粪臭素的生成[34-35]。此外,微生物通过代谢粪便中的色氨酸合成菌体蛋白,进而活性提高,最终抑制色氨酸向吲哚和粪臭素转化[36]。由此可知,豌豆淀粉可以改变粪便中微生物的发酵模式,使其偏向于碳水化合物发酵,最终降低吲哚和粪臭素的生成。
3.4 不同直/支链淀粉比饲粮对育肥猪粪便中挥发性脂肪酸动态排放的影响挥发性脂肪酸主要是由微生物发酵碳水化合物和膳食纤维而生成的一类物质[23]。本试验结果发现,与木薯淀粉组相比,豌豆淀粉组粪便中乳酸、乙酸、丁酸和总挥发性链脂肪酸含量显著提高,同时粪便pH显著降低,这与本试验前期在盲肠和结肠的试验结果[6, 9]相似。挥发性脂肪酸在生成的过程中会降低pH,而pH的降低可以减弱微生物代谢蛋白质所分泌的蛋白酶的活性,进而减少氨、挥发性生物胺和吲哚等含氮臭气物质的生成[24];此外,挥发性脂肪酸的恶臭阈值远高于含氮化合物发酵产生的臭气物质,对动物危害程度较小[37]。本试验中,豌豆淀粉饲粮提高了粪便中挥发性脂肪酸含量,降低了粪便pH,提示豌豆淀粉可以一定程度上减少臭气的排放和污染。本试验还发现,从第20天开始,豌豆淀粉组粪便中丁酸含量出现提高,pH降低,这可能是从第20天开始,豌豆淀粉可以增加粪便中梭菌ⅩⅣ的数量,而梭菌ⅩⅣ可以通过代谢粪便中碳水化合物产生大量丁酸,最终降低粪便pH。
4 结论通过对粪便中主要微生物数量和臭气排放的动态分析表明,饲喂含高直/支链淀粉比的豌豆淀粉饲粮可以增加育肥猪粪便中碳水化合物降解菌梭菌ⅩⅣ、双歧杆菌、乳酸杆菌以及普雷沃氏菌属的数量,同时减少粪便中蛋白质降解菌大肠杆菌的数量;同时,含高直/支链淀粉比的豌豆淀粉饲粮可通过改变粪便中微生物的发酵模式,使其偏向于碳水化合物发酵,降低粪便pH,从而减少粪便中微生物对蛋白质的腐败发酵,最终降低NH3-N、挥发性生物胺、吲哚和粪臭素等臭气物质的排放。
| [1] |
LE P D, AARNINK A J A, OGINK N W M, et al. Odour from animal production facilities: its relationship to diet[J]. Nutrition Research Reviews, 2005, 18(1): 3-30. DOI:10.1079/NRR200592 |
| [2] |
贾华清. 畜禽粪便的除臭技术研究进展[J]. 安徽农学通报, 2007, 13(5): 49-51. JIA H Q. Advances in research on deodorant technique of livestock wastes[J]. Anhui Agricultural Science Bulletin, 2007, 13(5): 49-51 (in Chinese). DOI:10.3969/j.issn.1007-7731.2007.05.022 |
| [3] |
邓远帆, 廖新俤. 营养途径调控动物肠道微生物与臭气减排研究进展[J]. 家畜生态学报, 2015, 36(3): 1-9. DENG Y F, LIAO X D. Advances in relationship between nutrition regulation for intestinal microflora and odor emission reduction[J]. Acta Ecologae Animalis Domastici, 2015, 36(3): 1-9 (in Chinese). DOI:10.3969/j.issn.1673-1182.2015.03.001 |
| [4] |
NOFRARÍAS M, MARTÍNEZ-PUIG D, PUJOLS J, et al. Long-term intake of resistant starch improves colonic mucosal integrity and reduces gut apoptosis and blood immune cells[J]. Nutrition, 2007, 23(11/12): 861-870. |
| [5] |
TREMAROLI V, BÄCKHED F. Functional interactions between the gut microbiota and host metabolism[J]. Nature, 2012, 489(7415): 242-249. DOI:10.1038/nature11552 |
| [6] |
BACH KNUDSEN K E, HEDEMANN M S, LÆRKE H N. The role of carbohydrates in intestinal health of pigs[J]. Animal Feed Science and Technology, 2012, 173(1/2): 41-53. |
| [7] |
YU M, LI Z M, RONG T, et al. Different dietary starch sources alter the carcass traits, meat quality, and the profile of muscle amino acid and fatty acid in finishing pigs[J]. Journal of Animal Science and Biotechnology, 2020, 11: 78. DOI:10.1186/s40104-020-00484-9 |
| [8] |
余苗, 李贞明, 崔艺燕, 等. 不同淀粉类型饲粮对育肥猪营养物质表观消化率、血清生化指标、结肠黏膜免疫和微生物的影响[J]. 动物营养学报, 2021, 33(10): 5519-5533. YU M, LI Z M, CUI Y Y, et al. Effects of different starch type diets on nutrient apparent digestibility, serum biochemical indices, colonic mucosal immune and microorganism of finishing pigs[J]. Chinese Journal of Animal Nutrition, 2021, 33(10): 5519-5533 (in Chinese). DOI:10.3969/j.issn.1006-267x.2021.10.013 |
| [9] |
余苗, 李贞明, 陈卫东, 等. 不同淀粉类型饲粮对育肥猪盲肠食糜主要微生物及其代谢产物的影响[J]. 动物营养学报, 2020, 32(2): 613-625. YU M, LI Z M, CHEN W D, et al. Effects of different starch type diets on main microbes and their metabolites in cecal digesta of finishing pigs[J]. Chinese Journal of Animal Nutrition, 2020, 32(2): 613-625 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.02.017 |
| [10] |
YU M, LI Z M, CHEN W D, et al. Microbiome-metabolomics analysis investigating the impacts of dietary starch types on the composition and metabolism of colonic microbiota in finishing pigs[J]. Frontiers in Microbiology, 2019, 10: 1143. DOI:10.3389/fmicb.2019.01143 |
| [11] |
余苗, 李贞明, 王刚, 等. 黑水虻幼虫粉对育肥猪盲肠食糜主要微生物数量和代谢产物的影响[J]. 畜牧兽医学报, 2020, 51(2): 299-310. YU M, LI Z M, WANG G, et al. Effects of Hermetia illucens larvae meal on the number of main microbes and metabolites in the cecal digesta of finishing pigs[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(2): 299-310 (in Chinese). |
| [12] |
YU M, LI Z M, CHEN W D, et al. Dietary supplementation with citrus extract altered the intestinal microbiota and microbial metabolite profiles and enhanced the mucosal immune homeostasis in yellow-feathered broilers[J]. Frontiers in Microbiology, 2019, 10: 2662. DOI:10.3389/fmicb.2019.02662 |
| [13] |
YU M, ZHANG C J, YANG Y X, et al. Long-term effects of early antibiotic intervention on blood parameters, apparent nutrient digestibility, and fecal microbial fermentation profile in pigs with different dietary protein levels[J]. Journal of Animal Science and Biotechnology, 2017, 8: 60. DOI:10.1186/s40104-017-0192-2 |
| [14] |
CHANEY A L, MARBACH E P. Modified reagents for determination of urea and ammonia[J]. Clinical Chemistry, 1962, 8: 130-132. DOI:10.1093/clinchem/8.2.130 |
| [15] |
YANG Y X, MU C L, ZHANG J F, et al. Determination of biogenic amines in digesta by high performance liquid chromatography with precolumn dansylation[J]. Analytical Letters, 2014, 47(8): 1290-1298. DOI:10.1080/00032719.2013.871550 |
| [16] |
YU M, LI Z M, CHEN W D, et al. Hermetia illucens larvae as a potential dietary protein source altered the microbiota and modulated mucosal immune status in the colon of finishing pigs[J]. Journal of Animal Science and Biotechnology, 2019, 10: 50. DOI:10.1186/s40104-019-0358-1 |
| [17] |
LEFTER N A, HABEANU M, GHEORGHE A, et al. Dietary effect of a mixture of alfalfa hay: peas powder on growing pigs.Certain plasma and faeces microbiological analyses[J]. Scientific Papers: Animal Science and Biotechnologies, 2020, 53(2): 17-23. |
| [18] |
REN W, YAN H L, YU B, et al. Prevotella-rich enterotype may benefit gut health in finishing pigs fed diet with a high amylose-to-amylopectin ratio[J]. Animal Nutrition, 2021, 7(2): 400-411. DOI:10.1016/j.aninu.2020.08.007 |
| [19] |
CHEN X Y, SONG P X, FAN P X, et al. Moderate dietary protein restriction optimized gut microbiota and mucosal barrier in growing pig model[J]. Frontiers in Cellular and Infection Microbiology, 2018, 8: 246. DOI:10.3389/fcimb.2018.00246 |
| [20] |
SMITH E A, MACFARLANE G T. Enumeration of human colonic bacteria producing phenolic and indolic compounds: effects of pH, carbohydrate availability and retention time on dissimilatory aromatic amino acid metabolism[J]. The Journal of Applied Bacteriology, 1996, 81(3): 288-302. DOI:10.1111/j.1365-2672.1996.tb04331.x |
| [21] |
WANG W, CHEN L P, ZHOU R, et al. Increased proportions of Bifidobacterium and the Lactobacillus group and loss of butyrate-producing bacteria in inflammatory bowel disease[J]. Journal of Clinical Microbiology, 2014, 52(2): 398-406. DOI:10.1128/JCM.01500-13 |
| [22] |
DEN BESTEN G, VAN EUNEN K, GROEN A K, et al. The role of short-chain fatty acids in the interplay between diet, gut microbiota, and host energy metabolism[J]. Journal of Lipid Research, 2013, 54(9): 2325-2340. DOI:10.1194/jlr.R036012 |
| [23] |
FLINT H J, BAYER E A, RINCON M T, et al. Polysaccharide utilization by gut bacteria: potential for new insights from genomic analysis[J]. Nature Reviews Microbiology, 2008, 6(2): 121-131. DOI:10.1038/nrmicro1817 |
| [24] |
钟智康, 王燕, 吴银宝, 等. 单胃动物肠道细菌群落及其产臭机制研究进展[J]. 家畜生态学报, 2018, 39(6): 5-11. ZHONG Z K, WANG Y, WU Y B, et al. Effect of intestinal bacteria community and its mechanism on odor production in monogastric animals[J]. Acta Ecologae Animalis Domastici, 2018, 39(6): 5-11 (in Chinese). DOI:10.3969/j.issn.1673-1182.2018.06.002 |
| [25] |
李新建, 吕刚, 任广志. 影响猪场氨气排放的因素及控制措施[J]. 家畜生态学报, 2012, 33(1): 86-93. LI X J, LV G, REN G Z. Influencing factors of ammonia emissions from pig houses and mitigation techniques[J]. Acta Ecologae Animalis Domastici, 2012, 33(1): 86-93 (in Chinese). DOI:10.3969/j.issn.1673-1182.2012.01.019 |
| [26] |
PHILIPPE F X, CANART B, LAITAT M, et al. Gaseous emissions from group-housed gestating sows kept on deep litter and offered an ad libitum high-fibre diet[J]. Agriculture, Ecosystems & Environment, 2009, 132(1/2): 66-73. |
| [27] |
崔艺燕, 田志梅, 邓盾, 等. 柑橘提取物对肥育猪肠道抗氧化指标、消化酶活性、氨态氮含量以及粪便氮、磷、臭气含量的影响[J]. 动物营养学报, 2021, 33(5): 2585-2594. CUI Y Y, TIAN Z M, DENG D, et al. Effects of citrus extract on intestinal antioxidant indices, digestive enzyme activities, ammonia nitrogen contents and fecal nitrogen, phosphorus and odor contents of finishing pigs[J]. Chinese Journal of Animal Nutrition, 2021, 33(5): 2585-2594 (in Chinese). |
| [28] |
PI Y, GAO K, PENG Y, et al. Antibiotic-induced alterations of the gut microbiota and microbial fermentation in protein parallel the changes in host nitrogen metabolism of growing pigs[J]. Animal, 2019, 13(2): 262-272. DOI:10.1017/S1751731118001416 |
| [29] |
ZHU J. A review of microbiology in swine manure odor control[J]. Agriculture, Ecosystems & Environment, 2000, 78(2): 93-106. |
| [30] |
MACKIE R I, STROOT P G, VAREL V H. Biochemical identification and biological origin of key odor components in livestock waste[J]. Journal of Animal Science, 1998, 76(5): 1331-1342. DOI:10.2527/1998.7651331x |
| [31] |
王光强, 俞剑燊, 胡健, 等. 食品中生物胺的研究进展[J]. 食品科学, 2016, 37(1): 269-278. WANG G Q, YU J S, HU J, et al. Progress in research on biogenic amines in foods[J]. Food Science, 2016, 37(1): 269-278 (in Chinese). |
| [32] |
NYANGALE E P, MOTTRAM D S, GIBSON G R. Gut microbial activity, implications for health and disease: the potential role of metabolite analysis[J]. Journal of Proteome Research, 2012, 11(12): 5573-5585. DOI:10.1021/pr300637d |
| [33] |
郭林霞, 赵国先, 杨博文, 等. 从源头减少鸡舍臭味物质排放措施研究进展[J]. 中国家禽, 2020, 42(2): 94-99. GUO L X, ZHAO G X, YANG B W, et al. Research advances on measures for reduce the emission of smelly substances from the source[J]. China Poultry, 2020, 42(2): 94-99 (in Chinese). |
| [34] |
WELLOCK I J, FORTOMARIS P D, HOUDIJK J G M, et al. The effect of dietary protein supply on the performance and risk of post-weaning enteric disorders in newly weaned pigs[J]. Animal Science, 2006, 82(3): 327-335. DOI:10.1079/ASC200643 |
| [35] |
RIST V T S, WEISS E, EKLUND M, et al. Impact of dietary protein on microbiota composition and activity in the gastrointestinal tract of piglets in relation to gut health: a review[J]. Animal, 2013, 7(7): 1067-1078. DOI:10.1017/S1751731113000062 |
| [36] |
LI X Q, JENSEN B B, CANIBE N. The mode of action of chicory roots on skatole production in entire male pigs is neither via reducing the population of skatole-producing bacteria nor via increased butyrate production in the hindgut[J]. Applied and Environmental Microbiology, 2019, 85(6): e02327-18. |
| [37] |
张信宜, 王燕, 吴银宝, 等. 规模化猪场臭气减排的营养和饲养技术研究进展[J]. 家畜生态学报, 2017, 38(4): 1-7, 14. ZHANG X Y, WANG Y, WU Y B, et al. Research progress on nutrition and feeding technology in reducing odour in large scale pig farms[J]. Acta Ecologae Animalis Domastici, 2017, 38(4): 1-7, 14 (in Chinese). DOI:10.3969/j.issn.1673-1182.2017.04.001 |




