2. 国家肉牛改良中心, 杨凌 712100
2. National Beef Cattle Improvement Center, Yangling 712100, China
单宁广泛存在于植物根茎叶中,因其抗营养性被认为是“抗营养因子”,而其因具有保护过瘤胃蛋白、抗炎抗菌及减少甲烷产量等功能也成功在反刍动物研究中应用。单宁属于多酚类化合物,广泛存在于树叶、灌木、豆科牧草和谷物籽实中,不同植物及组织中单宁含量不同,根据结构将单宁分为水解单宁和缩合单宁2类[1-3]。有研究表明,单宁具有抗炎抗菌、改变瘤胃微生物区系、提高动物机体免疫力、提高饲粮利用及转换效率和减少甲烷排放等功能。Heckendorn等[4]研究发现,在红豆草地上放牧绵羊其体内寄生虫、蛇形毛圆线虫幼虫数量均明显降低。在饲粮中添加2%、4%富含单宁的植物叶片粉末后,犊牛血清生化指标、细胞免疫和体液免疫能力均显著提高[5]。董春晓等[6]发现,在饲粮中添加植物单宁时粗饲料的表观消化率显著下降可能是与瘤胃微生物区系被限制有关。从紫色达利菊中提取的缩合单宁提高菌体蛋白合成效率,对干物质消化率并未产生影响[7]。在肉牛饲粮中添加不同分子质量的植物提取缩合单宁后,瘤胃中蛋白质含量显著增加,而瘤胃中可溶性氮及氨态氮含量显著降低[8]。Patra等[9]研究发现,单宁对产甲烷菌、原虫有毒害作用,能够有效降低甲烷产量。在饲粮中添加10%板栗和葡萄籽单宁,体外发酵试验结果表明产甲烷菌相对丰度降低,甲烷产量显著降低[10-11]。体内和体外试验表明,在山羊饲粮中添加单宁后干物质表观消化率均增加,体外试验的甲烷日排放量比体内试验降低更明显[12]。目前,国内外通过体内、外试验研究单宁对反刍动物的影响,但因单宁种类繁多、结构复杂,不同单宁对反刍动物血液及瘤胃调节的调控效果不同,但综合而言单宁对反刍动物的蛋白质利用、瘤胃微生物区系方面的影响利大于弊。基于此,本试验在秦川肉牛饲粮中添加不同剂量的植物水解单宁,探究葡萄渣提取单宁对秦川肉牛血清生化指标、瘤胃消化指标及微生物区系的影响,为非常规粗饲料原料的开发利用、肉牛养殖“节能减排”提供理论依据。
1 材料与方法 1.1 试验设计选取14月龄、体况相近、体重为(280±20) kg的秦川牛肉用新品系(简称秦川肉牛)20头,随机分为5组,每组4头,分为对照组和4个试验组(试验Ⅰ、Ⅱ、Ⅲ、Ⅳ组)。试验期共45 d,预试期15 d,正试期30 d。对照组饲喂基础饲粮,其精料补充料的配方根据《肉牛饲养标准》(NY/T 81—2004)进行配制,基础饲粮组成及营养水平见表 1;试验组分别在基础饲粮中添加3.22、6.44、9.66、12.88 g/kg DM的葡萄皮渣水解单宁。饲喂试验牛前,将饲喂的精饲料、粗饲料、不同添加量的葡萄皮渣水解单宁混合均匀,保证每日饲喂量充足。
|
|
表 1 基础饲粮组成及营养水平 Table 1 Composition and nutrient levels of the basal diet |
试验牛提前做好驱虫消毒工作,保证正常采食。保持食槽和水槽内清洁卫生,将试验牛分组饲喂,每天饲喂2次(08:30和15:30),每次饲喂青贮饲料7 kg,精料补充料2 kg,干麦草1 kg。保证自由采食饮水。将干麦草提前进行处理,保证与青贮草、精料、单宁化合物混合均匀后饲喂。定期对试验牛进行健康检查,做好防护工作,按时消毒。保证牛舍环境卫生整洁干净,按时清粪。
1.3 样品采集及测定 1.3.1 生长性能的测定在正试期开始前3 d以及正试期最后3 d连续测定试验牛体重。在试验牛早上空腹情况下,利用地磅,测定试验牛的体重,记为初重及末重。
1.3.2 血液样品的采集及测定正试期最后3 d连续采血,试验牛空腹情况下,利用含K2-乙二胺四乙酸(K2-EDTA)的真空采血管颈静脉采血,采取试验牛15 mL血液。装在冰盒中送至实验室,4 ℃下3 000 r/min低温离心15 min,提取上端血清,保存至-80 ℃的超低温冰箱,利用迈瑞(bs-420)全自动生化仪采用比色法测定血清生化指标。
1.3.3 瘤胃液的采集及测定正试期最后3 d在试验牛空腹情况下从口腔插入乳胶软管抽取采集瘤胃液,每次抽取100 mL,用4层纱布过滤后立即测定pH,取上清液加入预先装有偏磷酸溶液(25%)的离心管中,测定挥发性脂肪酸(VFA)含量,然后将剩余样品置于50 mL的离心管中均放于-20 ℃冷冻保存,分析氨态氮含量。混匀后另取10 mL放入离心管中于-80 ℃保存,用于分析瘤胃微生物区系。瘤胃液pH利用便携式实验室pH计检测,挥发性脂肪酸含量参考Erwin等[13]的方法,利用日本岛津GC-14B气相色谱仪进行测定。参照冯宗慈等[14]的方法测定氨态氮含量,利用氯化铵作为标准液,在700 nm的光波下进行比色。
1.3.4 瘤胃微生物区系16S rDNA测序根据育肥效果及试验期间日增重显著的差异,选择试验Ⅲ组测定其微生物区系。随机抽取对照组3个样本及试验Ⅲ组4个样本(添加量为9.66 g/kg DM)进行瘤胃微生物区系16S rDNA测序。利用DNA提取试剂盒(M5 HiPer Universal DNAMini Kit)提取。将提取的DNA片段进行扩增,在扩增前利用酶标仪检测提取DNA的添加量,将其进行稀释后,作为目的基因组DNA模板。瘤胃液DNA扩增目的片段为V3+V4区, 由引物341F和805R PCR扩增得到的目的片段长度约为469 bp[15],其引物的序列为341F:5′-CCTACGGGNGGCWGCAG-3′;805R:5′-GACTACHVGGGTATCTAATCC-3′。将扩增得到的产物在1.5%的琼脂糖凝胶进行添加量检测,利用回收试剂盒回收产物。由杭州联川生物技术股份有限公司测序。
1.4 数据的统计分析将测定得到的数据通过Excel 2010进行预整理后,利用SPSS 26.0统计软件,对秦川肉牛血清、瘤胃发酵指标进行单因素方差分析(one-way ANOVA),差异显著时采用Duncan氏法进行多重比较;对微生物区系间的试验结果进行t检验(t-test),试验结果用平均值和均值标准误(SEM)表示,P<0.05为差异显著。
2 结果与分析 2.1 不同添加量的植物水解单宁对秦川肉牛生长性能的影响由表 2可知,在试验初期各组之间试验牛体重均无显著差异(P>0.05)。试验Ⅲ组全期总增重显著高于对照组(P<0.05),且全期总增重量较对照组高16.53%。平均日增重试验组显著高于对照组(P<0.05)。
|
|
表 2 不同添加量的植物水解单宁对秦川肉牛生长性能的影响 Table 2 Effects of different addition amounts of plant hydrolyzed tannins on growth performance of Qinchuan beef cattle |
由表 3可知,饲粮中添加不同添加量的植物水解单宁后,试验Ⅳ、Ⅲ组血清中总蛋白的含量显著高于对照组(P<0.05),而对照组血清肌酐、尿酸的含量均高于各试验组,并且试验Ⅰ、Ⅱ组血清尿酸含量显著高于试验Ⅲ、Ⅳ组(P<0.05);试验Ⅳ组血清丙氨酸氨基转移酶活性显著高于对照组、试验Ⅰ、Ⅱ组,且这3组显著高于试验Ⅲ组(P<0.05),该指标从高至低依次为试验Ⅳ、Ⅱ、Ⅰ组、对照组、试验Ⅲ组。除以上指标,试验牛血清生化其他指标各组间差异均不显著(P>0.05)。
|
|
表 3 不同添加量的植物水解单宁对秦川肉牛血清生化指标的影响 Table 3 Effects of different addition amounts of plant hydrolyzed tannin on serum biochemical indexes of Qinchuan beef cattle |
由表 4可知,在饲粮中添加不同添加量的植物水解单宁后,试验Ⅲ组乙酸的含量最低,最高的为对照组,瘤胃中乙酸的含量随着植物水解单宁添加量增加呈逐渐下降的趋势,但各组间差异不显著(P>0.05);试验组丙酸含量显著高于对照组(P<0.05);乙酸/丙酸(A/P)值对照组最高,对照组显著高于试验Ⅲ组(P<0.05),其余各试验组间无显著差异(P>0.05);试验组瘤胃中氨态氮的含量与对照组间差异不显著(P>0.05),其中对照组含量最高,试验Ⅳ组最低;除上述指标外,其余瘤胃消化指标各组间差异均不显著(P>0.05)。
|
|
表 4 不同添加量的植物水解单宁对秦川肉牛瘤胃消化指标的影响 Table 4 Effects of different addition amounts of plant hydrolyzed tannin on rumen digestion indexes of Qinchuan beef cattle |
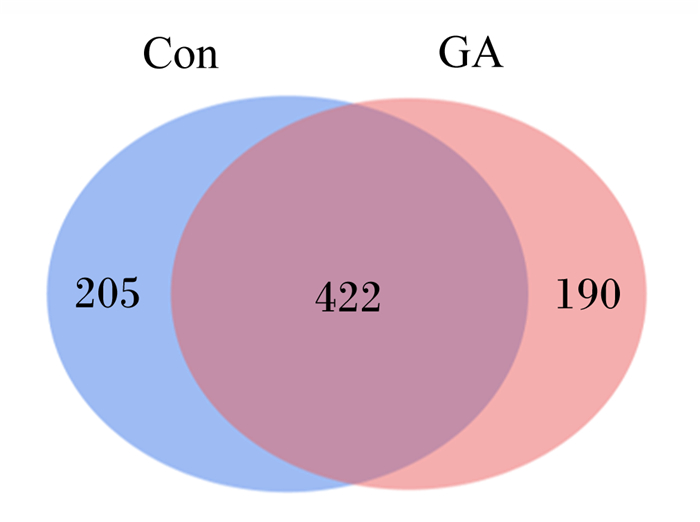
经Illumina Miseq测序结束后,将得到的基因信息特征值(feature)利用QIIME2通过过滤筛查、去重降重、嵌合体过滤等方法修正扩增序列的测序错误获得更为精确的特征表和特征序列[16]。根据获得的特征值丰度表,计算不同试验组和对照组共有的feature数量,利用韦恩图(Venn graph)呈现各组共有和特有的feature数目。由图 1可知,添加了9.66 g/kg DM植物水解单宁降低了菌群的多样性。
|
Con:对照组;GA:试验组。 Con: control group; GA: experimental group. 图 1 植物水解单宁对秦川肉牛瘤胃菌群特征值的影响 Fig. 1 Effects of plant hydrolyzed tannin on rumen microflora characteristics of Qinchuan beef cattle |
Alpha多样性是对每个瘤胃液样品中微生物菌落多样性的分析,其指标主要包括Chao1指数、ACE指数、Shannon指数以及Simpson指数等[17]。其中Chao1指数、ACE指数代表微生物菌群的丰度,该数值越大,则表示菌群丰度越高;而Shannon指数以及Simpson指数代表微生物菌群的多样性,两者之间呈负相关关系,Shannon指数越高说明微生物菌群多样性越多[18]。由表 5可知,在本试验中各组序覆盖度达到99%,说明采集的样品足以反映菌群的丰富程度,以及所测结果满足后续的分析研究。其中对照组ACE指数、Chao1指数均显著高于试验组(P<0.05);但试验组Shannon指数、Simpson指数水解与对照组均无显著差异(P>0.05)。这说明添加水解单宁后瘤胃菌群丰度下降。
|
|
表 5 植物水解单宁对秦川肉牛瘤胃菌群Alpha多样性的影响 Table 5 Effects of plant hydrolyzed tannin on alpha diversity in rumen microflora of Qinchuan beef cattle |
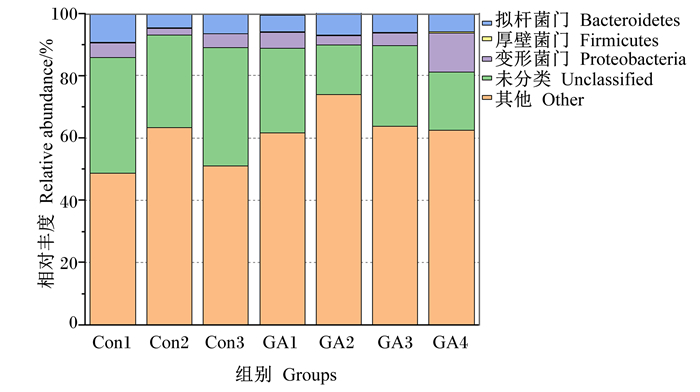
由图 2、表 6可知,在秦川肉牛饲粮中添加9.66 g/kg植物水解单宁后,通过16s rDNA测序总共得到25个门类细菌,其中主要包括拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutesb)、变形菌门(Proteobacteria)、Kiritimatiellaeota、髌骨细菌门(Patescibacteria)、软壁菌门(Tenericutes)、丝状杆菌门(Fibrobacteres)、螺旋菌门(Spirochaetes)、广古菌门(Euryarchaeota)、黏胶球形菌门(Lentisphaerae)、放线菌门(Actinobacteria)、浮霉菌门(Planctomycetes)、绿弯菌门(Chloroflexi)等。其中拟杆菌门、厚壁菌门、变形菌门相对丰富度占总菌门的92%以上。在添加植物水解单宁后,试验组拟杆菌门相对丰度显著高于对照组(P<0.05),对照组厚壁菌门相对丰度显著高于试验组(P<0.05)。除此之外,添加植物水解单宁后,变形菌门、Kiritimatiellaeota、丝状杆菌相对丰度有升高趋势;髌骨细菌门、软壁菌门、广古菌门相对丰度均有下降的趋势,但2组间差异均不显著(P>0.05)。
|
Con1~3为对照组;GA1~4为试验组。图 3同。 Con1 to 3 were control groups, GA1 to 4 were experimental groups. The same as Fig. 3. 图 2 植物水解单宁对秦川肉牛瘤胃菌群门水平的影响 Fig. 2 Effects of plant hydrolyzed tannin on rumen flora at phylum level of Qinchuan beef cattle |
|
|
表 6 植物水解单宁对秦川肉牛瘤胃微生物区系门水平的影响 Table 6 Effects of plant hydrolyzed tannin on rumen microflora at phylum level of Qinchuan beef cattle |
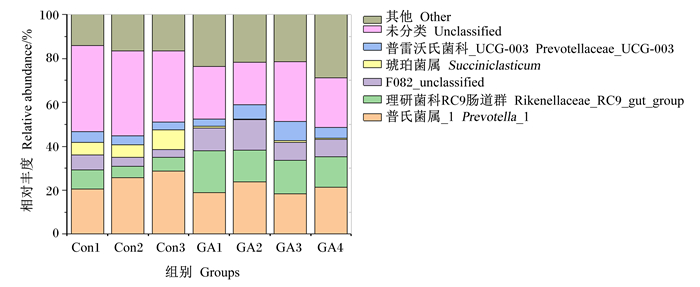
通过对2组微生物属水平上的分析研究,从中总共检测到129个属种。由图 3、表 7可知,表中共显示相对丰度相对较高的22个属种占各样品总菌属85%以上,相对丰度较高的主要为以下菌属:普氏菌属_1(Prevotella_1)、理研菌科RC肠道群(Rikenellaceae_RC9_gut_group)、F082_unclassified、琥珀菌属(Succiniclasticum)、普雷沃氏菌科_UCG-003(Prevotellaceae_UCG-003)、乙酸糖发酵菌属(Saccharofermentans)、瘤胃球菌科_NK4A214(Ruminococcaceae_NK4A214)、伯克氏菌群(Burkholderia-Caballeronia-Paraburkholderia group)、普雷沃氏菌科_UCG-001(Prevotellaceae_UCG-001)、韦荣球菌属_UCG-004(Veillonella_UCG-004)、假丁酸弧菌属(Pseudobutyrivibrio)。试验组瘤胃菌群中瘤胃球菌属相对丰度显著高于对照组(P<0.05),并且F082_unclassified菌属的相对丰度显著高于对照组(P<0.05)。对照组瘤胃液中理研菌科RC9肠道群、琥珀菌属、乙酸糖发酵菌属、瘤胃球菌科_NK4A214、克里斯滕森菌科R-7肠道群的菌群相对丰度均显著高于试验组(P<0.05)。除此之外,对照组中伯克氏菌群的相对丰度显著高于试验组(P<0.05)。其余菌种相对丰度组间并无显著差异(P>0.05)。
|
图 3 植物水解单宁对秦川肉牛瘤胃菌群属水平的影响 Fig. 3 Effects of plant hydrolyzed tannin on rumen flora at genus level of Qinchuan beef cattle |
|
|
表 7 植物水解单宁对秦川肉牛瘤胃微生物区系属水平的影响 Table 7 Effects of plant hydrolyzed tannin on rumen microflora at genus level of Qinchuan beef cattle |
生长性能是衡量动物生长快慢最重要的指标,也是动物对饲粮中营养物质消化吸收的最终表现,其中包括体尺性能、生长性能的增加[19]。解湧芳等[20]的研究表明,当饲粮中含有4%的单宁时,能够显著提高绵羊的平均日增重和生长速度。其可能原因是单宁具有保护过瘤胃蛋白的作用,降低了饲粮中蛋白质的损失,提高反刍动物小肠内蛋白质的吸收,并且能够有效降低病原微生物对反刍动物的侵害,提高免疫力[21]。这与本研究中各试验组平均日增重显著高于对照组的结果一致。
3.2 不同添加量的植物水解单宁对秦川肉牛血清生化指标的影响血清生化指标能够反映试验牛健康状况以及其对饲粮消化吸收情况。总蛋白是血液中关键的指标之一,血液中总蛋白含量高意味着蛋白质吸收效率高,动物机体代谢水平好[22]。有研究表明,血液中尿素氮含量受反刍动物饲粮中蛋白质和体内的氨基酸平衡代谢调控,饲粮中蛋白质吸收效率降低,饲粮中氮的消化吸收好,说明动物体内氨基酸平衡趋于稳定[23]。李林株[24]研究表明,在延边黄牛饲粮中添加单宁后,试验组血液中总蛋白含量显著高于对照组。熊忙利等[25]研究表明,血液总蛋白含量升高说明动物机体对氮的消化吸收程度增加,氮的沉积增加,这与本研究结论一致。反刍动物血液中的肌酐是机体肌肉代谢产物,其产量通过肾小球滤过后全部随尿液排出,并且体内的肌酐与尿素通常按相应比例产生,而尿液中尿素含量的减少会降低血液中肌酐含量[26]。天门冬氨基酸转移酶(AST)、丙氨酸氨基转移酶(ALT)是存在于肝脏和心脏细胞以及细胞线粒体中的氨基酸转移酶[27],该指标可衡量内脏器官健康程度及内脏蛋白代谢是否正常。血液中免疫球蛋白可作为衡量免疫性能的重要指标。在本研究中,饲粮中添加水解单宁后,试验组的血清中肌酐的含量显著低于对照组,并随着添加量的增加逐渐降低,其主要原因可能是因为单宁保护过瘤胃蛋白,改变蛋白质转化路径,从而减少瘤胃中氨类物质和尿素的产生,降低尿液中尿素的含量[20],从而增加氮沉积量和提高氮的利用效率。刘英娜等[28]的研究结果不同,育肥第15天时,在肉牛饲粮中添加柠条单宁后血清中AST和ALT活性均显著低于对照组。在本研究中,添加植物水解单宁后,血清中AST活性呈下降趋势,但试验组ALT活性显著高于对照组,并且其变化值均在正常指标之内,AST活性的下降说明单宁能够增强内脏的活力,对于内脏器官合成代谢蛋白具有促进的作用。导致结果不同的原因可能是不同种类的单宁对动物的影响方式和作用机制均有差异。综上所述,在饲粮中添加适量的单宁能够有效提高秦川肉牛氮沉积的含量和提高机体免疫力。
3.3 不同添加量的植物水解单宁对秦川肉牛瘤胃消化指标的影响瘤胃消化指标主要包括瘤胃液pH及挥发性脂肪酸、氨态氮含量等。本研究中,不同添加量的植物水解单宁对于瘤胃pH未产生显著性改变,其变化均在正常范围之内。挥发性脂肪酸是瘤胃消化饲料中碳水化合物的主要产物,是为机体提供能量最主要的物质,能够反映反刍动物的能源供给是否充足[29]。氨态氮是瘤胃微生物氮代谢的重要物质,氨作为瘤胃中微生物生长的重要氮源之一,该指标可评价瘤胃中氮的存留率,其主要由微生物降解外源性蛋白质及内源氮消化形成的氮化合物产生[30]。在体外消化试验研究中,添加板栗总包多酚后,显著降低了发酵底物中乙酸含量,乙酸/丙酸的值也显著下降[31]。在吕忠蕾[32]的研究中,添加大分子质量的缩合单宁有效地降低了乙酸的含量以及乙酸/丙酸的值。在本研究中,添加了植物水解单宁后瘤胃中乙酸的含量显著降低,丙酸的含量呈升高的趋势,乙酸/丙酸的值也显著降低,说明添加水解单宁后瘤胃向着丙酸型发酵方式转变,提高饲料的利用率,这与前人的研究结果一致。在本研究中添加植物水解单宁后均未显著降低氨态氮的含量,但随着添加量的增大,该值呈逐渐下降的趋势。该结论与赵栋等[33]的研究结果一致,利用添加不同葡萄渣缩合单宁含量的全混合日粮饲喂绵羊,发现绵羊瘤胃中氨态氮的含量随着葡萄渣添加量增加逐渐降低,添加葡萄渣缩合单宁的试验组氨态氮含量均低于对照组。
3.4 植物水解单宁对秦川肉牛瘤胃微生物丰富度的影响微生物群落是反刍动物瘤胃中最为重要的构成部分,其中的细菌、原虫、真菌等微生物能够相互“协作”降解饲粮、促进代谢从而为机体供能。各个菌落均参与机体代谢过程,如拟杆菌门主要参与碳水化合物代谢反应;厚壁菌门参与能量的吸收;而当发生菌群失调时,厚壁菌门相对丰度增加,拟杆菌门相对丰度减少从而导致代谢紊乱,影响动物机体发育[34]。在本研究中,在饲粮中添加了9.66 g/kg DM的水解单宁后,秦川肉牛瘤胃液中菌群丰富度ACE指数、Chao1指数显著低于对照组,说明添加水解单宁后显著降低了肉牛瘤胃液中微生物菌群的丰富度。邸凌峰[35]研究表明,肉羊饲粮中添加0.1%缩合单宁可显著提高其瘤胃微生物的丰富度和多样性,这与本研究改变瘤胃菌群丰富度的结论一致。同时,也有研究发现饲粮中添加0.2%的缩合单宁不影响瘤胃微生物的丰富度和多样性[36],本研究中菌群丰富度下降,但多样性未发生变化,其原因可能受单宁的种类和添加量、动物所处地理位置、饲养环境、饲粮、环境温、湿度、饲粮营养水平等多种因素的影响[37]。有研究表明,在饲粮中添加2%和6%单宁时,均显著降低绵羊和山羊瘤胃内容物中白色瘤胃球菌、黄色瘤胃球菌和产琥珀酸丝状杆菌的数量,厚壁菌门数量及丰度显著下降[38]。研究发现,饲粮中添加1.3%和2.6%水解单宁可显著降低肉牛瘤胃中原虫、产甲烷菌和白色瘤胃球菌的数量[39]。在本研究中,添加植物水解单宁后,在菌属水平上甲烷短杆菌属相对丰度显著下降,伯克氏菌群、普雷沃氏菌科_UCG-001、琥珀菌属、乙酸糖发酵菌属、瘤胃球菌科_NK4A214、克里斯滕森菌科R-7肠道群相对丰度显著升高。王敬尧等[40]的研究表明,在绵羊饲粮中添加2%和4%的单宁后,降低瘤胃总菌群落及产甲烷菌的数量,这与本试验研究结果一致。其主要原因可能是单宁改变了甲烷等部分菌属的形态结构,导致细胞失水、塌陷等,使其代谢紊乱甚至死亡,最终逐渐被其他优势菌群吞噬[41]。
4 结论在本试验中,随着植物水解单宁添加量的增加,秦川肉牛的氮沉积及饲料利用率逐渐提高。添加植物水解单宁能够提高肉牛瘤胃微生物区系的丰富度,降低甲烷菌的产生。
| [1] |
SCHOFIELD P, MBUGUA D M, PELL A N. Analysis of condensed tannins: a review[J]. Animal Feed Science and Technology, 2001, 91(1/2): 21-40. |
| [2] |
SMITH A H, ZOETENDAL E, MACKIE R I. Bacterial mechanisms to overcome inhibitory effects of dietary tannins[J]. Microbial Ecology, 2005, 50(2): 197-205. DOI:10.1007/s00248-004-0180-x |
| [3] |
ETUK E B, OKEUDO N J, ESONU B O, et al. Antinutritional factors in sorghum: chemistry, mode of action and effects on livestock and poultry[J]. Online Journal of Animal and Feed Research, 2012, 2(2): 113-119. |
| [4] |
HECKENDORN F, HÄRING D A, MAURER V, et al. Effect of sainfoin (Onobrychisviciifolia) silage and hay on established populations of Haemonchuscontortusand Cooperiacurticei in lambs[J]. Veterinary Parasitology, 2006, 142(3/4): 293-300. |
| [5] |
LAKHANI N, KAMRA D N, LAKHANI P, et al. Immune status and haemato-biochemical profile of buffalo calves supplemented with phytogenic feed additives rich in tannins, saponins and essential oils[J]. Tropical Animal Health and Production, 2019, 51(3): 565-573. DOI:10.1007/s11250-018-1727-z |
| [6] |
董春晓, 张金龙, 郭晓飞, 等. 单宁对反刍动物生产性能、瘤胃发酵及微生物区系影响的研究进展[J]. 畜牧兽医学报, 2020, 51(2): 234-242. DONG C X, ZHANG J L, GUO X F, et al. Research Progress on the effects of tannins on ruminant production performance, rumen fermentation and microflora[J]. Journal of Animal Husbandry and Veterinary Medicine, 2020, 51(2): 234-242 (in Chinese). |
| [7] |
金龙. 紫色达利菊提取缩合单宁对大肠杆菌和瘤胃氮代谢以及瘤胃微生物的影响[D]. 博士学位论文. 哈尔滨: 东北农业大学, 2011: 13-15. JIN L. Effect of condensed tannins from purple prairie clover on fecal shedding of Escherichia coli by beef cattle and on rumen fermentation and rumen bacteria[D]. Ph. D. Thesis. Harbin: Northeast Agricultural University, 2011: 13-15. (in Chinese) |
| [8] |
刘思扬, 李丽莉, 尹云厚, 等. 饲喂不同相对分子质量缩合单宁对延边黄牛蛋白质消化吸收的影响[J]. 饲料研究, 2015(2): 1-4, 38. LIU S Y, LI L L, YIN Y H, et al. The effect of different relative molecular weight condensed tannins on protein digestion and absorption of Yanbian yellow cattle[J]. Feed Research, 2015(2): 1-4, 38 (in Chinese). |
| [9] |
PATRA A, PARK T, KIM M, et al. Rumen methanogens and mitigation of methane emission by anti-methanogenic compounds and substances[J]. Journal of Animal Science and Biotechnology, 2017, 8: 13. DOI:10.1186/s40104-017-0145-9 |
| [10] |
WITZIG M, ZEDER M, RODEHUTSCORD M. Effect of the ionophoremonensin and tannin extracts supplemented to grass silage on populations of ruminal cellulolytics and methanogens in vitro[J]. Anaerobe, 2018, 50: 44-54. DOI:10.1016/j.anaerobe.2018.01.012 |
| [11] |
PUCHALA R, ANIMUT G, PATRA A K, et al. Methane emissions by goats consuming sericea lespedeza at different feeding frequencies[J]. Animal Feed Science and Technology, 2012, 175(1/2): 76-84. |
| [12] |
PARTHASARATHI T, CHANDRA A S, RAMANAD B V, et al. Effect of feeding tanniferous diets on methaneemissions in sheep[J]. The Pharma Innovation Journal, 2018, 7(4): 434-439. |
| [13] |
ERWIN E S, MARCOAND G J, EMERY E M. Vola tile fatty acid analysis of food and rumen fluid by gaschromatography[J]. Journal of Dairy Science, 1961, 44: 1768-1777. DOI:10.3168/jds.S0022-0302(61)89956-6 |
| [14] |
冯宗慈, 高民. 通过比色测定瘤胃液氨氮含量方法的改进[J]. 畜牧与饲料科学, 2010, 31(Z1): 37. FENG Z C, GAO M. Improvement of colorimetric method for determination of ammonia nitrogen in rumen fluid[J]. Animal Husbandry and Feed Science, 2010, 31(Z1): 37 (in Chinese). |
| [15] |
YU Y, LEE C, KIM J, et al. Group-specific primer and probe sets to detect methanogenic communities using quantitative real-time polymerase chain reaction[J]. Biotechnology and Bioengineering, 2005, 89(6): 670-679. DOI:10.1002/bit.20347 |
| [16] |
BOLYEN E, RIDEOUT J R, DILLON M R, et al. Authorcorrection: reproducible, interactive, scalable and extensible microbiome data science using QIIME 2[J]. Nature Biotechnology, 2019, 37(9): 1091. |
| [17] |
SAR C, SANTOSO B, MWENYA B, et al. Manipulation of rumen methanogenesis by the combination of nitrate with β1-4 galacto-oligosaccharides or nisin in sheep[J]. Animal Feed Science and Technology, 2004, 115(1/2): 129-142. |
| [18] |
彭婉婉, 马忠杰, 王彦, 等. 日粮中添加不同比例葡萄籽对多浪羊瘤胃真菌菌群结构的影响[J]. 塔里木大学学报, 2020, 32(4): 7-16. PENG W W, MA Z J, WANG Y, et al. Effects of supplements of different proportions grape seeds to diets on rumen fungi flora in Duolang sheep[J]. Journal of Tarim University, 2020, 32(4): 7-16 (in Chinese). DOI:10.3969/j.issn.1009-0568.2020.04.002 |
| [19] |
康婧鹏, 王文基, 郭亚敏, 等. 不同能量水平低氮饲粮对藏羊表观消化率、氮代谢和生长性能的影响[J]. 草业学报, 2018, 27(9): 166-174. KANG J P, WANG W J, GUO Y M, et al. Effects of different dietary energy levels on apparent digestibility, nitrogen metabolism and growth performance of Tibetan sheep under low nitrogen conditions[J]. ActaPrataculturae Sinica, 2018, 27(9): 166-174 (in Chinese). |
| [20] |
解湧芳, 朱寿谦, 王敬尧, 等. 饲粮中不同水平单宁对绵羊氮代谢及生长性能的影响[J]. 饲料研究, 2020, 43(11): 1-5. XIE Y F, ZHU S Q, WANG J Y, et al. Effect of different levels of tannin in diet on nitrogen metabolism and growth performance of sheep[J]. Feed Research, 2020, 43(11): 1-5 (in Chinese). |
| [21] |
PILUZZA G, SULAS L, BULLITTA S. Tannins in forage plants and their role in animal husbandry and environmental sustainability: a review[J]. Grass and Forage Science, 2014, 69(1): 32-48. DOI:10.1111/gfs.12053 |
| [22] |
高天爽. 不同比例的高粱日粮对羔羊生产性能及消化代谢的影响[D]. 硕士学位论文. 哈尔滨: 东北农业大学, 2014. GAO T S. Effects of different proportion of sorghum grain diets on performance and digestive metabolism lamb production[D]. Master's Thesis. Harbin: Northeast Agricultural University, 2014. (in Chinese) |
| [23] |
STANLEY C C, WILLIAMS C C, JENNY B F, et al. Effects of feeding milk replacer once versus twice daily on glucose metabolism in Holstein and Jersey calves[J]. Journal of Dairy Science, 2002, 85(9): 2335-2343. DOI:10.3168/jds.S0022-0302(02)74313-0 |
| [24] |
李林株. 饲喂不同分子量缩合单宁对延边黄牛血液生化指标及蛋白质消化吸收的影响[D]. 硕士学位论文. 延吉: 延边大学, 2014. LI L Z. Effect of feeding different molecular weight condensed tannin of the Yanbian cattle's serum biochemical and protein digestive absorption[D]. Master's Thesis. Yanji: Yanbian University, 2014. (in Chinese) |
| [25] |
熊忙利, 吴旭锦, 朱小甫, 等. 不同苹果渣水平对关中奶山羊泌乳性能、养分表观消化率、血清生化指标及瘤胃液pH值的影响[J]. 草业学报, 2021, 30(3): 81-88. XIONG G L, WU X J, ZHU X F, et al. Effects of different levels of apple pomace on lactation performance, apparent nutrient digestibility, serum biochemical indexes and pH value of rumen juice of Guanzhong dairy goats[J]. Journal of Prataculture, 2021, 30(3): 81-88 (in Chinese). |
| [26] |
王宁, 王建文, 孟军, 等. 间歇训练法对速步马血液生化指标影响的研究[J]. 新疆农业科学, 2014, 51(12): 2308-2314. WANG N, WANG J W, MENG J, et al. The effects of intermittent training on the serum biochemical indexes of the trot horse[J]. Xinjiang Agricultural Sciences, 2014, 51(12): 2308-2314 (in Chinese). |
| [27] |
MANAFI M, UMAKANTHA B, MOHAN K, et al. Synergistic effects of two commonly contaminating mycotoxins(aflatoxin and T-2 Toxin) on biochemical parameters and immune status of broiler chickens[J]. World Applied Sciences Journal, 2012, 17(3): 364-367. |
| [28] |
刘英娜, 张慧媛, 林嘉楠, 等. 单宁酸对脂多糖诱导小鼠肝损伤的保护作用及机制研究[J]. 人参研究, 2017, 29(6): 36-39. LIU Y N, ZHANG H Y, LIN J N, et al. Protective effect of tannic acid on lipopolysaccharide-induced liver damage in murine and its mechanism[J]. Ginseng Research, 2017, 29(6): 36-39 (in Chinese). |
| [29] |
BERRA G, FINSTER L, VALTORTA S E. Use of tannins to mitigate methane emission in grazing dairy cows[C]//Livestock Environment Ⅷ, Michigan: American Society of Agricultural and Biological Engineers, 2009.
|
| [30] |
王宇星, 刘大森. 能氮同步释放与饲喂频率对瘤胃微生物蛋白质合成的影响[J]. 中国畜牧杂志, 2012, 48(5): 46-49. WANG Y X, LIU D S. Effects of simultaneous release of energy and nitrogen and feeding frequency on rumen microbial protein synthesis[J]. Chinese Journal of Animal Science, 2012, 48(5): 46-49 (in Chinese). DOI:10.3969/j.issn.0258-7033.2012.05.012 |
| [31] |
熊颖. 板栗总苞多酚对肉牛瘤胃发酵、甲烷产量及微生物的影响[D]. 硕士学位论文. 北京: 北京农学院, 2016. XIONG Y. Effects of polyphenolic extract from involucres of Castaneamollissima Blumeon rumen fermentation, methane and microbial production[D]. Master's Thesis. Beijing: Beijing University of Agriculture, 2016. (in Chinese) |
| [32] |
吕忠蕾. 不同分子量缩合单宁对延边黄牛瘤胃发酵及微生物区系的影响[D]. 硕士学位论文. 延吉: 延边大学, 2014. LV Z L. Effects of different molecular weights of condensed tannins on ruminal fermentation and microflora to Yanbian yellow cattle[D]. Master's Thesis. Yanji: Yanbian University, 2014. (in Chinese) |
| [33] |
赵栋, 郑琛, 李发弟, 等. 葡萄渣单宁对绵羊养分消化代谢及瘤胃发酵的影响[J]. 草业学报, 2014, 23(4): 285-292. ZHAO D, ZHENG C, LI F D, et al. Effects of tannins from grape pomace on digestibility, metabolism and rumen fermentation in sheep[J]. Acta Prataculturae Sinica, 2014, 23(4): 285-292 (in Chinese). |
| [34] |
GROVERM. Role of gut pathogens in development of irritable bowel syndrome[J]. Indian Journal of Medical Research, 2014, 139(1): 11-18. |
| [35] |
邸凌峰. 饲用纤维素酶与单宁对肉用湖羊生产性能的影响[D]. 硕士学位论文. 延吉: 延边大学, 2018. DI L F. Effect of feeding with cellulase and tannins on the reproduceive ability of Hu sheep[D]. Master's Thesis. Yanji: Yanbian University, 2018. (in Chinese) |
| [36] |
DÍAZ CARRASCO J M, CABRAL C, REDONDO L M, et al. Impact of chestnut and quebracho tannins on rumen microbiota of bovines[J]. BioMed Research International, 2017, 2017: 9610810. |
| [37] |
TAJIMA K, NONAKA I, HIGUCHI K, et al. Influence of high temperature and humidity on rumen bacterial diversity in Holstein heifers[J]. Anaerobe, 2007, 13(2): 57-64. DOI:10.1016/j.anaerobe.2006.12.001 |
| [38] |
董春晓, 张金龙, 郭晓飞, 等. 单宁对反刍动物生产性能、瘤胃发酵及微生物区系影响的研究进展[J]. 畜牧兽医学报, 2020, 51(2): 234-242. DONG C X, ZHANG J L, GUO X F, et al. Research progress on the effects of tannins on ruminant production performance, rumen fermentation and microflora[J]. Journal of Animal Husbandry and Veterinary Medicine, 2020, 51(2): 234-242 (in Chinese). |
| [39] |
赵广永, 魏晨, 杨凯. 没食子酸对肉牛瘤胃发酵、营养物质消化及氮排放的影响[C]//中国畜牧兽医学会动物营养学分会第十二次动物营养学术研讨会论文集. 北京: 中国农业大学出版社有限公司, 2016: 517. ZHAO G Y, WEI C, YANG K. Effects of gallic acid on rumen fermentation, nutrient digestion and nitrogen emission of beef cattle[C]//Proceedings of the 12th Animal Nutrition Academic Seminar of Animal Nutrition Branch of China Animal Husbandry and Veterinary Society. Beijing: China Agricultural University Press Co. Ltd., 2016: 517. (in Chinese) |
| [40] |
王敬尧, 解湧芳, 丽丽, 等. 添加不同水平单宁酸对绵羊体外发酵参数和甲烷产量的影响[J]. 中国畜牧兽医, 2020, 47(5): 1428-1435. WANG J Y, XIE Y F, LI L, et al. Effects of adding different levels of tannic acid on rumen fermentation parameters and methane production of sheep in vitro method[J]. China Animal Husbandry & Veterinary Medicine, 2020, 47(5): 1428-1435 (in Chinese). |
| [41] |
王卫云. 不同水平的单宁对瘤胃主要纤维降解细菌纤维降解特性和细胞形态结构的影响[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2017. WANG W Y. Effects of different levels of tannins on cellulose degradation and morphology of major ruminal cellulolytic bacteria[D]. Master's Thesis. Hohhot: Inner Mongolia Agricultural University, 2017. (in Chinese) |




