2. 青海省高原放牧家畜营养与饲料科学重点实验室, 西宁 810016;
3. 青海省牦牛工程技术研究中心, 西宁 810016;
4. 中国农业大学动物科技学院, 北京 100193;
5. 国家肉牛牦牛产业技术体系中卫综合试验站, 中卫 755000
2. Key Laboratory of Plateau Grazing Animal Nutrition and Feed Science of Qinghai Province, Xining 810016, China;
3. Yak Engineering Technology Research Centre of Qinghai Province, Xining 810016, China;
4. Animal Science and Technology, China Agricultural University, Beijing 100193, China;
5. National Beef cattle and yak Industrial Technology System Zhongwei Comprehensive Experimental Station, Zhongwei 755000, China
牦牛是生活在青藏高原的特有畜种,是当地牧民重要的生产和生活资料[1]。目前,牦牛的饲养方式主要以放牧为主,由于青藏高原独特的地理环境,导致天然牧草存在季节性动态变化,尤其是在冷季,牧草产量和营养水平远不能满足牦牛正常的营养需要,导致牦牛出栏周期长、养殖效益低[2]。研究表明,全混合日粮(TMR)舍饲在一定程度上可提高肉牛的平均日增重、净肉率和屠宰率,改善瘤胃发酵,降低甲烷的排放[3-5],但是牦牛全混合日粮舍饲方面的研究报道较少。瘤胃是反刍动物消化饲粮的重要场所,其中含有大量的细菌、真菌、原生虫和古生菌等[6]。众所周知,饲粮组成和营养成分是影响瘤胃微生物的最重要因素[7]。田发益等[8]研究发现,放牧组彭波半细毛羊的瘤胃细菌多样性和丰富度较舍饲组显著提高,而拟杆菌门(Bacteroidetes)相对丰度显著降低。胡丹丹[9]研究表明,随着饲粮精粗比的提高,奶牛瘤胃中总挥发性脂肪酸(TVFA)浓度和降解淀粉和蔗糖等碳水化合物的相关菌属相对丰度也随之升高,但瘤胃pH和降解木质纤维素的相关菌群相对丰度随之降低。由此可见,不同的饲养方式会影响反刍动物瘤胃发酵及菌群结构组成,进而影响其生产性能。因此,本研究旨在通过16S rDNA高通量测序技术,研究不同饲养方式下牦牛瘤胃细菌结构的差异,为牦牛高效养殖提供理论依据。
1 材料与方法 1.1 试验动物与试验设计试验于2020年5—8月在青海省海晏县夏华牧场进行。选取3周岁、体重[(176.3±14.7) kg]相近、体况良好的公牦牛20头,随机分为2组(n=10):放牧组(放牧)、舍饲组(全混合日粮)。试验期100 d,其中预试期10 d,正试期90 d。
1.2 试验饲粮与饲养管理放牧组牦牛08:00出牧,18:00收牧。放牧草场主要包括高山嵩草、矮嵩草、紫花针茅、异针茅、芨芨草、珠芽蓼、苔草等。舍饲组牦牛全混合日粮参考《肉牛饲养标准》(NY/T 815—2004)[10]配制,06:00、17:00各饲喂1次,所有牦牛试验期自由采食与饮水。牧草营养水平和全混合日粮组成及营养水平见表 1。
|
|
表 1 牧草营养水平和全混合日粮组成及营养水平(干物质基础) Table 1 Nutrient levels of pasture and composition and nutrient levels of the total mixed ration (DM basis)% |
在正式试验第50天,观察试验放牧耗牛所吃的牧草,然后驱离试验牦牛,在牦牛吃草的地方用1 m×1 m样方框采集牧草10份,去除不可食牧草,保留可食牧草,放于105 ℃烘箱烘至质量恒定,粉碎过筛后进行牧草营养成分的测定。在正式试验第90天,晨饲前,采用胃管式采样器每头耗牛采集瘤胃液150 mL,4层纱布过滤后立即测定pH,剩余瘤胃液样品分装至15 mL离心管中,立即用液氮冷冻。
1.4 指标测定与方法 1.4.1 营养成分的测定粗蛋白质(CP)含量采用GB/T 6432—2018[11]的方法测定,粗脂肪(EE)含量采用GB/T 6433—2006[12]的方法测定,中性洗涤纤维(NDF)、酸性洗涤纤维(ADF)含量采用Van Soest等[13]的方法测定,钙(Ca)含量采用GB/T 6436—2002[14]的方法测定,磷(P)含量采用GB/T 6437—2002[15]的方法测定。
1.4.2 瘤胃发酵参数的测定采用台式酸度计(HI221型,意大利HANNA公司)测定瘤胃液pH;参照冯宗慈[16]的比色法测定瘤胃液中氨态氮(NH3-N)浓度,使用仪器为紫外可见分光光度计(TU-1810型,北京普析通用仪器有限公司),提前预热30 min,在波长625 nm处测定溶液吸光度(OD)值,并利用标准曲线计算样品的NH3-N浓度;参照Cotta等[17]差速离心法分离出发酵液中的微生物蛋白(MCP),采用考马斯亮蓝法测定MCP浓度;挥发性脂肪酸(VFA)浓度测定参考文献[18-19],使用仪器为气相色谱仪(GC-2014型,日本Shimadzu公司)。
1.4.3 瘤胃微生物菌群测定及数据分析瘤胃液样品送至北京奥维森基因科技有限公司测序,测序平台为Miseq PE 300,利用16S rRNA技术测定瘤胃微生物菌群多样性。从瘤胃液样品中提取DNA,用1.0%琼脂糖凝胶电泳评价DNA的质量。测序平台获得的原始测序数据采用Trimmomatic V0.36、Pear V0.9.6软件进行处理和质量过滤,利用Flash V1.20、Pear V0.9.6软件根据PE的overlap关系对两端序列进行拼接处理,得到Fasta序列,通过uchime比对去除Fasta序列的嵌合体,得到有效序列。对相似性大于97%的序列进行筛选,产生操作分类单元(OTU),并对OTU聚类、物种分类、多样性指数和群落结构进行统计分析。通过Spearman检验方法,选取瘤胃发酵参数和相对丰度前20的属进行相互关联性分析。利用PICRUSt软件进行瘤胃微生物的代谢途径的功能预测。
1.5 数据统计与分析试验数据使用SPSS 26.0软件进行统计分析和t检验,P < 0.05表示显著差异,P>0.05表示差异不显著,结果均以平均值和均值标准误(SEM)表示。
2 结果与分析 2.1 不同饲养方式对牦牛瘤胃发酵参数的影响由表 2可知,与放牧组对比,舍饲组瘤胃TVFA、乙酸、丙酸、丁酸浓度显著提高(P < 0.05),而瘤胃pH显著降低(P < 0.05)。
|
|
表 2 不同饲喂方式对牦牛瘤胃发酵参数的影响 Table 2 Effects of different feeding methods on rumen fermentation parameters of yaks |
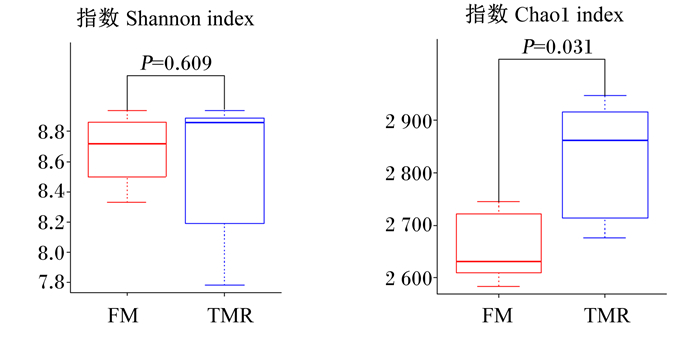
通过α多样性分析(表 3和图 1)可知,2组的微生物菌群丰富度存在差异,舍饲组Chao1指数显著高于放牧组(P < 0.05)。这表明舍饲增加了牦牛瘤胃微生物菌群的丰富度。
|
|
表 3 不同饲养方式对牦牛瘤胃微生物菌群α多样性的影响 Table 3 Effects of different feeding methods on rumen microbial flora α diversity of yaks |
|
FM:放牧组herding group;TMR:舍饲组barn feeding group。下图同the same as below. 多样性用Shannon指数估算,丰富度用Chao1指数估算。Diversity was estimated by Shannon index, and richness was estimated by Chao1 index. 图 1 放牧组和舍饲组的牦牛瘤胃微生物菌群多样性和丰富度 Fig. 1 Rumen microbial flora diversity and richness of yaks in herding group and barn feeding group |
在门水平上,鉴定出23种菌门,厚壁菌门(Firmicutes)和拟杆菌门分别占总数的51.98%和41.27%(图 2-A)。在门水平上(图 2-B),舍饲组牦牛瘤胃的Saccharibacteria、迷踪菌门(Elusimicrobia)、拟杆菌门、螺旋体门(Spirochaetae)、软壁菌门(Tenericutes)相对丰度显著高于放牧组(P < 0.05)。与此相反,放牧组牦牛瘤胃的浮霉菌门(Planctomycetes)、互养菌门(Synergistetes)和厚壁菌门相对丰度显著高于舍饲组(P < 0.05)。

|
A:Relative abundance:相对丰度;Firmicutes:厚壁菌门;Bacteroidetes:拟杆菌门;Actinobacteria:放线菌门;Proteobacteria:变形菌门;Tenericutes:软壁菌门;Other:其他。 B:95% confidence intervals:95%置信区间;Difference in mean proportions:平均比例差;Mean proportion:平均比例;Elusimicrobia:迷踪菌门;Planctomycetes:浮霉菌门;Bacteroidetes:拟杆菌门;Synergistetes:互养菌门;Firmicutes:厚壁菌门;Spirochaetae:螺旋体门;Tenericutes:软壁菌门。 图 2 放牧组和舍饲组的牦牛瘤胃微生物菌群组成的分类(门水平) Fig. 2 Classification of rumen microbial flora composition of yaks in herding group and barn feeding group (phylum level) |
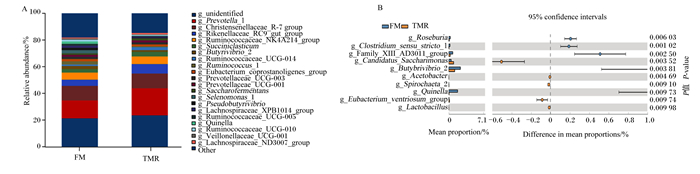
在属水平上,共鉴定出226种菌属,优势属为未确认属(unidentified)(22.38%)、普雷沃菌属_1(Prevotella_1)(16.89%)、克里斯滕森菌科_R-7(Christensenellaceae_R-7)(10.96%)、理研菌科_RC9(Rikenellaceae_RC9)(5.89%)、瘤胃球菌科_NK4A214(Ruminococcaceae_NK4A214)(5.55%)、解琥珀酸菌属(Succiniclasticum)(2.99%)、丁酸弧菌属_2(Butyrivibrio_2)(1.80%)、瘤胃球菌科_UCG-014(Ruminococcaceae_UCG-014)(1.68%)、瘤胃球菌属_1(Ruminococcus_1)(1.57%)和产粪甾醇真细菌(Eubacterium_coprostanoligenes)(1.57%)(图 3-A)。在属水平上(图 3-B),舍饲组牦牛瘤胃的Candidatus_Saccharimonas、醋酸杆菌属(Acetobacter)、螺旋体属_2(Spirochaeta_2)、凸腹真杆菌属(Eubacterium_ventriosum_group)和乳酸杆菌属(Lactobacillus)相对丰度显著高于放牧组(P < 0.05)。与此相反,放牧组牦牛瘤胃的罗斯氏菌属(Roseburia)、狭义梭菌属(Clostridium_sensu_stricto_1)、Family-ⅩⅢ-AD3011、丁酸弧菌属_2和奎因氏菌属(Quinella)相对丰度均显著高于舍饲组(P < 0.05)。
|
A:Relative abundance:相对丰度;unidentified:未确认属;Prevotella_1:普雷沃菌属_1;Christensenellaceae_R-7:克里斯滕森菌科_R-7;Rikenellaceae_RC9:理研菌科_RC9;Ruminococcaceae_NK4A214:瘤胃球菌科_NK4A214;Succiniclasticum:解琥珀酸菌属;Butyrivibrio_2:丁酸弧菌属_2;Ruminococcaceae_UCG-014:瘤胃球菌科_UCG-014;Ruminococcus_1:瘤胃球菌属_1;Eubacterium_coprostanoligenes:产粪甾醇真细菌;Prevotellaceae_UCG-003:普雷沃菌科_UCG-003;Prevotellaceae_UCG-001:普雷沃菌科_UCG-001;Saccharofermentans:产乙酸糖发酵菌属;Selenomonas_1:月形单胞菌属;Pseudobutyrivibrio:假丁酸弧菌;Lachnospiraceae_XPB1014:毛螺菌科_XPB1014;Ruminococcaceae_UCG-005:瘤胃球菌科_UCG-005;Ruminococcaceae_UCG-010:瘤胃球菌科_UCG-010;Veillonellaceae_UCG-001:韦荣氏菌科_UCG-001;Lachnospiraceae_ND3007:毛螺菌科_ND3007;Other:其他。 B:95% confidence intervals:95%置信区间;Difference in mean proportions:平均比例差;Mean proportion:平均比例;Roseburia:罗斯氏菌属;Clostridium_sensu_stricto_1:狭义梭菌属;Butybrivibrio_2:丁酸弧菌属_2;Acetobacter:醋酸杆菌属;Spirochaeta_2:螺旋体属_2;Eubacterium_ventriosum_group:凸腹真杆菌属;Quinella:奎氏菌属;Lactobacillus:乳酸杆菌属。 图 3 放牧组和舍饲组的牦牛瘤胃微生物菌群组成的分类(属水平) Fig. 3 Classification of rumen microbial flora composition of yaks in herding group and barn feeding group (genus level) |
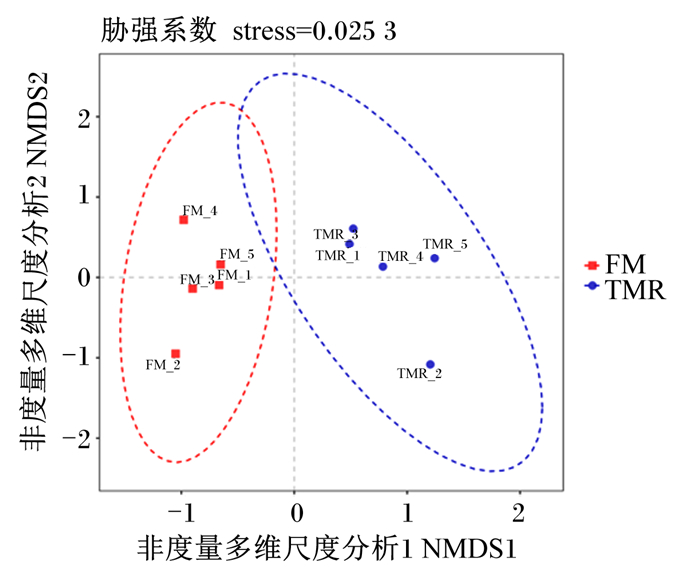
使用加权UniFrac基质距离的主坐标分析(PCoA)来揭示2种不同饲养方式对瘤胃细菌菌落的影响,结果发现细菌菌落按不同饲养方式聚类(图 4)。
|
图 4 牦牛瘤胃微生物菌群的主坐标分析 Fig. 4 PCoA of rumen microbial flora of yaks |
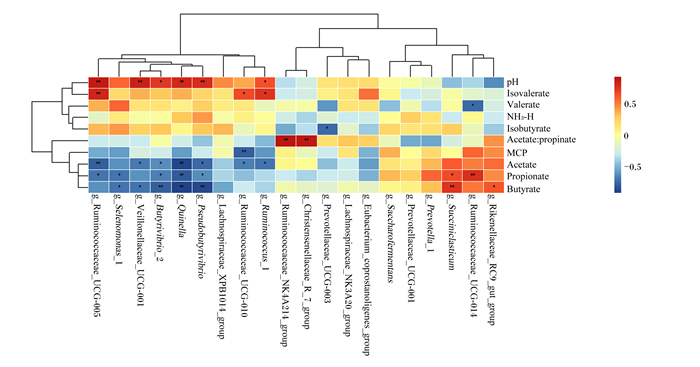
根据Spearman的相关系数,对瘤胃发酵参数与瘤胃微生物菌群进行了关联性分析(图 5)。异戊酸、戊酸、异丁酸、乙酸、丙酸、丁酸、MCP浓度和乙酸/丙酸、pH与瘤胃微生物菌群之间的相关性显著(P < 0.05),而NH3-N浓度与瘤胃微生物菌群之间的相关性不显著(P>0.05)。其中,瘤胃球菌科_UCG_014(Ruminococcaceae_UCG_014)相对丰度与戊酸浓度呈显著负相关(P < 0.05),普雷沃氏菌科_UCG_003(Prevotellaceae_UCG_003)相对丰度与异丁酸浓度呈显著负相关(P < 0.05),瘤胃球菌属_1相对丰度与乙酸浓度呈显著负相关(P < 0.05),瘤胃球菌科_UCG_010(Ruminococcaceae_UCG_010)相对丰度与乙酸和MCP浓度呈显著负相关(P < 0.05),假丁酸菌属(Pseudobutyrivibrio)、奎氏菌属(Quinella)和丁酸弧菌属_2相对丰度与乙酸、丙酸和丁酸浓度呈显著负相关(P < 0.05),韦荣氏球菌科_UCG_001(Veillonellaceae_UCG_001)相对丰度与乙酸和丁酸浓度呈显著负相关(P < 0.05),月形单胞菌_1(Selenomonas_1)相对丰度与丙酸和丁酸浓度呈显著负相关(P < 0.05),瘤胃球菌科_UCG_005(Ruminococcaceae_UCG_005)相对丰度与乙酸和丙酸浓度呈显著负相关(P < 0.05);理研菌科_RC9相对丰度与乙酸浓度呈显著正相关(P < 0.05),瘤胃球菌科_UCG_014相对丰度与丙酸浓度呈显著正相关(P < 0.05),解琥珀酸菌属相对丰度与丙酸和丁酸浓度呈显著正相关(P < 0.05),克里斯滕森菌科_R_7(Christensenellaceae_R_7)和瘤胃球菌科_UCG_NK4A214(Ruminococcaceae_UCG_NK4A214)相对丰度与乙酸/丙酸呈显著正相关(P < 0.05),瘤胃球菌属_1、瘤胃球菌科_UCG_010和瘤胃球菌科_UCG_005相对丰度与异戊酸浓度呈显著正相关(P < 0.05),瘤胃球菌属_1、假丁酸菌属、奎因氏菌属、丁酸弧菌属_2、韦荣氏球菌科_UCG_001和瘤胃球菌科_UCG_005相对丰度与pH呈显著正相关(P < 0.05)。
|
Isovalerate:异戊酸;Valerate:戊酸;NH3-H:氨态氮;Isobutyrate:异丁酸;Acetate: propinate:乙酸/丙酸;MCP:微生物蛋白;Acetate:乙酸;Propionate:丙酸;Butyrate:丁酸;Rikenellaceae_RC9:理研菌科_RC9;Ruminococcaceae_UCG_014:瘤胃球菌科_UCG_014;Succiniclasticum:解琥珀酸菌属;Prevotella_1:普雷沃菌属_1;Prevotellaceae_UCG-001:普雷沃菌科_UCG-001;Saccharofermentans:产乙酸糖发酵菌属;Lachnospiraceae_NK3A20:毛螺菌科_NK3A20;Prevotellaceae_UCG-003:普雷沃菌科_UCG-003;Christensenellaceae_R_7:克里斯滕森菌科_R_7;Ruminococcaceae_UCG_NK4A214:瘤胃球菌科_UCG_NK4A214;Ruminococcus_1:瘤胃球菌属_1;Ruminococcaceae_UCG_010:瘤胃球菌科_UCG_010;Lachnospiraceae_XPB1014:毛螺菌科_XPB1014;Pseudobutyrivibrio:假丁酸菌属;Quinella:奎氏菌属;Butyrivibrio_2:丁酸弧菌属;Veillonellaceae_UCG_001:韦荣氏球菌科_UCG_001;Selenomonas_1:月形单胞菌_1;Ruminococcaceae_UCG_005:瘤胃球菌科_UCG_005。 红色表示正相关,而蓝色表示负相关。*表示放牧组和舍饲组之间存在显著相关性(P < 0.05)。 Red mean positive correlation, while blue mean negative correlation. * mean significant correlation between herding group and barn feeding group (P < 0.05). 图 5 瘤胃发酵参数与瘤胃微生物菌群的相关性 Fig. 5 Correlation between rumen fermentation parameters and rumen microbial flora |
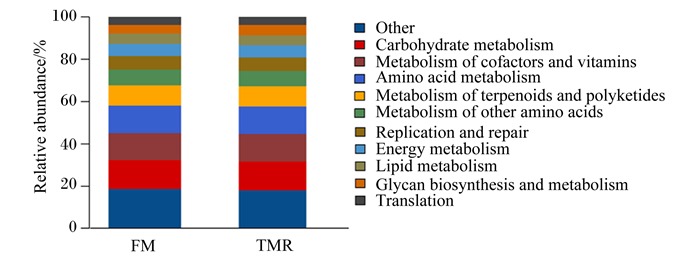
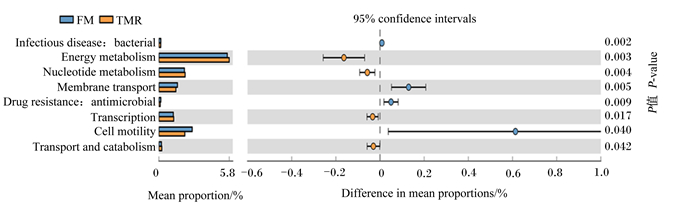
用PICR USt预测瘤胃微生物菌群的代谢功能。在KEGG2水平,所有的瘤胃样本中最丰富(相对丰度>0.10%)的有24个基因家族。属于碳水化合物代谢(carbohydrate metabolism)、辅因子和维生素代谢(metabolism of cofactors and vitamins)、氨基酸代谢(amino acid metabolism)、萜类和多酮类代谢(metabolism of terpenoids and polyketides)、其他氨基酸代谢(metabolism of other amino acids)、复制和修复(replication and repair)、能量代谢(energy metabolism)、脂类代谢(lipid metabolism)、聚糖生物合成与代谢(glycan biosynthesis and metabolism)和翻译(translation)的基因家族在2组中相对丰度最高(图 6)。在这些基因家族中,舍饲组能量代谢、核苷酸代谢(nucleotide metabolism)、转录(transcription)、运输和分解代谢(transport and catabolism)的基因家族相对丰度显著高于放牧组(P < 0.05),舍饲组细菌传染病(infectious disease:bacterial)、膜转运(membrane transport)、抗菌剂耐药性(drug resistance:antimicrobial)和细胞运动(cell motility)的基因家族相对丰度显著低于放牧组(P < 0.05)(图 7)。
|
Relative abundance:相对丰度;Other:其他;Carbohydrate metabolism:碳水化合物代谢;Metabolism of cofactors and vitamins:辅因子和维生素代谢;Amino acid metabolism:氨基酸代谢;Metabolism of terpenoids and polyketides:萜类和多酮类代谢;Metabolism of other amino acids:其他氨基酸代谢;Replication and repair:复制和修复;Energy metabolism:能量代谢;Lipid metabolism:脂类代谢;Glycan biosynthesis and metabolism:聚糖生物合成与代谢;Translation:翻译。 图 6 KEGG2水平注释的大部分基因序列 Fig. 6 Majority gene sequences annotated to KEGG2 level |
|
95% confidence intervals:95%置信区间;Difference in mean proportions:平均比例差;Mean proportion:平均比例;Infectious disease:bacterial:细菌传染病;Energy metabolism:能量代谢;Nucleotide metabolism:核苷酸代谢;Membrane transport:膜转运;Drug resistance:antimicrobial:抗菌剂耐药性;Transcription:转录;Cell motility:细胞运动;Transport and catabolism:运输和分解代谢。 图 7 KEGG2水平有显著差异的瘤胃微生物菌群相对丰度图 Fig. 7 Relative abundance maps of rumen microbial flora with significant differences at KEGG2 level |
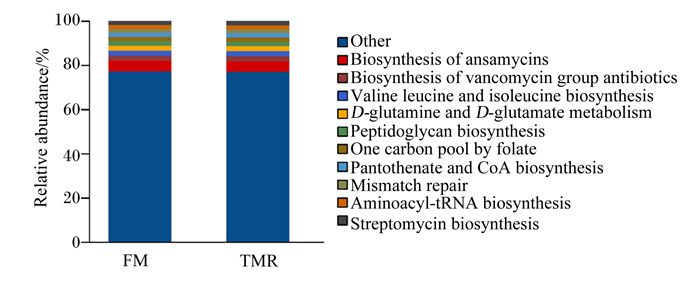
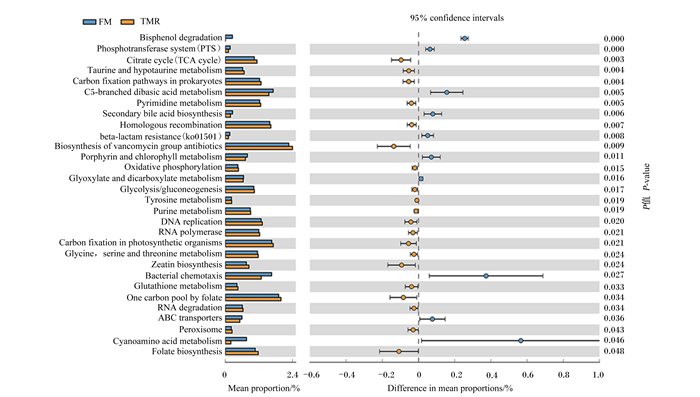
在KEGG3水平,有106条最丰富的途径。在这些途径中,安沙霉素的生物合成(biosynthesis of ansamycins),万古霉素类抗生素的生物合成(biosynthesis of vancomycin group antibiotics),缬氨酸、亮氨酸、异亮氨酸生物合成(valine leucine and isoleucine biosynthesis),D-谷氨酰胺和D-谷氨酸代谢(D-glutamine and D-glutamate metabolism),肽聚糖生物合成(peptidoglycan biosynthesis),叶酸一碳库(one carbon pool by folate),泛酸和辅酶A生物合成(pantothenate and CoA biosynthesis),配错基因修复(mismatch repair),胺酰tRNA生物合成(aminoacyl-tRNA biosynthesis)和链霉素生物合成(streptomycin biosynthesis)具有高度代表性(图 8)。30种途径的相对丰度显示出2组之间的显著差异(图 9)。舍饲组三羧酸循环[citrate cycle(TCA cycle)]、牛磺酸和亚牛磺酸代谢(taurine and hypotaurine metabolism)、原核生物的碳固定途径(carbon fixation pathways in prokaryotes)、嘧啶代谢(pyrimidine metabolism)、同源重组(homologous recombination)、万古霉素类抗生素的生物合成、氧化磷酸化(oxidative phosphorylation)、糖酵解/糖异生(glycolysis/gluconeogenesis)、酪氨酸代谢(tyrosine metabolism)、嘌呤代谢(purine metabolism)、DNA复制(DNA replication)途径的相对丰度显著高于放牧组(P < 0.05)。舍饲组双酚降解(bisphenol degradation)、磷酸转移酶系统[phosphotransferase system (PTS)]、C5-支链二元酸代谢(C5-branched dibasic acid metabolism)、次级胆汁酸生物合成(secondary bile acid biosynthesis)、β内酰胺抗药性[beta-lactam resistance (ko01501)]、卟啉与叶绿素代谢(porphyrin and chlorophyll metabolism)和二羧酸代谢(glyoxylate and dicarboxylate metabolism)途径的相对丰度显著低于放牧组(P < 0.05)。
|
Relative abundance:相对丰度;Other:其他;Biosynthesis of ansamycins:安沙霉素的生物合成;Biosynthesis of vancomycin group antibiotics:万古霉素类抗生素的生物合成;Valine leucine and isoleucine biosynthesis:缬氨酸、亮氨酸、异亮氨酸生物合成;D-glutamine and D-glutamate metabolism:D-谷氨酰胺和D-谷氨酸代谢;Peptidoglycan biosynthesis:肽聚糖生物合成;One carbon pool by folate:叶酸一碳库;Pantothenate and CoA biosynthesis:泛酸和辅酶A生物合成;Mismatch repair:配错基因修复;Aminoacyl-tRNA biosynthesis:胺酰tRNA生物合成;Streptomycin biosynthesis:链霉素生物合成。 图 8 KEGG3水平注释的大部分基因序列 Fig. 8 Majority gene sequences annotated to KEGG3 level |
|
95% confidence intervals:95%置信区间;Difference in mean proportions:平均比例差;Mean proportion:平均比例;P-value:P值;Bisphenol degradation:双酚降解;Phosphotransferase system(PTS):磷酸转移酶系统;Citrate cycle(TCA cycle):三羧酸循环;Taurine and hypotaurine metabolism:牛磺酸和亚牛磺酸代谢;Carbon fixation pathways in prokaryotes:原核生物的碳固定途径;C5-branched dibasic acid metabolism:C5-支链二元酸代谢;Pyrimidine metabolism:嘧啶代谢;Secondary bile acid biosynthesis:次级胆汁酸生物合成;Homologous recombination:同源重组;beta-lactam resistance(ko01501):β内酰胺抗药性;Biosynthesis of vancomycin group antibiotics:万古霉素类抗生素的生物合成;Porphyrin and chlorophyll metabolism:卟啉与叶绿素代谢;Oxidative phosphorylation:氧化磷酸化;Glyoxylate and dicarboxylate metabolism:二羧酸代谢;Glycolysis/gluconeogenesis:糖酵解/糖异生;Tyrosine metabolism:酪氨酸代谢;Purine metabolism:嘌呤代谢;DNA replication:DNA复制;RNA polymerase:RNA聚合酶;Carbon fixation in photosynthetic organisms:光合生物的固碳作用;Glycine,serine and threonine metabolism:甘氨酸,丝氨酸和苏氨酸代谢;Zeatin biosynthesis:玉米素生物合成;Bacterial chemotaxis:细菌趋化性;Glutathione metabolism:谷胱甘肽代谢;One carbon pool by folate:叶酸一碳库;RNA degradation:RNA降解;ABC transporters:ABC转运蛋白;Peroxisome:过氧化物酶体;Cyanoamino acid metabolism:氨基酸代谢;Folate biosynthesis:叶酸合成。 图 9 KEGG3水平有显著差异的瘤胃微生物菌群相对丰度图 Fig. 9 Relative abundance maps of rumen microbial flora with significant differences at KEGG3 level |
瘤胃是反刍动物特有的消化器官,对反刍动物来说稳定的瘤胃内环境尤为重要。pH和VFA是衡量瘤胃内环境稳定和反映瘤胃发酵状况的重要指标[20]。pH是直接反映瘤胃发酵水平最基础的指标[21]。张永胜等[22]研究发现,与放牧补饲相比,舍饲育肥显著提高了绒山羊羔羊瘤胃MCP和NH3-N浓度,有降低pH的趋势。本研究结果表明:舍饲组的瘤胃MCP和NH3-N浓度与放牧组差异不显著,但舍饲组在数值上有所增加,舍饲组的瘤胃pH显著低于放牧组。本试验在全混合日粮的饲喂方式下,瘤胃NH3-N和MCP浓度较高,说明全混合日粮的饲喂方式可以提高瘤胃MCP的合成,但舍饲组的瘤胃pH显著低于放牧组,可能是由于在舍饲的条件下,牦牛摄入的非结构性碳水化合物增加,在瘤胃中迅速发酵,产生大量的VFA和乳酸等物质,而导致pH的下降。
VFA是反刍动物瘤胃饲粮中碳水化合物和蛋白质的最终产物,为机体提供了70%~80%的能量[23]。瘤胃中的乙酸、丙酸和丁酸是VFA的主要组成部分[24]。乙酸有利于动物体脂率的提高,丙酸能提高葡萄糖的转化和贮存,丁酸为机体各组织提供能量[25]。本试验条件下,舍饲组的瘤胃TVFA、乙酸、丙酸、丁酸浓度显著高于放牧组,这与孙国平等[26]研究结果基本一致,说明在舍饲的条件下饲粮营养水平均衡,使瘤胃TVFA浓度升高。在全混合日粮的饲喂方式下可以提高瘤胃乙酸、丙酸和丁酸浓度,乙酸浓度的增加会使分解纤维素菌活性增加;丙酸浓度的增加会提高瘤胃上皮对VFA的吸收率,进而提高饲粮营养物质消化率[27];乙酸、丙酸和丁酸浓度的增加使瘤胃TVFA浓度增加,促进饲料中纤维素物质的降解,从而提高营养物质的消化率,有利于牦牛的育肥。
3.2 不同饲养方式对牦牛瘤胃微生物菌群丰富度与多样性的影响16S rDNA高通量测序技术可以快速、全面了解不同饲养方式对牦牛瘤胃微生物菌群的影响。微生物多样性是衡量微生物菌群丰富度和均匀度的综合指标,主要包括的指标有Chao1指数和Shannon指数。Chao1指数衡量菌群的丰富度,Chao1指数越高,表示样本中的菌群丰富度越大。Shannon指数衡量菌群的多样性,Shannon指数越高,表示样本中的菌群多样性越高[28]。张振宇等[29]研究发现,随着饲粮能量水平的增加,Chao1指数显著降低,Shannon指数无显著差异,这说明不同的饲粮能量水平会影响牦牛瘤胃微生物菌群,并且饲粮能量水平的增加会降低瘤胃微生物菌群的丰富度,但Shannon指数变化不显著,说明在2种饲养方式下设计的饲粮能量水平的差异没有影响牦牛瘤胃微生物菌群的多样性。本试验中,与放牧组相比,舍饲组牦牛瘤胃微生物菌群Chao1指数显著升高,Shannon指数无显著差异,表明舍饲牦牛的瘤胃微生物菌群丰富度高于放牧牦牛,这与上述研究结果基本一致。
3.3 不同饲养方式对牦牛瘤胃微生物菌群组成的影响饲料的结构是影响反刍动物瘤胃微生物菌群发生变化的首要因素[30]。饲料的类型也会影响瘤胃微生物菌群的结构和多样性[31]。大量对反刍动物的研究表明,厚壁菌门和拟杆菌门是反刍动物瘤胃微生物的优势菌门[32-33],其次是变形菌门,还有少量的软壁菌门和螺旋体菌门等[34]。厚壁菌门主要参与纤维物质的分解;而拟杆菌门主要参与非纤维物质的降解[35-36],对反刍动物的营养代谢非常重要。本研究结果表明,舍饲组和放牧组牦牛瘤胃的厚壁菌门和拟杆菌门相对丰度分别占整个菌门的51.98%和41.27%,与以上研究结果一致。曹连宾等[37]研究表明,舍饲牦牛瘤胃的拟杆菌门相对丰度所占的比例比放牧牦牛要高,舍饲牦牛瘤胃的厚壁菌门相对丰度所占比例比放牧牦牛瘤胃要低。本试验中,舍饲组牦牛瘤胃的拟杆菌门相对丰度显著高于放牧组,而厚壁菌门相对丰度显著低于放牧组,与以上研究结果相一致,说明在全混合日粮的饲喂方式下有利于提高与非纤维物质降解有关的细菌数量。黎凌铄等[38]研究表明,小肽和酵母培养物的添加提高了螺旋体门、纤维杆菌门和Saccharibacteria相对丰度,与本研究结果相似。本研究结果表明,舍饲组牦牛瘤胃的Saccharibacteria相对丰度显著高于放牧组。浮霉菌门是严格厌氧的革兰氏阴性菌,有研究者在研究黄粉虫降解肠道塑料废物的能力时发现,黄粉虫的肠道浮霉菌门可以降解燕麦等纤维饲料,在喂食聚苯乙烯后浮霉菌门的摄食频率增加[39]。李娟等[40]研究表明,与放牧组相比,舍饲组牦牛瘤胃的拟杆菌门、软壁菌门和浮霉菌门相对丰度均增加,与本研究结果相一致。本试验中,舍饲组牦牛瘤胃的拟杆菌门和软壁菌门相对丰度均显著高于放牧组,但浮霉菌门相对丰度显著低于放牧组,原因可能是由于放牧环境及饲粮组成的不同而产生差异。研究表明,螺旋体门能有效降解纤维素、果胶和磷酸盐,发酵形成VFA,为反刍动物机体提供能量[41]。王柏辉[42]研究表明,舍饲组苏尼特羊瘤胃的螺旋体门相对丰度显著高于放牧组,互养菌门相对丰度显著低于放牧组。本试验中,舍饲组牦牛瘤胃的螺旋体门相对丰度显著高于放牧组,舍饲组的互养菌门相对丰度显著低于放牧组,这与以上研究结果相一致,这可能是因为在全混合日粮的饲喂方式下调节了牦牛瘤胃菌群,既提高了牦牛瘤胃对纤维素的降解率,又调控了瘤胃菌落结构的合理性。螺旋体门相对丰度的升高有利于降解纤维素,提高牦牛对饲料的消化吸收,从可发酵的碳水化合物中合成VFA,进而为牦牛提供能量。
在属水平上,本试验中的unidentified、普雷沃菌属_1和克里斯滕森菌科_R-7是瘤胃内的优势菌属。普雷沃菌属是反刍动物瘤胃和胃肠道的一种蛋白质降解菌,主要降解饲粮中的半纤维成分,并且普雷沃菌属可产生大量复合酶,促进非纤维性多糖和果胶的降解[43]。王祖艳等[44]研究表明,奶牛瘤胃菌群属水平的普雷沃菌属是主要优势菌属。陈凯等[45]研究也发现,在肉牛瘤胃细菌区系中普雷沃氏菌属和解琥珀酸菌属是已知分类菌属的优势菌属。本试验中,舍饲组牦牛瘤胃的普雷沃菌属_1相对丰度比放牧组高,但差异不显著,这与Bekele等[46]研究结果一致,说明在全混合日粮的饲喂方式下能提高普雷沃菌属的数量,提高半纤维素被分解的效率。克里斯滕森菌科和毛螺旋菌属都属于梭菌纲的梭菌目,这些菌群中的大多数能够在宿主肠道内发酵未被吸收的多糖,产生短链脂肪酸(SCFAs),如乙酸、丙酸和丁酸[47]。在本研究中,舍饲组牦牛瘤胃的克里斯滕森菌科_R-7相对丰度比放牧组高,同时舍饲组牦牛瘤胃乙酸浓度显著高于放牧组,与李岚捷等[48]的研究结果相一致。醋酸杆菌属主发酵产物为乙酸[49];螺旋体属是严格发酵碳水化合物的微生物,其代谢与梭状芽孢菌属相似,它通过糖酵解途径发酵葡萄糖,产生乙酸、乙醇、二氧化碳和氢气作为主要终产物[50]。乳酸杆菌属可发酵糖产生大量乳酸[51],乳酸越多,糖酵解的能量供应能力越强。本试验中,舍饲组牦牛瘤胃的醋酸杆菌属、螺旋体属_2和乳酸杆菌属相对丰度显著高于放牧组,结果表明,全混合日粮的饲喂方式下有利于提高牦牛瘤胃中纤维降解菌属相对丰度,并且提高乙酸和乳酸浓度,促进瘤胃发酵,提高牦牛的生长发育。
3.4 不同饲养方式对瘤胃发酵参数与瘤胃微生物的相关性研究通过瘤胃发酵参数与瘤胃微生物的相关性分析发现,乙酸、丙酸和丁酸浓度与瘤胃球菌属_1、瘤胃球菌科_UCG_010、假丁酸菌属、奎氏菌属、丁酸弧菌属_2、韦荣氏球菌科_UCG_001、硒单胞菌、瘤胃球菌科_UCG_005、理研菌科_RC9、瘤胃球菌科_UCG_014、解琥珀酸菌属和瘤胃球菌科_UCG_NK4A214相对丰度密切相关。瘤胃球菌属是瘤胃中重要的纤维降解菌,主要发酵产物为乙酸[52],在瘤胃内对降解纤维素的产生起着关键作用,其中瘤胃球菌属_1、瘤胃球菌科_UCG_010和瘤胃球菌科_UCG_005相对丰度与乙酸浓度呈负相关,这与张林[53]的研究结果相一致。在不同的饲喂方式下,饲料来源不同,特别是全混合日粮,饲粮营养水平均衡,这就导致放牧牦牛和舍饲牦牛的饲粮营养水平存在差异,营养物质的变化导致瘤胃内微生物菌群的结构变化,进而微生物代谢产物也发生相应的变化[54]。由此可见,牦牛在不同饲养方式下产生的VFA与瘤胃微生物菌群有相同之处,也有不同之处,说明这些瘤胃微生物之间可能存在一定的协同调控作用,进而维持瘤胃内环境的稳定。
3.5 不同饲养方式对瘤胃微生物菌群代谢途径及功能的预测利用PICRUSt预测瘤胃微生物菌群的代谢功能,在KEGG2水平检测到预测功能的相对丰度,其中,碳水化合物代谢是与代谢相关的最丰富的途径,其次是辅助因子和维生素代谢、氨基酸代谢、萜类和聚酮类代谢、其他氨基酸代谢、复制和修复、能量代谢、类脂物代谢作用、聚糖生物合成与代谢和翻译,这些对动物胃肠道微生物群落的生存、生长和繁殖至关重要[55]。碳水化合物是反刍动物的主要能量来源[56],能量是饲料的重要组成部分,它能确定动物的饲料摄入量[57],并且在维持动物的生长及新陈代谢中起着重要的作用。因此,动物的碳水化合物代谢和能量代谢对动物机体生长尤为重要。本试验结果表明,舍饲组能量代谢、核苷酸代谢、转录、运输和分解代谢的相对丰度显著高于放牧组,说明在全混合日粮的饲喂方式下有助于牦牛能量代谢通路的上调。在KEGG3水平,安沙霉素的生物合成相对丰度最高,在舍饲组中,负责糖酵解/糖异生的基因上调,这表明瘤胃微生物菌群的发酵速率提高。目前的研究表明,不同的饲养方式会改变瘤胃微生物的组成和推测的微生物功能,在全混合日粮的饲喂方式下的瘤胃微生物菌群模式可能会提高牦牛的高效代谢,进而有效地促进牦牛的生长。
4 结论与放牧相比,全混合日粮舍饲育肥提高了牦牛瘤胃VFA、MCP和NH3-N浓度,增加了关于非纤维物质的降解菌以及半纤维降解菌属的相关丰度,促进牦牛的高效代谢,有助于牦牛的生长发育。
| [1] |
LONG R J, DING L M, SHANG Z H, et al. The yak grazing system on the Qinghai-Tibetan plateau and its status[J]. The Rangeland Journal, 2008, 30(2): 241-246. DOI:10.1071/RJ08012 |
| [2] |
REN Q M, SI H Z, YAN X T, et al. Bacterial communities in the solid, liquid, dorsal, and ventral epithelium fractions of yak (Bos grunniens) rumen[J]. Microbiology Open, 2020, 9(2): e963. |
| [3] |
陈前岭, 王梦芝, 喻礼怀, 等. 生长期不同品种牛饲喂颗粒化TMR日粮生长性能的比较[J]. 饲料工业, 2013, 34(24): 37-41. CHEN Q L, WANG M Z, YU L H, et al. Comparison on the growth performance of pellet TMR between different species of growing cattle[J]. Feed Industry, 2013, 34(24): 37-41 (in Chinese). |
| [4] |
罗晓瑜, 陈志强, 何立荣, 等. 全混合日粮营养水平对肉牛育肥效果的影响[J]. 饲料工业, 2011, 32(17): 49-53. LUO X Y, CHEN Z Q, HE L R, et al. Influence of nutrition level of TMR on fattening effect for beef cattle[J]. Feed Industry, 2011, 32(17): 49-53 (in Chinese). DOI:10.3969/j.issn.1001-991X.2011.17.010 |
| [5] |
高爱琴, 王聪, 刘强, 等. 不同饲喂方式对肉牛瘤胃发酵、血液指标和甲烷排放的影响[J]. 饲料博览, 2013(4): 1-4. GAO A Q, WANG C, LIU Q, et al. Effects of feeding patterns on ruminal fermentation, blood parameters and methane emissions in Simmental beef cattle[J]. Feed Review, 2013(4): 1-4 (in Chinese). DOI:10.3969/j.issn.1001-0084.2013.04.001 |
| [6] |
QIU Q H, GAO C Y, AZIZ UR RAHMAN M, et al. Digestive ability, physiological characteristics, and rumen bacterial community of Holstein finishing steers in response to three nutrient density diets as fattening phases advanced[J]. Microorganisms, 2020, 8(3): 335. DOI:10.3390/microorganisms8030335 |
| [7] |
YÁÑEZ-RUIZ D R, ABECIA L, NEWBOLD C J. Manipulating rumen microbiome and fermentation through interventions during early life: a review[J]. Frontiers in Microbiology, 2015, 6: 1133. |
| [8] |
田发益, 武俊喜. 放牧与舍饲对彭波半细毛羊瘤胃细菌群落的生物学信息影响[J]. 畜牧兽医学报, 2019, 50(11): 2252-2263. TIAN F Y, WU J X. Effects of grazing and barn feeding on biological information of rumen bacterial communities in Pengbo semi-fine wool sheep[J]. Acta Veterinaria et Zootechnica Sinica, 2019, 50(11): 2252-2263 (in Chinese). DOI:10.11843/j.issn.0366-6964.2019.11.009 |
| [9] |
胡丹丹. 不同精粗比日粮下奶牛瘤胃发酵与菌群结构及血清生化指标变化的研究[D]. 硕士学位论文. 银川: 宁夏大学, 2019. HU D D. Study the changes of rumen fermentation, flora structure and serum biochemical parameters on dairy cows with different ratios of concentrate and roughage[D]. Master's Thesis. Yinchuan: Ningxia University, 2019. (in Chinese) |
| [10] |
中华人民共和国农业部. 肉牛饲养标准NY/T 815—2004[S]北京: 中国标准出版社, 2004. Ministry of Agriculture of the People's Republic of China. Feeding standard of beef cattle NY/T 815—2004[S]. Beijing: China Standards Press, 2004. (in Chinese) |
| [11] |
国家市场监督管理总局, 中国国家标准化管理委员会. 饲料中粗蛋白的测定凯氏定氮法GB/T 6432—2018[S]北京: 中国标准出版社, 2018. State Administration for Market Regulation. Standardization Administration of China. Determination of crude protein in feeds—Kjeldahl method GB/T 6432—2018[S]. Beijing: China Standards Press, 2018. (in Chinese) |
| [12] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 饲料中粗脂肪的测定GB/T 6433—2006[S]北京: 中国标准出版社, 2006. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. Standardization Administration of China. Determination of crude fat in feeds GB/T 6433—2006[S]. Beijing: China Standards Press, 2018. (in Chinese) |
| [13] |
VAN SOEST P J, ROBERTSON J B, LEWIS B A. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition[J]. Journal of Dairy Science, 1991, 74(10): 3583-3597. DOI:10.3168/jds.S0022-0302(91)78551-2 |
| [14] |
中华人民共和国国家质量监督检验检疫总局. 饲料中钙的测定GB/T 6436—2002[S]北京: 中国标准出版社, 2002. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. Determination of calcium in feed GB/T 6436—2002[S]. Beijing: China Standards Press, 2002. (in Chinese) |
| [15] |
中华人民共和国国家质量监督检验检疫总局. 饲料中总磷的测定分光光度法GB/T 6437—2002[S]北京: 中国标准出版社, 2002. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. Determination of phosphorus in feed—spectphotometry GB/T 6437—2002[S]. Beijing: China Standards Press, 2002. (in Chinese) |
| [16] |
冯宗慈, 高民. 通过比色测定瘤胃液氨氮含量方法的改进[J]. 畜牧与饲料科学, 2010, 31(Z1): 37. FENG Z C, GAO M. Improvement of the method for determination of ammonia nitrogen in rumen fluid by colorimetric method[J]. Animal Husbandry and Feed Science, 2010, 31(Z1): 37 (in Chinese). |
| [17] |
COTTA M A, RUSSELL J B. Effect of peptides and amino acids on efficiency of rumen bacterial protein synthesis in continuous culture[J]. Journal of Dairy Science, 1982, 65(2): 226-234. DOI:10.3168/jds.S0022-0302(82)82181-4 |
| [18] |
郭盼盼, 严昌国, 高青山, 等. 日粮精粗比对延边黄牛瘤胃发酵特性及微生物区系的影响[J]. 饲料研究, 2015(21): 36-41. GUO P P, YAN C G, GAO Q S, et al. Effects of dietary concentrate to forage ratio on rumen fermentation characteristics and microflora of Yanbian cattle[J]. Feed Research, 2015(21): 36-41 (in Chinese). |
| [19] |
周航. 不同精粗比日粮对延边黄牛消化发酵和瘤胃微生物多样性的影响[D]. 硕士学位论文. 延吉: 延边大学, 2014. ZHOU H. The effects of diets with different concentrate to forage ratios on digestibility, fermentation and microorganisms diversity in Yanbian yellow cattle[D]. Master's Thesis. Yanji: Yanbian University, 2014. (in Chinese) |
| [20] |
周瑞, 刘立山, 吴建平, 等. 牛至精油对绵羊瘤胃体外养分降解率、发酵特性及CH4产量的影响[J]. 草业学报, 2019, 28(11): 168-176. ZHOU R, LIU L S, WU J P, et al. Effects of oregano essential oil on nutrient degradability, rumen fermentation, and CH4 production in sheep[J]. Acta Prataculturae Sinica, 2019, 28(11): 168-176 (in Chinese). DOI:10.11686/cyxb2019124 |
| [21] |
李宏, 宋淑珍, 高良霜, 等. 饲养水平对阿勒泰羊胃肠道发育、瘤胃发酵参数及瘤胃微生物区系的影响[J]. 草业学报, 2021, 30(4): 180-190. LI H, SONG S Z, GAO L S, et al. Effects of feeding level on the gastrointestinal development, rumen fermentation and rumen microbiota in Altay sheep[J]. Acta Prataculturae Sinica, 2021, 30(4): 180-190 (in Chinese). |
| [22] |
张永胜, 闫素梅, 孙国平. 两种育肥方式对阿尔巴斯白绒山羊羔羊瘤胃发酵功能的影响[J]. 饲料工业, 2018, 39(11): 29-32. ZHANG Y S, YAN S M, SUN G P. Effects of two fattening methods on rumen fermentation function of Aerbasi white cashmere goat lambs[J]. Feed Industry, 2018, 39(11): 29-32 (in Chinese). |
| [23] |
王晓飞, 乌日勒格, 田丰, 等. 膨化秸秆微生物发酵饲料对杜寒杂交肉羊瘤胃发酵的影响[J]. 畜牧与饲料科学, 2021, 42(2): 32-36. WANG X F, WU R L G, TIAN F, et al. Effect of extruded straw microbial fermented feed on ruminal fermentation of Dorper×thin-tailed Han crossbred sheep[J]. Animal Husbandry and Feed Science, 2021, 42(2): 32-36 (in Chinese). |
| [24] |
邹诗雨, 陈思葵, 唐启源, 等. 青贮剂对再生稻头季全株青贮品质和体外瘤胃发酵特性的影响[J]. 草业学报, 2021, 30(7): 122-132. ZOU S Y, CHEN S K, TANG Q Y, et al. Effects of silage additives on quality and in vitro rumen fermentation characteristics of first season ratoon rice whole silage[J]. Acta Prataculturae Sinica, 2021, 30(7): 122-132 (in Chinese). |
| [25] |
刘绘汇. 饲粮中添加甘露寡糖对湖羊生长和屠宰性能、胃肠道组织形态及微生物区系的影响[D]. 硕士学位论文. 兰州: 甘肃农业大学, 2021. LIU H H. Effects of adding mannan oligosaccharide on growth and slaughter performance, gastrointestinal histological morphology and microflora of Hu sheep[D]. Master's Thesis. Lanzhou: Gansu Agricultural University, 2021. (in Chinese) |
| [26] |
孙国平, 闫素梅, 荷花, 等. 不同饲养方式对阿尔巴斯白绒山羊瘤胃发酵功能的影响[J]. 饲料工业, 2013, 34(13): 51-54. SUN G P, YAN S M, HE H, et al. Effects of different feeding methods on the rumen fermentation function of albas white cashmere goats[J]. Feed Industry, 2013, 34(13): 51-54 (in Chinese). |
| [27] |
王贝. 饲粮NDF/NFC对不同泌乳阶段奶牛瘤胃甲烷排放量、营养物质表观消化率及生产性能的影响[D]. 硕士学位论文. 阿拉尔: 塔里木大学, 2019. WANG B. Effects of dietary NDF/NFC on rumen methane emissions, nutrient apparent digestibility and production performance of dairy cows during different lactating stages[D]. Master's Thesis. Alaer: Tarim University, 2019. (in Chinese) |
| [28] |
杨鑫, 樊吴静, 唐洲萍, 等. 不同覆盖栽培对马铃薯根际土壤细菌多样性、酶活性及化学性状的影响[J]. 核农学报, 2021, 35(9): 2145-2153. YANG X, FAN W J, TANG Z P, et al. Effects of different mulching cultivation on bacterial diversity, enzyme activity and physicochemical properties of potato rhizosphere soil[J]. Journal of Nuclear Agricultural Sciences, 2021, 35(9): 2145-2153 (in Chinese). |
| [29] |
张振宇. 饲养方式和日粮能量对牦牛生产性能及瘤胃细菌多样性的影响[D]. 硕士学位论文. 兰州: 西北民族大学, 2021. ZHANG Z Y. Effects of different feeding strategies and dietary energy levels on yak production performance and rumen bacteria diversity[D]. Master's Thesis. Lanzhou: Northwest University for Nationalities, 2021. (in Chinese) |
| [30] |
朱相德, 李娅楠, 徐晓锋. 反刍动物瘤胃纤维降解微生物的研究进展[J]. 家畜生态学报, 2021, 42(7): 8-13. ZHU X D, LI Y N, XU X F. Research progress on rumen fiber-degrading microorganism in ruminants[J]. Acta Ecologae Animalis Domastici, 2021, 42(7): 8-13 (in Chinese). DOI:10.3969/j.issn.1673-1182.2021.07.002 |
| [31] |
宋峰, 李颖, 苏德其其格, 等. 比较驼绒藜和苜蓿颗粒料对双胞胎羔羊屠宰性能和肉品质的影响[J]. 畜牧与兽医, 2021, 53(8): 32-36. SONG F, LI Y, SU D Q Q G, et al. Comparison of the effects of Ceratoides arborescens and Medicago sativa pellets on the slaughter performance and meat quality of twin lambs[J]. Animal Husbandry & Veterinary Medicine, 2021, 53(8): 32-36 (in Chinese). |
| [32] |
BI Y L, ZENG S Q, ZHANG R, et al. Effects of dietary energy levels on rumen bacterial community composition in Holstein heifers under the same forage to concentrate ratio condition[J]. BMC Microbiology, 2018, 18: 69. DOI:10.1186/s12866-018-1213-9 |
| [33] |
ZHOU Z M, FANG L, MENG Q X, et al. Assessment of ruminal bacterial and archaeal community structure in yak (Bos grunniens)[J]. Frontiers in Microbiology, 2017, 8: 179. |
| [34] |
刘祥圣. 不同水平铜源对奶牛生产性能、瘤胃发酵和血清生化的影响[D]. 硕士学位论文. 扬州: 扬州大学, 2021. LIU X S. Effects of different levels of copper sources on performance, rumen fermentation and serum biochemistry of dairy cows[D]. Master's Thesis. Yangzhou: Yangzhou University, 2021. (in Chinese) |
| [35] |
EVANS N J, BROWN J M, MURRAY R D, et al. Characterization of novel bovine gastrointestinal tract Treponema isolates and comparison with bovine digital dermatitis treponemes[J]. Applied and Environmental Microbiology, 2011, 77(1): 138-147. DOI:10.1128/AEM.00993-10 |
| [36] |
REIGSTAD C S, KASHYAP P C. Beyond phylotyping: understanding the impact of gut microbiota on host biology[J]. Neurogastroenterology and Motility, 2013, 25(5): 358-372. DOI:10.1111/nmo.12134 |
| [37] |
曹连宾, 崔占鸿, 孙红梅, 等. 全放牧牦牛与舍饲牦牛瘤胃细菌多样性比较[J]. 江苏农业科学, 2016, 44(3): 242-248. CAO L B, CUI Z H, SUN H M, et al. Comparison of rumen bacterial diversity between fully grazed and housed yaks[J]. Jiangsu Agricultural Sciences, 2016, 44(3): 242-248 (in Chinese). |
| [38] |
黎凌铄, 彭忠利, 陈仕勇, 等. 小肽与酵母培养物对舍饲牦牛瘤胃微生物多样性和发酵参数的影响[J]. 中国饲料, 2021(5): 16-23. LI L S, PENG Z L, CHEN S Y, et al. Effects of small peptide and yeast culture on rumen microbial diversity and fermentation parameters of yaks[J]. China Feed, 2021(5): 16-23 (in Chinese). |
| [39] |
马秀花, 桂瑞麒, 焦娜, 等. 荞麦秸秆饲粮条件下甘露寡糖对滩羊瘤胃菌群结构的影响[J]. 动物营养学报, 2021, 33(4): 2365-2377. MA X H, GUI R Q, JIAO N, et al. Effect of mannan oligosaccharides on rumen bacterial flora structure of Tan sheep under buckwheat straw diet condition[J]. Chinese Journal of Animal Nutrition, 2021, 33(4): 2365-2377 (in Chinese). DOI:10.3969/j.issn.1006-267x.2021.04.054 |
| [40] |
李娟, 王利, 罗晓林, 等. 舍饲养殖对麦洼牦牛瘤胃微生物宏基因组的影响[J]. 动物营养学报, 2020, 32(9): 4185-4193. LI J, WANG L, LUO X L, et al. Effects of confined farming on rumen microbial metagenome of Maiwa yaks[J]. Chinese Journal of Animal Nutrition, 2020, 32(9): 4185-4193 (in Chinese). |
| [41] |
郭威, 郭晓军, 周贤, 等. 复合菌剂发酵玉米秸秆对绵羊瘤胃液细菌多样性的影响[J]. 畜牧兽医学报, 2018, 49(4): 736-745. GUO W, GUO X J, ZHOU X, et al. Effect of corn stalk fermented by complex bacterial on rumen bacteria diversity in sheep[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(4): 736-745 (in Chinese). |
| [42] |
王柏辉. 饲养方式对苏尼特羊胃肠道菌群、脂肪酸代谢和羊肉品质的影响及机理研究[D]. 博士学位论文. 呼和浩特: 内蒙古农业大学, 2019. WANG B H. Effects of feeding regimens on gastrointestinal microbiota, fatty acid metabolism and meat quality of Sunit sheep and its underlying mechanism[D]. Ph. D. Thesis. Hohhot: Inner Mongolia Agricultural University, 2019. (in Chinese) |
| [43] |
PURUSHE J, FOUTS D E, MORRISON M, et al. Comparative genome analysis of Prevotella ruminicola and Prevotella bryantii: insights into their environmental niche[J]. Microbial Ecolony, 2010, 60(4): 721-729. DOI:10.1007/s00248-010-9692-8 |
| [44] |
王祖艳, 曲永利, 张帅, 等. 不同添加剂处理全株玉米青贮对奶牛瘤胃发酵参数和菌群结构的影响[J]. 动物营养学报, 2021, 33(4): 2093-2103. WANG Z Y, QU Y L, ZHANG S, et al. Effects of whole corn silage treated with different additives on rumen fermentation parameters and bacterial community structure of dairy cows[J]. Chinese Journal of Animal Nutrition, 2021, 33(4): 2093-2103 (in Chinese). DOI:10.3969/j.issn.1006-267x.2021.04.029 |
| [45] |
陈凯, 王晓力, 王永刚, 等. 青贮饲用高粱对肉牛瘤胃液微生物多样性的影响[J]. 基因组学与应用生物学, 2021, 40(1): 279-286. CHEN K, WANG X L, WANG Y G, et al. Effect of silage forage sorghum on microbial diversity of rumen fluid of beef cattle[J]. Genomics and Applied Biology, 2021, 40(1): 279-286 (in Chinese). |
| [46] |
BEKELE A Z, KOIKE S, KOBAYASHI Y. Genetic diversity and diet specificity of ruminal Prevotella revealed by 16S rRNA gene-based analysis[J]. FEMS Microbiology Letters, 2010, 305(1): 49-57. DOI:10.1111/j.1574-6968.2010.01911.x |
| [47] |
张亮, 王世达, 谢方, 等. 肠易激综合征大鼠肠道菌群和氨基酸代谢的变化[J]. 营养学报, 2018, 40(3): 240-244. ZHANG L, WANG S D, XIE F, et al. Changes of intestinal flora and amino acid metabolism in rats with irritable bowel syndrome[J]. Acta Nutrimenta Sinica, 2018, 40(3): 240-244 (in Chinese). DOI:10.3969/j.issn.0512-7955.2018.03.006 |
| [48] |
李岚捷, 成述儒, 刁其玉, 等. 不同NFC/NDF水平饲粮对犊牛瘤胃发酵参数和微生物区系多样性的影响[J]. 畜牧兽医学报, 2017, 48(12): 2347-2357. LI L J, CHENG S R, DIAO Q Y, et al. Effects of diets with different NFC/NDF levels on the rumen fermentation parameters and bacterial community in male calves[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(12): 2347-2357 (in Chinese). DOI:10.11843/j.issn.0366-6964.2017.12.014 |
| [49] |
郭成. 低乳脂日粮诱导模式下奶牛瘤胃细菌菌群变化的研究[D]. 硕士学位论文. 银川: 宁夏大学, 2019. GUO C. Study on the changes of rumen bacterial flora in dairy cows under the model by inducting with low milk fat diet[D]. Master's Thesis. Yinchuan: Ningxia University, 2019. (in Chinese) |
| [50] |
焦安英. 甘蔗压榨汁制氢系统的工程控制对策及其微生物群落研究[D]. 博士学位论文. 哈尔滨: 东北林业大学, 2011. JIAO A Y. Engineering control measures and microbial community analysis of hydrogen production system from sugarcane juice[D]. Ph. D. Thesis. Harbin: Northeast Forestry University, 2011. (in Chinese) |
| [51] |
郭俊良. 发情期大熊猫肛周腺标记物化学成分与菌群结构相关性研究[D]. 硕士学位论文. 南充: 西华师范大学, 2020. GUO J L. Correlation analysis of chemical components and flora structure of perianal gland markers in pandas during estrus[D]. Master's Thesis. Nanchong: China West Normal University, 2020. (in Chinese) |
| [52] |
谢建林, 张巧娥, 张转弟, 等. 复合菌发酵稻草对安格斯牛生长性能、瘤胃发酵参数及菌群结构的影响[J]. 动物营养学报, 2021, 33(5): 2738-2751. XIE J L, ZHANG Q E, ZHANG Z D, et al. Effects of compound bacteria fermented rice straw on growth performance, rumen fermentation parameters and microbial structure of Angus cattle[J]. Chinese Journal of Animal Nutrition, 2021, 33(5): 2738-2751 (in Chinese). |
| [53] |
张林. 日粮NFC/NDF比例对奶牛生产性能、体外瘤胃发酵和细菌微生物区系的影响[D]. 硕士学位论文. 南京: 南京农业大学, 2018. ZHANG L. Effects of NFC/NDF ratios on performances of cows, rumen fermentation and bacterial microflora in vitro[D]. Master's Thesis. Nanjing: Nanjing Agricultural University, 2018. (in Chinese) |
| [54] |
沙玉柱. 放牧藏绵羊瘤胃发酵-宿主-微生物互作对其寒冷环境适应的影响[D]. 硕士学位论文. 兰州: 甘肃农业大学, 2021. SHA Y Z. Effect of rumen fermentation-host-microbe interaction on the adaptation to cold environment of grazing Tibetan sheep[D]. Master's Thesis. Lanzhou: Gansu Agricultural University, 2021. (in Chinese) |
| [55] |
LAMENDELLA R, DOMINGO J W, GHOSH S, et al. Comparative fecal metagenomics unveils unique functional capacity of the swine gut[J]. BMC Microbiology, 2011, 11: 103. DOI:10.1186/1471-2180-11-103 |
| [56] |
王洪荣. 反刍动物碳水化合物代谢利用机制及消化道健康的系统营养调控研究进展[J]. 动物营养学报, 2020, 32(10): 4686-4696. WANG H R. Research advances in system-nutritional regulation on mechanism of carbohydrates metabolism and gastrointestinal health of ruminants[J]. Chinese Journal of Animal Nutrition, 2020, 32(10): 4686-4696 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.10.020 |
| [57] |
刘道杨, 付戴波, 瞿明仁, 等. 11~12月龄夏南牛能量代谢规律与需要量研究[J]. 江西农业大学学报, 2013, 35(4): 802-806. LIU D Y, FU D B, QU M R, et al. The metabolism rule and requirements of energy of 11 to 12-month-old Xianan cattle[J]. Acta Agriculturae Universitatis Jiangxiensis, 2013, 35(4): 802-806 (in Chinese). DOI:10.3969/j.issn.1000-2286.2013.04.024 |




