2. 西藏自治区农牧科学院草业科学研究所, 拉萨 850000;
3. 山东大学(威海)海洋学院, 威海 264209;
4. 大理大学农学与生物科学学院, 大理 671003;
5. 青岛农业大学草业学院, 青岛 266200
2. Institute of Practaculture Science, Tibet Academy of Agricultural and Animal husbandry Sciences, Lhasa 850000, China;
3. Marine College, Shandong University, Weihai 264209, China;
4. College of Agricultural and Biological Sciences, Dali University, Dali 671003, China;
5. College of Grassland Science, Qingdao Agricultural University, Qingdao 266200, China
荨麻(Urtica L.)是被子植物门(Angiospermae)、荨麻科(Urticaceae)多年生草本植物,全世界有50余种;我国有15种,3亚种,其中西藏有9种,2亚种[1],占全国的60%,物种资源丰富。西藏荨麻是荨麻属成员之一,为传统药食同源植物,既被地方居民作为营养美味的野菜直接食用,也常被晒制成干草用来补饲越冬家畜。荨麻属植物不仅富含维生素、矿物质、次生代谢物等多种活性成分,而且叶量大,粗蛋白质含量高达36.4%,在无人工管理条件下干草产量可达3.6~7.8 t/hm2[2],能为家畜提供大量高蛋白质优质牧草,发挥促生长、调肉质、保健康的作用[3-4]。面对西藏草牧业生产系统长期缺乏饲草料的现实问题,挖掘利用类似西藏荨麻的地方优势特色草资源,有助于提高优质饲草自给能力,加快突破家畜口粮卡脖子困境。然而,不同种类饲草能够通过影响反刍家畜瘤胃微生物种类、数量和相互关系改变瘤胃发酵模式,从而影响动物生长性能[5-6]。Zhang等[7]体外研究表明,添加50%麻叶荨麻可显著增加瘤胃菌体蛋白含量,减少原虫数量,从而促进瘤胃微生物菌群繁殖。Jin等[8]研究表明,含50%麻叶荨麻的混合颗粒料对乌珠穆沁杂交羔羊瘤胃pH无显著影响,可显著提高瘤胃乙酸和挥发性脂肪酸(VFA)产量,并有效加快羔羊消化道发育。Kliem等[9]将异株荨麻干草粉加入小麦粉(添加量为100 mg/g)经人工瘤胃发酵48 h,发酵液氢离子(H+)浓度从7.0 μmol/L下降到5.1 μmol/L,pH升高了37%,有效防止了酸中毒。从上述体内、体外试验不难看出,荨麻对瘤胃代谢具有积极作用。针对西藏地区丰富的荨麻资源,将其加工成便于投喂的荨麻草块饲粮,对藏系绵羊瘤胃发酵及生长性能有何影响,尚不清楚。为此,本试验以拉萨河谷著名的彭波半细毛羊为研究对象,采用开花期西藏荨麻,制成不同精粗比的荨麻草块饲粮,研究其对藏系绵羊瘤胃细菌群落结构、发酵参数及生长性能影响,以期为荨麻在藏系绵羊生产中的科学应用提供理论依据和技术支撑。
1 材料与方法 1.1 试验时间与地点试验于2018年8—10月在西藏自治区拉萨市林周县拉萨河谷腹地卡孜乡进行。放牧草场以白草(Pennisetum ecentrasiaticum Tzvel.)为建群种,放牧季干草产量为400 kg/hm2。彭波半细毛羊是当地培育的毛肉兼用型藏系绵羊新品种,产毛和产肉性能较好。
1.2 动物设计与饲养管理选用30只1岁左右、体重相近的彭波半细毛羊公羊,随机分为3组(n=10):自由放牧组(G组,作为对照组)、混合荨麻草块饲粮组(M组)和单一荨麻草块饲粮组(N组)。参照我国《肉羊饲养标准》(NY/T 816—2004)配制试验饲粮,M、N组饲粮的精粗比分别为40:60和8:92,粗蛋白质水平接近,分别为19.61%和19.48%,荨麻草块饲粮组成及营养水平见表 1(需要说明的是,因西藏荨麻钙含量较高,为了平衡2组饲粮钙水平及钙磷比,饲粮的钙和磷水平高于饲养标准)。饲粮均加工成草块(横截面直径为35 mm,密度为540 kg/m3)。试验开始前所有羊只自由放牧,无补饲。试验开始后,G组羊只按照当地传统方式随大群羊放牧;M、N组羊只舍饲,每天分早、晚2次单栏饲喂,每天每只投喂量为1.5 kg。试验期共57 d,其中预试期18 d,正试期39 d。试验期间,每天记录采食量,每2周称取1次空腹体重。
|
|
表 1 荨麻草块饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of nettle cube diets (DM basis) |
正试期最后1 d,每组随机选择6只羊,采用鼻胃管法,收集每只羊的瘤胃液约50 mL。采集时,将羊侧卧并保定,使瘤胃一侧向外,然后将硅胶软管(长1 m、直径5 mm)从鼻腔插入瘤胃,随着羊呼吸时肺扩张产生的负压,瘤胃液自行流出,将其快速收入离心管。新鲜瘤胃液经过4层纱布过滤,测定pH,然后分装入2 mL冻存管并埋入干冰速冻,转移到实验室于-80 ℃冰箱保存,以备瘤胃发酵参数测定及瘤胃细菌测序。
1.3 测定指标与方法 1.3.1 采食量G组放牧采食量根据Mayes等[10]提出的饱和链烷法,参照金艳梅等[11]描述的方法进行测定。M、N组采食量按照日投喂量与剩余量之差计算。
1.3.2 瘤胃发酵参数瘤胃液pH采用雷磁pHS-3C酸度计(上海仪电科学仪器股份有限公司)测定,瘤胃液VFA含量采用GC-14B气相色谱仪(日本岛津公司)测定。
1.3.3 瘤胃细菌测序及数据分析提取瘤胃液样本总DNA,根据保守区设计引物,在引物末端加上测序接头,进行PCR扩增并对产物进行纯化、定量和均一化形成测序文库。文库质检合格后利用Illumina HiSeq 2500测序平台,对各组羊的瘤胃液样本细菌16S rDNA的V3~V4区进行检测。测序得到的原始图像数据文件,经碱基识别分析转化为原始测序序列,使用Flash v1.2.7软件,通过overlap对每个样本的reads进行拼接,利用Trimmomatic v0.33对拼接得到的raw tags进行过滤,经Uchime v4.2软件鉴定并去除嵌合体序列,得到最终的有效数据。在97%相似度水平下,使用QIIME v1.8.0软件Uclust程序对tags聚类,获得操作分类单元(OTU),从而生成不同分类水平上的物种相对丰度表,再通过R语言工具绘制样本在各分类学水平下的群落结构图。使用Mothur v1.30软件对各样本alpha多样性指数进行评估,统计单个样本每个OTU物种多样性及物种相对丰度。使用QIIME软件对各样本进行beta多样性分析,并比较3组瘤胃液样本在物种多样性方面存在的差异。最后运用R软件对瘤胃发酵参数与相对丰度排名前10的瘤胃菌属进行Spearman相关分析。
1.4 数据统计与分析瘤胃发酵参数、alpha多样性指数和生长性能数据采用SAS 8.2软件进行单因素方差分析(one-way ANOVA),采用Duncan氏法进行多重比较,结果用平均值±标准误表示,P < 0.05为差异显著。
2 结果 2.1 荨麻草块饲粮对绵羊瘤胃细菌多样性的影响 2.1.1 对alpha多样性的影响如表 2所示,对18个瘤胃样本进行测序共获得850个OTU,其中M、N组的瘤胃细菌OTU数量分别为500和474个,显著低于G组的627个(P < 0.05)。M、N组的瘤胃细菌ACE指数、Chao1指数和Shannon指数显著低于G组(P < 0.05),Simpson指数显著高于G组(P < 0.05),但M、N组之间无显著差异(P>0.05)。各组测序覆盖率均大于0.995,表示本次测序结果可以代表样本细菌数量的真实情况。
|
|
表 2 荨麻草块饲粮对绵羊瘤胃细菌alpha多样性的影响 Table 2 Effects of nettle cube diet on rumen bacterial alpha diversity of sheep |
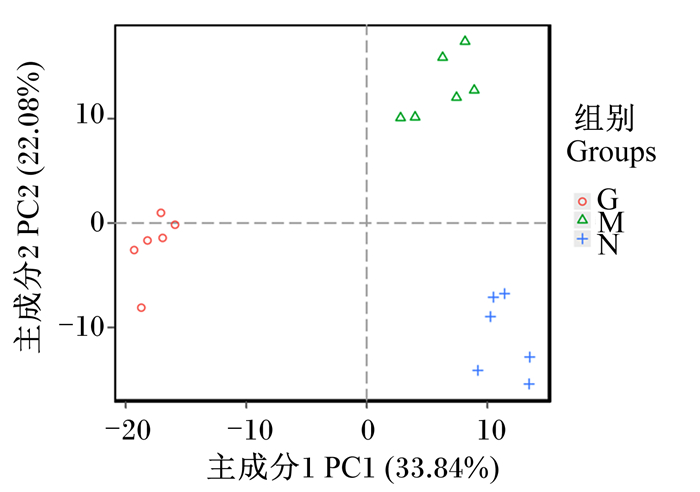
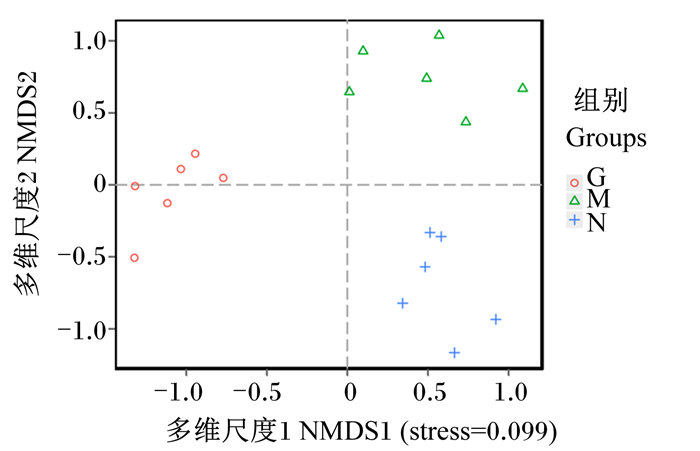
对瘤胃细菌群落进行主坐标分析(PCoA),如图 1所示,3组在PCoA图上的距离彼此间较远,主成分1(PC1)贡献率为33.84%,主成分2(PC2)贡献率为22.08%,组间聚类较好。进一步进行的非度量多维分析(NMDS)模型更好地反映了生态学数据的非线性结构,当应力系数(stress) < 0.2时表示NMDS具有一定的可靠性。如图 2所示,3组样本组内聚集度较高而在组间明显区分开来,说明瘤胃细菌种群结构存在明显的组间差异。
|
图 1 瘤胃细菌构成的主坐标分析 Fig. 1 PCoA of rumen bacterial composition |
|
图 2 瘤胃细菌构成的非度量多维分析 Fig. 2 NMDS of rumen bacterial composition |
如表 3所示,在门水平,G、M和N组瘤胃均以拟杆菌门(Bacteroidetes)为第一大优势菌门,相对丰度依次为51.48%、66.94%和59.18%,M、N组瘤胃拟杆菌门相对丰度显著高于G组(P<0.05);G、M和N组瘤胃均以厚壁菌门(Firmicutes)为第二大优势菌门,相对丰度依次为31.20%、27.30%和27.29%,G组瘤胃厚壁菌门相对丰度显著高于M、N组(P<0.05)。G组瘤胃蓝细菌门(Cyanobacteria)相对丰度显著高于M组(P<0.05)。
|
|
表 3 荨麻草块饲粮对绵羊瘤胃细菌群落组成的影响(门水平) Table 3 Effects of nettle cube diet on rumen bacterial community of sheep (at phylum level) |
如表 4所示,在属水平,各组瘤胃优势菌属为普雷沃氏菌属_1(Prevotella_1)、理研菌科_RC9肠道群(Rikenellaceae_RC9_gut_group)和未培养_瘤胃菌属(uncultured_rumen_bacterium)。M、N组瘤胃普雷沃氏菌属_1、普雷沃氏菌科_UCG-003(Prevotellaceae_UCG-003)相对丰度显著高于G组(P<0.05),而瘤胃瘤胃球菌科_NK4A214群(Ruminococcaceae_NK4A214_group)、瘤胃球菌属_2(Ruminococcus_2)相对丰度显著低于G组(P<0.05);N组瘤胃未培养细菌_f_拟杆菌目_BS11肠道群(uncultured_bacterium_f_Bacteroidales_BS11_gut_group)相对丰度显著高于G、M组(P<0.05),而瘤胃丁酸弧菌属_2(Butyrivibrio_2)相对丰度显著低于G、M组(P<0.05)。
|
|
表 4 荨麻草块饲粮对绵羊瘤胃细菌群落组成的影响(属水平) Table 4 Effects of nettle cube diet on rumen bacterial community of sheep (at genus level) |
如表 5所示,N组瘤胃pH为6.07,显著低于G、M组的6.83和6.75(P<0.05)。M组瘤胃总挥发性脂肪酸(TVFA)含量最高,显著高于G、N组(P<0.05),而G、N组之间无显著差异(P>0.05)。M、N组瘤胃丙酸比例显著高于G组(P<0.05),而瘤胃乙酸/丙酸和丁酸比例显著低于G组(P<0.05)。各组之间瘤胃乙酸、异丁酸、异戊酸和戊酸比例无显著差异(P>0.05)。
|
|
表 5 荨麻草块饲粮对绵羊瘤胃发酵参数的影响 Table 5 Effects of nettle cube diet on rumen fermentation parameters of sheep |
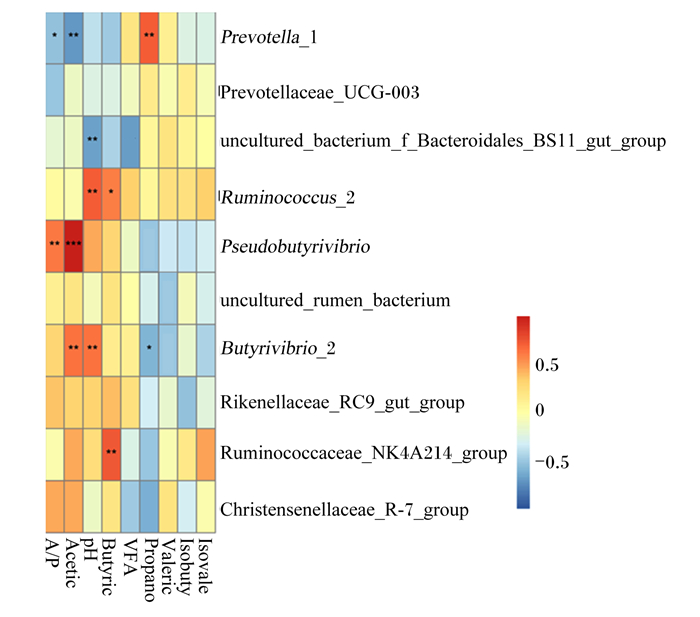
如图 3所示,乙酸含量与丁酸弧菌属_2(r=0.532,P=0.004)和假丁酸弧菌相对丰度(r=0.710,P < 0.001)呈显著正相关,而与普雷沃氏菌属_1相对丰度呈显著负相关(r=0.540,P=0.006);pH与丁酸弧菌属_2(r=0.527,P=0.008)和瘤胃球菌属_2相对丰度(r=0.607,P=0.003)呈显著正相关;丁酸含量与瘤胃球菌科_NK4A214群(r=0.650,P=0.004)和瘤胃球菌属_2相对丰度(r=0.398,P=0.024)呈显著正相关;丙酸含量与普雷沃氏菌属_1相对丰度呈显著正相关(r=0.659,P=0.006),与丁酸弧菌属_2相对丰度呈显著负相关(r=0.385,P=0.031)。
|
Prevotellaceae_UCG-003:普雷沃氏菌科_UCG-003;Prevotella_1:普雷沃氏菌属_1;Rikenellaceae_RC9_gut_group:理研菌科_RC9肠道群;Butyrivibrio_2:丁酸弧菌属_2;uncultured_rumen_bacterium:未培养_瘤胃菌属;Pseudobutyrivibrio:假丁酸弧菌属;Ruminococcus_2:瘤胃球菌属_2;uncultured_bacterium_f_Bacteroidales_BS11_gut_group:未培养细菌_f_拟杆菌目_BS11肠道群;Christensenellaceae_R-7_group:克里斯滕森菌科_R7群;Ruminococcaceae_NK4A214_group:瘤胃球菌科_NK4A214群。 每一对变量之间的相关强度用不同着色和*表示。红色代表正相关,蓝色代表负相关;*表示P < 0.05,**表示P < 0.01,***表示P < 0.001。The correlation strength between each pair of variables was represented by color and *. The red color represented a positive correlation, and the blue color represented a negative correlation; * represented P < 0.05, ** represented P < 0.01, and *** represented P < 0.001. 图 3 瘤胃发酵参数和属水平细菌群落相对丰度的相关关系 Fig. 3 Correlation between rumen fermentation parameters and relative abundances of bacterial community at genus level |
如表 6所示,各组之间期末体重无显著差异(P>0.05)。M、N组平均日增重显著高于G组(P < 0.05),料重比显著低于G组(P < 0.05)。G、M组干物质采食量显著高于N组(P < 0.05),G、M组间无显著差异(P>0.05)。
|
|
表 6 荨麻草块饲粮对绵羊生长性能的影响 Table 6 Effects of nettle cube diet on growth performance of sheep |
与单胃动物不同,反刍动物之所以能够利用大量的植物性饲料(粗饲料)是因为它们瘤胃内寄居着数量庞大、种类繁多的微生物区系。通常,反刍动物饲养体系提倡饲粮成分多样化,以优化瘤胃微生物组成及功能。
成分单一的饲粮影响瘤胃微生物群落数量、相对丰度和组成,本试验中,M、N组瘤胃细菌OTU数量显著减少的结果直观地反映出这一点。与采食多种天然牧草的G组放牧羊相比较,M、N组放牧羊瘤胃细菌数量减少和多样性降低,一方面是因为饲粮构成比较简单,粗饲料成分仅有荨麻一种,另一方面主要是因为荨麻的纤维组分含量较低,在瘤胃内停留时间短,不利于微生物定植,从而造成瘤胃细菌数量和多样性减少。霍俊宏等[6]研究证实,低纤维饲粮能显著降低山羊瘤胃细菌OTU数量和多样性。
瘤胃内数量最多的微生物是细菌,主要由拟杆菌门和厚壁菌门组成。本试验中,荨麻草块饲粮虽然减少了瘤胃细菌总数,但并没有改变优势菌群组成,仍以拟杆菌门和厚壁菌门为优势菌门,分别占据第一和第二优势菌门。拟杆菌门内数量最多的普雷沃氏菌属主要负责降解和消化利用淀粉、植物细胞壁多糖,如木聚糖和果胶,但是不能降解纤维素[12]。低纤维饲粮加速普雷沃氏属的增殖,使其在瘤胃微生物区系中快速占据有利生态位[13]。本试验中,M、N组瘤胃拟杆菌门和普雷沃氏属相对丰度均显著增加,主要是由于荨麻与天然混合牧草在纤维数量和结构上的差异造成的。天然混合牧草的木质素含量高达8.81%,是荨麻木质素含量(一般为35~45 g/kg[8, 14-15])的2.9倍,木质素结晶化程度很高,很难被家畜消化利用;相反,荨麻的非纤维碳水化合物(NFC)含量远高于天然混合牧草,能提供大量可发酵底物,加快拟杆菌门细菌增殖并定植优势生态位。G组放牧羊采食的天然混合牧草含有的大量植物纤维激发了厚壁菌门纤维素分解菌的活动和增殖,所以G组厚壁菌门的相对丰度较M和N组均上调了14.3%,其中瘤胃球菌属_2和瘤胃球菌科_NK4A214群贡献最大。在西藏相同地方、相同品种羊上开展的试验表明,放牧彭波半细毛羊瘤胃厚壁菌相对丰度较以绿麦草为主的混合草块舍饲羊提高18.0%,贡献者主要为丁酸弧菌属和未知菌属[16]。丁酸弧菌在羊瘤胃内主要负责降解纤维素(产生乙酸、丁酸等)。随着饲粮纤维含量降低,溶纤维丁酸弧菌数量减少。本试验中,N组丁酸弧菌属_2相对丰度显著降低,既与荨麻草块饲粮纤维含量低有关,也可能与荨麻含有多酚有关。荨麻多酚含量高达125 g/kg[3],对瘤胃丁酸弧菌属有强烈地抑制作用[17-18]。需要注意的是,M组同样是低纤维草块饲粮,但却没有这种作用,主要是二者来自荨麻的多酚含量不同(75 g/kg vs. 116 g/kg)。
3.2 荨麻草块饲粮对绵羊瘤胃发酵参数的影响pH是判断反刍动物瘤胃发酵正常与否的决定性指标。通常瘤胃内正常pH为5.50~7.50,当pH低于6.0时纤维素降解菌和原虫的生长繁殖就会受到抑制。本试验各组瘤胃pH为6.07~6.83,均在正常范围内。王珊等[19]和张振斌等[20]也得到一致结果。这说明饲粮中添加荨麻能够保持瘤胃内环境相对平衡,符合反刍动物瘤胃发酵正常模式。但从瘤胃微生物活动角度讲,微生物合成菌体蛋白要求的最适pH为6.3~7.4[21]。本试验中,G、M组瘤胃pH能够满足此条件,而N组瘤胃pH较低,且低于最适值范围下限。瘤胃pH降低与饲料粒径小、食糜流速快、微生物活动时间短等因素有关[12]。本试验中,M、N组在饲粮压块工艺相同、瘤胃丙酸含量相近的情况下,N组瘤胃pH显著降低,一方面是因为饲料成分仅为荨麻的单一饲粮在瘤胃内停留时间短,造成微生物消化作用减少;另一方面仍然是因为荨麻纤维含量较低。研究发现,在维持咀嚼和瘤胃pH方面,秸秆比苜蓿干草更有效[22];低纤维饲粮可显著降低瘤胃pH[23]。以上说明,含60%荨麻的混合草块饲粮不影响反刍动物瘤胃pH及微生物正常活动,但单一荨麻草块饲粮抑制瘤胃微生物合成菌体蛋白,不宜长期饲喂。
VFA是反刍动物瘤胃发酵的主要产物,为家畜提供70%~80%的能量需要。本试验中,M组TVFA含量较G组提高了1.24倍(102.38 mmol/L vs. 82.41 mmol/L),与Jin等[8]应用混合麻叶荨麻颗粒料得到的研究结果类似。荨麻饲粮之所以有此效果,主要是因为荨麻NFC含量高而木质素含量低。Van Soest[24]指出,纤维素的可利用性与木质素含量密切相关,大量木质素直接降低纤维消化率。木质素含量与NFC含量呈负相关[25]。研究表明,与低质牧草相比较,高质量牧草显著增加瘤胃丙酸和乙酸含量,显著降低瘤胃丁酸含量[26-28]。瘤胃VFA组分及其产量决定于瘤胃食糜附着的细菌种类。研究发现,瘤胃丙酸含量与普雷沃氏菌科_UCG-001相对丰度呈正相关关系,而丁酸含量与瘤胃球菌属_2相对丰度呈正相关关系[29-30]。与之类似,本试验中,M、N组饲粮较高含量的NFC促进普雷沃氏菌增殖,但却无益于瘤胃球菌属增殖,因此,M、N组瘤胃丙酸含量较高而丁酸含量及乙酸/丙酸较低。瘤胃丙酸含量与普雷沃氏菌属_1、丁酸与瘤胃球菌科_NK4A214群和瘤胃球菌属_2相对丰度之间存在的显著正相关关系也支持此结果。瘤胃VFA中丙酸转化效率最高,M、N组丙酸含量较G组分别提高了1.95和1.78倍,将有益于提高绵羊生长性能。
3.3 荨麻草块饲粮对绵羊生长性能的影响本试验中,N组干物质采食量显著降低,与单一成分荨麻草块饲粮的适口性相对较差有关。尽管如此,由于荨麻的可消化养分含量远高于天然混合牧草,经瘤胃发酵产生更多的高效能量,配合其高蛋白质水平,能够满足试验羊快速增重的需求,故而N组羊的平均日增重不减反增。Humphries等[31]用10%异株荨麻替代黑麦草青贮后泌乳奶牛采食量有一定数量的减少,但能维持正常产奶量。Jin等[8]在饲粮能氮水平一致的条件下,混合荨麻颗粒饲料对羔羊平均日采食量、平均日增重、饲料转化效率都没有显著影响。本试验中,G组料重比显著高于M、N组,这主要与G组羊营养水平低且放牧过程中消耗能量高有关。综上所述,荨麻草块饲粮之所以提高试验羊的生长性能,可能的途径在于通过优化瘤胃微生物菌群结构调控瘤胃发酵模式,产生更多的高效能VFA,从而提高饲料转化利用效率,并加快动物体增重。
4 结论将西藏荨麻应用在藏系绵羊养殖中,综合瘤胃细菌群落构成、瘤胃发酵参数和生长性能,由60%西藏荨麻+40%精饲料构成的混合荨麻草块饲粮饲喂效果较好,更适合在当地推广应用。
| [1] |
陈家瑞. 荨麻属Urtica L. [M]//吴征镒. 西藏植物志. 北京: 科学出版社, 1983: 524. CHEN J R. Urtica L. [M]//WU Z Y. Flora of Tibet. Beijing: Science Press, 1983: 524. (in Chinese) |
| [2] |
ZHANG X Q, JIN Y M, ZHANG Y J, et al. Silage quality and preservation of Urtica cannabina ensiled alone and with additive treatment[J]. Grass and Forage Science, 2014, 69(3): 405-414. DOI:10.1111/gfs.12036 |
| [3] |
ZHANG X Q, JIANG C, JIN Y M, et al. The effect of substitution of mixed grass hay with Urtica cannabina hay and/or Leymus chinensis hay on blood biochemical profile, carcass traits, and intramuscular fatty acid composition in finishing lambs[J]. Animal Feed Science and Technology, 2021, 272: 114780. DOI:10.1016/j.anifeedsci.2020.114780 |
| [4] |
BOURGEOIS C, LECLERC É A, CORBIN C, et al. Nettle (Urtica dioica L.) as a source of antioxidant and anti-aging phytochemicals for cosmetic applications[J]. Comptes Rendus Chimie, 2016, 19(9): 1090-1100. DOI:10.1016/j.crci.2016.03.019 |
| [5] |
AZAD E, FEHR K B, DERAKHSHANI H, et al. Interrelationships of fiber-associated anaerobic fungi and bacterial communities in the rumen of bloated cattle grazing alfalfa[J]. Microorganisms, 2020, 8(10): 1543. DOI:10.3390/microorganisms8101543 |
| [6] |
霍俊宏, 方绍培, 吴平山, 等. 不同精粗比日粮对努比亚山羊瘤胃菌群结构的影响[J]. 草业科学, 2020, 37(12): 2558-2566. HUO J H, FANG S P, WU P S, et al. Effects of diets with different concentration-roughage ratios on the microbial community structure of Nubian goat rumen[J]. Pratacultural Science, 2020, 37(12): 2558-2566 (in Chinese). |
| [7] |
ZHANG Z B, WANG S, WANG M Z, et al. Effects of Urtica cannabina to Leymus chinensis ratios on ruminal microorganisms and fiber degradation in vitro[J]. Animals, 2020, 10(2): 335. DOI:10.3390/ani10020335 |
| [8] |
JIN Y M, JIANG C, ZHANG X Q, et al. Effect of dietary Urtica cannabina on the growth performance, apparent digestibility, rumen fermentation and gastrointestinal morphology of growing lambs[J]. Animal Feed Science and Technology, 2018, 243: 1-9. DOI:10.1016/j.anifeedsci.2018.06.014 |
| [9] |
KLIEM K E, MORGAN R, MOULD F L. Persistency of the effect of Lactuca sativa and Urtica dioica on in vitro acidosis[J]. Proceedings of the British Society of Animal Science, 2005, 2005: 225. DOI:10.1017/S1752756200011364 |
| [10] |
MAYES R W, DOVE H. Measurement of dietary nutrient intake in free-ranging mammalian herbivores[J]. Nutrition Research Reviews, 2000, 13(1): 107-138. DOI:10.1079/095442200108729025 |
| [11] |
金艳梅, 武俊喜, 李鹏, 等. 补饲精料对西藏彭波半细毛羊羊肉品质的影响[J]. 动物营养学报, 2017, 29(2): 562-570. JIN Y M, WU J X, LI P, et al. Effects of concentrate supplementation on meat quality of Pengbo semi-fine wool sheep in Tibet[J]. Chinese Journal of Animal Nutrition, 2017, 29(2): 562-570 (in Chinese). DOI:10.3969/j.issn.1006-267x.2017.02.024 |
| [12] |
冯仰廉. 反刍动物营养学[M]. 北京: 科学出版社, 2004: 5. FENG Y L. Ruminants nutrition[M]. Beijing: Science Press, 2004: 5 (in Chinese). |
| [13] |
TAJIMA K, AMINOV R I, NAGAMINE T, et al. Diet-dependent shifts in the bacterial population of the rumen revealed with real-time PCR[J]. Applied and Environmental Microbiology, 2001, 67(6): 2766-2774. DOI:10.1128/AEM.67.6.2766-2774.2001 |
| [14] |
BACCI L, BARONTI S, PREDIERI S, et al. Fiber yield and quality of fiber nettle (Urtica dioica L.) cultivated in Italy[J]. Industrial Crops and Products, 2009, 29(2/3): 480-484. |
| [15] |
YAVAS A, AVINC O, GEDIK G. Ultrasound and microwave aided natural dyeing of nettle biofibre (Urtica dioica L.) with madder (Rubia tinctorum L.)[J]. Fibres & Textiles in Eastern Europe, 2017, 25(4): 111-120. |
| [16] |
田发益, 武俊喜. 放牧与舍饲对彭波半细毛羊瘤胃细菌群落的生物学信息影响[J]. 畜牧兽医学报, 2019, 50(11): 2252-2263. TIAN F Y, WU J X. Effects of grazing and barn feeding on biological information of rumen bacterial communities in Pengbo semi-fine wool sheep[J]. Acta Veterinaria et Zootechnica Sinica, 2019, 50(11): 2252-2263 (in Chinese). DOI:10.11843/j.issn.0366-6964.2019.11.009 |
| [17] |
FRUTOS P, HERVÁS G, NATALELLO A, et al. Ability of tannins to modulate ruminal lipid metabolism and milk and meat fatty acid profiles[J]. Animal Feed Science and Technology, 2020, 269: 114623. DOI:10.1016/j.anifeedsci.2020.114623 |
| [18] |
VASTA V, DAGHIO M, CAPPUCCI A, et al. Invited review: plant polyphenols and rumen microbiota responsible for fatty acid biohydrogenation, fiber digestion, and methane emission: experimental evidence and methodological approaches[J]. Journal of Dairy Science, 2019, 102(5): 3781-3804. DOI:10.3168/jds.2018-14985 |
| [19] |
王珊, 史良峰, 张振斌, 等. 麻叶荨麻和羊草比例对体外培养瘤胃微生物发酵参数的影响[J]. 家畜生态学报, 2018, 39(4): 33-37. WANG S, SHI L F, ZHANG Z B, et al. Effects of the ratio of Leymus chinensis and Urtica cannbina on rumen microbial fermentation in vitro[J]. Acta Ecologae Animalis Domastici, 2018, 39(4): 33-37 (in Chinese). DOI:10.3969/j.issn.1673-1182.2018.04.007 |
| [20] |
张振斌, 史良峰, 王珊, 等. 麻叶荨麻、羊草组合对乌珠穆沁羔羊表观消化率和瘤胃发酵参数的影响[J]. 家畜生态学报, 2017, 38(5): 21-26. ZHANG Z B, SHI L F, WANG S, et al. Influences of associative effects between Leymus chinensis and Urtica cannabina on apparent digestibility and rumen fermentation parameters of Wuzhumuqin lamb[J]. Acta Ecologae Animalis Domastici, 2017, 38(5): 21-26 (in Chinese). DOI:10.3969/j.issn.1673-1182.2017.05.005 |
| [21] |
SALTER D N, DANESHVAR K, SMITH R H. The origin of nitrogen incorporated into compounds in the rumen bacteria of steers given protein- and urea-containing diets[J]. British Journal of Nutrition, 1979, 41(1): 197-209. DOI:10.1079/BJN19790026 |
| [22] |
SHAIN D H, STOCK R A, KLOPFENSTEIN T J, et al. The effect of forage source and particle size on finishing yearling steer performance and ruminal metabolism[J]. Journal of Animal Science, 1999, 77(5): 1082-1092. DOI:10.2527/1999.7751082x |
| [23] |
GOULART R S, VIEIRA R A M, DANIEL J L P, et al. Effects of source and concentration of neutral detergent fiber from roughage in beef cattle diets on feed intake, ingestive behavior, and ruminal kinetics[J]. Journal of Animal Science, 2020, 98(5): skaa107. DOI:10.1093/jas/skaa107 |
| [24] |
VAN SOEST P J. Nutritional ecology of the ruminant[M]. 2nd ed. Ithaca: Cornell University Press, 1994: 282.
|
| [25] |
YARI M, VALIZADEH R, NNASERIAN A A, et al. Carbohydrate and lipid spectroscopic molecular structures of different alfalfa hay and their relationship with nutrient availability in ruminants[J]. Asian-Australasian Journal of Animal Sciences, 2017, 30(11): 1575-1589. DOI:10.5713/ajas.16.0756 |
| [26] |
CASTRO-MONTOYA J M, GOETZ K, DICKHOEFER U. In vitro fermentation characteristics of tropical legumes and grasses of good and poor nutritional quality and the degradability of their neutral detergent fibre[J]. Animal Production Science, 2021, 61(7): 645-654. DOI:10.1071/AN20136 |
| [27] |
STIERWALT M R, BLALOCK H M, FELIX T L. Effects of the interaction of forage and supplement type on digestibility and ruminal fermentation in beef cattle[J]. Journal of Animal Science, 2017, 95(2): 892-900. |
| [28] |
王金飞, 杨国义, 樊子菡, 等. 饲粮中全株玉米青贮比例对杜湖杂交母羔生长性能、瘤胃发酵、养分消化率及血清学指标的影响[J]. 中国农业科学, 2021, 54(4): 831-844. WANG J F, YANG G Y, FAN Z H, et al. Effects of whole plant corn silage ratio in diet on growth performance, rumen fermentation, nutrient digestibility and serological parameters of Dorper×Hu crossbred female lambs[J]. Scientia Agricultura Sinica, 2021, 54(4): 831-844 (in Chinese). |
| [29] |
曾钰, 高彦华, 彭忠利, 等. 饲粮中添加酵母培养物对舍饲牦牛瘤胃发酵参数及微生物区系的影响[J]. 动物营养学报, 2020, 32(4): 1721-1733. ZENG Y, GAO Y H, PENG Z L, et al. Effects of yeast culture supplementation in diets on rumen fermentation parameters and microflora of house-feeding yak[J]. Chinese Journal of Animal Nutrition, 2020, 32(4): 1721-1733 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.04.031 |
| [30] |
FAN Q S, WANAPAT M, YAN T H, et al. Altitude influences microbial diversity and herbage fermentation in the rumen of yaks[J]. BMC Microbiology, 2020, 20(1): 370. DOI:10.1186/s12866-020-02054-5 |
| [31] |
HUMPHRIES D J, REYNOLDS C K. The effect of adding stinging nettle (Urtica dioica) haylage to a total mixed ration on performance and rumen function of lactating dairy cows[J]. Animal Feed Science and Technology, 2014, 189: 72-81. DOI:10.1016/j.anifeedsci.2014.01.006 |



