乳腺是仔猪在哺乳期从母体获得营养的最重要的器官,乳腺的泌乳能力对仔猪在哺乳期间的生长情况,断奶时的成活率、个体重以及断奶后的生长发育情况都有至关重要的影响[1]。在家畜物种(如母猪和奶牛)中,产奶量是后代断奶前生长和存活最大的限制因素[2-4]。所有哺乳动物的乳汁都是乳腺上皮细胞的分泌产物[5],在母猪中,乳腺上皮细胞的数量一般在分娩时翻倍,通常乳腺上皮细胞的数量和产奶量呈正相关[6]。人们普遍认为,母猪产奶量很大程度上取决于乳腺上皮细胞的数量和它们的分泌能力[4]。在泌乳过程中,乳腺上皮细胞从血液循环中吸收营养并合成乳成分[7]。血液循环中的氨基酸、葡萄糖以及乳脂合成的前体,离开血液进入细胞外液,被乳腺上皮细胞通过其基底外膜上特定的氨基酸转运载体、葡萄糖转运载体以及脂肪酸转运载体吸收进入细胞;然后,氨基酸通过多肽键共价结合在一起,在内质网的核糖体中形成蛋白质后转移到高尔基体,在那里它们被加工运输出细胞[2];血液中的葡萄糖进入乳腺上皮细胞后,一些葡萄糖转化为半乳糖,随后葡萄糖和半乳糖通过过一系列酶催化反应进入高尔基体形成乳糖,并通过渗透梯度运输至乳腺上皮细胞的顶膜,与乳蛋白一起从分泌小泡释放到肺泡腔中[8];而乳脂的合成前体进入细胞后到达细胞内光滑内质网,参与甘油三酯的合成途径,形成小脂滴并融合产生更大的脂滴,向乳腺上皮细胞顶膜移动并释放[2]。乳腺上皮细胞新合成的乳汁以及包括免疫球蛋白在内的部分母体血液成分,被分泌和运输到乳腺肺泡腔和导管系统,然后在催产素激增后释放给仔猪。由此可见,乳腺上皮细胞的转运合成能力直接影响了母猪的泌乳性能和哺乳仔猪的生长情况。
与哺乳母猪有关的大量研究表明,氨基酸不仅是蛋白质的构建底物,而且是代谢途径的关键调控信号,对乳的生成至关重要[4]。已有研究证明,亮氨酸可以通过刺激与蛋白质合成相关的哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)信号通路,促进骨骼肌的合成[9]。而且亮氨酸可以促进乳腺组织中蛋白质的合成[10]。在奶牛的研究中发现,牛乳腺上皮细胞用亮氨酸处理后,可以显著促进细胞乳蛋白的合成[11]。而用氨基酸缺乏培养基培养的牛乳腺上皮细胞,再加入亮氨酸后可以显著促进κ-酪蛋白的合成速率[12]。还有研究发现,用亮氨酸处理乳腺上皮细胞后,αs2-酪蛋白(CSN1S2)和κ-酪蛋白(CSN3)基因表达量显著提升,并且可以促进脂滴的形成[13]。用0.75 mmol/L的亮氨酸处理牛乳腺上皮细胞,可以显著地促进乳脂和乳蛋白的合成,并促进了mTOR信号通路磷酸化[14]。还有研究报道,亮氨酸可以通过mTOR信号通路,促进乳腺上皮细胞的生长增殖和乳蛋白的合成,还可以促进乳腺上皮细胞中氨基酸转运载体和脂肪酸运载体的表达[15]。
因此,本研究旨在利用细胞模型进一步探究亮对猪乳腺上皮细胞增殖、氨基酸转运载体、葡萄糖转运载体、脂肪酸转运载体以及mTOR信号通路的影响,以期对妊娠母猪饲粮中亮氨酸的使用提供一定的理论基础。
1 材料与方法 1.1 试验材料所用细胞来自本实验室前期分离培养的母猪乳腺上皮细胞系;胎牛血清(FBS)、DMEM/F12培养基、双抗购自美国Gibco公司;牛血清白蛋白(BSA)、氢化可的松、ITS、胰岛素样生长因子-1(IGF-1)、表皮生长因子(EGF)、噻唑蓝(MTT)、油红O干粉、焦磷酸二乙酯(DEPC)购自美国Sigma公司;二甲基亚砜(DMSO)购自美国MP Biomedicals公司;RNA反转录试剂盒、DNase Ⅰ(RNase Free,1 000 Units)、DNA Marker(DL 2000)和SYBR Green RT-PCR Master Mix购自日本TaKaKa公司;Trizol裂解液购自美国Invitrogen公司;琼脂糖购自Agarose I-H公司;Western Blot相关试验材料购自上海碧云天公司;一抗mTOR、核糖体蛋白S6激酶1(S6K1)及其磷酸化蛋白、内参基因β-肌动蛋白(β-actin)购自美国CST公司;二抗购自Zenbio公司。
1.2 引物的设计与合成根据NCBI中GenBank公布的基因序列检索出相关基因的序列,用Primer Premier 5.0软件设计目的基因乳蛋白合成基因[αs1-酪蛋白(CSN1S1)、CSN1S2、CSN3]、氨基酸转运载体[溶质载体家族1成员1(SLC1A1)、溶质载体家族1成员4(SLC1A4)、溶质载体家族1成员5(SLC1A5)、溶质载体家族7成员5(LAT1)、溶质载体家族7成员1(SLC7A1)、溶质载体家族7成员2(SLC7A2)、溶质载体家族7成员6(SLC7A6)、溶质载体家族7成员7(SLC7A7)、溶质载体家族7成员8(SLC7A8)、溶质载体家族7成员11(SLC7A11)、溶质载体家族38成员1(SNAT1)、溶质载体家族38成员2(SNAT2)、溶质载体家族38成员4(SNAT4)、溶质载体家族3成员2(4F2hc)、溶质载体家族3成员1(rBAT)]、葡萄糖转运载体[葡萄糖转运体1(GLUT1)、葡萄糖转运体8(GLUT8)]及脂肪酸转运载体[脂肪酸移位酶(CD36)、脂肪酸转运蛋白(FATP)1、FATP2、FATP3、FATP4、脂肪酸结合蛋白(FABP)3、FABP4、FABP5、FABP6、FABP7、酰基辅酶A结合蛋白(ACBP)]的上、下游引物,再使用BLAST分析引物特异性,找出最佳引物序列,由上海生工生物技术有限公司进行合成,引物序列见表 1。
|
|
表 1 相关目的基因及内参基因β-肌动蛋白的引物参数 Table 1 Primer parameters of related target genes and reference gene β-actin |
从液氮中取出本实验室前期分离培养的母猪乳腺上皮细胞系,复苏后使用细胞完全培养基DMEM/F12(含10% FBS和1%双抗,使用正常亮氨酸浓度的完全培养基,而非亮氨酸缺乏培养基L-亮氨酸浓度为59.05 mg/L),在37 ℃、5% CO2培养箱培养,传至3~4代后用于后续试验。
1.4 细胞活力检测采用MTT法检测不同浓度亮氨酸对猪乳腺上皮细胞活力的影响。将猪乳腺上皮细胞接种到96孔板,并置于37 ℃、5% CO2培养箱中培养48 h后,分别更换含不同浓度亮氨酸[0(作为对照组)、1、5、10 mmol/L]的培养基(含5 g/L BSA的DMEM/F12培养基),每组设10个重复(此处增设1组不含细胞只含培养基的空白组),置于37 ℃、5% CO2培养箱中继续培养24 h,各培养孔中加入事先准备好的5 mg/mL MTT 20 μL继续培养4 h;终止培养,吸去孔内培养液,每孔加入150 μL DMSO,置摇床上低速振荡10 min,用全自动酶标仪检测各孔在490 nm波长下的吸光度(A)。细胞活力计算公式如下:
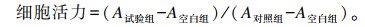
|
采用油红O染色法检测不同浓度亮氨酸对猪乳腺上皮细胞脂滴合成的影响。将猪乳腺上皮细胞接种到24孔板并置于37 ℃、5% CO2培养箱中培养48 h后,分别更换含不同浓度亮氨酸[0(作为对照组)、1、5、10 mmol/L]的培养基,每组设5个重复,置于37 ℃、5% CO2培养箱中培养24 h后,吸去孔内培养液,用预冷的磷酸盐缓冲溶液(PBS)清洗2~3次,加入250 μL 4%多聚甲醛,室温固定30 min;吸出固定液,用PBS清洗2~3次,加入油红O染液500 μL,静置2 h后吸出染液,PBS清洗3~5次,加适量水或甘油进行封孔,最后于倒置显微镜(400×)下拍照。
1.6 目的基因mRNA表达情况测定将猪乳腺上皮细胞接种到6孔板并置于37 ℃、5% CO2培养箱中培养48 h后,分别更换含不同浓度亮氨酸[0(作为对照组)、1、5、10 mmol/L]的培养基,每组设6个重复,培养24 h后,使用Trizol法提取总RNA,RNA反转录根据RNA反转录试剂盒说明书进行,然后依据SYBR Green RT-PCR Master Mix说明进行实时荧光定量PCR,对乳蛋白合成基因、氨基酸转运载体、葡萄糖转运载体、脂肪酸转运载体的mRNA表达情况进行检测,使用2-△△Ct法计算目的基因mRNA相对表达量。
1.7 目的蛋白磷酸化水平测定采用Western Blot法检测mTOR、S6K1、β-actin的表达及磷酸化情况,并使用Image J软件分析。
1.8 统计分析采用SPSS 19.0统计软件进行方差分析和Duncan氏法多重比较,结果以平均值±标准误表示,P < 0.05表示差异显著,P < 0.01表示差异极显著。
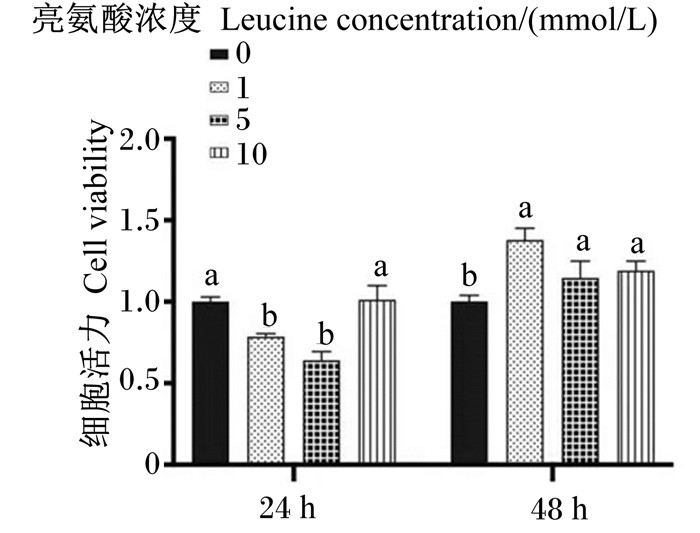
2 结果与分析 2.1 亮氨酸对猪乳腺上皮细胞活力的影响如图 1所示,不同浓度亮氨酸处理24 h后,1 mmol/L组和5 mmol/L组的细胞活力与对照组相比显著降低(P < 0.05);不同浓度亮氨酸处理48 h后,各浓度亮氨酸组细胞活力均较对照组显著提高(P < 0.05),且以亮氨酸浓度为1 mmol/L时细胞活力最高。
|
数据柱标注相同字母或无字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P < 0.05),不同大写字母表示差异极显著(P < 0.01)。下图同。 Data columns with the same letter or no letter mean no significant difference (P > 0.05), while with different small letters mean significant difference (P < 0.05), and with different capital letters mean significant difference (P < 0.01). The same as below. 图 1 不同浓度亮氨酸对猪乳腺上皮细胞活力的影响 Fig. 1 Effects of different concentrations of leucine on pMEC viability |
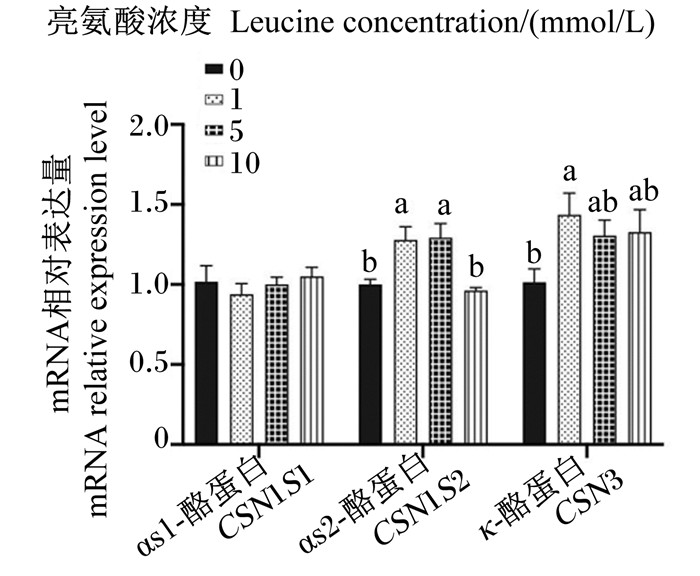
如图 2所示,与对照组相比,1 mmol/L组的CSN1S2和CSN3 mRNA相对表达量显著提高(P < 0.05),5 mmol/L组的CSN1S2 mRNA相对表达量显著提高(P < 0.05)。
|
图 2 不同浓度亮氨酸对猪乳腺上皮细胞中乳蛋白合成mRNA相对表达量的影响 Fig. 2 Effects of different concentrations of leucine on mRNA relative expression levels of milk protein synthesis genes in pMEC |
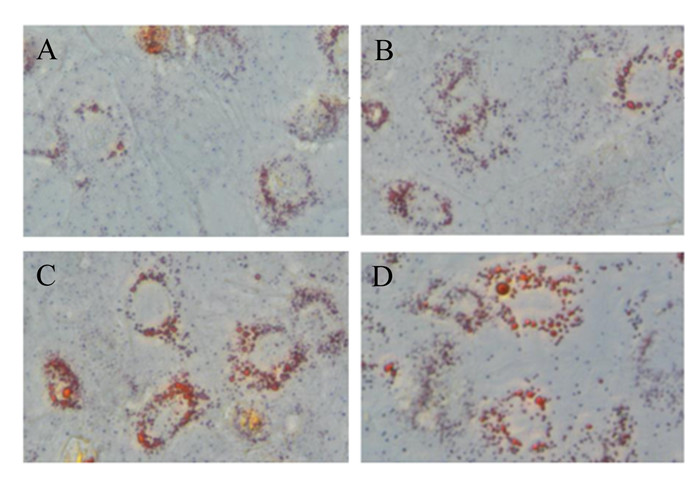
图 3展示的是用不同浓度亮氨酸处理48 h的猪乳腺上皮细胞内用油红O染色的脂滴形成情况,从图中可以看出,随着亮氨酸浓度的增加,脂滴含量逐渐增多,脂滴大小逐渐增大,且在亮氨酸浓度为5 mmol/L时脂滴的合成达到峰值。
|
图A、B、C、D依次是猪乳腺上皮细胞在含有0、1、5、10 mmol/L亮氨酸的培养基中培养48 h,采用油红O染色后光学显微镜下所拍照片。 Figures A, B, C and D were taken under light microscope after porcine mammary epithelial cells were cultured in medium containing 0, 1, 5 and 10 mmol/L leucine for 48 h and stained with oil red O. 图 3 不同浓度亮氨酸培养48 h对猪乳腺上皮细胞中脂滴合成的影响 Fig. 3 Effects of different concentrations of leucine culture for 48 h on lipid droplet synthesis in pMEC (400×) |
图 4、图 5、图 6为不同浓度亮氨酸对猪乳腺上皮细胞中氨基酸转运载体mRNA相对表达量的影响。与对照组相比,1 mmol/L组的SLC1A4、SLC1A5、SNAT1、SLC7A11、LAT1、SLC7A2、SLC7A7 mRNA相对表达量显著增加(P < 0.05);5 mmol/L组的SLC1A4、SNAT1、SLC7A11、LAT1、SLC7A2、SLC7A7、4F2hc、rBAT mRNA相对表达量显著增加(P < 0.05),但SLC1A1 mRNA相对表达量显著降低(P < 0.05);10 mmol/L组的SLC1A4、SLC1A5、SLC7A11、LAT1、SLC7A7、4F2hc和rBAT mRNA相对表达量显著升高(P < 0.05),但SLC1A1 mRNA相对表达量显著降低(P < 0.05)。总的来看,亮氨酸可以显著增加猪乳腺上皮细胞中性氨基酸转运载体和碱性氨基酸转运载体mRNA的表达。
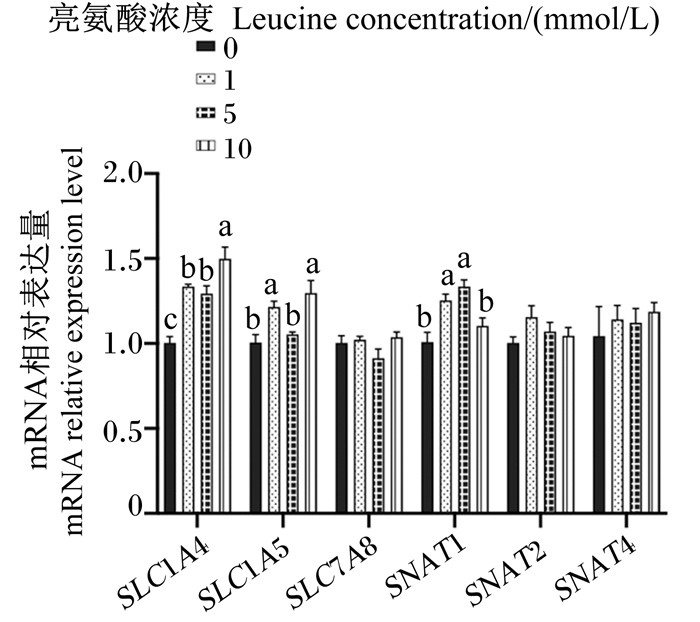
|
SLC1A4:溶质载体家族1成员4 solute carrier family 1 member 4;SLC1A5:溶质载体家族1成员5 solute carrier family 1 member 5;SLC7A8:溶质载体家族7成员8 solute carrier family 7 member 8;SNAT1:溶质载体家族38成员1 solute carrier family 38 member 1;SNAT2:溶质载体家族38成员2 solute carrier family 38 member 2;SNAT4:溶质载体家族38成员4 solute carrier family 38 member 4。 图 4 不同浓度亮氨酸对猪乳腺上皮细胞中中性氨基酸转运载体mRNA相对表达量的影响 Fig. 4 Effects of different concentrations of leucine on mRNA relative expression levels of neutral amino acid transporters in pMEC |
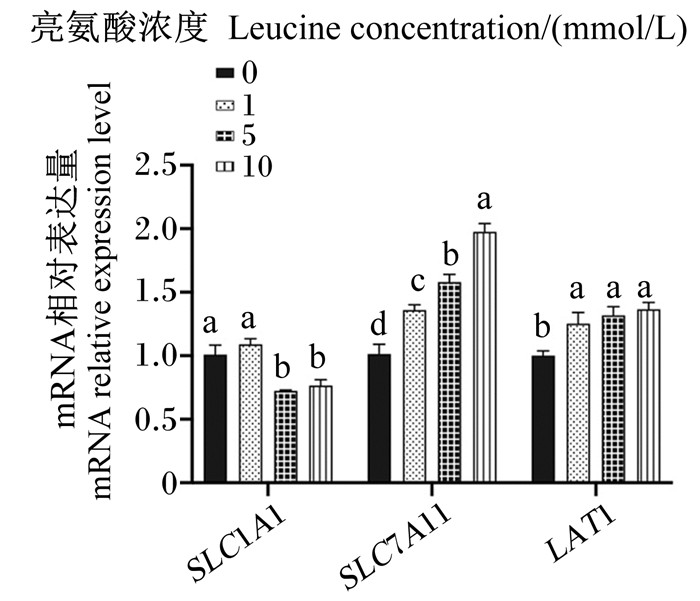
|
SLC1A1:溶质载体家族1成员1 solute carrier family 1 member 1;SLC7A11:溶质载体家族7成员11 solute carrier family 7 member 11;LAT1:溶质载体家族7成员5 solute carrier family 7 member 5。 图 5 不同浓度亮氨酸对猪乳腺上皮细胞中酸性氨基酸转运载体mRNA相对表达量的影响 Fig. 5 Effects of different concentrations of leucine on mRNA relative expression levels of acidic amino acid transporters in pMEC |
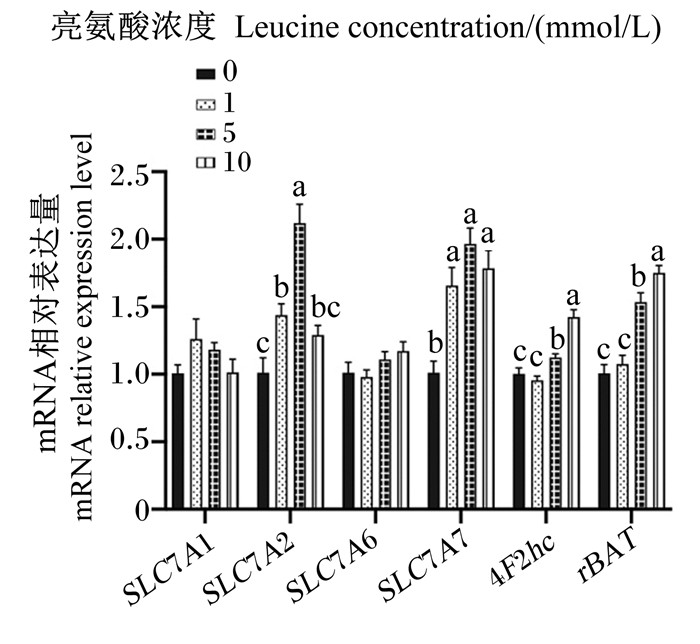
|
SLC7A1:溶质载体家族7成员1 solute carrier family 7 member 1;SLC7A2:溶质载体家族7成员2 solute carrier family 7 member 2;SLC7A6:溶质载体家族7成员6 solute carrier family 7 member 6;SLC7A7:溶质载体家族7成员7 solute carrier family 7 member 7;4F2hc:溶质载体家族3成员2 solute carrier family 3 member 2;rBAT:溶质载体家族3成员1 solute carrier family 3 member 1。 图 6 不同浓度亮氨酸对猪乳腺上皮细胞中碱性氨基酸转运载体mRNA相对表达量的影响 Fig. 6 Effects of different concentrations of leucine on mRNA relative expression levels of basic amino acid transporters in pMEC |
图 7为不同浓度亮氨酸对猪乳腺上皮细胞中葡萄糖转运载体mRNA相对表达量的影响。与对照组相比,5和10 mmol/L亮氨酸处理显著降低了GLUT8 mRNA相对表达量(P < 0.05),但各浓度亮氨酸处理对GLUT1 mRNA相对表达量无显著影响(P>0.05)。
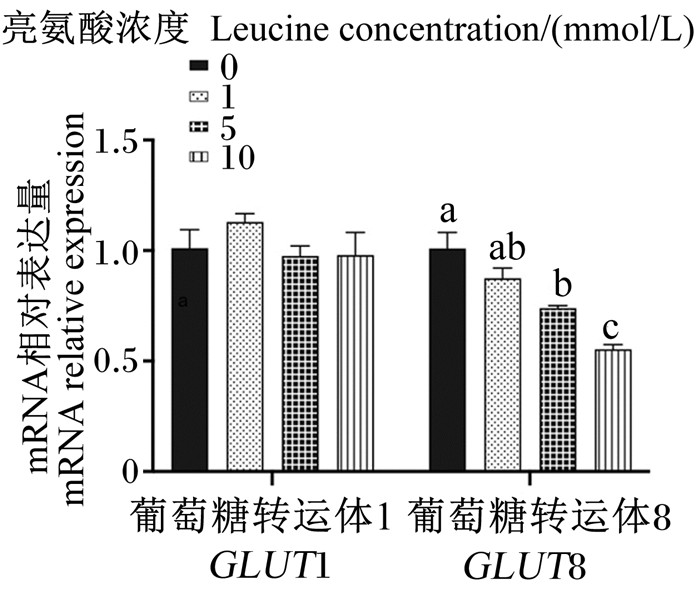
|
图 7 不同浓度亮氨酸对猪乳腺上皮细胞中葡萄糖转运载体mRNA相对表达量的影响 Fig. 7 Effects of different concentrations of leucine on mRNA relative expression levels of glucose transporters in pMEC |
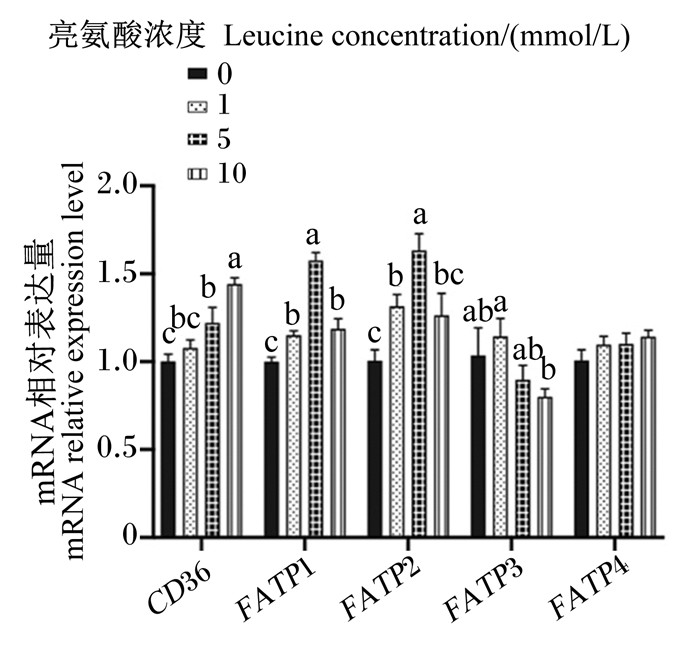
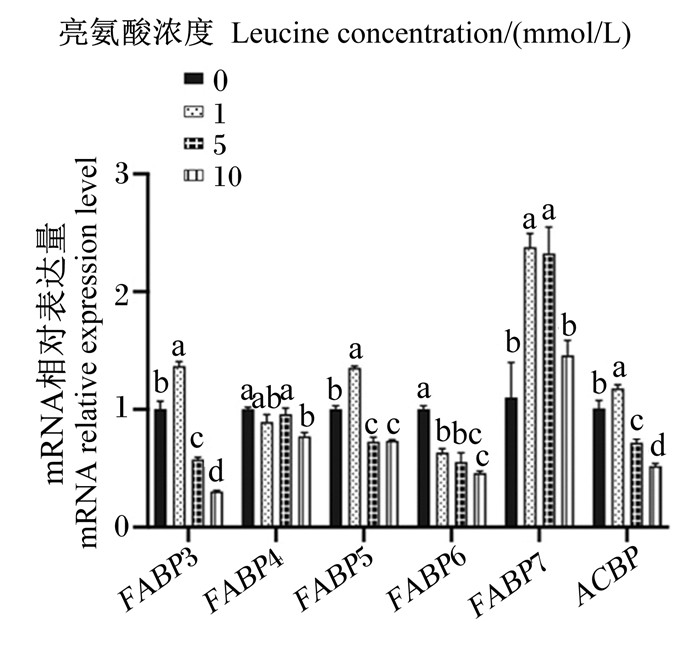
图 8、图 9为不同浓度亮氨酸对猪乳腺上皮细胞中脂肪酸转运载体mRNA相对表达量的影响。与对照组相比,1 mmol/L亮氨酸处理显著增加了FATP1、FATP2、FABP3、FABP5、FABP7和ACBP mRNA相对表达量(P < 0.05),但显著降低了FABP6 mRNA相对表达量(P < 0.05);5 mmol/L亮氨酸处理显著增加了CD36、FATP1、FATP2和FABP7 mRNA相对表达量(P < 0.05),但显著降低了FABP3、FABP5、FABP6和ACBP mRNA相对表达量(P < 0.05);10 mmol/L亮氨酸处理显著增加了CD36和FATP1 mRNA相对表达量(P < 0.05),但显著降低了FABP3、FABP4、FABP5、FABP6和ACBP mRNA相对表达量(P < 0.05)。综上可知,一定浓度的亮氨酸可以促进猪乳腺上皮细胞中脂肪酸转运载体mRNA的表达,但是高浓度的亮氨酸则会抑制其表达。
|
CD36:脂肪酸移位酶fatty acid translocase; FATP1:脂肪酸转运蛋白1 fatty acid transport protein 1;FATP2:脂肪酸转运蛋白2 fatty acid transport protein 2;FATP3:脂肪酸转运蛋白3 fatty acid transport protein 3;FATP4:脂肪酸转运蛋白4 fatty acid transport protein 4。 图 8 不同浓度亮氨酸对猪乳腺上皮细胞中脂肪酸摄取相关基因mRNA相对表达量的影响 Fig. 8 Effects of different concentrations of leucine on mRNA relative expression levels of genes related to fatty acid uptake in pMEC |
|
FABP3:脂肪酸结合蛋白3 fatty acid binding protein 3;FABP4:脂肪酸结合蛋白4 fatty acid binding protein 4;FABP5:脂肪酸结合蛋白5 fatty acid binding protein 5;FABP6:脂肪酸结合蛋白6 fatty acid binding protein 6;FABP7:脂肪酸结合蛋白7 fatty acid binding protein 7;ACBP: 酰基辅酶A结合蛋白acyl-CoA-binding protein。 图 9 不同浓度亮氨酸对猪乳腺上皮细胞中脂肪酸胞内转运相关基因mRNA相对表达量的影响 Fig. 9 Effects of different concentrations of leucine on mRNA relative expression levels of genes related to intracellular transport of fatty acids in pMEC |
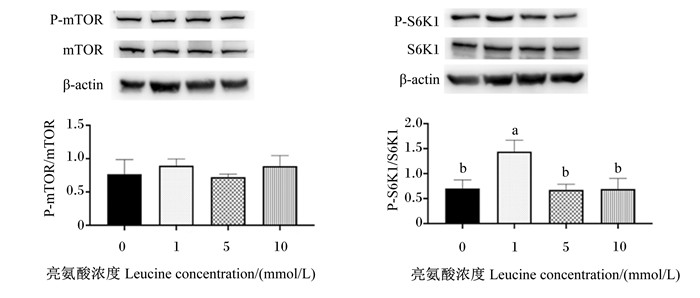
图 10为不同浓度亮氨酸对猪乳腺上皮细胞中mTOR信号通路关键蛋白表达的影响。与对照组相比,1 mmol/L亮氨酸处理显著增加了mTOR信号通路中S6K1的磷酸化水平(P < 0.05),其他浓度亮氨酸处理对S6K1的磷酸化水平无显著影响(P>0.05);不同浓度亮氨酸处理对mTOR信号通路中mTOR的磷酸化水平均无显著影响(P>0.05)。
|
mTOR:哺乳动物雷帕霉素靶蛋白mammalian target of rapamycin;P-mTOR:磷酸化哺乳动物雷帕霉素靶蛋白phosphorylated mammalian target of rapamycin;S6K1:核糖体蛋白S6激酶1 ribosomal protein S6 kinase 1;P-S6K1:磷酸化核糖体蛋白S6激酶1 phosphorylated ribosomal protein S6 kinase 1;β-actin: β-肌动蛋白。 图 10 不同浓度亮氨酸对猪乳腺上皮细胞中mTOR信号通路关键蛋白表达的影响 Fig. 10 Effects of different concentrations of leucine on expression of key proteins of mTOR signaling pathway in pMEC |
在乳腺中,乳蛋白的合成效率与乳腺上皮细胞的数量关系密切[16],而亮氨酸对乳腺细胞的生长发育有十分重要的作用。有关亮氨酸对泌乳性能影响的研究主要集中在奶牛上,对猪泌乳性能的相关报道较少,大量的研究指出,培养基中加入亮氨酸可以显著促进牛乳腺上皮细胞的增殖[12, 17-18]。而在本试验中,用不同浓度的亮氨酸处理猪乳腺上皮细胞48 h后,各浓度亮氨酸组细胞活力均显著提高,亮氨酸浓度为1 mmol/L时细胞活力最高,这与前人的研究相符。有报道指出,牛乳腺上皮细胞的增殖可以由mTOR信号通路调控,因此推测亮氨酸可能通过mTOR信号通路促进猪乳腺上皮细胞增殖。
3.2 亮氨酸对猪乳腺上皮细胞中乳蛋白合成基因表达的影响有研究报道,适量的氨基酸处理可以促进牛乳腺上皮细胞中酪蛋白基因的表达[19];氨基酸处理可以上调牛乳腺上皮细胞中CSN3基因的表达,还可以上调mTOR及下游S6K1、真核翻译起始因子4E结合蛋白1(4E-BP1)的磷酸化水平[20]。还有报道称,亮氨酸处理可以显著升高牛乳腺上皮细胞中CSN1S1和CSN1S2基因的表达[13]。而在本试验中,1 mmol/L亮氨酸处理可显著提高猪乳腺上皮细胞中CSN1S2和CSN3基因的表达,5 mmol/L亮氨酸处理可显著提高CSN1S2基因的表达,说明亮氨酸可以促进猪乳腺上皮细胞中CSN1S2和CSN3基因的表达,与前人在奶牛乳腺上皮细胞中的研究结果相似。
3.3 亮氨酸对猪乳腺上皮细胞中氨基酸转运载体基因表达的影响血浆的游离氨基酸库为乳合成提供了90%的氨基酸,而乳腺上皮细胞吸收这些氨基酸,除了用于自身常规的氧化分解外,最主要的作用是作为合成乳的原料。氨基酸是重要的母体营养素,是乳蛋白的基石,是新生儿潜在的能量来源[21]。而有些氨基酸,除了作为乳合成的底物,还能促进乳腺上皮细胞氨基酸转运载体的表达,进一步促进乳的合成。氨基酸作为大分子蛋白质的组成单位,在细胞膜之间不能自由扩散,需要通过细胞膜上氨基酸转运载体的协助。氨基酸转运载体是一种跨膜蛋白,在细胞和全身水平上通过调节能量代谢、蛋白质合成、基因表达、氧化还原平衡、信号转导途径和生长发挥重要作用[22]。氨基酸转运载体可以感知表内氨基酸水平的变化,介导氨基酸信号传导途径的激活。本研究从氨基酸转运载体的营养转运功能讨论亮氨酸处理对猪乳腺上皮细胞的营养传输的影响。对氨基酸转运系统分类的方法有许多种,其中按照其底物的化学性质可分为中性氨基酸转运载体、碱性氨基酸转运载体和酸性氨基酸转运载体[22]。本研究选择了中性氨基酸转运载体、碱性氨基酸转运载体和酸性氨基酸转运载体中几个主要的基因进行探讨。有研究报道,在体外培养的荷斯坦奶牛的乳腺腺泡组织中补充必需氨基酸,可以促进氨基酸转运载体LAT1和4F2hc基因的表达[23]。而在本试验中,各浓度亮氨酸处理均显著增加了LAT1基因的表达,5、10 mmol/L的亮氨酸处理显著增加了4F2hc基因的表达。还有研究报道称,用氨基酸处理体外培养的牛乳腺上皮细胞可以促进其氨基酸转运载体SLC6A14基因的表达[24]。而体外培养的小鼠乳腺细胞,在添加氨基酸处理后,其SNAT2的表达量显著提高[25]。从前人的研究可以看出氨基酸对氨基酸转运载体的表达有一定的促进作用。而在本试验中,不同浓度的亮氨酸处理猪乳腺上皮细胞均可促进不同氨基酸转运载体的表达,其中以5 mmol/L的亮氨酸处理效果最佳,但高浓度的亮氨酸处理会抑制SLC1A1的表达,推测高浓度的亮氨酸会导致细胞氨基酸失衡,从而影响细胞正常的蛋白质合成。
3.4 亮氨酸对猪乳腺上皮细胞中葡萄糖转运载体基因表达的影响葡萄糖是哺乳动物体内最重要的供能物质,还作为众多代谢的底物参与其代谢过程。在奶牛泌乳的研究中揭示了乳蛋白的合成可能受蛋白质和能量供应等因素的控制[26]。GLUT1是目前体内分布最广泛的葡萄糖转运载体,对葡萄糖分子有很高的亲和力,也是乳腺上皮细胞中主要表达的葡萄糖转运载体,GLUT8在牛的乳腺中也有少量表达[27]。本试验在猪乳腺上皮细胞中发现GLUT8也有少量表达。有研究证明了异亮氨酸可以促进肠道和肌肉中葡萄糖转运载体的表达[28]。还有研究提出亮氨酸可能促进mTOR信号通路中的S6K1磷酸化,进而促进GLUT1的表达[29]。但是本研究结果显示,用不同浓度亮氨酸处理对猪乳腺上皮细胞中GLUT1的表达无显著影响,其原因有待进一步研究。
3.5 亮氨酸对猪乳腺上皮细胞中脂肪酸转运载体基因表达的影响乳腺中乳脂的合成包括血液循环吸收、活化、细胞内转运以及乳腺上皮细胞内从头合成[30]。长链脂肪酸是乳腺上皮细胞主要的能量来源之一[31]。长链脂肪酸由CD36转移传递给脂肪酸转运蛋白(FATP)[32],FATP将长链脂肪酸进行跨膜转运后,由ACBP将之带到细胞内的代谢场所[33]。有报道称乳脂合成似乎受到SREBP1、PPAR和LXR相互作用网络的调控[34]。还有研究报道称,必需氨基酸可以通过mTOR-SREBP1通路调控脂肪酸和甘油三酯的合成[35]。而本试验发现,一定浓度亮氨酸处理促进了猪乳腺上皮细胞中脂肪酸转运载体基因的表达,由此推测,亮氨酸可能通过mTOR-SREBP1通路调控脂肪酸转运载体基因的表达,进而调控脂肪酸和甘油三酯的合成。本试验结果显示一定浓度(5 mmol/L)的亮氨酸可以促进猪乳腺上皮细胞中脂肪酸转运载体的表达,但亮氨酸浓度过高则会抑制其表达,可以用来解释前人的研究结果。
3.6 亮氨酸对猪乳腺上皮细胞中mTOR信号通路关键蛋白表达的影响氨基酸不仅作为蛋白质合成的底物,还作为某些特殊的信号分子激活细胞内的信号通路,调控蛋白质的合成[36]。亮氨酸通过Sestrin2激活哺乳动物骨骼肌、脂肪组织和胎盘细胞中mTOR的靶蛋白来增加蛋白质的合成[37]。而在哺乳动物的乳腺研究中,有报道称,用不含亮氨酸的培养基培养乳腺上皮细胞,发现其mTOR信号通路及其中下游蛋白S6K1和4E-BP1的磷酸化受到影响,从而影响乳蛋白的合成速率[15]。在对乳腺组织切片的研究中发现,加入亮氨酸可以促使mTOR磷酸化,从而促进乳蛋白的合成[10]。还有研究报道称,氨基酸对mTOR信号通路正向或负向的信号传导与胰岛素调节相结合,这种作用方式调控了乳腺上皮细胞中蛋白质的合成速率[13]。还有研究报道称,在母猪妊娠晚期补充缬氨酸可以显著提高猪乳腺上皮细胞中蛋白质的合成和细胞的增殖,原因可能是缬氨酸促进了mTOR磷酸化及其中下游的关键蛋白S6K1和4E-BP1磷酸化导致的[38]。有研究显示,亮氨酸处理牛乳腺上皮细胞后mTOR、S6K1、4E-BP1的mRNA相对表达量均有升高趋势,但是没有达到显著水平[12]。而在本试验中,1 mmol/L亮氨酸处理显著提高了猪乳腺上皮细胞中S6K1的磷酸化水平,但不同浓度亮氨酸处理对mTOR的磷酸化水平无显著影响,因此本试验得出亮氨酸对mTOR信号通路下游关键蛋白的磷酸化有促进作用。
4 结论① 在培养基中添加一定浓度的亮氨酸可以显著提高猪乳腺上皮细胞的活力,以1 mmol/L亮氨酸的效果最佳。
② 在培养基中添加一定浓度的亮氨酸可以提高猪乳腺上皮细胞中乳蛋白合成以及氨基酸转运载体和脂肪酸转运载体基因的表达,以5 mmol/L亮氨酸的效果最佳。
| [1] |
宋广鹏. 母猪泌乳力的影响因素和提高措施[J]. 现代畜牧科技, 2020(5): 13-14. SONG G P. Influencing factors and improving measures of lactation ability of sows[J]. Modern Animal Husbandry Science & Technology, 2020(5): 13-14 (in Chinese). |
| [2] |
AKERS R M. Lactation and the mammary gland[M]. Oxford: Blackwell Publishing Company, 2002.
|
| [3] |
ARENDT L M, KUPERWASSER C. Form and function: how estrogen and progesterone regulate the mammary epithelial hierarchy[J]. Journal of Mammary Gland Biology and Neoplasia, 2015, 20(1/2): 9-25. |
| [4] |
KIM S W, WU G Y. Regulatory role for amino acids in mammary gland growth and milk synthesis[J]. Amino Acids, 2009, 37(1): 89-95. DOI:10.1007/s00726-008-0151-5 |
| [5] |
REZAEI R, WU Z L, HOU Y Q, et al. Amino acids and mammary gland development: nutritional implications for milk production and neonatal growth[J]. Journal of Animal Science and Biotechnology, 2016, 7: 20. DOI:10.1186/s40104-016-0078-8 |
| [6] |
CAPUCO A V, ELLIS S E. Comparative aspects of mammary gland development and homeostasis[J]. Annual Review of Animal Biosciences, 2013, 1: 179-202. DOI:10.1146/annurev-animal-031412-103632 |
| [7] |
TROTTIER N L, SHIPLEY C F, EASTER R A. Plasma amino acid uptake by the mammary gland of the lactating sow[J]. Journal of Animal Science, 1997, 75(5): 1266-1278. DOI:10.2527/1997.7551266x |
| [8] |
BOYD D R, KENSINGER R S, HARRELL R J, et al. Nutrient uptake and endocrine regulation of milk synthesis by mammary tissue of lactating sows[J]. Journal of Animal Science, 1995, 73(Suppl.2): 36-56. |
| [9] |
MURGAS TORRAZZA R, SURYAWAN A, GAZZANEO M C, et al. Leucine supplementation of a low-protein meal increases skeletal muscle and visceral tissue protein synthesis in neonatal pigs by stimulating mTOR-dependent translation initiation[J]. The Journal of Nutrition, 2010, 140(12): 2145-2152. DOI:10.3945/jn.110.128421 |
| [10] |
APPUHAMY J A D R N, KNOEBEL N A, NAYANANJALIE W A D, et al. Isoleucine and leucine independently regulate mTOR signaling and protein synthesis in MAC-T cells and bovine mammary tissue slices[J]. The Journal of Nutrition, 2012, 142(3): 484-491. DOI:10.3945/jn.111.152595 |
| [11] |
高海娜. 亮氨酸、组氨酸、赖氨酸和蛋氨酸对奶牛乳腺上皮细胞中酪蛋白合成的影响及调控机理研究[D]. 硕士学位论文. 兰州: 甘肃农业大学, 2016. GAO H N. Effects of Leu, His, Lys and Met on casein synthesis and its manipulating mechanism in bovine mammary epithelial cells[D]. Master's Thesis. Lanzhou: Gansu Agricultural University, 2016. (in Chinese) |
| [12] |
庞学燕, 季昀, 田青, 等. 亮氨酸对κ-酪蛋白合成的影响及相关信号通路的研究[J]. 中国畜牧杂志, 2013, 49(9): 38-41. PANG X Y, JI Y, TIAN Q, et al. Leucine pair κ-study on the effect of casein synthesis and related signal pathways[J]. Chinese Journal of Animal Science, 2013, 49(9): 38-41 (in Chinese). |
| [13] |
PRIZANT R L, BARASH I. Negative effects of the amino acids Lys, His, and Thr on S6K1 phosphorylation in mammary epithelial cells[J]. Journal of Cellular Biochemistry, 2008, 105(4): 1038-1047. DOI:10.1002/jcb.21904 |
| [14] |
QIU Y W, QU B, ZHEN Z, et al. Leucine promotes milk synthesis in bovine mammary epithelial cells via the PI3K-DDX59 signaling[J]. Journal of Agricultural and Food Chemistry, 2019, 67(32): 8884-8895. DOI:10.1021/acs.jafc.9b03574 |
| [15] |
MOSHEL Y, RHOADS R E, BARASH I. Role of amino acids in translational mechanisms governing milk protein synthesis in murine and ruminant mammary epithelial cells[J]. Journal of Cellular Biochemistry, 2006, 98(3): 685-700. DOI:10.1002/jcb.20825 |
| [16] |
MERCIER J C, GAYE P. Early events in secretion of main milk proteins: occurrence of precursors[J]. Journal of Dairy Science, 1982, 65(2): 299-316. DOI:10.3168/jds.S0022-0302(82)82192-9 |
| [17] |
王超先, 王旭贞, 管武太, 等. 母猪妊娠后期日粮添加亮氨酸对断奶仔猪生长性能及乳成分的影响[J]. 中国畜牧杂志, 2016, 52(9): 48-52. WANG C X, WANG X Z, GUAN W T, et al. Effects of leucine supplementation in late gestation sow diets on growth performance of weanling piglets and milk components of Sows[J]. Chinese Journal of Animal Science, 2016, 52(9): 48-52 (in Chinese). |
| [18] |
代文婷. 亮氨酸对奶牛乳腺上皮细胞酪蛋白合成影响和机理研究[D]. 硕士学位论文. 长春: 吉林大学, 2015. DAI W T. Effects of leucine on casein synthesis and its regulating mechanism in bovine mammary epithelial cell[D]. Master's Thesis. Changchun: Jilin University, 2015. (in Chinese) |
| [19] |
杨金勇. 蛋氨酸、赖氨酸及其二肽对奶牛乳腺上皮细胞酪蛋白αs1基因表达的影响[D]. 硕士学位论文. 杭州: 浙江大学, 2006. YANG J Y. Effect of free amino acids and peptides on the expression of casein αs1 gene in cultured bovine mammary epithelial cells[D]. Master's Thesis. Hangzhou: Zhejiang University, 2006. (in Chinese) |
| [20] |
孙振稳. 氨基酸、葡萄糖和胰岛素对奶牛乳腺上皮细胞增殖及乳蛋白合成的影响[D]. 硕士学位论文. 泰安: 山东农业大学, 2018. SUN Z W. Effects of essential amino acids, glucose and insulin on proliferation and protein synthesis in bovine mammary epithelial cells[D]. Master's Thesis. Taian: Shandong Agricultural University, 2018. (in Chinese) |
| [21] |
BACKWELL F R, BEQUETTE B J, WILSON D, et al. Evidence for the utilization of peptides for milk protein synthesis in the lactating dairy goat in vivo[J]. The American Journal of Physiology, 1996, 271(4 Pt 2): R955-R960. |
| [22] |
KANDASAMY P, GYIMESI G, KANAI Y, et al. Amino acid transporters revisited: new views in health and disease[J]. Trends in Biochemical Sciences, 2018, 43(10): 752-789. DOI:10.1016/j.tibs.2018.05.003 |
| [23] |
林叶, 侯晓明, 田雷, 等. 必需氨基酸上调乳腺腺泡中L型氨基酸转运载体1的表达[J]. 中国畜牧兽医, 2014, 41(3): 83-86. LIN Y, HOU X M, TIAN L, et al. Essential amino acid upregulates L-type amino acid transporter 1 expression in mammary acinus[J]. China Animal Husbandry & Veterinary Medicine, 2014, 41(3): 83-86 (in Chinese). |
| [24] |
ZHOU M M, WU Y M, LIU H Y, et al. Effects of phenylalanine and threonine oligopeptides on milk protein synthesis in cultured bovine mammary epithelial cells[J]. Journal of Animal Physiology and Animal Nutrition, 2015, 99(2): 215-220. DOI:10.1111/jpn.12246 |
| [25] |
LÓPEZ A, TORRES N, ORTIZ V, et al. Characterization and regulation of the gene expression of amino acid transport system A (SNAT2) in rat mammary gland[J]. American Journal of Physiology.Endocrinology and Metabolism, 2006, 291(5): E1059-E1066. DOI:10.1152/ajpendo.00062.2006 |
| [26] |
LAPIERRE H, GALINDO C E, LEMOSQUET S, et al. Protein supply, glucose kinetics and milk yield in dairy cows[M]//CROVETTO G M. Energy and protein metabolism and nutrition. Wageningen: Wageningen Academic Publishers, 2010: 275-286.
|
| [27] |
ZHAO F Q, KEATING A F. Expression and regulation of glucose transporters in the bovine mammary gland[J]. Journal of Dairy Science, 2007, 90(Suppl.1): E76-E86. |
| [28] |
张世海. 支链氨基酸调节仔猪肠道和肌肉中氨基酸及葡萄糖转运的研究[D]. 博士学位论文. 北京: 中国农业大学, 2016. ZHANG S H. Branched-chain amino acids modulate amino acid and glucose transport in intestine and muscle of piglets[D]. Ph. D. Thesis. Beijing: China Agricultural University, 2016. (in Chinese) |
| [29] |
吕佳栋. 低蛋白过瘤胃氨基酸补饲日粮对奶牛乳腺组织氨基酸和葡萄糖转运载体的影响[D]. 硕士学位论文. 泰安: 山东农业大学, 2017. LV J D. Effects of low protein diets supplemented with rumen-protected amino acid on the expression of amino acid transporters and glucose transporters in the mammary gland of lactating cows[D]. Master's Thesis. Taian: Shandong Agricultural University, 2017. (in Chinese) |
| [30] |
BAUMAN D E, GRIINARI J M. Nutritional regulation of milk fat synthesis[J]. Annual Review of Nutrition, 2003, 23: 203-227. DOI:10.1146/annurev.nutr.23.011702.073408 |
| [31] |
KAZANTZIS M, STAHL A. Fatty acid transport proteins, implications in physiology and disease[J]. Biochimica et Biophysica Acta, 2012, 1821(5): 852-857. DOI:10.1016/j.bbalip.2011.09.010 |
| [32] |
BONEN A, CHABOWSKI A, LUIKEN J J F P, et al. Is membrane transport of FFA mediated by lipid, protein, or both? Mechanisms and regulation of protein-mediated cellular fatty acid uptake: molecular, biochemical, and physiological evidence[J]. Physiology, 2007, 22: 15-29. DOI:10.1152/physiologyonline.2007.22.1.15 |
| [33] |
HUI D Y, LABONTÉ E D, HOWLES P N. Development and physiological regulation of intestinal lipid absorption.Ⅲ.Intestinal transporters and cholesterol absorption[J]. American Journal of Physiology: Gastrointestinal and Liver Physiology, 2008, 294(4): G839-G843. DOI:10.1152/ajpgi.00061.2008 |
| [34] |
OSORIO J S, LOHAKARE J, BIONAZ M. Biosynthesis of milk fat, protein, and lactose: roles of transcriptional and posttranscriptional regulation[J]. Physiological Genomics, 2016, 48(4): 231-256. |
| [35] |
李珊珊. 必需氨基酸调节奶牛乳腺合成乳蛋白和乳脂肪的作用机制[D]. 博士学位论文. 杭州: 浙江大学, 2015. LI S S. Regulation role of essential amino acid in synthesis of the protein and fat in mammary cell of dairy cow[D]. Ph. D. Thesis. Hangzhou: Zhejiang University, 2015. (in Chinese) |
| [36] |
SUZUKI T, INOKI K. Spatial regulation of the mTORC1 system in amino acids sensing pathway[J]. Acta Biochimica et Biophysica Sinica, 2011, 43(9): 671-679. |
| [37] |
WOLFSON R L, CHANTRANUPONG L, SAXTON R A, et al. Sestrin2 is a leucine sensor for the mTORC1 pathway[J]. Science, 2016, 351(6268): 43-48. |
| [38] |
CHE L, XU M M, GAO K G, et al. Valine supplementation during late pregnancy in gilts increases colostral protein synthesis through stimulating mTOR signaling pathway in mammary cells[J]. Amino Acids, 2019, 51(10): 1547-1559. |




